非洲猪瘟病毒实时荧光RPA快速检测方法的建立
李 林,刘拂晓,樊晓旭,李金明,邹艳丽,刘 珊,包静月,吴晓东,王志亮
(中国动物卫生与流行病学中心,山东青岛 266032)
非洲猪瘟病毒实时荧光RPA快速检测方法的建立
李 林,刘拂晓,樊晓旭,李金明,邹艳丽,刘 珊,包静月,吴晓东,王志亮
(中国动物卫生与流行病学中心,山东青岛 266032)
非洲猪瘟是一种跨境动物疫病,对世界养猪业危害严重。目前,该病的流行范围越来越广。为防止该病传入我国,当前急需建立快速、简便、可靠的检测方法。本研究通过分析非洲猪瘟病毒B646L基因保守区域,设计并合成了特异性引物和exo探针,建立了检测非洲猪瘟病毒的实时荧光RPA方法。利用该方法可在20 min内完成检测过程,最低可检测到16拷贝/反应;与猪的其他常见病原核酸无交叉反应;与荧光PCR方法具有相似的灵敏度和特异性;利用该方法对100份国内临床样品进行检测,结果均为阴性。本研究所建立的非洲猪瘟病毒实时荧光RPA检测方法具有简单、快速、敏感性高、特异性强的优点,在临床鉴别诊断、检验检疫和病原监测等方面具有广泛的应用价值。
非洲猪瘟;非洲猪瘟病毒;实时荧光RPA;实时荧光PCR
非洲猪瘟(African swine fever,ASF)是猪的一种急性、热性、高度接触性传染病,能感染所有品种和年龄的猪,引起一系列综合症状,临床上以高热、食欲废绝、皮肤和内脏器官出血、高死亡率为特征。该病属于世界动物卫生组织(OIE)的法定报告动物疫病,在我国被列为一类动物疫病。ASF的病原为非洲猪瘟病毒(African swine fever virus,ASFV)。该病毒为双链DNA,是非洲猪瘟病毒科(Asfarviridae)的唯一成员[1]。ASF主要在非洲和欧洲东部流行,已经在非洲以外的意大利撒丁岛、西班牙、葡萄牙、加勒比地区、巴西以及东欧等国家或地区发现[2]。自2007年该病传入俄罗斯以来,不断蔓延,已经传至俄罗斯的46个地区[3]。2017年3月,在距离我国较近的俄罗斯远东地区伊尔库茨克州发生ASF疫情,使得该病传入我国的风险骤然增加,因此我国急需提高对该病的检测和防控能力。
ASF与猪瘟(CSF)无法通过临床症状和病理变化进行鉴别,而且这两种病应与猪的其他急性出血性疫病进行鉴别诊断。由于ASF没有疫苗,当前ASF的实验室诊断方法以检测特异性抗体为主,其他方法如病毒分离、直接免疫荧光法以及检测病毒核酸的方法(如常规PCR和荧光PCR)等也相继建立并广泛应用[4]。但上述检测方法大多需要昂贵的仪器设备、繁琐的试验程序以及较长的检测时间,难以满足现场或临床检测需要[5]。
近年来,一些核酸等温扩增技术逐渐发展起来,这些技术不需要昂贵的PCR仪,可在短时间内大量扩增出目的片段,具有简单、快速、灵敏度高等优点。其中的重组酶聚合酶扩增技术(Recombinase polymerase amplif i cation,RPA)更是被称为可替代PCR的核酸检测技术[6]。RPA技术是模拟了生物体内DNA复制,基于重组酶和聚合酶介导的扩增原理发展而来。该技术主要依赖于结合单链核酸(寡核苷酸引物)的重组酶、单链DNA结合蛋白(SSB)和链置换DNA聚合酶三种酶。这3种酶的混合物在常温下即具有活性,最佳反应温度在37~42 ℃。它可以在非常短的时间内(20 min)使目的基因以指数级增长,配合荧光标记的探针和荧光信号检测仪还可实现对扩增的实时监控。应用该技术已经建立起对多种病原微生物(如口蹄疫病毒、寨卡病毒和裂谷热病毒等)的快速检测技术[7-9]。本研究建立和初步评估了一种用于快速检测ASFV的实时荧光RPA方法。
1 材料与方法
1.1病毒核酸和临床样品
含有ASFV E70株B646L基因(p72)的质粒pMD 18-p72由本实验室构建并保存。ASF阳性组织样品均从欧盟非洲猪瘟参考实验室(CISA-INIA,西班牙)引进。口蹄疫病毒核酸、猪繁殖与呼吸障碍综合征病毒核酸、猪瘟病毒核酸和猪圆环病毒核酸,以及健康猪全血和淋巴结样品均为本实验室保存。实时荧光RPA引物与exo探针、荧光PCR引物和TaqMan探针均由宝生物工程(大连)有限公司合成,其他试剂均为进口分装或国产分析纯。
1.2实时荧光RPA引物和exo探针的设计
根据TwistDx公司RPA指导手册中的引物和exo探针设计原则,比对GenBank中ASFV的B646L基因(p72)序列中保守部分,设计出的引物和探针序列为:
RPAf:5′-GCTTTCAGGATAGAGATACAGCT CTTCCAGACGC-3′;
RPAr:5′-CCGTAGTGGAAGGGTATGTAAGA GCTGCAGAAC-3′;
exo探针RPAp的序列为:5′-ATTATTAAAAAC ATTTCCGTAACTGCTCATGG (FAM-dt)(THF)(BHQ1-dt)AATCTTATCG-C3Spacer-3′。
1.3实时荧光RPA
使用TwistAmp exo试剂盒(TwistDx,Cambridge,UK)在50 μL反应体系进行RPA试验。Twista等温实时荧光扩增仪器和软件(Twista Studio,2.06版)为英国TwistDx公司产品。首先在1.5 mL离心管中加入再水化缓冲液29.5 μL,引物RPAf和RPAr(均为10 μM)各2.1 μL,exo探针RPAp(10 μM)0.6 μL,DNA模板3 μL和灭菌水10.2 μL,混匀后,将前述混合液加入到含有冻干酶球的RPA反应管中,混匀,最后加入280 mM的醋酸镁溶液2.5 μL,混匀后立即将反应管置于RPA扩增检测仪中,39 ℃反应20 min,实时收集FAM荧光信号。对于模板浓度较低的反应(1.5×103~1.5×101拷贝/反应)在第230秒时取出混匀1次。结果判定采用软件中的阈值时间(Threshold time)方法。
1.4荧光PCR
荧光PCR参照OIE诊断手册中推荐的方法[10],检测的目的基因同样为B646L。使用TaKaRa公司的Premix ExTaq(Probe qPCR)试剂盒在LightCycler 480荧光PCR仪(Roche,Germany)上进行,反应体系为25 μL,模板加3 μL,反应程序为95 ℃ 3 min,94 ℃ 15 s,60 ℃ 1 min,40个循环。
1.5敏感性分析
对引物和探针序列在GenBank中Blast,分析本方法中所用引物和探针序列与不同基因型的ASFV序列的差异。人工合成与本文中的RPA引物和exo探针序列有差异基因片段(GenBank登录号分别为:AF270708、AF270709、AF270710、AF449475、AF449476、AY274452、AY494552、DQ250112),使用建立的实时荧光RPA方法分别检测。
以质粒pMD18-p72 为标准品,测量浓度后,根据分子量大小计算拷贝数浓度,连续10倍倍比稀释。对不同浓度的DNA标准品(1.5×107~1.5×101拷贝/反应)分别使用实时荧光RPA和荧光PCR检测。使用Prism统计软件(Graphpad Software Inc,USA)对实时荧光RPA和荧光PCR能检测到的模板数与阈值时间或Ct值分别进行半对数回归分析。另外,使用实时荧光RPA方法对不同浓度的标准品重复检测10次,使用统计软件对能检测到的模板数进行概率回归分析。
1.6特异性分析
使用High Pure viral nucleic acid kit(Roche公司)提取临床上猪常见的几种疫病的病原核酸,如口蹄疫、猪瘟、猪繁殖与障碍呼吸综合征和猪圆环病毒病等。同时设立ASF阳性样品对照,采用相同的方法处理样品。实时荧光RPA方法检测提取的病毒核酸。
1.7临床样品检测
采用High Pure PCR template preparation kit(Roche公司)提取4份ASFV阳性组织样品和100份国内送检的健康猪全血中的DNA,使用荧光PCR方法与本文建立的实时荧光RPA方法检测,比较两种方法的结果差异。
2 结果
2.1引物和探针的设计
查找GenBank中ASFV的B646L基因序列,使用MEGA软件序列比对后查找保守区域,根据保守区域的共同序列为模板设计了引物和exo探针,扩增片段的长度为181 bp。参照Georgia 2007株ASFV的B646L基因序列(GenBank登录号AM999764.1),最终使用的RPA引物RPAf、RPAr和探针RPAp的对应位置分别为29~62、177~209和115~160。
2.2实时荧光RPA的敏感性分析
实时荧光RPA方法对不同浓度的模板(1.5×107~1.5×101拷贝/反应)进行检测,检测下限最低可至1.5×101拷贝/反应(图1-A)。分别对几种不同的B646L基因片段(GenBank登录号为:AF270708,AF270709、AF270710、AF449475、AF449476、AY274452、AY494552、DQ250112)检测,结果均能出现扩增曲线(图1-B)。使用所建立的实时荧光RPA对4份阳性ASF组织样品的检测结果均为阳性,与荧光PCR结果一致。
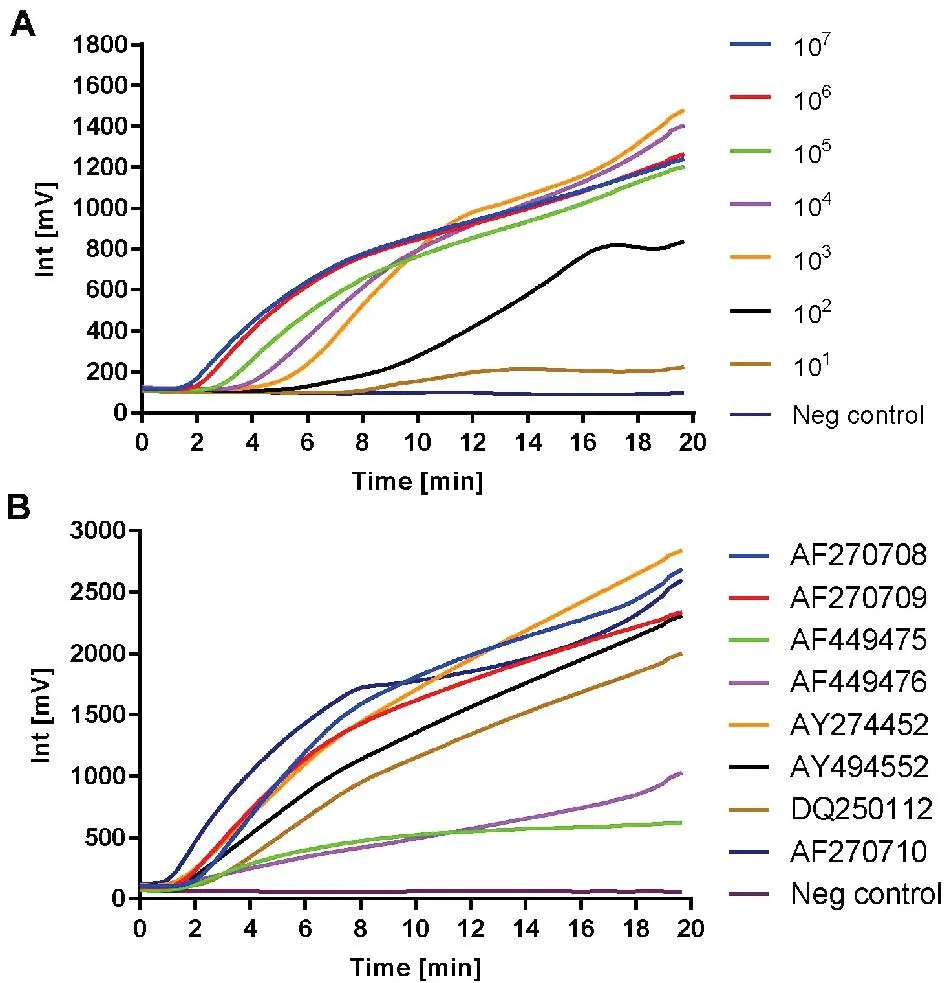
图1实时荧光RPA扩增曲线
以标准品为模板,实时荧光RPA和荧光PCR对每个浓度梯度的模板分别重复检测10次,荧光PCR的检测下限为15个拷贝。而经概率回归分析,实时荧光RPA方法检测下限(95%的概率)为16.9个拷贝(图2)。在标准品为1.5×107~1.5×102拷贝/反应时,实时荧光RPA的阈值时间与模板拷贝数的对数具有良好的线性相关性(R2=0.7618),但阈值时间的变化范围较大(图3-A)。而荧光PCR在1.5×107~1.5×101拷贝/反应时,Ct值的与模板拷贝数的对数线性相关性较好(R2=0.997 1),Ct值变异较小(图3-B)。
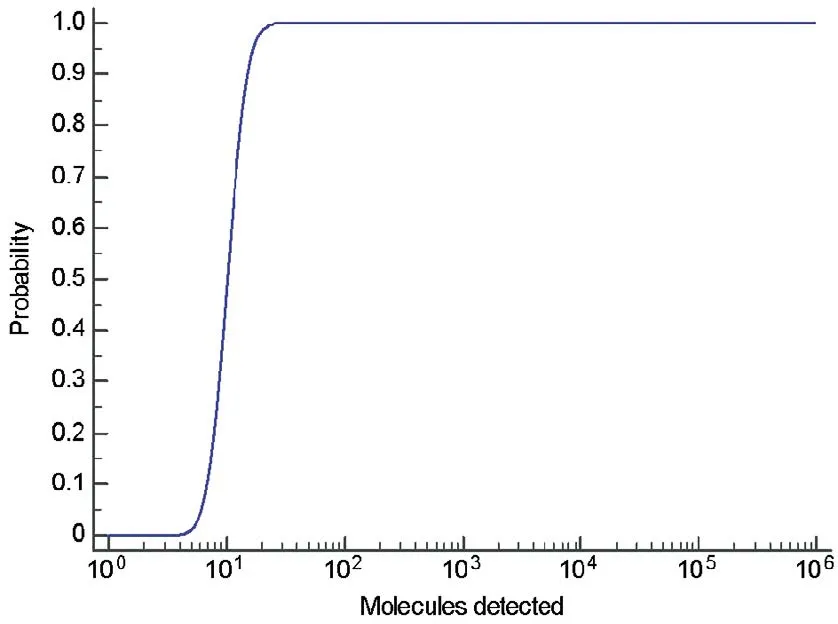
图2实时荧光RPA检测下限的概率回归分析
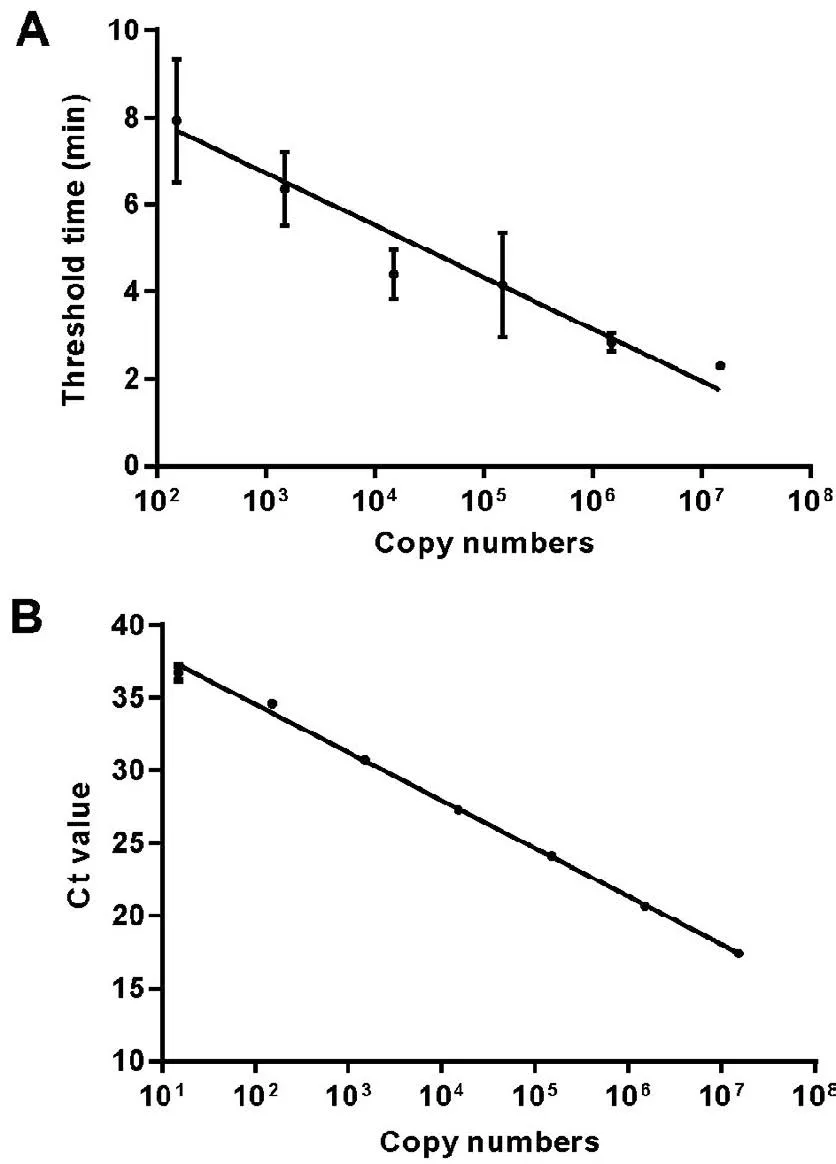
图3对不同浓度的标准品检测结果
在标准品模板数为1.5×107~1.5×102拷贝/反应时,实时荧光RPA的阈值时间和荧光PCR的Ct值具有良好的线性回归关系(R2= 0.961 5)(图4)。
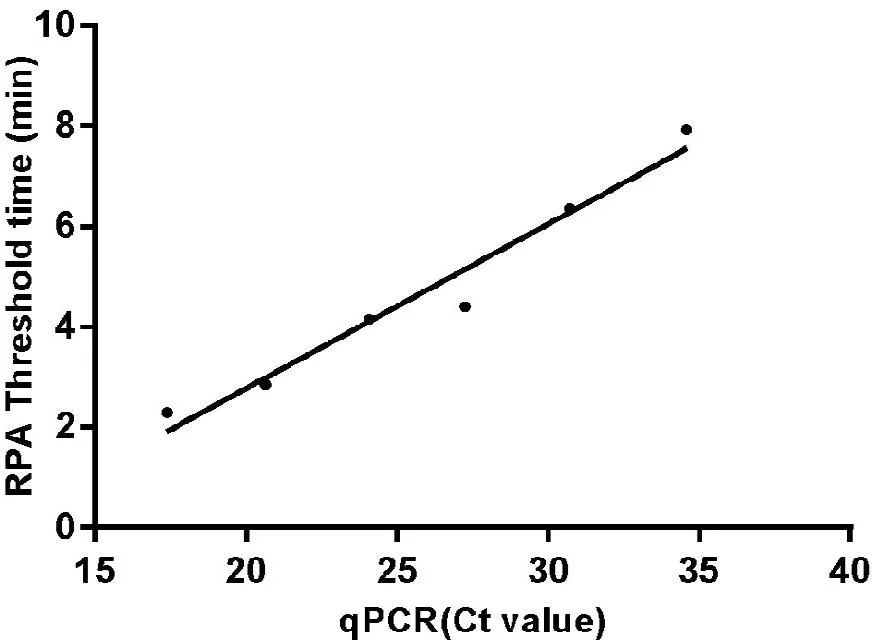
图4实时荧光RPA与荧光PCR的相关性分析
2.3实时荧光RPA的特异性
以其它猪常见的病原核酸,如口蹄疫病毒、猪繁殖与呼吸障碍综合征病毒、猪瘟病毒和圆环病毒等,以及健康猪淋巴结总核酸为模板,进行实时荧光RPA检测后均没有出现扩增曲线,而使用实时荧光RPA对ASF阳性对照样品检测均出现扩增曲线。对国内送检的100份样品进行检测,实时荧光RPA检测结果均为ASFV阴性,与荧光PCR检测结果一致。
3 讨论
2017年3月,俄罗斯远东地区伊尔库茨克(Irkutsk)发生ASF疫情,这是2007年以来该病在俄罗斯首次向东长距离跨越式传播。由于疫情发生地距离我国较近,传入我国的风险大大增加。为此,农业部下发了《关于进一步加强非洲猪瘟风险防范工作的紧急通知》(农办医〔2017〕14号),要求各地警惕疫情风险,做好防范工作。鉴于非洲猪瘟具有危害十分严重且无特征性临床症状的特点,建立适用于各级实验室和临床应用的简便快速鉴别诊断技术对于该病的防控尤为重要。
RPA技术是近年来出现的等温扩增技术,具有操作简便、试剂易保存和携带、反应快速等优点,非常适于临床检测。目前,一些实验室已经建立了基于RPA的病原学检测方法。与其他等温扩增方法或PCR相比,RPA具有反应快、操作简便、无需复杂的实验室设备即可实现快速检测等优点。本方法反应所需要的酶,经过冻干,能在常温下长时间保存,检测时只需加入提前配制好的缓冲液(包含水解缓冲液、引物和探针等),再加入简单纯化的病原核酸和醋酸镁即可开始反应,只需20 min即可完成检测。
本研究建立的实时荧光RPA方法具有非常高的敏感性和特异性。经概率回归分析,该方法的检测下限最低可达到16.9个拷贝数(95%可能性),与荧光PCR的检测下限相似。本研究所建立的实时荧光RPA方法比王建昌等[11]建立的RPA检测ASFV方法检测下限提高了10倍,且不需要电泳,节约时间。本研究建立的RPA方法比荧光PCR检测下限提高,原因可能是由于使用不同的扩增试剂盒而引起的。对临床阴性样品检测的结果显示,实时荧光RPA与荧光PCR具有相似的特异性。由于在实时荧光RPA反应中加入了exo探针,相比普通RPA增加了反应的特异性。与荧光PCR方法不同的是,RPA反应体系中添加了核酸外切酶III,对扩增产物进行切割,扩增产物在反应结束后即降解,进一步降低了扩增产物污染所带来的假阳性风险。
实时荧光RPA方法的阈值时间与荧光PCR的Ct值相比变异性较大,原因可能有如下几点:一是由于RPA反应非常快,在室温下即可开始反应,荧光RPA的阈值时间受手工操作熟练程度的影响较大,对阈值时间的大小产生影响,但不会改变结果的性质(阴性或阳性)。二是由于RPA是在等温条件下进行反应,若反应体系没有充分混匀将影响反应结果,尤其是在模板数较少的情况下。随着模板数的降低,阈值时间的变异也越来越大。而荧光PCR在变温条件下(变性、退火和延伸)进行反应,反应液在每个循环都可以得到充分混匀,Ct值的标准差也较小。因此,通常在RPA反应开始3~4 min后将反应管拿出混匀,可提高检出率并缩短检测时间,这在模板数较少的情况下影响尤为显著。另外,国外有报道,将反应体积缩小至5 μL后也可以提高敏感性,同时还能节约成本[12]。
本研究所建立的ASFV实时荧光RPA快速检测方法,结合快速核酸纯化技术和便携式的仪器设备,具有操作简单、敏感性高、特异性强和快速等优点,非常适合于临床现场和基层检测应用,对于我国ASF防控具有重大意义。
[1] DIXON L K,ESCRIBANO J M,MARTINS C,et al. Asfarviridae[C] // FAUQUET C M,MAYO M A,MANILOFF J,et al. Virus taxonomy VIII report of the international committee on taxonomly of viruses. London:Elsevier Academic Press,2005:135-143.
[2] OLSEVSKIS E,GUBERTI V,SERZANTS M,et al. African swine fever virus introduction into the EU in 2014:Experience of Latvia[J]. Res Vet Sci,2016,105:28-30.
[3] SANCHEZ-VIZCAINO J M,MUR L,GOMEZVILLAMANDOS J C,et al. An update on the epidemiology and pathology of African swine fever[J]. J Comp Pathol,2015,152(1):9-21.
[4] SANCHEZ-VIZCAINO J M,MUR L. African swine fever diagnosis update[J]. Dev Biol(Basel),2013,135:159-165.
[5] OURA C A,EDWARDS L,BATTEN C A. Virological diagnosis of African swine fever--comparative study of available tests[J]. Virus Res,2013,173(1):150-158.
[6] PIEPENBURG O,WILLIAMS C H,STEMPLE D L,et al. DNA detection using recombination proteins[J]. PLoS Biol,2006,4(7):e204.
[7] CHAN K,WEAVER S C,WONG P Y,et al. Rapid,affordable and portable medium-throughput molecular device for zika virus[J]. Sci Rep,2016,6:38223.
[8] EULER M,WANG Y,NENTWICH O,et al. Recombinase polymerase amplif i cation assay for rapid detection of Rift Valley fever virus[J]. J Clin Virol,2012,54(4):308-312.
[9] ABD EL WAHED A,EL-DEEB A,EL-THOLOTH M,et al. A portable reverse transcription recombinase polymerase amplification assay for rapid detection of foot-and-mouth disease virus[J]. PLoS One,2013,8(8):e71642.
[10] KING D P,REID S M,HUTCHINGS G H,et al. Development of a TaqMan PCR assay with internal amplification control for the detection of African swine fever virus[J]. J Virol Methods,2003,107(1):53-61.
[11] 王建昌,王金凤,刘立兵,等.非洲猪瘟病毒RPA等温检测方法的建立[J]. 中国动物检疫,2016,33(7):78-81.
[12] LILLIS L,SIVERSON J,LEE A,et al. Factors influencing Recombinase polymerase amplification (RPA)assay outcomes at point of care[J]. Mol Cell Probes,2016,30(2):74-78.
(责任编辑:朱迪国)
Establishment of a Real-time Recombinase Polymerase Amplif i cation Assay for Rapid Detection of African Swine Fever Virus
Li Lin,Liu Fuxiao,Fan Xiaoxu,Li Jinming,Zou Yanli,Liu Shan,Bao Jingyue,Wu Xiaodong,Wang Zhiliang
(China Animal Health and Epidemiology Center,Qingdao,Shandong 266032)
African swine fever(ASF)is a transboundary swine disease,causing huge economic losses for swine industry in the world. At present,the prevalence of the disease has been spreading widely. In order to prevent the disease from being introduced into China,it is urgent to establish a fast,simple and reliable method. In this study,the specif i c primers and exo probes were designed and synthesized by analyzing the conserved region of B646L gene of African swine fever virus(ASFV). A real-time fl uorescence RPA method for detection of ASFV was established. The minimal detection limit of the novel real-time RPA assay was 16 copies per reaction,and the detection could be fi nished in 20 minutes. Cross reactivity with other swine associated viruses was not observed. The sensitivity and specif i city of the assay was comparable to that of the real-time PCR. 100 domestic samples were detected by this method,and the results were negative. The real-time RPA assay developed in this study was of great signif i cance of simple,fast,high sensitivity and strong specif i city,with wide application value in clinical differential diagnosis,laboratory quarantine and pathogen surveillance.
African swine fever;African swine fever virus;real-time RPA;real-time PCR
S851.3
A
1005-944X(2017)08-0087-05
10.3969/j.issn.1005-944X.2017.08.023
国家重点研发计划项目(2017YFC1200500);农业部动物疫情监测与防治项目
王志亮

