移植肾排异背景下血清多反应性IgG对凋亡细胞反应性升高并激活补体途径
贾 丹,荣春书,童 岚,高宝山*
(1.吉林大学第一医院,吉林 长春130021;2.长春中医药大学附属医院,吉林 长春130021)
*通讯作者
移植肾排异背景下血清多反应性IgG对凋亡细胞反应性升高并激活补体途径
贾 丹1,荣春书2,童 岚1,高宝山1*
(1.吉林大学第一医院,吉林 长春130021;2.长春中医药大学附属医院,吉林 长春130021)
抗体介导的排异反应(Antibody mediated rejection,AMR)是肾移植后导致移植物失功的主要原因之一。而AMR的核心特征是受者循环中出现针对移植物的抗体,此类抗体包括移植前预存于体内的抗体以及移植后新生抗体。当抗体为特异性识别供者所表达的HLA抗原时则被称为供者特异性抗体(Donor specific antibodies,DSA),而当抗体识别的是自身表达的抗原时则被称为自身抗体。 研究发现在AMR过程中另一种形式的抗体[1]表现出广泛的反应性,此类抗体可以与多种毫不相关的抗原诸如双链DNA、胰岛素、磷酸脂多糖以及多态性HLA分子发生反应。通过分子实验技术发现,其中一个单克隆的多反应性抗体由一个在循环中高度扩增的记忆性B淋巴细胞产生,而这个单克隆的B细胞占据了AMR患者外周血B细胞的0.2%。值得关注的是,AMR患者血清所识别的HLA位点恰好与这个高度扩增的B细胞克隆分泌的抗体所识别的HLA位点重合,此现象提示我们,多反应性抗体的存在可对肾移植患者总体血清反应性做出贡献。
在小鼠中,多反应性抗体由B1细胞产生,B1细胞作为固有B细胞的一个亚群,初始位于腹膜腔内而并非淋巴组织,B1细胞被认为分泌“自然抗体”,这些抗体可与程序性死亡的细胞发生反应并参与它们的清除。本文研究AMR过程中产生的多反应性抗体对凋亡细胞作用,从而评估此背景下B1细胞的反应性。
另一个重要问题,即多反应性抗体的临床意义及其在AMR中的作用。目前已经明确的是,DSA通过激活补体途径介导移植物组织损伤,而补体途径的激活可通过C4d分子沉积于移植物内膜细胞来揭示。本研究通过探索多反应性抗体是否也能激活补体途径,从而评估其对AMR病理进程造成的影响。
1 资料与方法
1.1 一般资料
本研究所用血清样本来源于:(1)肾移植术后移植肾功能正常的患者30例;(2)肾移植术后出现移植肾AMR的患者18例;(3)健康志愿者5例。其中,移植肾功能正常组患者与AMR组患者在性别构成、年龄、透析方式、移植前透析时间、原发病、体重指数、移植前诱导用药、免疫抑制方案等方面均无统计学差异。
1.2 方法
1.2.1 凋亡细胞的制备 Jurkat细胞株0.5×106/ml与200 ng/ml抗FAS抗体于37℃孵育箱内共孵育15小时。Annexin-V及7-AAD(BD公司)染色以确认细胞凋亡。
1.2.2 血清IgG纯化 将血清与纯化缓冲液以1∶10混匀后加入预装有吸附胶体及滤膜的纯化容器,6000 rpm离心2 min,通过滤膜落入Eppendorf试管中的稀释血清即纯化后的IgG抗体,收集待用。
1.2.3 血清IgG对凋亡细胞的反应性 将分别从肾移植患者及健康志愿者血清中纯化的IgG抗体与1×106诱导凋亡后的Jurkat细胞株混匀,37℃孵育30 min,低温洗涤二次,分别向标本中加入FITC耦联的抗IgG的二抗(Invitrogen公司),4℃避光孵育30 min。低温洗涤二次,流式细胞仪检测IgG对凋亡细胞的反应性。反应强度用平均荧光强度(MFI)表示。
1.2.4 C4d沉积实验 0.5×106Jurkat凋亡细胞分别与60 μl稀释成1∶2的纯化血清IgG于37℃孵育15 min。Hank's平衡盐以1∶100稀释健康志愿者血清做为补体来源加入样本,37℃孵育15 min。低温洗涤,于反应体系中加入抗C4d二抗(Quidel公司),4℃避光孵育30 min。低温洗涤二次,加入FITC耦联的鼠抗人IgG二抗(BD公司),4℃避光孵育30 min。低温洗涤后用流式细胞仪检测凋亡细胞表面C4d沉积情况。C4d沉积强度用MFI表示。
1.2.5 移植肾活检组织C4d及活化caspase-3免疫荧光染色 来自2例AMR患者移植肾穿刺组织,连续冰冻切片风干30 min并于PBS液中漂洗,抗C4d抗体(1∶100,Quidel公司)及抗caspase-3抗体(1/50,BD公司)分别染色1 h,漂洗后加入羊抗兔IgG二抗(1/200,Vector公司)孵育30 min,漂洗后分别加入FITC-streptavidin (1/150,Vector公司)以及Cy3-streptavidin(1/5000,Jackson公司)。应用Olympus BX60荧光显微镜观察切片染色情况。
1.2.6 统计学方法 Student非配对t检验用以比较各组间血清IgG对凋亡细胞的反应性及补体激活能力,P<0.05为差异具有统计学意义。
2 结果
2.1 血清IgG对凋亡细胞的反应性比较
本研究分别检测了健康志愿者、移植肾功能正常患者、AMR患者血清IgG对凋亡细胞的反应性,结果显示(图1),分别与移植肾功能正常者及健康志愿者相比较,AMR患者血清IgG对凋亡细胞的反应性显著升高,差异具有统计学意义(P<0.0001,P=0.030)。

图1 不同组别血清IgG对凋亡细胞的反应性
2.2 血清IgG对补体激活能力的比较
在移植肾功能异常的病例中,可通过检测移植物组织中C4d的沉积来揭示是否有补体途径的参与。本研究中,我们利用体外实验检测肾移植患者及健康志愿者血清IgG与凋亡细胞反应后能否激活补体途径。如图2所示,分别与移植肾功能正常者及健康志愿者相比较,AMR患者血清IgG与凋亡细胞反应后,具有更强的补体激活能力,导致C4d沉积于靶细胞表面的强度显著增加(P=0.0033,P=0.038)。
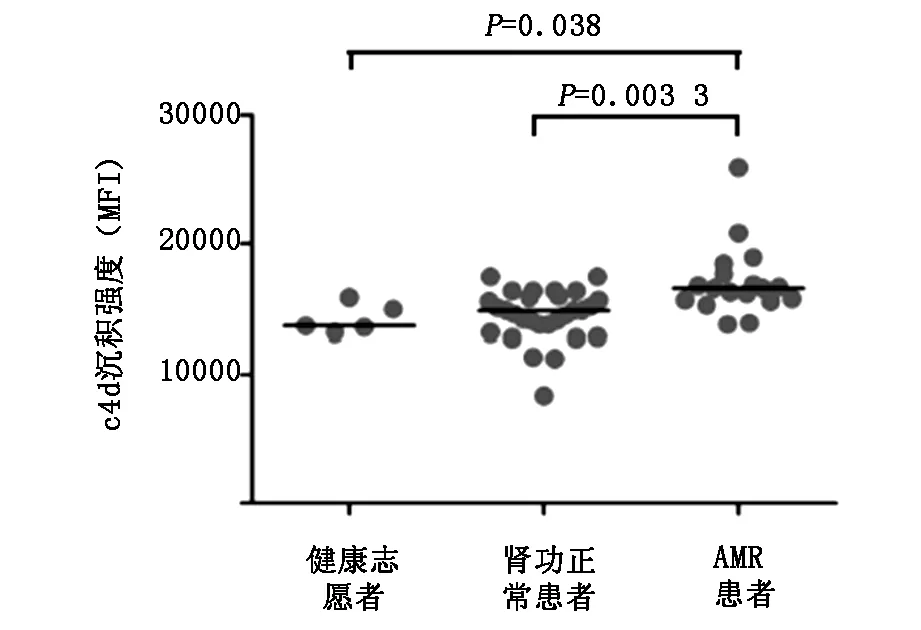
图2 不同组别血清IgG激活补体途径的能力
2.3 移植肾活检组织中C4d与活化caspase-3的共区域化现象
AMR的典型病理特征是补体代谢产物C4d的沉积,而活化的caspase-3是细胞凋亡的证据。我们体外研究证实,AMR患者血清中纯化的IgG抗体可以与凋亡细胞反应并激活补体途径。在移植肾组织中也观察到了类似现象:对移植肾组织的荧光染色结果显示,移植肾组织中C4d与活化的caspase-3的共区域化现象(图3),说明细胞凋亡与补体途径的激活可共存于发生AMR的移植肾组织中。
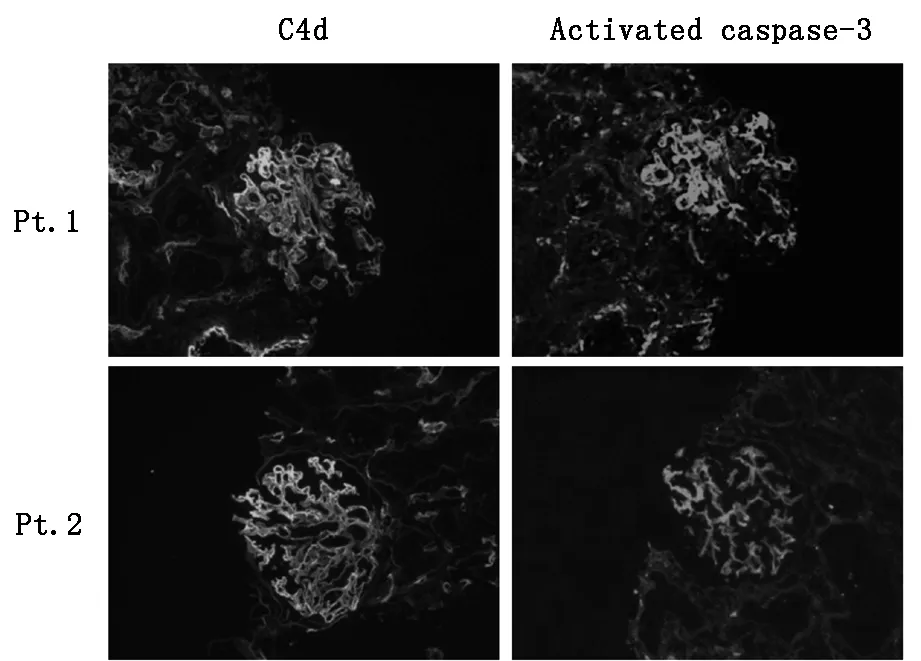
图3 移植肾组织C4d及caspase-3荧光染色
3 讨论
有学者研究报道[1]在AMR过程中发现的一类抗体,既不是同种异体特异性也并非自身反应性的,这类抗体可与广泛的抗原诸如核酸及多态性HLA分子发生反应,从而表现为多反应性。尽管既往对多反应性单克隆抗体的深度鉴定仅限于一个肾移植患者,但本研究将此发现扩展至其他AMR的患者。结果显示,相对于移植物功能正常的患者,AMR患者血清中多反应性IgG的活性显著升高。表明此类抗体作为免疫反应的组成部分与AMR相关。然而多反应性IgG的产生原因尚不明确。既往有报道[2],自身抗体在细胞凋亡后可以与隐蔽抗原相结合,基于这个原因,我们不能排除部分多反应性抗体是由于单克隆自身抗体的存在所致。
多反应性抗体初始形式为IgM,其被认为是免疫系统中自身反应性的组成部分,也有研究发现类型转换的多反应性IgG[3,4],但多与病理过程相关。例如在系统性红斑狼疮中,多反应性IgM通过类型转换变成IgG后可能具有致病作用[5]。多反应性IgM抗体如何转换成致病性IgG尚不明确,但在多种环境下,自然抗体可因凋亡细胞的暴露而改变活性,AMR与移植肾多部位调亡细胞数量的增加密切相关,这个过程中凋亡细胞的爆发性增加可能触发具有调亡细胞反应性的B细胞的类型转换,如果这个假设正确,多反应性抗体可随着移植物内细胞凋亡的进展而出现。
研究发现[1],经历AMR的患者血液中出现高频度的B细胞克隆,这个高频度表明此B细胞克隆在体内经历了扩增,而这个过程与免疫球蛋白重链区的体细胞突变的累积以及相对应永生化B细胞克隆表达CD27记忆性标志是一致的。这个B细胞克隆也可与诸多自身抗原、HLA I类抗原以及凋亡细胞发生反应。我们认为这个B细胞克隆并非特例,而是具有代表性的一个克隆。这类记忆性B细胞在生理条件下可分泌自然抗体IgM。移植物排异反应过程中,在炎症反应的背景下,受到凋亡细胞刺激后,这些多反应B细胞可扩增,经历类型转换重排后分泌IgG。类似凋亡细胞刺激导致的自然抗体和自身反应性抗体的扩增已在动物实验中得到证实[6]。
C4d沉积是AMR的标志。目前普遍接受的观点是移植肾病理中发现的C4d沉积源于DSA与供体内皮细胞表达的HLA抗原相结合。我们的体外研究显示,多反应性的单克隆抗体及从AMR患者血清中纯化的多反应性IgG可以激活补体途径,C4d沉积于靶细胞表面,我们也观察到AMR患者移植肾组织中C4d与活化的caspase-3的共区域化现象,而这些移植肾组织中均可将检测到凋亡细胞。综合以上发现,说明AMR患者中,除了DSA以外,血清中的多反应性抗体也可导致C4d在移植物中的沉积。值得关注的是,Haidar等人[7]在肾移植患者中发现了红细胞表面C4d沉积程度与ARM的相关性。既然红细胞来源于器官移植受者,不会成为DSA的靶细胞,因此有理由假设多反应性抗体很可能在此过程中发挥了作用。值得重视的是,C4d在红细胞表面的沉积也被发现并作为系统性红斑狼疮进展程度的标志[8-10]。然而需要进一步研究来明确这些具有补体激活能力的多反应性抗体是否有细胞毒性,毕竟并非所有的C4d沉积都与移植物损伤有关[11]。
[1]Porcheray F,DeVito J,Helou Y,et al.Expansion of polyreactive B cells cross-reactive to HLA and self in the blood of a patient with kidney graft rejection[J].Am J Transplant,2012,12(8):2088.
[2]Kim SJ,Gershov D,Ma X,et al.Elkon KB:I-PLA(2) activation during apoptosis promotes the exposure of membrane lysophosphatidylcholine leading to binding by natural immunoglobulin M antibodies and complement activation[J].J Exp Med,2002,196(5):655.
[3]Ikematsu H,Kasaian MT,Schettino EW,et al.Structural analysis of the VH-D-JH segments of human polyreactive IgG mAb.Evidence for somatic selection[J].J Immunol,1993,151(7):3604.
[4]Zhou ZH,Tzioufas AG,Notkins AL.Properties and function of polyreactive antibodies and polyreactive antigen-binding B cells[J].J Autoimmun,2007,29(4):219.
[5]Zhang J,Jacobi AM,Wang T,et al.Polyreactive autoantibodies in systemic lupus erythematosus have pathogenic potential[J].J Autoimmun,2009,33(3-4):270.
[6]Mevorach D,Zhou JL,Song X,et al.Systemic exposure to irradiated apoptotic cells induces autoantibody production[J].J Exp Med,1998,188(2):387.
[7]Haidar F,Kisserli A,Tabary T,et al.Comparison of C4d detection on erythrocytes and PTC-C4d to histological signs of antibody-mediated rejection in kidney transplantation[J].Am J Transplant,2012,12(6):1564.
[8]Liu CC,Manzi S,Kao AH,et al.Reticulocytes bearing C4d as biomarkers of disease activity for systemic lupus erythematosus[J].Arthritis Rheum,2005,52(10):3087.
[9]Manzi S,Navratil JS,Ruffing MJ,et al.Measurement of erythrocyte C4d and complement receptor 1 in systemic lupus erythematosus[J].Arthritis Rheum,2004,50(11):3596.
[10]Singh V,Mahoney JA,Petri M.Erythrocyte C4d and complement receptor 1 in systemic lupus erythematosus[J].J Rheumatol,2008,35(10):1989.
[11]Colvin RB.Antibody-mediated renal allograft rejection:diagnosis and pathogenesis[J].J Am Soc Nephrol,2007,18(4):1046.
1007-4287(2017)07-1242-03
2016-07-20)

