肺结核患者血清维生素D与外周血T淋巴细胞亚群水平变化及临床意义
周颖 董伟毅 倪佩青 钟慧君 俞萍
·论著·
肺结核患者血清维生素D与外周血T淋巴细胞亚群水平变化及临床意义
周颖 董伟毅 倪佩青 钟慧君 俞萍
目的 探讨肺结核患者血清25-羟基维生素D[25-(OH)D]与血清T淋巴细胞亚群水平的变化及临床意义。方法 于2012年2 月至2014年5月收集上海市徐汇区中心医院结核病防治门诊诊治的386例肺结核患者作为肺结核组;选取同期在医院进行健康体检的647名健康人群作为健康对照组。肺结核组中所有患者均进行了规范的抗结核药物治疗,采用数字表法随机选取 44例患者在抗结核药物治疗基础上增加维生素D治疗,作为治疗组;选取45例患者不增加维生素D治疗,作为治疗对照组。采用液相色谱-质谱联用法(LC-MS/MS)测定研究对象血清25-(OH)D2、25-(OH)D3和T淋巴细胞亚群CD3+、CD4+、CD8+绝对值水平,比较肺结核组与健康对照组,以及维生素D治疗组和治疗对照组上述指标的变化情况。结果 肺结核组患者25-(OH)D、25-(OH)D2、25-(OH)D3水平分别为31.3(22.5~41.5)、0.3(0.0~1.5)、31.9(22.3~41.1) nmol/L,明显低于健康对照组的42.0(34.3~51.5)、2.0(1.5~3.6)、40.1(31.9~49.5) nmol/L,差异有统计学意义(Z值分别为12.19、16.42、9.89,P值均<0.01);肺结核组CD3+、CD4+、CD8+绝对值水平分别为968.0(800.0~1164.0)、524.0(460.0~656.0)、394.0(288.0~512.0)个/μl,明显低于健康对照组的1324.0(1116.0~1568.0)、708.0(568.0~864.0)、524.0(412.0~652.0)个/μl,差异均有统计学意义(Z值分别为15.68、13.30、12.15,P值均<0.01)。肺结核维生素D治疗组25-(OH)D3、25-(OH)D以及CD3+绝对值水平在治疗6个月分别为39.3(31.7~54.5) nmol/L、46.5(36.0~57.5) nmol/L、1268.0(1012.0~1448.0)个/μl,高于治疗对照组同期水平[39.3(34.3~45.8) nmol/L、38.0(33.8~44.8) nmol/L、1008.0(752.0~1212.0)个/μl],差异有统计学意义(Z值分别为2.57、1.45、2.41,P值分别为0.012、0.150、0.018)。结论 肺结核患者血清25-(OH)D及外周血T淋巴细胞亚群水平低下,纠正维生素D的缺乏或不足可改善患者的细胞免疫功能。
结核,肺; 维生素D; T淋巴细胞亚群; 横断面研究
维生素D是一种脂溶性维生素,除具有调控钙、磷代谢和骨稳定状态等作用外,还参与宿主防御、炎症、免疫调节和修复等一系列病理生理过程[1]。研究表明,维生素D能作用于各种免疫细胞表面的维生素D受体(VDR)调节免疫系统[2],尤其是T淋巴细胞,维生素D能诱导其增殖分化[3]。笔者采用液相色谱-质谱-质谱(LC-MS-MS)联用法测定肺结核患者的血清25-羟基维生素D[25-(OH)D]水平,以及血清T淋巴细胞亚群CD3+、CD4+、CD8+绝对值水平,探讨肺结核患者血清25-(OH)D水平与外周血T 淋巴细胞亚群水平的变化及临床意义。
对象和方法
1.对象:于2012年2 月至2014年5月收集上海市徐汇区中心医院结核病防治门诊诊治的386例肺结核患者作为肺结核组;选取同期在医院进行健康体检的647名健康人群作为健康对照组。肺结核组中所有患者均进行了规范的抗结核药物治疗,应用随机数字表法选取 44例患者在抗结核药物治疗基础上增加维生素D治疗,作为治疗组;选取45例患者不增加维生素D治疗,作为治疗对照组。研究对象均签署知情同意书。
2.纳入排除标准:(1)肺结核组:参照《肺结核诊断标准》(WS288-2008),根据患者临床症状、体征、胸片、CT扫描结果、痰菌检查确诊,排除肝肾功能不全、恶性肿瘤、3个月内服用含维生素D保健品及药品者。(2)健康对照组:体检健康者,排除肝肾功能不全、恶性肿瘤、3个月内服用含维生素D的保健品及药品者。(3)患者治疗组:在确诊的肺结核患者中,排除年龄>65岁、<18岁的患者,应用数字表随机抽取44例患者在规范抗结核药物治疗的基础上增加维生素D治疗,即口服阿法骨化醇软胶囊(南通华山药业有限公司),0.25 μg/片,每次0.5 μg(2粒),1次/d。(4)治疗对照组:在确诊肺结核患者中,数字表法随机抽取45例患者,进行规范的抗结核药物治疗,不增加维生素D治疗,仅监测外周血维生素D及T淋巴细胞亚群水平。
3.维生素D检测:抽取研究对象空腹血清,采用LC-MS-MS法,以25-羟基维生素D2-氘3和25-羟基维生素D3-氘6为内标,测定25-(OH)D2和25-(OH)D3,用 Analyst 1.5软件采集检测数据并作定量分析。API 4000串联质谱仪购自美国AB Sciex公司,Shimadzu系列液相色谱仪购自日本島津公司。低、中、高浓度质控的准确度为85%~115%,精密度(CV)应在15%以内。
4.外周血T淋巴细胞亚群检测:采用 FACS流式细胞仪(美国BD公司),试剂由美国 BD公司提供,严格按照操作程序优化机器检测条件,进入Multi SE 自动运行软件,进行绝对计数质量控制和样本检测。
结 果
1.一般资料:肺结核组共386例,其中男 205例(53.1%),女181例(46.9%);年龄 15~84岁,平均年龄(39.21±17.86)岁。健康对照组共647名,其中男336名(51.9%),女311名(48.1%);年龄23~60岁,平均年龄(39.79±15.77)岁。两组研究对象性别、年龄差异无统计学意义,均衡可比(χ2=0.13,P=0.714;t=-0.54,P=0.590)。
患者治疗组44例中有3例拒绝使用维生素D治疗,故最终纳入41例患者。其中,男17例(41.5%),女24例(58.5%);平均年龄(34.82±18.30)岁;初治38例(92.7%),复治3例(7.3%);菌阳15例(36.6%),菌阴26例(63.4%)。治疗对照组45例患者中,男18例(40.0%),女27例(60.0%);平均年龄(41.27±18.00)岁;初治43例(95.6%),复治 2例(4.4%);菌阳 16例(35.6%),菌阴 29例(64.4%)。两组研究对象性别、年龄、初复治情况、菌阴菌阳情况差异均无统计学意义,均衡可比(χ2=0.02,P=0.890;t=-1.64,P=0.104;χ2=0.32,P=0.570;χ2=0.01,P=1.000)。
2.肺结核组与健康对照组比较:肺结核患者的25-(OH)D[包括25-(OH)D2和25-(OH)D3] 及CD3+、CD4+、CD8+绝对值水平均低于健康对照组,差异均有统计学意义(表 1)。
3.维生素D治疗组与治疗对照组的比较:维生素D治疗组与治疗对照组在治疗前25-(OH)D3、25-(OH)D水平及CD3+、CD4+、CD8+绝对值水平差异无统计学意义(Z值分别为0.86、1.02、0.44、0.81、0.35,P值分别为0.390、0.310、0.662、0.416、0.729)。治疗组在治疗2个月和6个月时25-(OH)D、25-(OH)D3水平及CD3+、CD4+、CD8+绝对值水平均较治疗前明显上升,差异有统计学意义(2个月与治疗前差值的统计量S值分别为207.5、204.5、202.0、64.5、82.5,P值分别为0.004、0.005、0.007、0.393、0.291;6个月与治疗前差值的统计量S值分别为316.5、255.5、255.5、188.0、159.5,P值分别为0.000、0.001、0.000、0.013、0.030);与治疗对照组同期相比,25-(OH)D3、25-(OH)D及CD3+绝对值水平明显高于治疗对照组,差异有统计学意义(治疗2个月:Z值分别为2.04、2.10、2.49,P值分别为0.045、0.039、0.015;治疗6个月:Z值分别为2.57、1.45、2.41,P值分别为0.012、0.150、0.018)。治疗对照组患者治疗6个月期间25-(OH)D3、25-(OH)D及CD3+、CD4+、CD8+绝对值水平差异无统计学意义(2个月与治疗前差值S值分别为42.0、36.5、-98.5、26.0、1.0,P值分别为0.641、0.685、0.271、0.773、0.991;6个月与治疗前差值S值分别为204.5、197.5、0.5、35.5、42.0,P值分别为0.019、0.024、0.996、0.693、0.641),见表2。
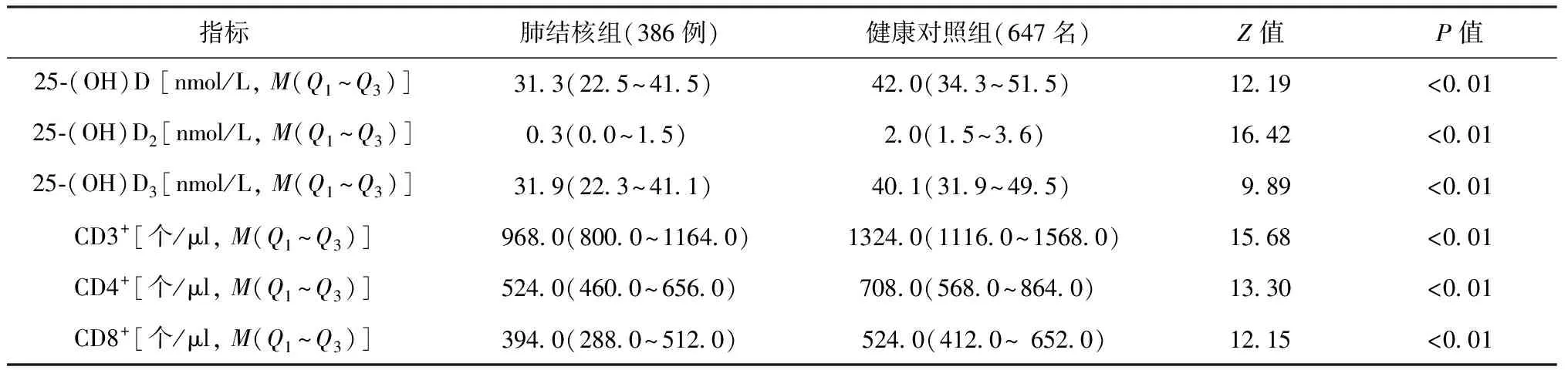
表1 25-(OH)D及T淋巴细胞亚群水平在肺结核组和健康对照组间的比较
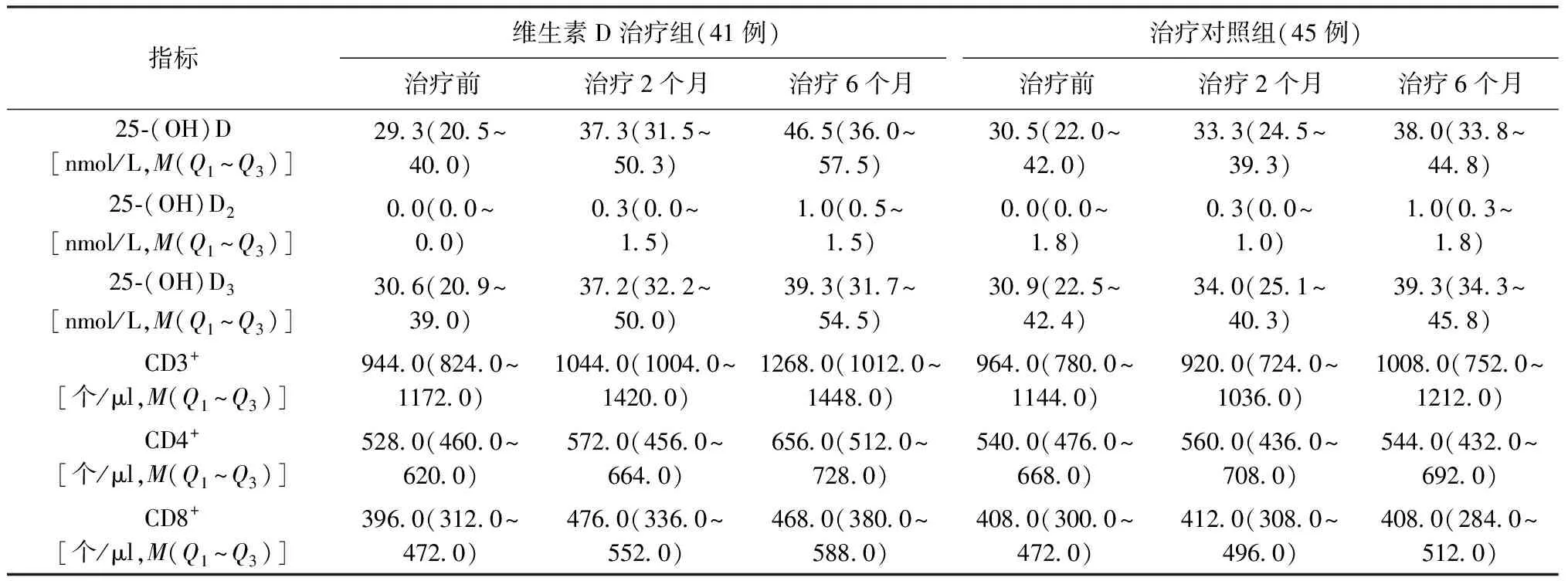
表2 25-(OH)D和T淋巴细胞亚群水平在肺结核维生素D治疗组与治疗对照组间的比较
讨 论
在科学家揭示了紫外光对皮肤结核有治疗作用并因此获得诺贝尔奖100多年后,研究人员终于弄清楚从阳光到维生素D到身体的识别结核分枝杆菌和对其发动免疫反应关键能力的途径,发现结核分枝杆菌感染发病与维生素D缺乏相关[4-5]。
维生素D在经肝、肾内羟基化后,形成具有生物活性的1,25-二羟基维生素D3,称为活性维生素D,但1,25-二羟基维生素D3在人体内的稳定性不如25-(OH)D3。25-(OH)D3是血清中多种维生素D代谢产物中含量最多且最稳定的一种[6],故以25-(OH)D3作为衡量体内维生素D水平的主要指标。传统观念认为25-(OH)D3仅与机体钙磷代谢有关,但近期研究表明,25-(OH)D3不仅具有调节钙磷代谢的作用,还具有神经内分泌及免疫调节的作用,其免疫调节的靶细胞主要为T淋巴细胞群族,单核细胞等[7],主要作用为正向的促增殖,从而提高机体细胞免疫功能。T淋巴细胞亚群水平的高低,是反应细胞免疫功能的重要指标[8],维生素D与T细胞亚群水平的变化需进一步的研究。此类相关研究在国内较为缺乏。笔者通过随访肺结核患者抗结核药物治疗过程中维生素D与T细胞亚群水平的变化,以及部分肺结核患者在常规抗结核治疗的基础上增加足量的维生素D治疗后维生素D与T细胞亚群水平的变化,探讨维生素D与T细胞亚群水平变化的临床意义,具有一定的科学依据。
本研究肺结核组患者总25-(OH)D[包括25-(OH)D2和25-(OH)D3]以及CD3+、CD4+、CD8+绝对值水平明显低于健康对照组,予以抗结核药物治疗后无论治疗组还是治疗对照组25-(OH)D3、25-(OH)D以及CD3+、CD4+、CD8+绝对值水平均较治疗前上升;肺结核患者血清25-(OH)D水平及外周血T 淋巴细胞亚群水平降低,证实维生素D缺乏抑制机体细胞免疫功能[9],从而导致机体对结核分枝杆菌易感,随着结核的治愈,细胞免疫功能改善,维生素D恢复正常水平。
肺结核患者在常规抗结核药物治疗的基础上增加足量的维生素D治疗,以提高患者免疫功能,协同提高抗结核药物治疗、提高肺结核治愈率[10]。本研究提示,增加维生素D治疗组25-(OH)D3、25-(OH)D以及CD3+、CD4+、CD8+绝对值水平在治疗2个月、6个月后均较治疗前明显上升,明显高于治疗对照组同期水平。25-(OH)D3水平低的肺结核患者,其机体免疫功能比较低下,如果能补充维生素D,使患者25-(OH)D3维持正常或较高水平,不仅可诱导、调节T淋巴细胞族群进一步分化,而且提高细胞免疫功能[11],对使患者在合理用药的基础上尽快康复具有重要的作用。但也有多中心、随机、双盲、安慰剂对照的有效性研究显示,活动性肺结核患者标准化疗方案基础上加用维生素D不能缩短患者的痰菌阴转时间[12],而由于本研究的研究对象例数有限,故尚需进一步研究。
维生素D在20世纪40年代末期曾用来治疗结核病。20世纪50年代中期,随着抗结核药物的出现,维生素D用来治疗结核的关注度已明显下降。通过维生素D治疗提高细胞免疫功能,是否可用作治疗结核病的辅助药物,是否适合对结核病密切接触和潜伏感染者用药,以及其对改善结核病患者预后情况等仍需要进一步研究。
[1] 王艳丽, 解卫平, 王虹, 等. 1,25-二羟维生素D3对结核病的免疫调节作用. 中华结核和呼吸杂志, 2013, 36(10): 772-774.
[2] Borges MC, Martini LA, Rogero MM, et al. Current perspectives on vitamin D, immune system, and chronic diseases. Nutrition, 2011, 27(6): 399-404.
[3] Maalouf NM. The noncalciotropic actions of vitamin D: recent clinical developments. Curr Opin Nephrol Hypertens, 2008, 17(4): 408-415.
[4] 郑晓艳. 维生素D3水平LC-MS/MS法检测方法研究及肺结核患者血清维生素D水平分析.青岛:青岛大学, 2012.
[5] 韩骏锋, 吴琦. 血清维生素D水平与活动性肺结核患病的相关性. 中国防痨杂志, 2016, 38(4): 312-315.
[6] Zeitz U, Weber K, Soegiarto DW, et al. Impaired insulin secretary capacity in mice lacking a functional vitamin D receptor. FASEB J, 2003, 17(3): 509-511.
[7] Khoo AL, Chai LY, Koenen HJ, et al. Vitamin D(3) down-regulates proinflammatory cytokine response toMycobacteriumtuberculosisthrough pattern recognition receptors while inducing protective cathelicidin production. Cytokine, 2011, 55(2): 294-300.
[8] 张慧洁, 陈兰举, 陈名武. T淋巴细胞亚群在结核感染免疫反应中的作用. 实用儿科临床杂志, 2006, 21(19): 1342-1343.
[9] 林得志, 张泽华, 李力韬, 等. 维生素D缺乏对脊柱结核患者T淋巴细胞亚群影响的研究. 中国矫形外科杂志, 2012, 20(5): 448-450.
[10] Luong Kv, Nguyen LT. Impact of vitamin D in the treatment of tuberculosis. Am J Med Sci, 2011, 341(6): 493-498.
[11] Lehouck A, Mathieu C, Carremans C, et al. High doses of vitamin D to reduce exacerbations in chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med, 2012, 156(2): 105-114.
[12] Daley P, Jagannathan V, John KR, et al. Adjunctive vitamin D for treatment of active tuberculosis in India: a randomised, double-blind, placebo-controlled trial. Lancet Infect Dis, 2015, 15: 528-534.
(本文编辑:李敬文)
The changes and significance of 25-hydroxy vitamin D and T lymphocyte subsets levels in patients with pulmonary tuberculosis
ZHOUYing,DONGWei-yi,NIPei-qing,ZHONGHui-jun,YUPing.
DepartmentofInfectiousDiseases,ShanghaiXuhuiCenterHospital,Shanghai200031,China
ZHOUYing,Email:yingzhouwu@hotmail.com
Objective To investigate the changes and clinical significance of serum 25-hydroxy vitamin D (25-(OH)D) and peripheral blood T lymphocyte subsets levels in patients with pulmonary tuberculosis. Methods From Feb 2012 to May 2014, 386 cases of pulmonary tuberculosis patients and 647 healthy controls in Shanghai Xuhui Center Hospital were enrolled. All cases received standard anti-tuberculosis treatment. By using random number method, 44 patients were assigned to receive standard anti-tuberculosis treatment and vitamin D therapy (vitamin D treatment group), while 45 patients were assigned to receive standard anti-tuberculosis treatment only (control group). By using liquid chromatography and mass spectrometry (LC-MS/MS), serum 25-(OH)D2, 25-(OH)D3, CD3+, CD4+, CD8+T lymphocyte subsets levels were determined in all subjects. The changes were compared between pulmonary tuberculosis patients and healthy controls as well as between vitamin D treatment and control groups. Results The levels of 25-(OH)D, 25(OH)D2, and 25(OH)D3in pulmonary tuberculosis patients (31.3 (22.5-41.5), 0.3 (0.0-1.5), and 31.9 (22.3-41.1) nmol/L) were significantly lower than those in the healthy controls (42.0 (34.3-51.5), 2.0 (1.5-3.6), and 40.1 (31.9-49.5) nmol/L); the differences were statistically significant (Z=12.19, 16.42, and 9.89, respectively; allP<0.01). The CD3+, CD4+, and CD8+absolute value levels in pulmonary tuberculosis patients (968.0(800.0-1164.0)/μl, 524.0 (460.0-656.0)/μl, and 394.0 (288.0-512.0)/μl) were significantly lower than those in healthy controls (1324.0 (1116.0-1568.0)/μl, 708.0 (568.0-864.0)/μl, and 524.0 (412.0- 652.0)/μl); the differences were statistically significant (Z=15.68, 13.30, and 12.15, respectively; allP<0.01). In the vitamin D treatment group, the levels of 25-(OH)D3, 25-(OH)D, CD3+after 6 months of treatment were 39.3 (31.7-54.5) nmol/L, 46.5 (36.0-57.5) nmol/L and 1268.0 (1012.0-1448.0)/μl, which were higher compared with the control group (39.3 (34.3-45.8) nmol/L, 38.0 (33.8-44.8) nmol/L and 1008.0 (752.0-1212.0)/μl; the differences were statistically significant (Z=2.57, 1.45, 2.41, respectively;P=0.012, 0.150, 0.018, respectively). Conclusion The levels of serum 25-(OH)D and peripheral blood T lymphocyte subsets in patients with pulmonary tuberculosis are decreased. Correcting vitamin D deficiency/insufficiency can improve cellular immune function of patients with pulmonary tuberculosis.
Tuberculosis, pulmonary; Vitamin D; T-lymphocyte subsets; Cross-sectional studies
10.3969/j.issn.1000-6621.2017.08.019
上海市徐汇区医学科研项目(SHXH201204)
200031 上海市徐汇区中心医院感染性疾病科
周颖,Email:yingzhouwu@hotmail.com
2017-02-23)

