环介导核酸等温扩增技术对疑似结核病患者的筛查效果
孙娇 王悦 孙秀华 彭娇 邢黎莉 孙炳奇
·论著·
环介导核酸等温扩增技术对疑似结核病患者的筛查效果
孙娇 王悦 孙秀华 彭娇 邢黎莉 孙炳奇
目的 评价环介导核酸等温扩增(loop-mediated isothermal amplification,LAMP)技术对疑似结核病患者的筛查效果。方法 选取沈阳市第十人民医院2015年5月至2016年6月收治的疑似结核病患者604例,收集标本604份,其中痰标本503份,胸腔积液抽取液98份,支气管肺泡灌洗液3份,分别行涂片抗酸染色镜检(简称“涂片镜检”)、改良罗氏固体培养(简称“固体培养”)、MGIT 960液体培养(简称“液体培养”)和LAMP检测,以临床诊断结果为标准,评价4种检测技术对结核病患者的检测效能,采用χ2检验比较结核分枝杆菌的阳性检出率,以P<0.05为差异有统计学意义。结果 以临床诊断结果为参照,LAMP检测、涂片镜检、液体培养、固体培养的敏感度分别为72.78%(262/360)、51.67%(186/360)、66.67%(240/360)和59.17%(213/360);特异度分别为88.11%(215/244)、99.59%(243/244)、99.59%(243/244)和99.59%(243/244),并且具有良好的一致性(Kappa值依次为0.58、0.46、0.61和0.54)。LAMP检测对病程<1年患者的阳性检出率[45.76%(189/413)]明显高于涂片镜检[27.12%(112/413)]、液体培养[37.05%(153/413)]和固体培养[31.48%(130/413)](χ2=62.41、16.62、40.95,P值均=0.000)。当患者出现的临床症状≤5个时,LAMP的阳性检出率(44.37%,268/604)明显高于涂片镜检(28.15%,170/604)、液体培养法(36.75%,222/604)和固体培养法(32.12%,194/604)(χ2值分别为76.22、21.59和47.21,P值均=0.000)。LAMP检测对涂片镜检阴性,液体培养及固体培养阴性标本具有较高的阳性检出率[分别为28.78%(120/417),(21.49%(78/363)和25.90%(101/390)]。结论 LAMP技术检测结核分枝杆菌较涂片镜检、液体培养和固体培养检测效能高,适用于病程短、临床症状较轻(1~5个症状)、涂阴和培阴的疑似结核病患者的筛查。
核酸扩增技术; 结核,肺; 多相筛查; 对比研究
结核病是由结核分枝杆菌感染引起的一种全球性的慢性传染病,2015年全球新发患者估算约为1040万例,但由于缺乏检测病原菌准确、快速、有效的技术手段,造成很多患者漏诊,实际报告的患者例数远远低于这一数据[1-3]。近年来,分子生物学诊断方法发展迅猛,并以其高敏感度、高特异度和耗时短等优点而备受推崇。然而,同传统的涂片抗酸染色法(简称“涂片镜检”)、MGIT 960液体培养(简称“液体培养”)和改良罗氏固体培养(简称“固体培养”)相比较,分子生物学的检测费用相对较高,这也限制了此类技术在经济欠发达地区的广泛应用。既能发挥分子生物学技术的检测优势,又能避免该检测技术的过度使用,已成为必须面对的难题。笔者以临床确诊的患者为检测参照,对比分析了环介导等温扩增检测(loop-mediated isothermal amplification,LAMP)技术与涂片镜检、液体培养和固体培养对疑似结核病患者的检测结果,以期发现适合LAMP技术的人群,达到快速、经济、有效、准确地诊断结核病的目的。
资料和方法
一、一般资料
1.患者的基本情况:选取沈阳市第十人民医院2015年5月至2016年6月收治的疑似结核病患者604例,其中男426例,年龄16~93岁,平均(52.08±17.63)岁;女178例,年龄11~89岁,平均(49.87±19.88)岁。采集各类标本604份(每例患者提供1份标本,痰标本优先),其中痰标本503份(晨起痰),胸腔积液抽取液98份,支气管肺泡灌洗液3份。最终临床确诊的肺结核患者为360例,未确诊患者为244例(由于缺乏检测病原菌准确、快速、有效的技术手段,造成目前临床诊断的结核病患者例数远远低于实际患者数)。本研究经本院伦理委员会批准,所有患者均签署知情同意书。
2.研究项目:大多数的文献研究均按照标本类型进行分析[4-8],可经过数据分析发现,LAMP对不同年龄、病程、临床症状和肺部病变严重程度不同的患者其筛查效果是不同的,因此笔者尝试依据患者的不同临床特点(年龄、病程、临床症状数量和肺部病变严重程度)分别进行数据分析,以期发现LAMP技术对不同临床特点患者检测效果的差异。(1)本组患者年龄分布情况:<20岁16例,20~岁149例,40~岁239例,≥60岁200例。(2)本组患者病程分布情况:<1年413例,1~5年117例,6~10年31例,11~20年13例,>20年30例。(3)本组患者临床症状发生个数分布情况:分析结核病患者常见的7个临床症状(发热、咳嗽、咯痰、咯血、消瘦、盗汗和胸痛),≤2个症状83例,3个症状167例,4个症状194例,5个症状113例,6个症状42例,7个症状5例。(4)本组患者肺部发生空洞的情况:有空洞133例,无空洞471例。
二、诊断标准
1.疑似肺结核:为胸部影像学检查符合结核病影像学特征者,具体诊断标准参见《肺结核诊断标准(WS288-2008)》[9]。
2.肺结核临床诊断:所有研究对象均经临床症状及体征、胸部影像学检查、标本细菌学检查,来确诊肺结核(诊断标准参见《肺结核诊断标准(WS288-2008)》[9])。
三、检测方法
本研究分别采用LAMP检测、涂片镜检、液体培养和固体培养对标本中结核分枝杆菌进行检测,所有检测均在标本采集后2 h内进行,避免因标本长期保存、细菌活力下降而造成检测结果异常。
1.涂片镜检:对采集的标本进行荧光法涂片镜检(金胺O染色),标本的收集、涂片、镜检流程按照《结核病诊断实验室检验规程》[10]进行操作。结果报告抗酸杆菌阴性为连续观察300个不同视野,未发现抗酸杆菌;若发现1条以上,即报告为阳性。
2.结核分枝杆菌细菌培养:取1 ml标本,向其加入1~1.5 ml的4%N-乙酰-L-半胱氨酸-NaOH枸橼酸钠溶液进行消化,旋紧盖子,在涡旋振荡器上涡旋振荡10~20 s,直至标本充分液化。将离心管室温静置15 min,加入磷酸盐缓冲液(pH 6.8)至40 ml,3000×g离心20 min。取100 μl和500 μl处理后的样品分别接种至分枝杆菌生长指示管[10]和改良罗氏培养基[11]中,37 ℃温箱培养。当生长指示管呈阳性结果,同时该培养物涂片抗酸染色也为阳性时,报告液体培养阳性。固体培养结果判定为接种后第3天和第7天观察培养情况,此后每周观察1次,直至第8个周末,无菌落生长报告培养阴性,发现典型结核分枝杆菌菌落形态即报告为阳性。
3. LAMP检测:本研究中LAMP检测所用试剂盒(loop amp PURE DNA提取试剂盒和loop amp MTBC检测试剂盒)为日本荣研株式会社的商品化试剂盒,所有操作均严格遵循操作说明书。将60 μl样本加入吸附剂试管中,充分混匀并加热裂解(90 ℃,5 min)。然后,将吸附试管装到样本处理管上,摇晃几次后得到初提的核酸,在样本处理管上加上滴注盖,轻压样本处理管将样本滴入到反应管中。盖上管盖,充分混合后即可进行LAMP反应,反应结束后直接放入荧光目视检测单元,通过自带的紫外线激发荧光观察反应结果。阳性:发出绿色荧光;阴性:未发出荧光。
四、 统计学分析
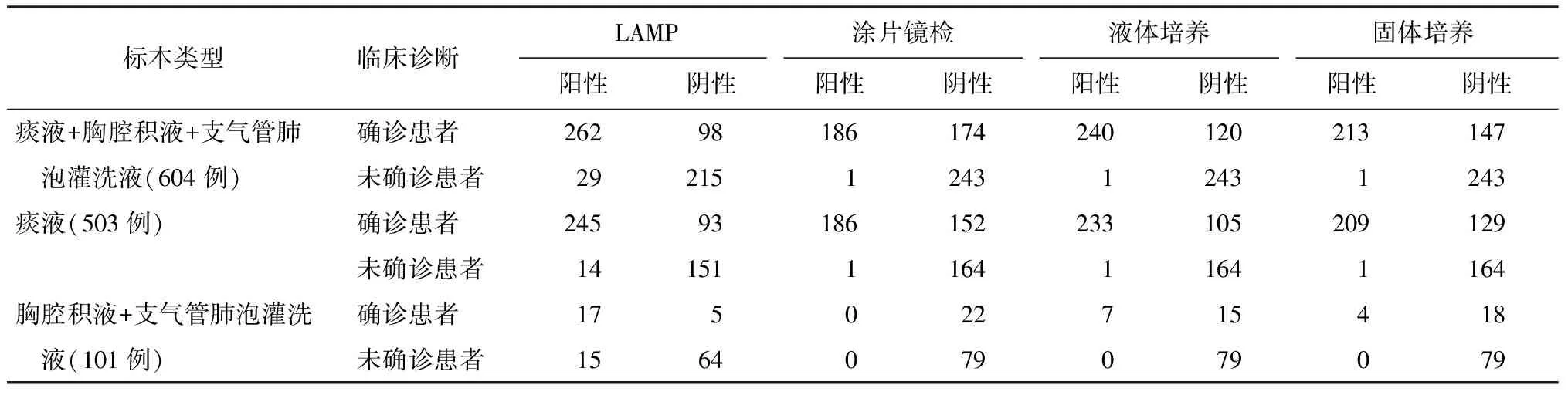
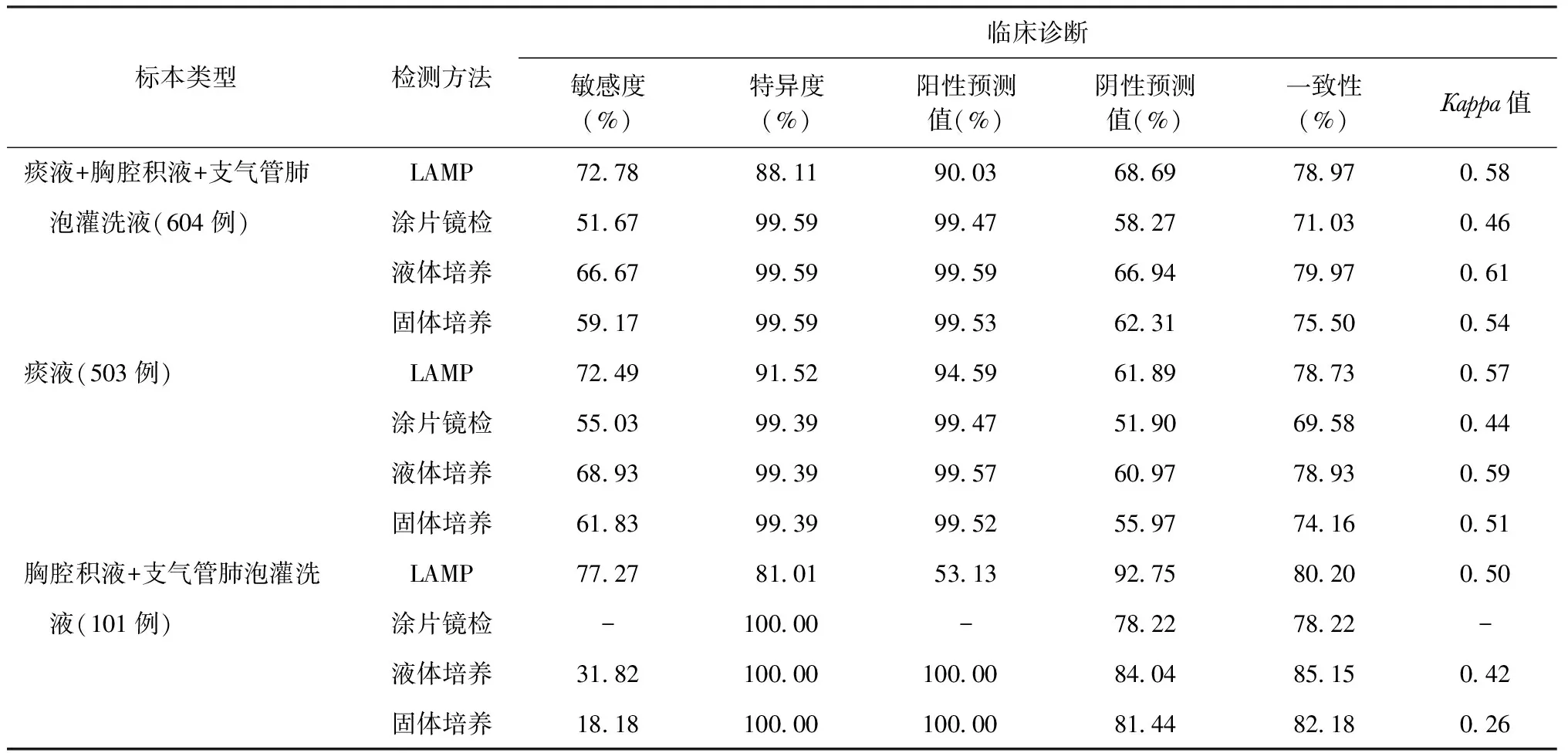
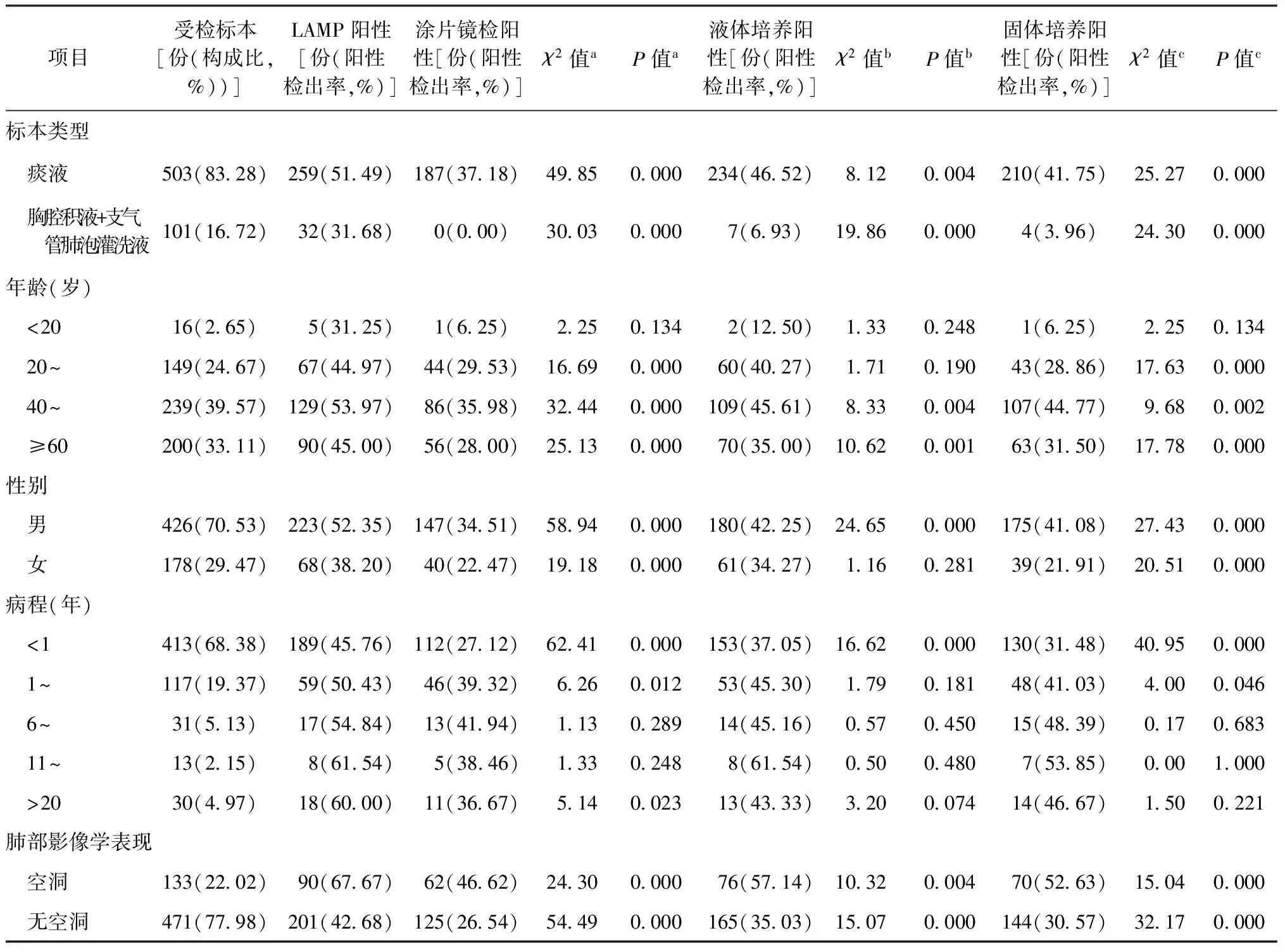
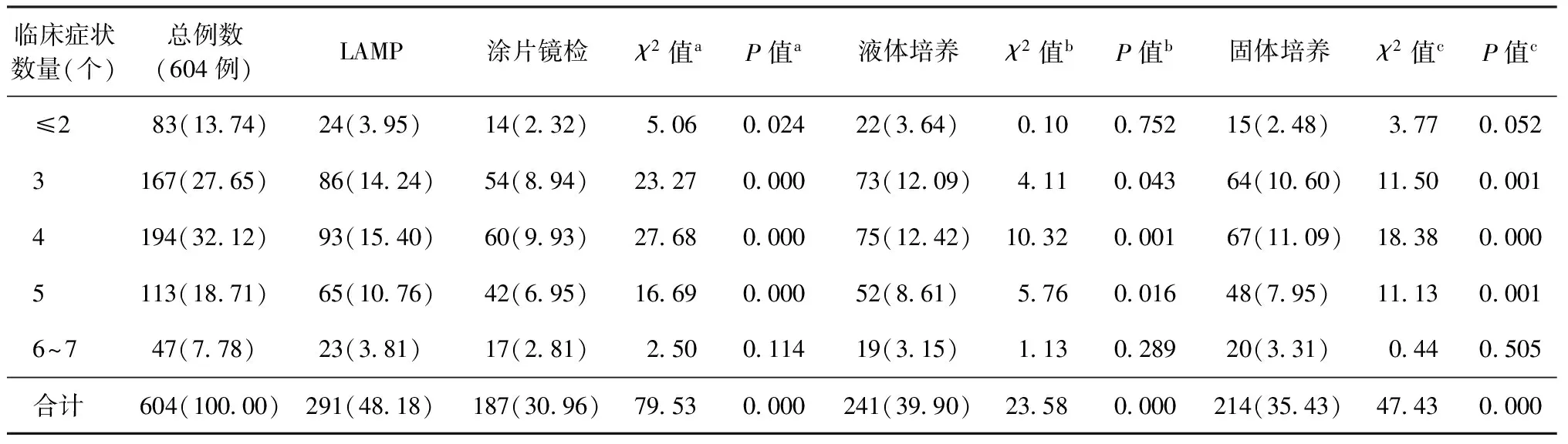
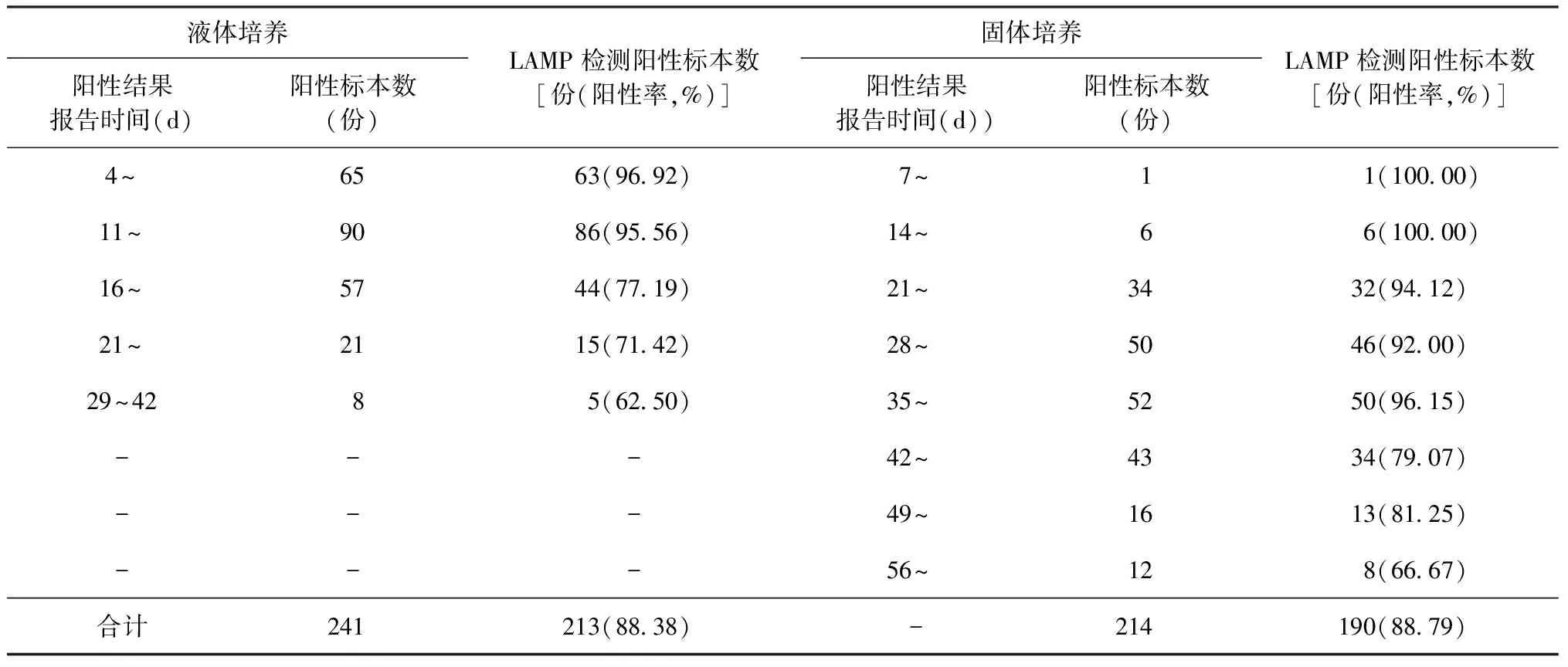
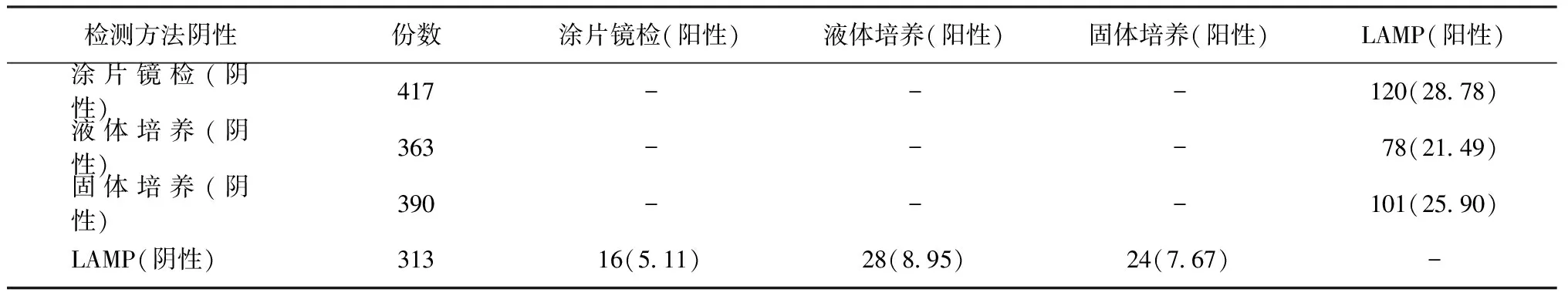
1.统计学方法:采用SPSS 19.0软件进行统计学分析,以临床诊断结果为检测参考,计算各种检测方法的敏感度、特异度、一致性、阳性预测值和阴性预测值。采用χ2检验比较4种检测方法对结核分枝杆菌不同情况下的阳性检出率,以P<0.05为差异有统计学意义。Kappa值≥0.75两者一致性较好;0.4 2.相关公式:敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%;一致性=(真阳性例数+真阴性例数)/(真阳性例数+假阳性例数+真阴性例数+假阴性例数)×100%。 1. 不同标本类型经4种方法检测的结果分析:对604份标本分别进行LAMP检测、涂片镜检、液体培养和固体培养,结果显示LAMP检测具有很高的敏感度、特异度及一致性,尤其是对胸腔积液的检测,其敏感度远远高于涂片法及培养法,详见表1,2。 2. LAMP技术对不同标本类型及患者的检测效果:LAMP对痰标本、胸腔积液的阳性检出率明显优于涂片镜检和培养法(P值均<0.01),而肺泡灌洗液由于标本数量过少,故无法进行统计学分析;对<20岁患者的阳性检出率与涂片镜检、液体培养和固体培养差异无统计学意义(P值均>0.05),而对>20岁患者的检出率差异均有统计学意义(P值均<0.01);对病程<1年患者的阳性检出率明显高于涂片镜检和培养法(P值均<0.01),但对于病程>5年的患者,上述检测技术之间的差异无统计学意义;对肺部有或无空洞患者的阳性检出率均明显高于涂片镜检法和培养法。详见表3。 3.临床症状的数量与不同检测方法阳性检出率的关系:统计数据发现,随着患者症状的不断增多,各种检测方法的阳性检出率逐渐增高,当患者的临床症状≤5个时,LAMP的阳性检出率(44.37%,268/604)明显高于涂片镜检(28.15%,170/604)、液体培养法(36.75%,222/604)和固体培养法(32.12%,194/604)(χ2值分别为76.22、21.59和47.21,P值均=0.000),但当患者的临床症状≥6个时,LAMP的阳性检出率(3.81%,23/604)与涂片镜检(2.81%,17/604)、液体培养法(3.15%,19/604)和固体培养法(3.31%,20/604)差异无统计学意义(χ2=2.50,P=0.114;χ2=1.13,P=0.289;χ2=0.44,P=0.505),详见表4。 表1 不同标本类型经4种方法检测的结果分析(例) 表2 不同标本类型经4种方法检测的效能比较 注 敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%;一致性=(真阳性例数+真阴性例数)/(真阳性例数+假阳性例数+真阴性例数+假阴性例数)×100%;Kappa值≥0.75两者一致性较好;0.4 表3 604例疑似结核病患者不同情况下4种检测方法的阳性检出率统计 注a:LAMP与涂片镜检检出率比较的统计值;b:LAMP与MGIT960培养检出率比较的统计值;c:LAMP与罗氏培养检出率比较的统计值 表4 604例患者临床症状数量与不同检测方法阳性检出率的关系 注 括号外数值为患者例数,括号内数值为发生率(%)或阳性检出率(%);a:LAMP与涂片镜检比较的统计值;b:LAMP与MGIT960培养比较的统计值;c:LAMP与罗氏比较的统计值;“-”无法计算 4. LAMP检测结果与不同标本阳性结果报告时间的关系:在液体培养阳性的241份标本中,随着阳性结果报告时间的延长,LAMP的阳性检出率不断下降,从96.92%降至62.50%,均偏低于液体培养法,但11~15 d是检出率最高的时间;同样的结果也出现在固体培养中,当阳性结果报告时间从7 d延长至56 d时,LAMP的阳性检出率也从100.00%降至66.67%,其中有1例标本固体培养阳性结果报告时间为7 d(博奥基因芯片法进行菌种鉴定为结核分枝杆菌),详见表5。 5.LAMP对涂阴或培阴标本的阳性检出率:LAMP对涂片镜检阴性、液体培养阴性、固体培养阴性的患者具有较高的阳性检出率[28.78%(120/417),21.49%(78/363)和25.90%(101/390)],达到20%~30%;而对于LAMP-TB检测阴性的标本,涂片镜检、液体培养和固体培养检测则只有不到10%的阳性检出率[5.11%(16/313)、8.95%(28/313)和7.67%(24/313)]。详见表6。 表5 两种培养法阳性结果报告时间与LAMP检测结果的关系 注 “-”为未统计 表6 LAMP对涂阴、培阴标本的阳性检出率 注 括号外数值为标本份数,括号内数值为阳性检出率(%) WHO结核病疫情报告指出,每年有大量的结核病患者被漏诊,可能因为新发患者病程较短、缺乏明显的临床症状表现,多在常规体检中发现肺部影像学改变而就诊,此时如果实验室检查不能检出病原菌,临床医生往往无法做出结核病诊断,造成延误治疗。目前,很多关于LAMP检测结核分枝杆菌的研究[12-24]都是对其高的特异度和敏感度的评价,本研究也分析了相关数据,结果与上述文献相符。然而,对于不同的人群,如病程长短和症状严重程度等的检测,LAMP技术与传统涂片镜检和培养法相比较,是否存在明显的优势还需要探讨。 本研究显示,LAMP对于不同标本类型的检测,痰标本无疑是阳性检出率最高的(51.49%,259/503),但也发现,对胸腔积液的阳性检出率也达到了31.63%(31/98),明显高于以往我院涂片镜检和培养法的结果(根据我院临床检验数据统计结果,我院近3年胸腔积液MGIT 960液体培养共5810例,阳性424例,阳性检出率仅为7.30%;固体培养349例,阳性15例,阳性检出率为4.30%;涂片镜检4281例,阳性13例,阳性检出率为0.28%)。上述结果提示传统涂片镜检和培养法对胸腔积液中结核分枝杆菌的检测效果不理想,导致临床缺乏诊断结核性胸膜炎的重要证据。造成这种结果可能因为胸腔积液标本是液体性质,涂片时对玻片的附着力较差,在之后的冲洗及脱色过程中极易出现标本脱片现象,直接导致胸腔积液涂片镜检的阳性检出率极低;另外,胸腔积液中结核分枝杆菌载菌量远低于痰标本,导致液体培养和固体培养的阳性检出率也不高。而LAMP技术是对结核分枝杆菌的核酸进行特异性扩增,其敏感度高,在胸腔积液检测方面具有明显的优势。 表1,2结果显示,在临床未确诊的患者中仍然有部分患者的LAMP检测结果为阳性,因此,我们对全部604例疑似结核病患者的检测结果进行了分析,并将LAMP检测结果与涂片镜检和培养法进行比较。本研究对患者病程长短的分析发现,当患者病程<1年时,LAMP的阳性检出率明显高于涂片镜检及培养法(P值均<0.01);病程为1~5年时,LAMP的阳性检出率与液体培养差异无统计学意义(P>0.05),但与涂片镜检和固体培养结果差异均有统计学意义(P值均<0.05);当病程>5年时,LAMP与涂片镜检和培养法的阳性检出率间差异均无统计学意义(P值均<0.05)。同样,通过对患者临床症状数量的分析发现,当患者症状≤5个时,LAMP的阳性检出率明显高于其他3种检测方法(P值均<0.05);而对于临床症状≥6个的患者,LAMP检测并无明显优势,可能因为症状重、病程长的患者多反复治疗、迁延不愈,肺部病变较严重(如肺部出现空洞等)、排菌量较大,大多可以通过涂片镜检和培养法检出,此时传统涂片镜检和培养法足以保证病原学检测的有效性,对于这类患者,没有必要为了追求更高的阳性检出率而放弃传统检测手段。不过,由于本研究的样本量有限,结论可能存在偏倚,在今后的研究中会增加观察的样本量进一步验证。 众所周知,标本培养报告阳性结果的时间与标本的载菌量密切相关,标本载菌量越大,培养后报告阳性时间越短。本研究依据MGIT 960液体培养和固体培养报告阳性的时间长短不同对数据结果进行分类,发现随着报告阳性时间的延长,LAMP对培养阳性标本的阳性检出率呈下降趋势,这与以往的研究结果可能有些不符[13],可能是由于报告阳性时间越长的标本,其载菌量越小,LAMP的阳性检出率也越低。但是,这样的结果是否说明LAMP技术的检测能力低于培养法呢?笔者进而比较了LAMP对涂阴或培阴标本的阳性检出率,发现阳性检出率能够达到20%~30%;而反过来分析发现,涂片镜检和培养法对LAMP检测阴性的标本阳性检出率只有不到10%,提示LAMP技术的检测优势,即对涂阴培阴标本具有很高的阳性检出率。 研究结果还发现,对于一些培养阳性而LAMP检测阴性的标本,可能因为此类标本载菌量较低,培养法前处理时加入的样本量为1~2 ml,远远多于LAMP检测的60 μl,因此培养法比LAMP更易检测到标本中的结核分枝杆菌,造成培养阳性而LAMP阴性的结果。建议对于这类标本可以在检测前进行浓缩处理,可以将标本离心后再进行LAMP检测,这样可以在一定程度上提高LAMP的阳性检出率。然而,我们并不能因此就否定LAMP检测技术的高敏感度,毕竟培养阳性而LAMP检测阴性的标本是极少的一部分,从标本的总体检测结果来看,其阳性检出率还是明显高于培养法。另外,对于那些培养阴性而LAMP检测阳性的标本,笔者认为并不是标本中不存在结核分枝杆菌而造成LAMP检测结果假阳性,而是因为标本载菌量低于培养法的检测下限,建议对于这部分患者的诊断应积极结合LAMP的检测结果进行临床综合诊断,行诊断性治疗后会发现LAMP技术对培养阴性的标本具有很高的阳性检出率。 通过研究数据分析发现,LAMP技术的优势在于诊断那些病程短、症状较轻、标本含菌量少(甚至是涂阴与培阴的标本)的患者。然而,对于病程长、症状重的患者,LAMP检测在阳性检出率上并无明显的优势,且不能像培养法一样提供药物敏感性实验的结果。故笔者认为,没有必要将LAMP检测作为这些患者的常规检测手段,而是应该把有限的资金用在培养法及药物敏感性试验上,为临床医生用药提供科学有效的技术支持。 [1] Hu YQ, Xu Z, Zhang S,et al.Recent developments of coumarin-containing derivatives and their anti-tubercular activity. Eur J Med Chem,2017,136:122-130. [2] GBD 2015 Disease and Injury Incidence and Prevalence Collabo-rators.Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990—2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet,2016,388(10053):1545-1602. [3] Ma Y, Pang Y, Du J,et al.Clinical outcomes for multi and extensively drug resistant tuberculosis patients with adjunctive resectional lung surgery in Beijing, China. J Thorac Dis,2017, 9(3):841-845. [4] Moon SH, Kim EJ, Tomono J,et al. Detection ofMycobacteriumtuberculosiscomplex in sputum specimens using a loop-mediated isothermal amplification assay in Korea.J Med Microbiol,2015,64(11):1335-1340. [5] Kumar P, Pandya D, Singh N,et al. Loop-mediated isothermal amplification assay for rapid and sensitive diagnosis of tuberculosis.J Infect,2014,69(6):607-615. [6] Bentaleb EM, Abid M, El Messaoudi MD, et al.Development and evaluation of an in-house single steploop-mediated isothermal amplification (SS-LAMP) assay for the detection ofMycobacteriumtuberculosiscomplex in sputum samples from Moroccan patients. BMC Infect Dis,2016,16(1):517. [7] Nagai K, Horita N, Yamamoto M, et al.Diagnostic test accuracy of loop-mediated isothermal amplification assay forMycobacteriumtuberculosis: systematic review and meta-analysis. Sci Rep,2016, 6:39090. [8] 丁卫忠,陈巍,石莲,等. 环介导等温扩增法对痰标本中结核分枝杆菌检测效果的评估.中国防痨杂志,2016,38(10):818-822. [9] 中华人民共和国卫生部. 肺结核诊断标准(WS288-2008). 北京:人民卫生出版社, 2008. [10] 中国防痨协会基础专业委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006:13-16,33-36,54. [11] World Health Organization. Laboratory services in tuberculosis control (part Ⅲ): culture. Geneva:World Health Organization,1998. [12] N’guessan K, Horo K, Coulibaly I, et al. Rapid detection ofMycobacteriumtuberculosiscomplex in sputum samples using pure TB-LAMP assay. Int J Mycobacteriol,2016,5 Suppl 1:S164-165. [13] Gray CM, Katamba A, Narang P,et al. Feasibility and operational performance of tuberculosis detection by loop-mediated isothermal amplification platform in decentralized settings: results from a multicenter study. J Clin Microbiol,2016, 54(8):1984-1991. [14] Gelaw B, Shiferaw Y, Alemayehu M,et al. Comparison of loop-mediated isothermal amplification assay and smear microscopy with culture for the diagnostic accuracy of tuberculosis. BMC Infect Dis,2017,17(1):79. [15] Saiyed H, Fatima S.Loop-mediated isothermal amplification (TB-lamp): a step forward in the diagnosis of tuberculosis? J Pak Med Assoc, 2017, 67(3):489. [16] Yoshida H, Onohara K, Tazawa T,et al. Study of direct TB-Lamp using non-centrifugal sputum about efficiency for rapid diagnosis of tuberculosis. Kekkaku, 2015, 90(5):497-502. [17] Kaku T, Minamoto F, D’Meza R,et al. Accuracy of LAMP-TB method for diagnosing tuberculosis in Haiti. Jpn J Infect Dis, 2016,69(6):488-492. [18] Bojang AL, Mendy FS, Tientcheu LD, et al. Comparison of TB-LAMP, GeneXpert MTB/RIF and culture for diagnosis of pulmonary tuberculosis in the Gambia. J Infect, 2016, 72(3):332-337. [19] 于霞,马异峰,付育红, 等,环介导等温扩增法检测临床标本中结核分枝杆菌的系统评价.中国防痨杂志,2014,36(4):260-266. [20] 陈涛,周琳,周杰, 等. 环介导等温扩增法快速检测结核分枝杆菌的临床应用评估.中国防痨杂志,2012,34(7): 413-418. [21] 李金莉, 王峰, 彭毅, 等.环介导等温扩增技术检测痰样结核分枝杆菌临床价值评价. 中国防痨杂志,2015,37(2): 134-139. [22] 孙雯雯, 肖和平.环介导等温扩增技术早期诊断结核性脑膜炎的研究.中国防痨杂志,2016, 38(12): 1102-1108. [23] 欧喜超, 夏辉, 李强, 等. 快速核酸提取环介导等温扩增检测技术在肺结核诊断中的应用评价. 中国防痨杂志,2016, 38(5): 393-397. [24] 陈愉生, 王大璇, 李鸿茹, 等. 环介导等温扩增技术在下呼吸道感染常见病原体检测中的应用. 中华结核和呼吸杂志, 2014, 37(4):270-273. (本文编辑:孟莉 薛爱华) Screening effect of loop-mediated isothermal amplification for suspected tuberculosis SUNJiao,WANGYue,SUNXiu-hua,PENGJiao,XINGLi-li,SUNBing-qi. TuberculosisLaboratory,Shenyang10thPeople’sHospital,Shenyang110044,China SUNJiao,Email:zhiyuanmantian@hotmail.com Objective To evaluate screening effect of loop-mediated isothermal amplification assay (LAMP) for suspected tuberculosis. Methods A total of 604 suspected tuberculosis patients from Shenyang 10th People’s Hospital between May 2015 and June 2016 were selected, and 604 specimens were collected, including 503 sputum, 98 pleural effusions and 3 bronchoalveolar lavage fluid. All specimens were examined by smear microscopy, solid culture, MGIT 960 liquid culture and LAMP, in order to test the different efficacy of four methods, based on clinical diagnosis. The positive detection rate was analyzed byχ2test, andP<0.05 was considered statistically significant. Results Compared with clinical diagnosis, sensitivities of these four methods were 72.78% (262/360), 51.67% (186/360), 66.67%(240/360) and 59.17% (213/360), respectively; and the specificities were 88.11% (215/244), 99.59% (243/244), 99.59% (243/244) and 99.59% (243/244), what’s more, the consistency was good (Kappavalue were 0.58, 0.46, 0.61 and 0.54, respectively). The positive detection rate of LAMP in patients with short course (less than 1 year) (45.76% (189/413)) was significantly higher than those of smear microscopy (27.12% (112/413)), MGIT 960 culture (37.05% (153/413)) and solid culture (31.48% (130/413)) (χ2=62.41, 16.62, 40.95, respectively, allP=0.000). In patients with less than 5 symptoms, positive detection rate of LAMP (44.37% (268/604)) was significantly higher than those of microscopy (28.15% (170/604)), liquid culture (36.75% (222/604)) and solid culture (32.12% (194/604)) (χ2=76.22, 21.59 and 47.21, respectively, allP=0.000). For smear negative, liquid culture negative and solid culture negative specimens, LAMP also had high positive detection rate (28.78% (120/417), 21.49% (78/363) and 25.90% (101/390), respectively). Conclusion LAMP is more effective than microscopy, liquid culture and solid culture. It is suitable for the screening of suspected tuberculosis patients with short course, mild clinical symptoms (less than 5 symptoms), smear negative and culture negative. Nucleic acid amplification techniques; Tuberculosis,pulmonary; Multiphasic screening; Comparative study 10.3969/j.issn.1000-6621.2017.08.010 110044 沈阳市第十人民医院结核病实验室 孙娇,Email:zhiyuanmantian@hotmail.com 2017-02-13)结 果
讨 论

