结核分枝杆菌膜囊泡的分离及其对细胞因子释放的作用
吕翎娜 贾红彦 廖莎 武剑楠 孙照刚 张宗德
·论著·
结核分枝杆菌膜囊泡的分离及其对细胞因子释放的作用
吕翎娜 贾红彦 廖莎 武剑楠 孙照刚 张宗德
目的 分离体外培养的结核分枝杆菌分泌的膜囊泡,检测其形态和粒径分布,初步探索结核分枝杆菌膜囊泡对巨噬细胞中细胞因子释放的作用。 方法 采用结核分枝杆菌实验室标准菌株H37Rv,通过7H9培养基复苏、扩大培养标准株H37Rv至对数生长期,菌体全部接种于苏通培养基中继续培养3周,离心取上清,超滤浓缩结合超速离心分离提取结核分枝杆菌H37Rv膜囊泡,通过透射电镜观察膜囊泡的大小、形态,采用纳米颗粒跟踪仪分析膜囊泡的粒径及分布。同时,设置不处理对照组、H37Rv感染组[按照感染复数(multiplicity of infection,MOI)=20∶1]和H37Rv膜囊泡处理组(按照膜囊泡∶细胞=100∶1)处理佛波酯(50 ng/ml)诱导贴壁的单核巨噬细胞(THP-1)4 h,更换新鲜培养基后0 h、4 h、8 h、24 h收集细胞培养上清,采用Milliplex多细胞因子检测试剂盒检测细胞因子的释放情况,通过曼-惠特尼U(Mann-WhitneyU)检验对各时间点H37Rv膜囊泡处理组和不处理对照组之间肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、白细胞介素1β(IL-1β)、白细胞介素10(IL-10)释放量进行比较,以P<0.05为差异有统计学意义。 结果 按照调整后的提取方法得到的提取物中可检测到H37Rv分泌的膜囊泡,平均粒径为137 nm,主要分布在30~510 nm之间,<250 nm的膜囊泡数量占总量的96.88%。4 h、8 h和24 h 的TNF-α、IL-6和IL-1β释放量与不处理对照组[分别为348.19(333.99,360.47) pg/ml、412.38(406.67,418.79) pg/ml、324.44(316.11,331.14) pg/ml;3.01(2.81,3.02) pg/ml、5.40(5.26,5.83) pg/ml、13.22(11.80,13.77) pg/ml;118.92(113.97,122.47) pg/ml、132.33(125.87,137.62) pg/ml、169.31(167.75,172.49) pg/ml]相比,H37Rv膜囊泡处理组[分别为507.33(501.80,513.84) pg/ml、4483.00(4130.75,4522.50) pg/ml、8170.00(8058.25,8206.75) pg/ml;12.88(12.04,13.84) pg/ml、68.51(66.88,69.77) pg/ml、335.44(331.02,340.64) pg/ml;800.57(791.18,809.60) pg/ml、1559.00(1546.00,1566.00) pg/ml、4316.50(4094.75,4389.75) pg/ml]均明显增加,差异均有统计学意义(U值均<0.001,P值均<0.01);但4 h、8 h和24 h的IL-10释放量[不处理对照组分别为1.23(1.21,1.31) pg/ml、1.56(1.31,1.82) pg/ml、5.41(4.99,5.89) pg/ml;H37Rv膜囊泡处理组分别为4.56(4.49,4.82) pg/ml、1.43(1.28,1.89) pg/ml、1.56(1.48,1.68) pg/ml]差异均无统计学意义(U值分别为6.00、17.00、7.00,P值分别为0.065、0.898和0.087)。 结论 本研究建立了结核分枝杆菌膜囊泡分离提取的技术流程,可以得到纯度较好、形态完整、粒径正常的膜囊泡。同时,结核分枝杆菌膜囊泡可以诱发巨噬细胞中细胞因子TNF-α、IL-6和IL-1β的释放。
分枝杆菌, 结核; 细胞因子类; R-SNARE蛋白质类; 细胞学技术; 膜囊泡
近年来,进化高度保守、普遍存在于多种生物体的细胞外膜泡这一分泌途径被发现。结核分枝杆菌也可以在宿主细胞内或体外培养条件下主动分泌膜囊泡(membrane vesicles,MV),直径为50~300 nm,携带着多种病原相关分子模式(pathogen-associated molecular patterns,PAMP),如蛋白质、脂类和核酸等,可被宿主细胞摄入,调控细胞免疫反应,诱导多种促炎因子和细胞因子的释放[1-3]。研究发现,结核分枝杆菌膜囊泡可通过Toll样受体2(Toll-like receptor 2,TLR2)依赖的方式调控小鼠巨噬细胞多种炎症因子,以及参与早期结核性肉芽肿形成的蛋白基质金属蛋白酶9(MMP-9)和环氧合酶2(Cox-2)的表达;膜囊泡注射过的小鼠再次感染结核分枝杆菌后,小鼠肺部具有更严重的炎症反应,且荷菌量增加,表明膜囊泡与结核病的发生、发展密切相关[2]。结核分枝杆菌膜囊泡具有很强的免疫原性,不需要佐剂便可诱导机体产生等同于卡介苗(BCG)的免疫保护效果[4];此外,结核分枝杆菌膜囊泡中含有特异度和敏感度较高的结核抗原,有望作为结核病诊断的分子标识[5]。
然而,结核分枝杆菌膜囊泡的研究尚处于初始阶段,对其分离方法及功能有待探索和研究。因此,作者通过借鉴国外文献报道的方法摸索建立了一套稳定有效的膜囊泡分离提取流程及形态表征方法,并且初步探索研究了结核分枝杆菌膜囊泡对巨噬细胞的细胞因子释放的作用。
材料和方法
一、菌株和细胞系
本实验采用结核分枝杆菌实验室标准菌株H37Rv,由国家结核病临床参比实验室提供;细胞系采用人源单核巨噬细胞系(THP-1),购自北京协和细胞库。
二、仪器和试剂
1. 仪器:Amicon 8400型超滤装置(美国Merk Milipore公司)、MX120/150超速离心机(美国Thermo Fisher公司)、NanoSight NS300纳米颗粒跟踪仪(英国Malvern仪器有限公司)、JEM-1400型透射电镜(美国FEI公司)。
2. 试剂:7H9培养基(美国BD公司)、RPMI-1640培养基(美国Gibco公司)、胎牛血清(美国Hyclone公司)、苏通培养基配制试剂(成分包括:天门冬素、柠檬酸、磷酸氢二钾、柠檬酸铁铵、硫酸镁、甘油,均购自北京鼎国昌盛生物技术有限公司)、Milliplex多细胞因子检测试剂盒(美国Merk Milipore公司)。
三、结核分枝杆菌膜囊泡的收集、提取
结核分枝杆菌培养液中膜囊泡的分离方法参考文献[2]并有所调整:7H9液体培养基(含10%促生长添加剂OADC、0.5%吐温-80)复苏、扩大培养H37Rv,至600 nm处吸光度值(A600)≈1.0,离心收集H37Rv菌体,磷酸盐缓冲液(PBS)清洗2次后接种于苏通基本培养基(成分包括:天门冬素4 g/L、枸橼酸盐2 g/L、磷酸氢二钾0.5 g/L、七水合硫酸镁0.5 g/L、枸橼酸铁铵0.5 g/L、甘油5%,pH=7.2)中,继续培养3周。3450×g离心20 min收集上清,使用0.22 μm滤器过滤除菌、Amicon超滤装置浓缩收集相对分子质量在100 000以上蛋白质的液体(包含膜囊泡)。依次以4000×g、15 000×g,4 ℃ 各离心15 min,最后以120 000×g超速离心4 h,弃上清,PBS洗涤膜囊泡沉淀2次。根据后续实验目的不同加入合适的缓冲液重悬膜囊泡沉淀,-80 ℃保存。
四、结核分枝杆菌膜囊泡形态表征
1. 透射电镜观察:用2%的戊二醛(溶解在0.1 mol/L 的二甲胂酸)室温固定膜囊泡2 h,继续在4%多聚甲醛、1%戊二醛、0.1% PBS中孵育过夜。固定好的样品在四氧化锇中染色90 min,乙醇脱水后包埋在Spurr环氧树脂上,采用Ultracut UCT切片机(美国Reichert公司)切成薄片后用0.5%醋酸双氧铀和0.5%柠檬酸铅染色。采用中国科学院微生物研究所仪器共享平台的JEM-1400型透射电镜在80 kV下观察。
2. 纳米颗粒跟踪仪检测:采用英国Malvern仪器有限公司的纳米颗粒跟踪仪NanoSight NS300进行观察。将合适浓度的膜囊泡(稀释液为PBS)经注射器注入分析室,调整参数使视野内膜囊泡分布均匀,密度一致,对视野内囊泡进行录像,通过纳米颗粒跟踪分析软件(nanoparticle tracking analysis,NTA)单独记录视频中每一个膜囊泡的布朗运动,自动定位并跟踪其中心运动的轨迹,计算平均位移,绘制出颗粒散射光强-粒径-数量分布强度的三维图谱,该技术同步跟踪所有颗粒,得到颗粒粒径的数量分布信息。
五、结核分枝杆菌膜囊泡处理巨噬细胞系
H37Rv培养至对数生长期,离心收集菌体并用PBS清洗。同时分离上清中膜囊泡,通过NanoSight NS300纳米颗粒跟踪仪测其浓度。佛波酯(50 ng/ml)诱导THP-1细胞系48 h后,用无血清培养基RPMI 1640按照感染复数(multiplicity of infection,MOI)=20∶1(细菌∶细胞)的比例处理细胞,作为结核分枝杆菌H37Rv感染组(阳性参照)。膜囊泡按照100∶1(膜囊泡∶细胞)的比例处理细胞[2],作为H37Rv膜囊泡处理组,同时设置不处理对照组。4 h后换新鲜培养基,继续培养0、4、8、24 h;在相应时间点收集上述细胞培养液进行细胞因子释放实验。
六、Milliplex多细胞因子检测试剂盒检测细胞因子释放
按照试剂盒(Millipore,货号:HCYTOMAG-60K,批号:HCY-108和 HCY-208)说明书对细胞因子TNF-α、IL-6、IL-1β、IL-10进行检测,反应结束后,将孔板放入多功能流式点阵仪Luminex 200读取数据。采用SPSS 19.0软件进行统计学分析,对各时间点膜囊泡处理组和不处理组之间各细胞因子数值的比较采用曼-惠特尼U(Mann-WhitneyU)检验,以P<0.05为差异具有统计学意义。
结 果
一、结核分枝杆菌膜囊泡分离方法及形态表征
本方法在原文献报道方法的基础上做了调整,具体调整条件见表1。H37Rv在7H9培养基中扩大培养至对数生长期(A600≈1.0),离心收集菌体并全部接种至苏通培养基继续培养3周,离心去除菌体并收集上清,0.22 μm滤器过滤除菌,采用相对分子质量为100 000的孔径膜经超滤杯超滤浓缩至约50 ml,4000×g、15 000×g依次离心15 min、30 min去除细胞碎片和大分子蛋白复合物,最后通过120 000×g离心4 h超速离心收集结核分枝杆菌H37Rv膜囊泡,经PBS清洗两次获得纯度较好的膜囊泡。
通过检测膜囊泡的结构和粒径分布进行形态表征,透射电镜结果显示(中国科学院微生物研究所仪器共享平台),提取方法调整前,提取物中观测不到结核分枝杆菌H37Rv膜囊泡,且细胞碎片等杂质较多;提取方法调整后,提取物中观测到结核分枝杆菌H37Rv膜囊泡,且大小均一,呈圆形囊泡结构,直径约100 nm(图1)。NanoSight NS300纳米颗粒追踪仪检测结果显示,结核分枝杆菌H37Rv膜囊泡粒径峰值为117 nm,平均粒径137 nm,主要分布在30~510 nm之间,<250 nm的膜囊泡数量占总量的96.88%(图2,表2)。
二、结核分枝杆菌膜囊泡处理巨噬细胞系后对细胞因子释放的作用
为了初步检测结核分枝杆菌H37Rv膜囊泡的功能,本研究采用Milliplex多细胞因子检测试剂盒,检测了H37Rv及其膜囊泡处理的THP-1人源单核巨噬细胞中4种细胞因子的释放,包括TNF-α、IL-6、IL-1β、IL-10。结果显示,与不处理对照组相比,H37Rv分泌的膜囊泡处理THP-1人源巨噬细胞后,培养上清中细胞因子TNF-α、IL-6、IL-1β的水平在4 h、8 h和24 h均明显增加,差异均有统计学意义(U值均<0.001,P值均<0.01);而膜囊泡处理组4 h、8 h和24 h培养上清中IL-10水平与不处理对照组相比,差异均无统计学意义(U值分别为6.00、17.00、7.00,P值分别为0.065、0.898和0.087)(表3)。
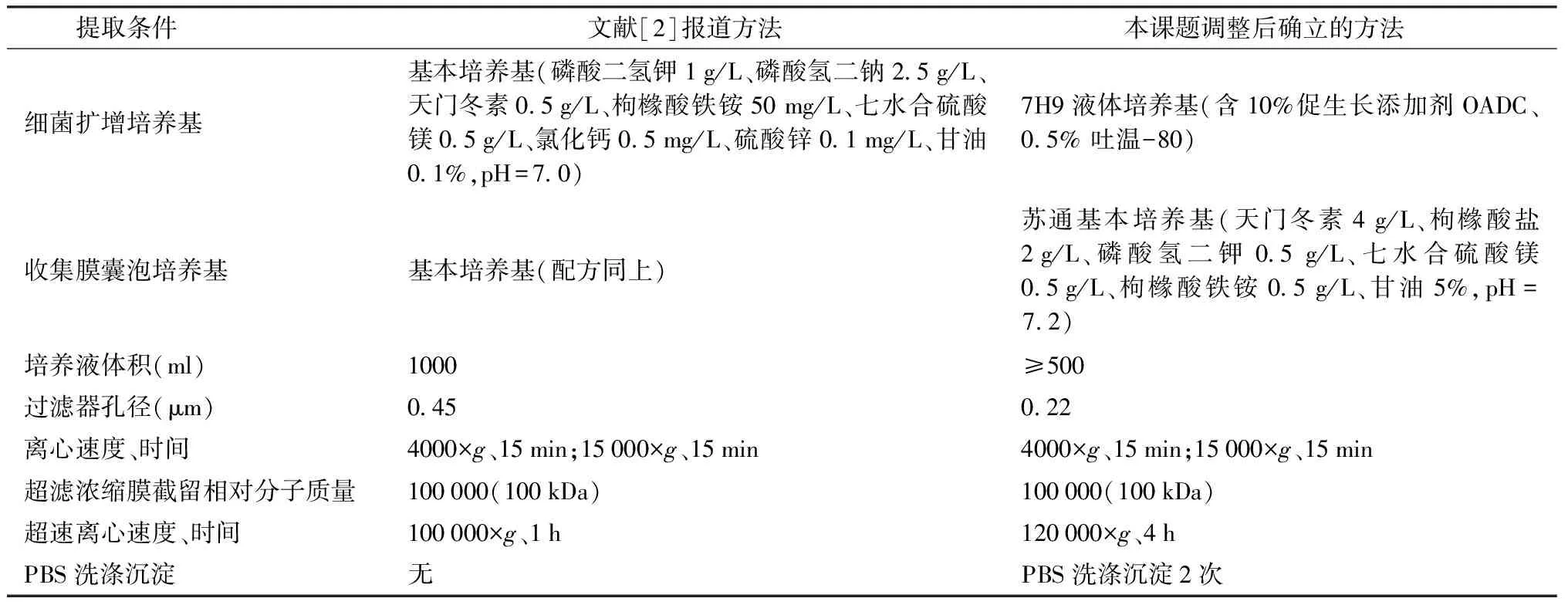
表1 膜囊泡提取条件调整情况
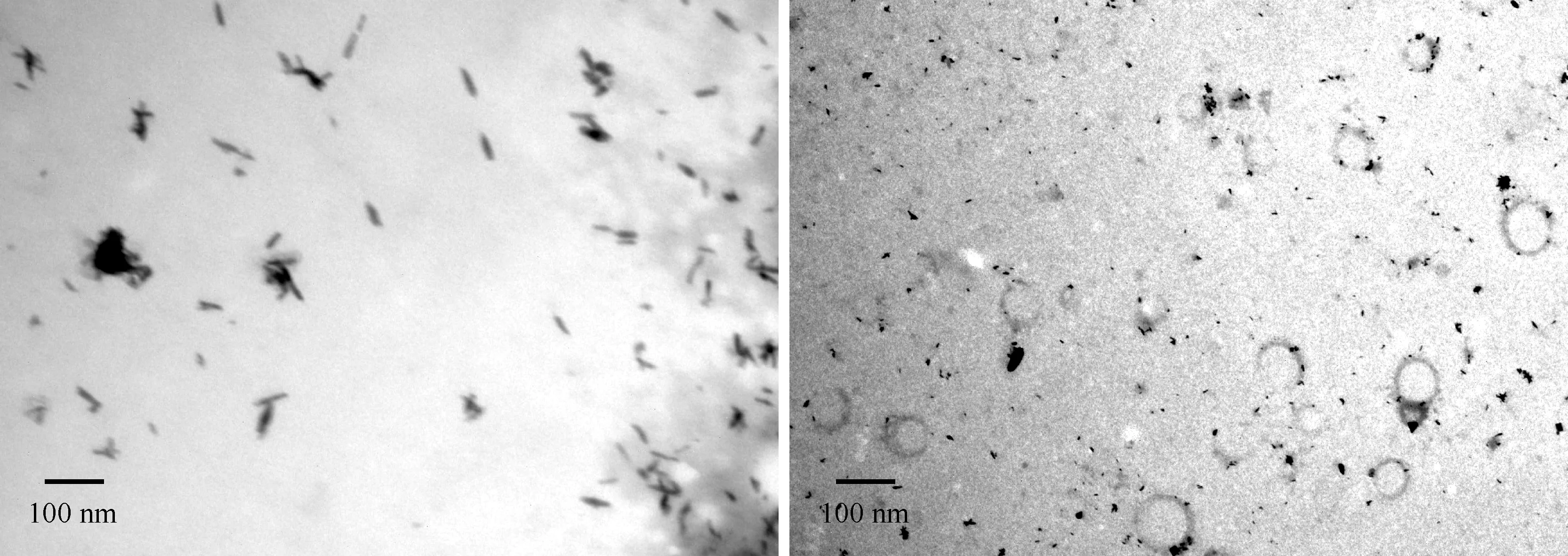
注 左图为提取方法调整前,右图为提取方法调整后;按照文献[2]报道的方法及摸索条件后调整的方法分别提取结核分枝杆菌H37Rv膜囊泡,透射电镜观察膜囊泡形态及结构;图中尺度标记代表100 nm图1 透射电镜观察结核分枝杆菌H37Rv膜囊泡
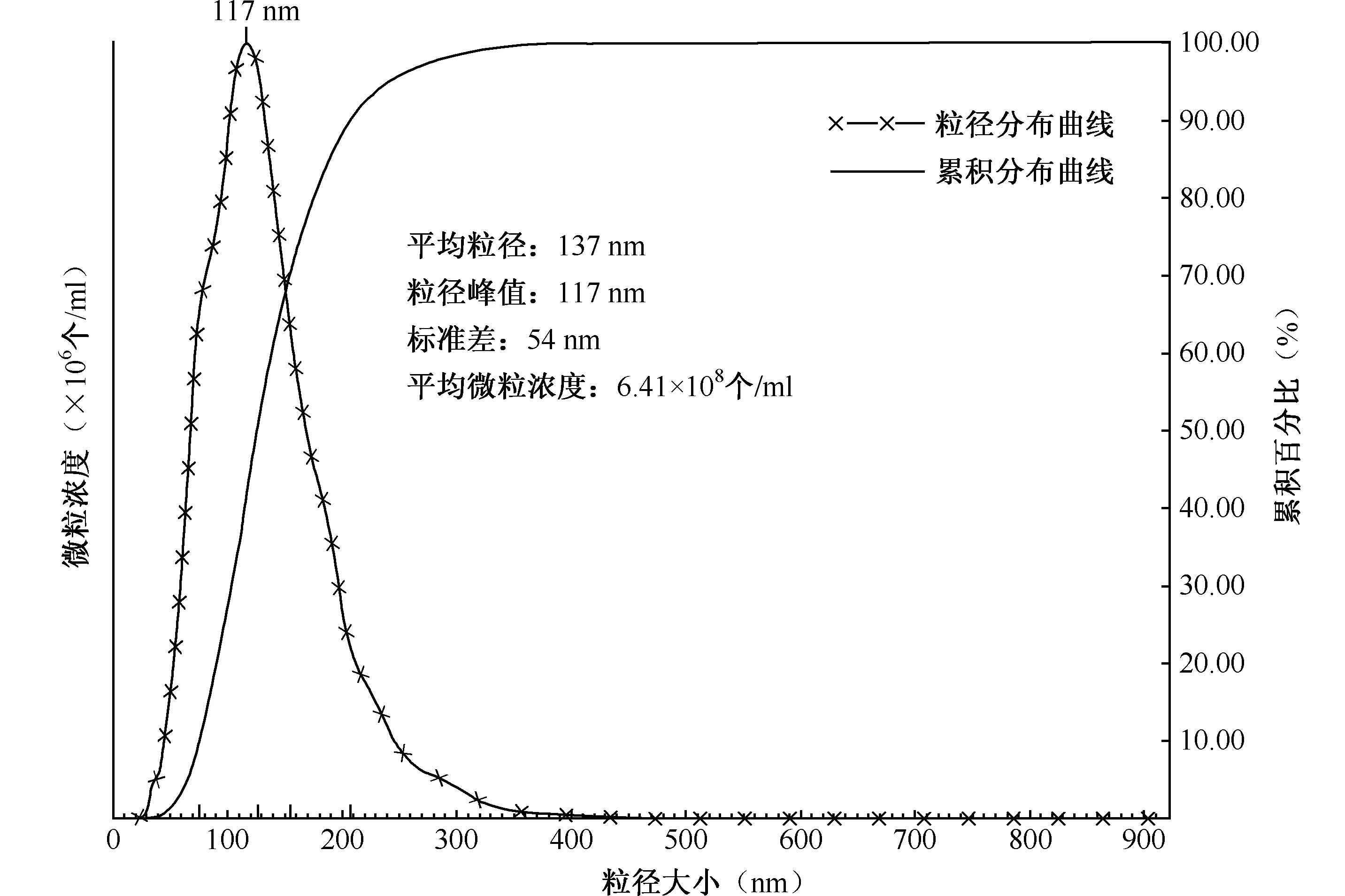
注 对提取的膜囊泡进行粒径及其分布的分析,横轴代表粒径大小,左侧纵轴代表微粒浓度,右侧纵轴代表累积百分比;累积百分比代表某一粒径的微粒累积占所有微粒的百分比,最终达到100.00%图2 NanoSight NS300颗粒跟踪仪的结核分枝杆菌H37Rv膜囊泡粒径分析情况
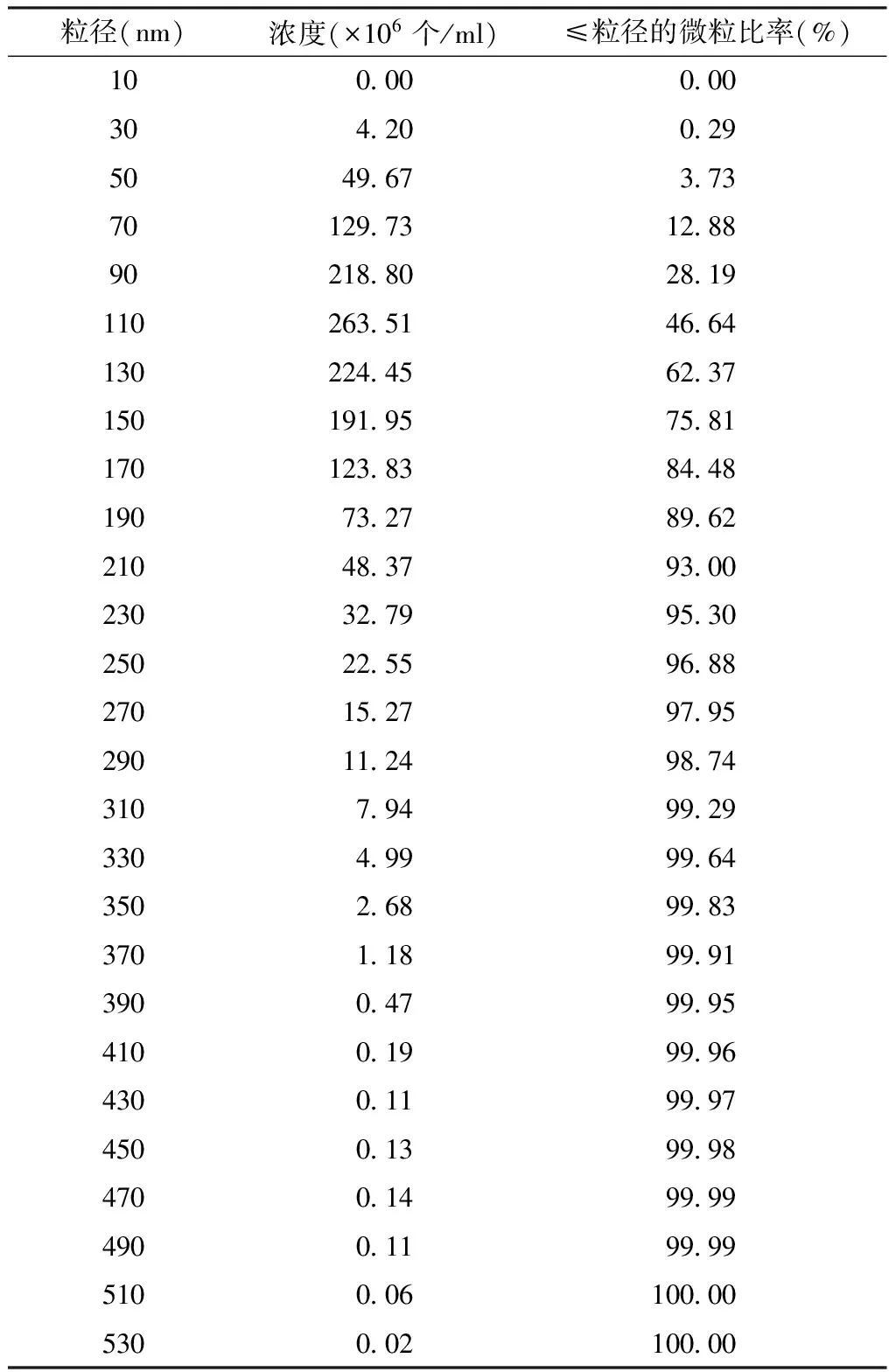
表2 结核分枝杆菌H37Rv膜囊泡粒径分析报告
讨 论
巨噬细胞是固有免疫应答反应中最主要的细胞,是机体抵抗结核感染的第一道防线。同时,巨噬细胞又是结核分枝杆菌在体内滞留,造成潜伏性结核感染的主要场所[6-7]。全球近1/3的人口感染过结核分枝杆菌,只有约10%的个体在感染结核分枝杆菌后发展为活动性结核病[8]。绝大多数情况下,结核分枝杆菌与宿主免疫应答保持平衡状态,无结核病临床症状[9]。因此,结核分枝杆菌与巨噬细胞的相互作用影响机体发生结核感染后的结局。病原菌产生的细胞外膜泡在调节病原菌与宿主的相互作用中发挥重要作用[10]。结核分枝杆菌膜囊泡的发现对研究病原菌与宿主间的相互作用提示了新的方向。
本研究在借鉴国外文献的基础上,摸索并建立了一套稳定有效的膜囊泡分离提取流程及形态表征方法,可重复多次提取得到形态完整并适合后续实验(如细胞因子释放试验)的膜囊泡。按照原文献方法,本课题组无法分离得到理想的膜囊泡。原提取方法中,培养细菌和收集膜囊泡的培养液都是基本培养基,虽然可以降低后期提取膜囊泡的杂质含量,但也会由于结核分枝杆菌生长速率较低导致培养时间增加,且总菌量较低使得提取时膜囊泡获得率较低。本课题组将培养细菌的培养基调整为可实现结核分枝杆菌快速增长的7H9培养基,快速获得大量菌体后,再将菌体全部接种于成分简单的苏通基本培养基中收集膜囊泡,这样不但缩短了培养时间,菌量的增加也使得提取时膜囊泡获得率提高,再通过增加超速离心力120 000×g(原方法为100 000×g)和离心时间4 h(原方法为1 h),均可以提高膜囊泡的提取效率,例如原文献使用1000 ml以上的培养液提取膜囊泡,本实验采用500 ml的培养上清就可以提取得到完整的、足量的膜囊泡。此外,本提取方法用0.22 μm滤器过滤代替原方法的0.45 μm滤器,这样可以过滤掉除菌体以外的其他大分子杂质。本方法还增加了对膜囊泡沉淀进行PBS清洗的过程,这也可以提高膜囊泡的纯度。本研究还通过结核分枝杆菌H37Rv膜囊泡处理THP-1人源单核巨噬细胞模型,初步探索发现结核分枝杆菌H37Rv膜囊泡对宿主细胞因子TNF-α、IL-6和IL-1β的释放具有促进作用,这与既往研究报道结果一致[2],而对IL-10的释放无明显影响。IL-6是参与肺结核患者抗感染免疫的重要调节因子[11],因此,结核分枝杆菌可能通过膜囊泡远程调控未受感染的巨噬细胞中炎性因子的释放。TNF-α是巨噬细胞感染结核分枝杆菌后通过自分泌或旁分泌的方式介导细胞凋亡途径的主要细胞因子[12]。IL-1β是参与细胞凋亡相关的炎症因子[13]。这提示结核分枝杆菌可能通过分泌膜囊泡在细胞凋亡过程中发挥一定作用。IL-10是抑制巨噬细胞释放发热的炎性因子,阻止抗原递呈而发挥特异性免疫效应[14]。结核分枝杆菌H37Rv膜囊泡不能像结核分枝杆菌菌体那样促进IL-10释放,原因可能是膜囊泡中缺乏触发IL-10释放的生物活性分子,具体机制有待进一步研究。
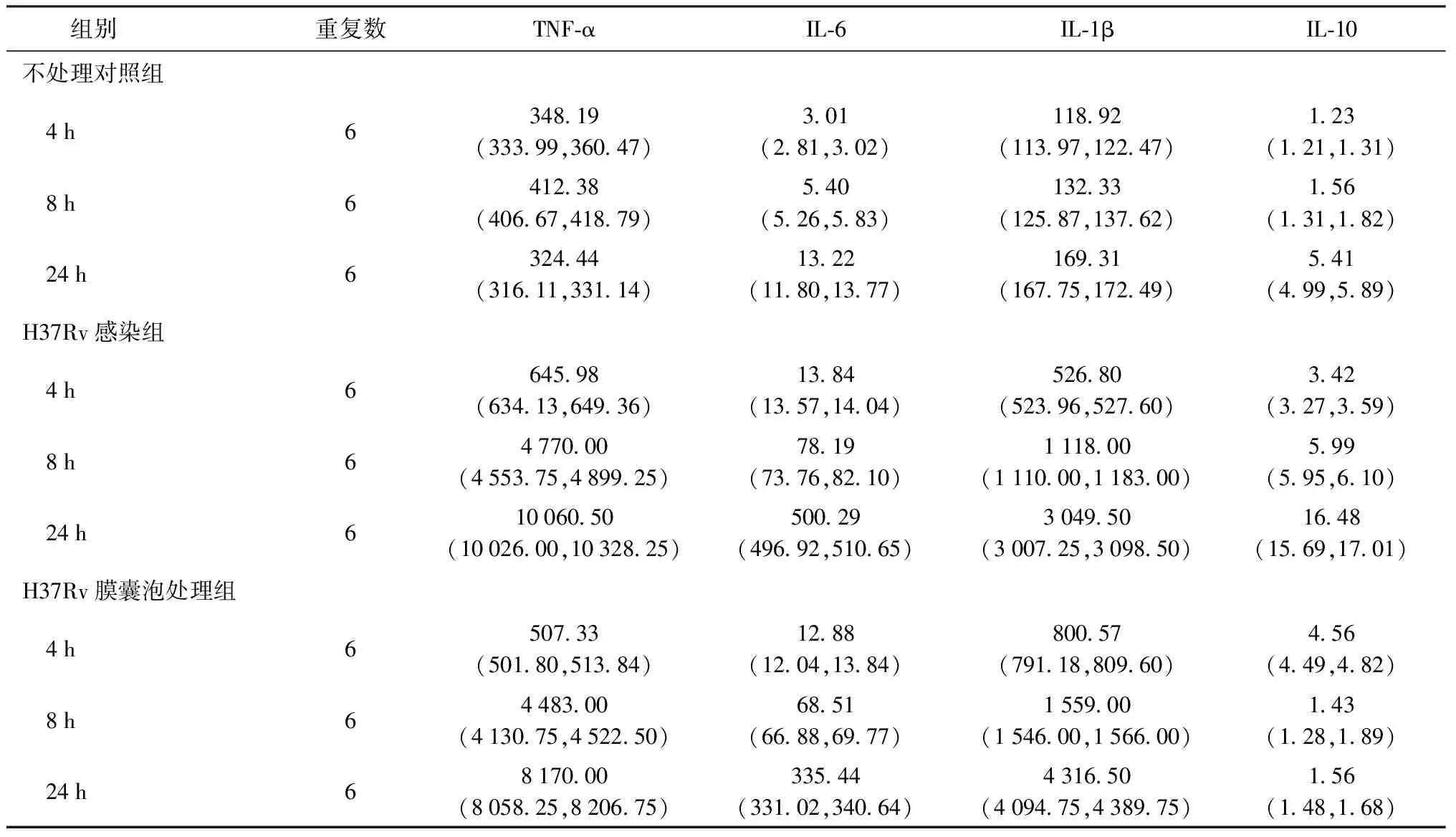
表3 H37Rv标准株及其膜囊泡处理巨噬细胞后不同时间点细胞因子水平[pg/ml,M(Q1,Q3)]
注 H37Rv感染组仅作为阳性参照,无需进行比较
综上所述,本研究建立了结核分枝杆菌膜囊泡的提取方法,并初步探索了膜囊泡对巨噬细胞相关细胞因子释放的作用,研究结果为深入开展结核分枝杆菌和宿主细胞间相互作用提供了新思路,为揭示结核分枝杆菌的致病机制奠定了理论基础。
[1] Brown L, Wolf JM, Prados-Rosales R, et al. Through the wall: extracellular vesicles in Gram-positive bacteria, mycobacteria and fungi. Nat Rev Microbiol, 2015, 13(10):620-630.
[2] Prados-Rosales R, Baena A, Martinez LR, et al. Mycobacteria release active membrane vesicles that modulate immune responses in a TLR2-dependent manner in mice. J Clin Invest, 2011, 121(4):1471-1483.
[3] Lee J, Kim SH, Choi DS, et al. Proteomic analysis of extracellular vesicles derived fromMycobacteriumtuberculosis. Proteomics, 2015, 15(19): 3331-3337.
[4] Prados-Rosales R, Carreo LJ, Batista-Gonzalez A, et al. Mycobacterial membrane vesicles administered systemically in mice induce a protective immune response to surface compartments ofMycobacteriumtuberculosis. MBio, 2014, 5(5):e01921-14.
[5] Ziegenbalg A, Prados-Rosales R, Jenny-Avital ER, et al. Immunogenicity of mycobacterial vesicles in humans: identification of a new tuberculosis antibody biomarker. Tuberculosis (Edinb), 2013, 93(4):448-455.
[6] Pieters J. Entry and survival of pathogenic mycobacteria in macrophages. Microbes Infect, 2001, 3(3):249-255.
[7] Sia JK, Georgieva M, Rengarajan J. Innate immune defenses in human tuberculosis: an overview of the interactions betweenMycobacteriumtuberculosisand innate immune cells. J Immunol Res, 2015, 2015:747543.
[8] Dye C, Scheele S, Dolin P, et al. Consensus statement. Global burden of tuberculosis: estimated incidence, prevalence, and mortality by country. WHO Global Surveillance and Monitoring Project. JAMA, 1999, 282(7):677-686.
[9] Hartman-Adams H, Clark K, Juckett G. Update on latent tuberculosis infection. Am Fam Physician, 2014, 89(11):889-896.
[10] Jurkoshek KS, Wang Y, Athman JJ, et al. Interspecies communication between pathogens and immune cells via bacterial membrane vesicles. Front Cell Dev Biol, 2016, 4:125.
[11] Jung BG, Wang X, Yi N, et al. Early secreted antigenic target of 6-kDa ofMycobacteriumtuberculosisstimulates IL-6 production by macrophages through activation of STAT3. Sci Rep, 2017,7:40984.
[12] Keane J, Balcewicz-Sablinska MK, Remold HG, et al. Infection byMycobacteriumtuberculosispromotes human alveolar macrophage apoptosis. Infect Immun, 1997, 65(1):298-304.
[13] 刘海鹏, 戈宝学. 结核病免疫机制及疫苗研制开发研究进展. 结核病与肺部健康杂志, 2012, 1(1):74-79.
[14] Arcila ML, Sánchez MD, Ortiz B, et al. Activation of apoptosis, but not necrosis, duringMycobacteriumtuberculosisinfection correlated with decreased bacterial growth: role of TNF-alpha, IL-10, caspases and phospholipase A2. Cell Immunol, 2007, 249(2):80-93.
(本文编辑:郭萌)
Isolation of mycobacterial membrane vesicles and preliminary investigation of their functions
LYÜLing-na,JIAHong-yan,LIAOSha,WUJian-nan,SUNZhao-gang,ZHANGZong-de.
BeijingChestHospital,CapitalMedicalUniversity,BeijingKeyLaboratoryforDrugResistantTuberculosisResearch,BeijingTuberculosisandThoracicTumorResearchInstitute,Beijing101149,China
ZHANGZong-de,Email:zzd417@163.com
Objective To isolate mycobacterial membrane vesicles (MV), examine their morphology and size distribution, and explore their roles in cellular cytokine release. Methods The H37Rv strain ofM.tuberculosiswas cultured in Middlebrook 7H9 medium supplemented with 10% (v/v) OADC enrichment until it reached an OD600≈1.0. It was then cultured in Sauton’s medium for a further 3 weeks. Cultures were harvested and vesicles were isolated by a combining concentration by ultrafiltration and ultracentrifugation. Transmission Electron Microscopy (TEM) was used to analyze the morphology and integrity of MV, and NanoSight NS300 was used to deter-ming the absolute size distribution of MV. To investigate cellular cytokine release, THP-1 cell were treated with PMA (50 ng/ml) for 48 h, and further incubated for 4 h (negative control, NC) or treated with H37Rv (MOI=20∶1) or its MV (MV∶Cell=100∶1) for 4 h. After incubating in fresh medium for 0, 4, 8, or 24 h, the supernatant was harvested and cytokine release was assayed using Milliplex MAP Kits according to the manufacturer’s instructions. The Mann-WhitneyUtest was used to analyze the difference between paired samples,P<0.05 being considered statistically significant. Results MV secreted here by the H37Rv strain were vesicular and intact. The size distribution of MV was between 30 and 510 nm, and the average size was 137 nm; 96.88% of vesicles were under 250 nm in diameter. Release of TNF-α, IL-6 and IL-1β by THP-1 cells treated with MV for 4, 8, and 24 h increased with time (507.33 (501.80,513.84) pg/ml, 4483.00 (4130.75,4522.50) pg/ml, 8170.00 (8058.25,8206.75) pg/ml; 12.88 (12.04,13.84) pg/ml, 68.51 (66.88,69.77) pg/ml, 335.44 (331.02,340.64) pg/ml; 800.57 (791.18,809.60) pg/ml, 1559.00 (1546.00,1566.00) pg/ml, 4316.50 (4094.75,4389.75) pg/ml) compared with the negative control (348.19 (333.99,360.47) pg/ml, 412.38 (406.67,418.79) pg/ml, 324.44 (316.11,331.14) pg/ml; 3.01 (2.81,3.02) pg/ml, 5.40 (5.26,5.83) pg/ml, 13.22 (11.80,13.77) pg/ml; 118.92 (113.97,122.47) pg/ml, 132.33 (125.87,137.62) pg/ml, 169.31 (167.75,172.49) pg/ml) (allU<0.001, allP<0.01). However, there was no significant change in IL-10 in the negative control (1.23 (1.21,1.31) pg/ml, 1.56 (1.31,1.82) pg/ml, 5.41 (4.99,5.89) pg/ml) or MV-treated THP-1 cells (4.56 (4.49,4.82) pg/ml, 1.43 (1.28,1.89) pg/ml, 1.56 (1.48,1.68) pg/ml) (U=6.00, 17.00 and 7.00;P=0.065, 0.898 and 0.087 respectively). Conclusion We have established a technical procedure for isolating mycobacterial MV with which we can obtain pure and intact vesicles. In addition, we have demonstrated that mycobacterial MV play a role in TNF-α, IL-6 and IL-1β release from infected THP-1 macrophages.
Mycobacteriumtuberculosis; Cytokines; R-SNARE proteins; Cytological techniques; Membrane vesicles
10.3969/j.issn.1000-6621.2017.08.003
北京市自然科学基金(5174035);“十二五”国家科技重大专项(2015ZX10004801-003);重大传染病防治协同创新中心项目(PXM2015_014226_000058,PXM2016_014226_000052);北京市医院管理局临床医学发展专项(ZYLX201304);北京市优秀人才培养项目(201500002146G188)
101149 首都医科大学附属北京胸科医院 耐药结核病研究北京市重点实验室 北京市结核病胸部肿瘤研究所
张宗德,Email:zzd417@163.com
2017-05-09)

