重组人促红细胞生成素对兔心肌缺血再灌注损伤的保护作用及其机制研究
庞英梁明亭马建群杨永张静
·论著·
重组人促红细胞生成素对兔心肌缺血再灌注损伤的保护作用及其机制研究
庞英1梁明亭1马建群2杨永1张静3
目的观察重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)对心肌缺血再灌注损伤(myocardial ischemia/reperfusion injury,MI/RI)兔心肌细胞凋亡及凋亡关键蛋白酶半胱氨酸蛋白酶-3(Caspase-3)表达的影响,探讨rhEPO对兔MI/RI损伤的保护作用及其机制。方法取新西兰大白兔16只,随机分为对照组(MI/RI组)和药物组(rhEPO组)。结扎兔左冠状动脉前降支制备MI/RI模型。rhEPO组于结扎左冠状动脉前降支的同时注入rhEPO(1 000 U/kg),对照组注入等量的0.9%氯化钠注射液。分别于缺血前、缺血60 min、再灌注60 min和再灌注180 min检测肌酸激酶同工酶MB(CK-MB)的浓度;取缺血区心肌组织,检测其凋亡指数以及凋亡关键蛋白酶Caspase-3的表达水平;制作光镜和电镜标本,观察心肌组织大体形态结构和超微组织结构。结果血清CK-MB浓度随缺血及再灌注时间延长而增加(P<0.01);缺血前rhEPO组与MI/RI组血清CK-MB浓度差异无统计学意义(P>0.05);缺血60 min、再灌注60 min、再灌注180 min时,rhEPO组血清CK-MB浓度均显著低于MI/RI组(均P<0.01)。与MI/RI组相比,rhEPO组缺血区心肌细胞凋亡指数显著下降(P<0.01),凋亡关键蛋白酶Caspase-3表达水平亦显著下降(P<0.01)。rhEPO组心肌组织细胞大体形态结构及超微组织结构损伤均较MI/RI组减轻。结论rhEPO对兔MI/RI具有明显保护作用,其机制与稳定心肌细胞膜结构、减少心肌酶释放和抑制心肌细胞凋亡有关;rhEPO抑制心肌细胞凋亡可能通过抑制Caspase-3蛋白表达发挥作用。
重组人促红细胞生成素; 缺血再灌注损伤; 细胞凋亡; 半胱氨酸蛋白酶-3; 兔
冠心病的发病率在各类心血管疾病中居首位,在人口死亡原因中居第2位[1]。其也是全球医疗健康事业的首要负担[2]。溶栓、经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)及外科冠状动脉搭桥等再灌注疗法通过恢复缺血区供血能有效挽救缺血心肌组织、减少梗死面积、改善心功能、减少泵衰竭发生率和患者病死率,是目前治疗心肌缺血和梗死的有效措施[3]。但相关研究表明,经历一定时间缺血后心肌组织再恢复血流供应时可能出现缺血性损伤进一步加重现象,此种现象被称为缺血再灌注(ischemia/reperfusion,I/R)损伤[4]。I/R损伤的发生机制涉及细胞凋亡、氧化应激及炎性反应等多种因素。
促红细胞生成素(erythropoietin,EPO)是细胞生长因子超家族成员之一,广泛分布于人体各个系统,主要用于促红细胞生成而治疗肾性贫血[5]。研究证实,EPO具有多种与促造血作用无关的非造血生物学作用,具有潜在的组织细胞保护作用[6]。既往研究证实EPO可通过抑制炎性反应而减轻大鼠心肌I/R损伤[7],而细胞凋亡是导致缺血再灌注损伤的重要因素之一。本研究主要探讨重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)对心肌I/R的保护作用及其抗细胞凋亡的相关机制,从而为rhEPO在心血管疾病临床应用方面提供理论依据。
材料与方法
1.实验动物与分组:新西兰大白兔16只,雄性,体重(2.0±0.3)kg,山东省农科院提供,合格证号:SCXK(鲁)20040013。适应性喂养1周后,按随机数字表法分为心肌缺血再灌注损伤(myocardial ischemia/reperfusion injury,MI/RI)组(对照组)和rhEPO组(药物组,于结扎左冠状动脉前降支的同时注入 rhEPO 1 000 U/kg),每组8只。
2.模型制作:经兔耳缘注射3%戊巴比妥钠(1 ml/kg)静脉麻醉后,四肢与心电图机连接,暴露颈静脉以备抽血用。保持处于自然呼吸状态,胸前区备皮并消毒。沿胸骨正中线切开皮肤,切断肌肉附着处并向左游离肌肉至暴露左侧肋骨。确认2、3、4肋骨,于胸骨左缘约1 cm处每根肋骨下穿双线后,将两线分开向相反方向牵拉,拉开肋骨上附着的薄层肌肉并结扎肋骨,从两线结扎中央剪断肋骨开胸。开胸后用小止血钳提起心包,将其缝置于两侧胸壁上,从中间剪开制作心包吊篮,将心脏提起。用棉棒将心脏逆时针转位以充分暴露左冠状动脉前降支,用3-0缝合线穿绕前降支中上1/3处放置硅胶管后一起结扎。心电图显示ST段明显弓背向上抬高(≥0.2 mv),其供血区心肌颜色变暗。60 min后剪断结扎线取出硅胶管,恢复前降支血流,心电图显示ST段回落1/2以上,标志为再灌注成功,再灌注180 min。
3.标本留取:分别于缺血前、缺血60 min、再灌注60 min和再灌注180 min时抽取大白兔静脉血2 ml,静置后 4℃下离心(3 000 r/min)15 min,取上清液测定血清肌酸激酶同工酶MB(CK-MB)含量。实验结束后取结扎线下1 mm相同部位缺血区心肌组织置于10%甲醛溶液中固定,石蜡包埋并切片,行HE染色以及采用免疫组织化学方法检测缺血区心肌细胞凋亡指数、凋亡关键蛋白酶半胱氨酸蛋白酶-3(Caspase-3)表达水平。另取相同部位大小约1 mm×1 mm×1 mm缺血区心肌组织块,放入预冷的2.5%戊二醛中4℃固定,待制作电镜标本。
4.统计学处理:血清CK-MB值采用重复测量资料的方差分析,心肌细胞凋亡指数以及心肌组织Caspase-3蛋白表达的积分光密度采用单因素方差分析,运用SPSS 15.0软件处理数据。以P<0.05为差异显著,以P<0.01为差异非常显著,均有统计学意义。
结 果
1.心肌缺血再灌注过程中心电图变化:持续心电监测并记录肢体Ⅱ导联心电图,可见结扎兔冠状动脉左前降支后,与缺血前(见图1)相比,肢体Ⅱ导联ST段迅速弓背向上抬高(见图2);于缺血60 min时可见抬高的ST段与QRS波群融合,呈城垛型(见图3);再灌注后ST段下降(≥1/2),可见再灌注性心律失常(室速)(见图4),标志再灌注成功;再灌注60 min时ST段明显下降,并出现病理性Q波;再灌注180 min时ST段已基本降至等电位线,T波倒置,病理性Q波持续存在。
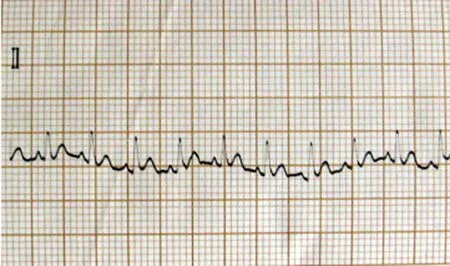
图1 正常心电图
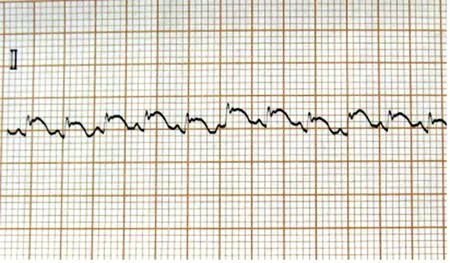
图2 缺血5 min心电图
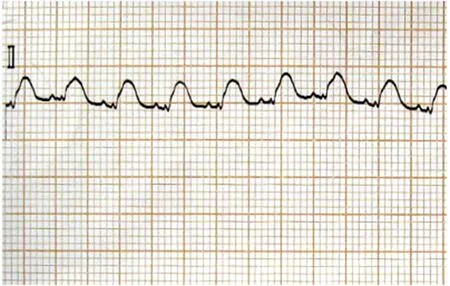
图3 缺血60 min心电图
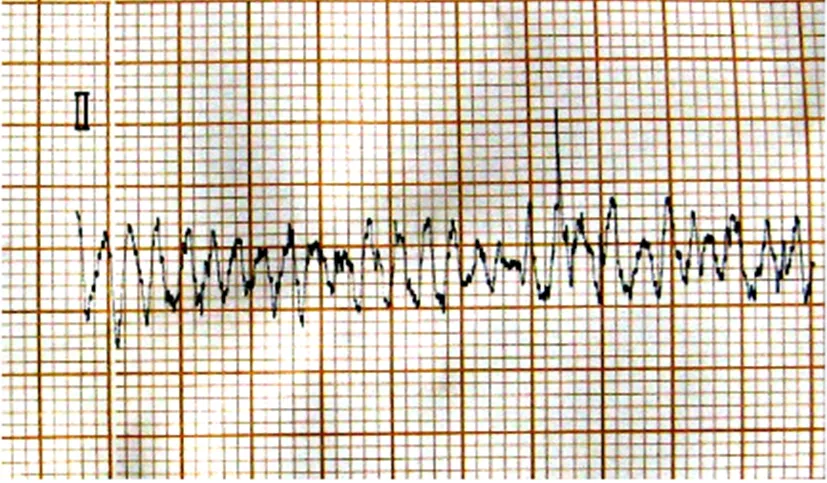
图4 再灌注性心律失常(室速)
2.病理改变:(1)光镜病理形态学观察:光镜下可见MI/RI组大量心肌细胞空泡变性,心肌组织水肿,较多心肌凋亡细胞表现为细胞核浓缩变小、胞浆嗜酸性变红染、细胞膜结构相对完整、大量炎性细胞浸润等特征,正常心肌细胞存活明显比rhEPO组少(见图5)。rhEPO组少量心肌细胞空泡变性、心肌组织水肿轻,偶见心肌凋亡细胞,少见炎性细胞浸润,大量正常心肌细胞尚存,病变程度较MI/RI组明显减轻(见图6)。
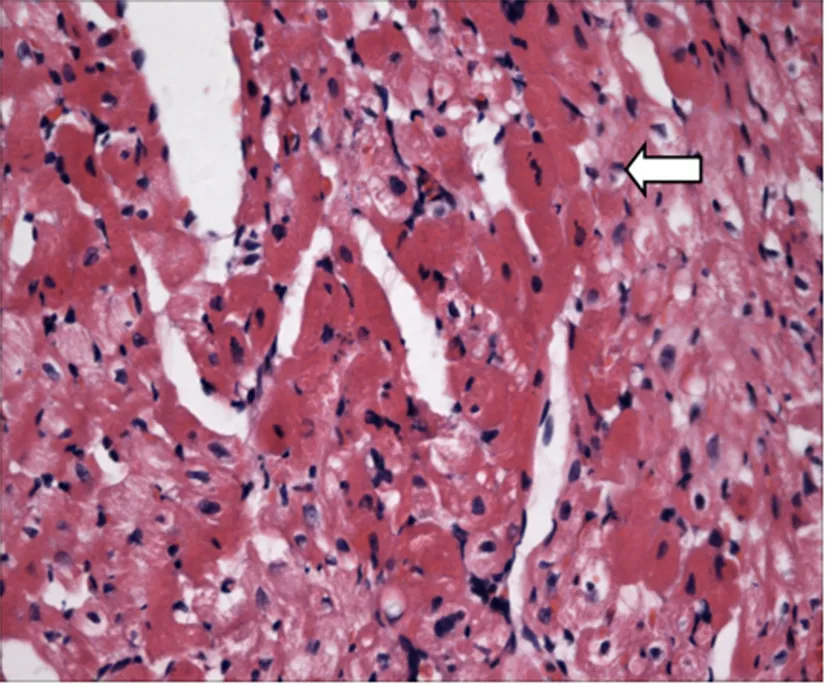
图5 MI/RI组心肌HE染色(×400)
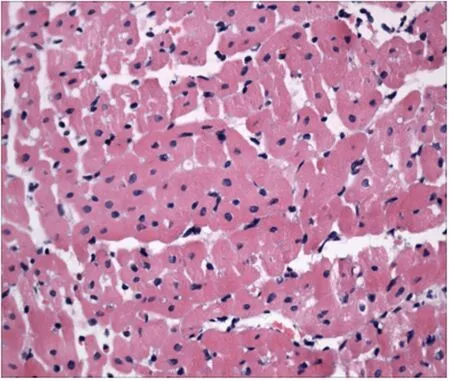
图6 rhEPO组心肌HE染色(×400)
(2)电镜病理形态学观察:透射电镜下可见 MI/RI组心肌中肌原纤维排列紊乱、部分肌丝溶解断裂,肌节模糊,线粒体广泛变性,表现为嵴排列紊乱,间隙加宽,甚至溶解、消失、线粒体空泡化;核旁线粒体轻度水肿,胞浆内糖原颗粒显著减少,细胞核形状不规则、固缩,染色质边聚、凝结成块状等细胞凋亡现象(见图7)。rhEPO组病变显著减轻,肌原纤维排列较整齐,肌节较清晰,少量肌丝溶解,线粒体形态基本正常,核膜完整,染色质密度有所增加、边聚现象较少(见图8)。
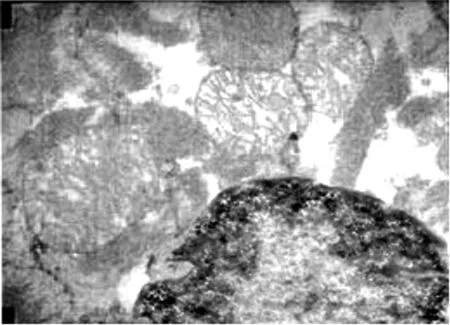
图7 MI/RI组心肌结构(TEM×15 000)
3.各组血清 CK-MB浓度变化:MI/RI组与rhEPO组血清CK-MB浓度均随缺血及再灌注时间延长而增加,差异有统计学意义(P<0.01);缺血前rhEPO组与MI/RI组组血清CK-MB浓度差异无统计学意义(P>0.05);缺血60 min、再灌注60 min、再灌注180 min时,rhEPO组血清CK-MB浓度均显著低于 MI/RI组,差异均有统计学意义(均 P<0.01)。具体数据见表1。
4.TUNEL法检测心肌细胞凋亡结果:凋亡心肌细胞的胞核呈深棕(褐)色,多位于梗死区中心及周边,正常心肌细胞胞核为蓝色。TUNEL结果显示,MI/RI组心肌中可见大量凋亡细胞(见图9),心肌细胞凋亡指数为(52.91±6.83)%;rhEPO组心肌凋亡细胞较MI/RI组明显减少 (见图10),其心肌细胞凋亡指数为(34.76±8.35)%,较 MI/RI组显著降低,差异有统计学意义(P<0.01)(见表2)。
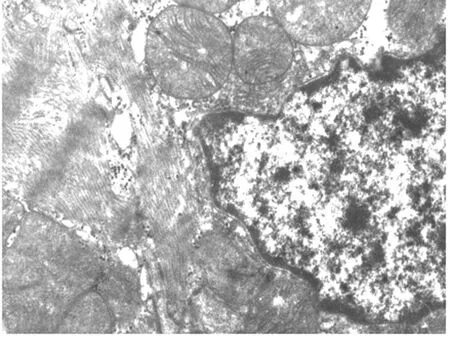
图8 rhEPO组心肌结构(TEM×15 000)
表1 血清CK-MB浓度变化(U/L±s)
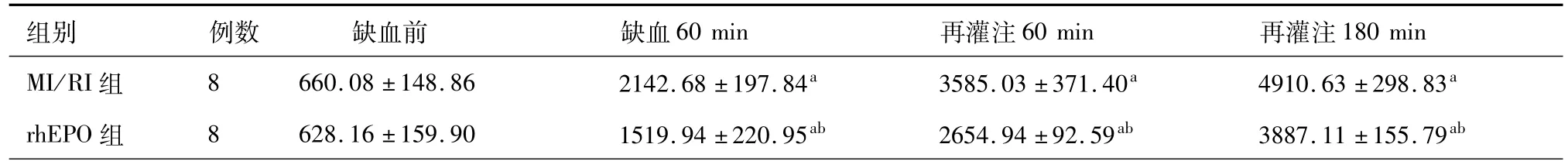
表1 血清CK-MB浓度变化(U/L±s)
注:a与前一时间点比较,P<0.01;b与同时段对照组比较,P<0.01
组别 例数 缺血前 缺血60 min 再灌注60 min 再灌注180 min MI/RI组 8 660.08±148.86 2142.68±197.84a 3585.03±371.40a 4910.63±298.83arhEPO组 8 628.16±159.90 1519.94±220.95ab 2654.94±92.59ab 3887.11±155.79ab
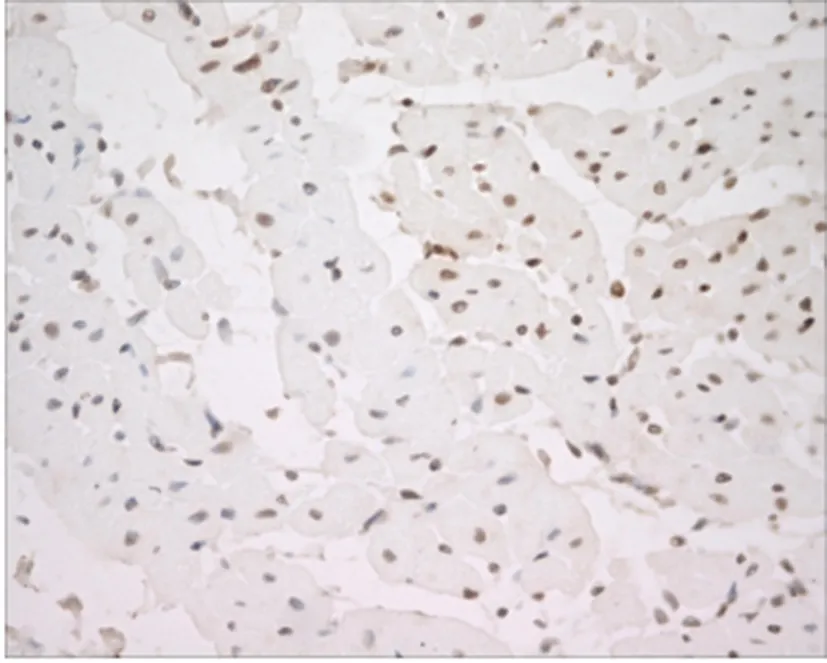
图9 MI/RI组TUNEL阳性细胞较多(×400)
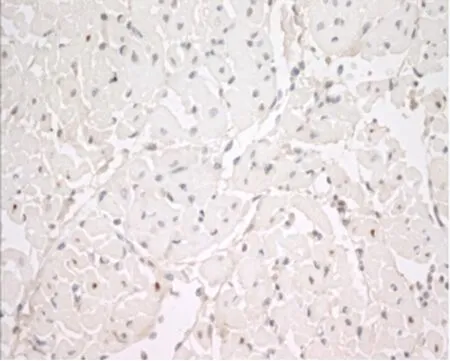
图10 EPO组TUNEL阳性细胞明显减少(×400)
表2 两组心肌凋亡指数比较(%,±s)

表2 两组心肌凋亡指数比较(%,±s)
注:a与 MI/RI组比较,P<0.01
组别 例数 心肌细胞凋亡指数MI/RI组52.91±6.83 rhEPO组 8 34.76±8.35 8 a
5.Caspase-3蛋白免疫组织化学结果:Caspase-3蛋白阳性染色颗粒主要在细胞浆,也有少数在细胞核,呈黄色至棕褐色颗粒。MI/RI组阳性染色细胞显著增加,多位于梗死区中心及周边,与TUNEL法所示心肌细胞凋亡区域一致(见图11),其Caspase-3蛋白表达为(4071.91±887.50)IOD;rhEPO组Caspase-3蛋白阳性染色的细胞较MI/RI组明显减少(见图12),其Caspase-3蛋白表达为(2669.61±82.67)IOD,较MI/RI组显著降低,差异有统计学意义(P<0.01)(见表3)。
表3 两组心肌Caspase-3表达积分光密度比较(IOD,±s)

表3 两组心肌Caspase-3表达积分光密度比较(IOD,±s)
注:a与 MI/RI组比较,P<0.01
组别 例数 Caspase-3蛋白表达的积分光密度MI/RI组8 4071.91±887.50 rhEPO组 8 2669.61±82.67a
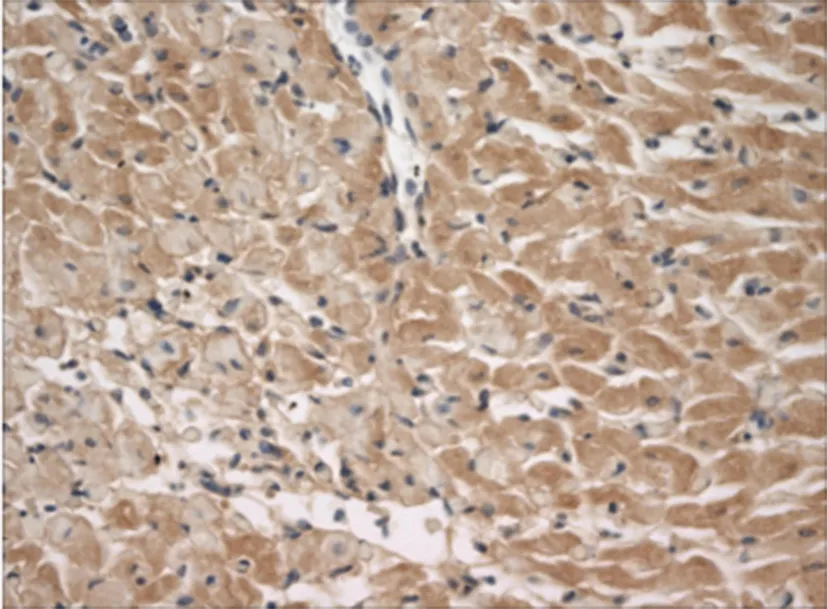
图11 MI/RI组 Caspase-3蛋白阳性染色细胞较多(×400)
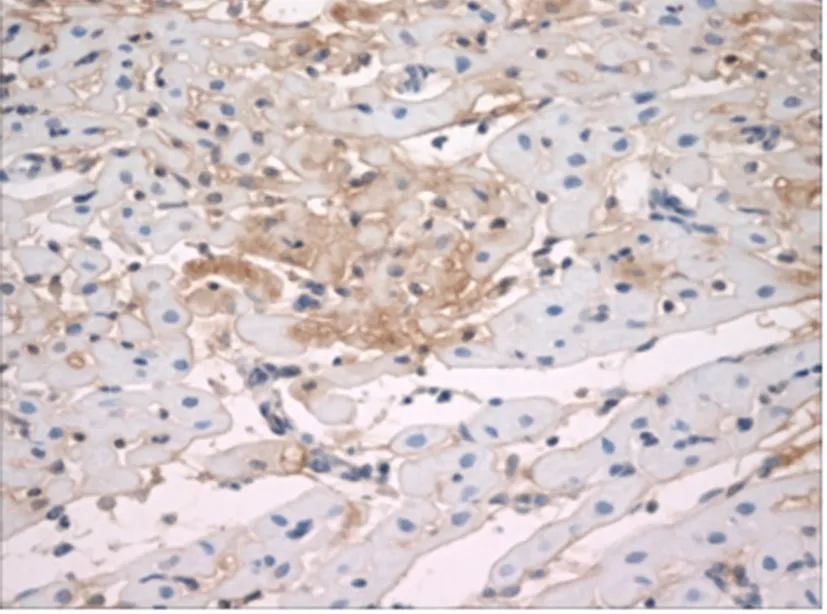
图12 EPO组Caspase-3蛋白阳性染色细胞明显减少(×400)
讨 论
MI/RI会引起再灌注性损伤,主要表现为室性心动过速及心室颤动,心肌收缩、舒张功能障碍,心肌细胞坏死、凋亡等,另外可导致冠状动脉血流中断、冠状动脉痉挛以及内皮功能失调等。其机理复杂,涉及多个环节,随着对心肌I/R损伤研究的深入,越来越多的证据显示细胞凋亡是造成损伤的重要机制之一[8]。因此,抑制细胞凋亡可预防和减轻I/R损伤。
EPO是一种刺激骨髓造血的糖蛋白类激素,天然存在的EPO主要来源于肾脏及胎肝,有α和β两种类型,由193个氨基酸组成,分子量为34 kDa。成人EPO主要由肾脏皮质髓质交界处的肾小管旁细胞分泌。EPO在体内不能储存,主要由血氧含量的变化来调节其生成[9]。有关EPO治疗心肌梗死效果的动物实验结果表明,EPO可以改善心脏功能,减小梗死面积和增加毛细血管密度[10]。
本研究中,光镜下可见:MI/RI组大量心肌细胞空泡变性,心肌组织水肿,较多的心肌凋亡细胞表现为细胞核浓缩变小、胞浆嗜酸性变红染、细胞膜结构相对完整、大量炎性细胞浸润等,正常心肌细胞存活明显比EPO组少。EPO组少量心肌细胞空泡变性、心肌组织水肿轻,偶见心肌凋亡细胞,少见炎性细胞浸润,大量正常心肌细胞尚存,病变程度明显轻于MI/RI组。透射电镜下可见:EPO组病变显著减轻,肌原纤维排列较整齐,肌节较清晰,少量肌丝溶解,线粒体形态基本正常,核膜完整,染色质密度有所增加,边聚现象较少。以上所述均表明EPO能维护心肌组织细胞大体形态结构及超微结构的完整性,对MI/RI损伤心肌细胞有保护作用。
EPO是细胞生长因子超家族成员之一,已广泛应用于神经系统和心血管系统疾病的细胞保护[5-7]。但EPO对心肌细胞的抗凋亡作用研究尚少。本实验采用TUNEL检测法直接显示MI/RI中凋亡心肌细胞,结果表明缺血再灌注损伤的心肌确实存在心肌细胞凋亡,与既往研究相符[7];MI/RI组心肌中可见大量凋亡心肌细胞,心肌细胞凋亡指数为(52.91±6.83)%,rhEPO组心肌凋亡细胞较 MI/RI组明显减少,其心肌细胞凋亡指数为(34.76±8.35)%,较 I/R组显著降低,差异有统计学意义(P<0.01)。初步表明rhEP0具有抗心肌细胞凋亡作用。
细胞凋亡涉及多种基因及其表达的复杂变化,其中,凋亡发生机制中最关键的环节之一是Caspase家族的激活[11]。ICE/CED-3蛋白酶家族均具有半胱氨酸蛋白酶类和特异性酶切天门冬氨酸氨基位点两大特点[12]。1996年 Alnemri等[13]将人类和哺乳动物ICE/CED-3蛋白酶统一命名为Caspase,其中最引人注目的是Caspase-3。普遍认为Caspase-3是哺乳类动物细胞凋亡中的关键蛋白酶,是细胞凋亡蛋白酶级联反应的必经之路。
本实验采用Caspase-3蛋白表达的积分光密度来充分反应其表达情况,积分光密度=相同视野下阳性表达平均光密度×阳性表达总面积,既包含Caspase-3蛋白表达的强度信息,又包含Caspase-3蛋白表达的面积信息,因此,可以客观精确地反应Caspase-3蛋白表达情况。本研究结果显示,MI/RI组Caspase-3蛋白表达的积分光密度显著高于rhEPO组Caspase-3蛋白表达的积分光密度;并且Caspase-3蛋白阳性表达心肌细胞多位于缺血区中心及周围区域,这与TUNEL法显示的细胞凋亡区域相同。说明rhEPO可通过降低Caspase-3表达,减少心肌细胞凋亡,从而起到抗心肌细胞凋亡的作用,进一步证实了rhEPO对MI/RI心肌的保护作用。
综上所述,rhEPO通过抑制细胞凋亡关键蛋白酶Caspase-3蛋白的表达而发挥抗心肌细胞凋亡作用,从而对在体兔MI/RI发挥保护作用,rhEPO可能对防治MI/RI有一定的临床应用价值。
[1] 朱妙章,袁文俊,吴博威,等.心血管生理学与临床[M].北京:高等教育出版社,2004.
[2] World Health Organization Report.Technical report series World Health Organization Report1997,Geneva.
[3] Shavelle DM.Almanac 2015:coronary artery disease[J].Heart,2016,102(7):492-499.
[4] Yang Q,He GW,Underwood MJ,et al.Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury:perspectives and implications for postischemic myocardial protection[J].Am JTransl Res,2016,8(2):765-777.
[5] Li F,Chong ZZ,Maiese K.Erythropoietin on a tightrope:balancing neuronal and vascular protection between intrinsic and extrinsic pathways[J].Neurosignals,2004,13(6):265-289.
[6] Maiese K,Li F,Chong ZZ.New avenues of exploration for erythropoietin[J].JAMA,2005,293(1):90-95.
[7] Rong R, Xijun X.Erythropoietin pretreatment suppresses inflammation by activating the PI3K/Akt signaling pathway in myocardial ischemia-reperfusion injury[J].Exp Ther Med,2015,10(2):413-418.
[8] Ke ZP,Xu P,Shi Y,et al.MicroRNA-93 inhibits ischemiareperfusion induced cardiomyocyte apoptosis by targeting PTEN[J].Oncotarget,2016,7(20):28796-28805.
[9] Weinhandl ED,Gilbertson DT,Collins AJ,et al.Relative safety of peginesatide and epoetin alfa[J].Pharmacoepidemiol Drug Saf,2014,23(10):1003-1011.
[10] Savino R,Ciliberto G.A paradigm shift for erythropoietin:no longer a specialized growth factor,but rather an all-purpose tissue-protective agent[J].Cell Death Differ,2004,11 Suppl 1:S2-S4.
[11] Wyllie AH.Apoptosis:cell death in tissue regulation[J].J Pathol,1987,153(4):313-316.
[12] Nicholson DW,Thornberry NA.Caspases:killer proteases[J].Trends Biochem Sci,1997,22(8):299-306.
[13] Alnemri ES,Livingston DJ,Nicholson DW,et al.Human ICE/CED-3 protease nomenclature[J].Cell,1996,87(2):171.
庞英,梁明亭,马建群,等.重组人促红细胞生成素对兔心肌缺血再灌注损伤的保护作用及其机制研究[J/CD].中华心脏与心律电子杂志,2017,5(1):1-6.
Protective effects and mechanism s of recombinant human erythropoietin on myocardial ischem ia/reperfusion injury in rabbits
Pang Ying1,Liang Mingting1,Ma Jianqun2,Yang Yong1,Zhang Jing3.
1Department of Cardiology, Liaocheng People′ s Hospital, Liaocheng, 252000,China;2Department of Cardiology,The Affiliated Hospital of Shandong Academy of Medical Sciences,Jinan,250031,China;3Department of Pediatrics,Shenxian People′s Hospital,Liaocheng,252000,China
Ma Jianqun,Email:mjianqun@163.com
ObjectiveTo investigate the influence of Recombinant Human Erythropoietin(rhEPO)on cardiac myocyte apoptosis and the expressing level of Caspase-3 protease which is critical in apoptosis in Myocardial ischemia/reperfusion injury(MI/RI)rabbits in order to explore the protective effects of rhEPO on MI/RI rabbit and itsmechanisms of action.MethodsSixteen New Zealand rabbits were randomly divided into two groups:control group(MI/RI group)and drug group(rhEPO group).Rabbits were subjected to descending coronary artery(LAD)occlusion to establish rabbit MI/RI models.When the left anterior descending coronary arteries were ligated,RhEPO(1 000 U/kg)were injected in rabbits of rhEPO group,the rabbits of control group were injected saline equivalently.Serum abstracted from the blood for testing the concentration of CK-MB at the following points:5 minutes before occlusion,60 minutes after occlusion,60 minutes and 180 minutes after reperfusion;At180 minutes after reperfusion,The apoptotic index of the corresponding ischemic myocardial cell and the level of Caspase-3 in ischemic region were tested;The specimens of lightmicroscope and electron microscopy were made to observe the general myocardial tissue morphosis and ultramicro organizational structure.ResultsThe Serum CK-MB concentration increasedgradually with protraction of the ischemia and reperfusion time(P<0.01).Before ischemia the serum CKMB concentration were no significant difference between rhEPO group and the MI/RIgroup(P>0.05).The increased level of CK-MB concentration in rhEPO group weremarkedly lower than those in the I/R group at 60 minutes after ischemia,60minutes after reperfusion and 180minutes after reperfusion.The differencewas statistically significant(P<0.01).Compared to the MI/RI group,both the ischemic myocardial apoptotic index and the expressing level of Caspase-3 in rhEPO group decreased significantly(P<0.01).The impaired changes of the generalmorphosis and the ultrastructure atMI/RIareas in the MI/RIgroup were severer than that in the rhEPO group.ConclusionRhEPO has visible protective effects on the MI/RI rabbits.The mechanism of cardioprotection may be associated with stabilizing themyocardium cellmembrane structure to decrease the release of myocardial enzyme and inhibit cardiac myocyte apoptosis.RhEPO can inhibit the cardiac myocyte apoptosis induced by ischemia/reperfusion injury through downregulation of the Caspase-3 protein expression.
Recombinant Human Erythropoietin; Myocardial ischemia/reperfusion injury;Apoptosis; Caspase-3; Rabbit
10.3877/cma.j.issn.2095-6568.2017.01.001
252000 山东聊城,山东省聊城市人民医院心内科1;250031 山东济南,山东省医学科学院附属医院心内科2;252000 山东聊城,山东省莘县人民医院儿科3
马建群,Email:mjianqun@163.com

