双膦酸盐及其联合甲氨蝶呤对CIA大鼠炎症与骨破坏影响的研究
解骏 肖涟波 黄新星
上海市光华中西医结合医院,上海 200052
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的慢性全身系统性自身免疫性疾病,全球患病率约1%~3%。RA能引起关节的疼痛、僵直及肿胀,在发病2年内即可能出现全身性骨质疏松和近关节的骨破坏,进而发生不可逆的关节损伤,致残率达50%。在我国约有四五百万人深受RA 的困扰[1-2]。RA的特征表现为对称性、慢性、进行性多关节炎并伴有全身多系统受累。关节滑膜的病理改变为慢性炎症、增生形成血管翳,侵犯关节软骨、软骨下骨、韧带和肌腱等,造成关节软骨、骨和关节囊破坏,最终导致关节畸形和功能丧失,并伴有局部和全身骨质的丢失。RA在疾病发展和治疗过程中会并发骨质疏松是RA的常见并发症之一,因此,在美国风湿病协会(American College of Rheumatology,ACR)提出的RA治疗指南增补文件中,就强调了对骨质疏松的防治,学术界也围绕着RA并发骨质疏松及骨破坏进行了诸多方面的研究。双膦酸盐(bisphosphonate,BP)类药物是近20年来发展起来的一类新药,1997年以来第二代双膦酸盐类药物(主要为阿仑膦酸钠等)上市,并逐渐被广泛应用,对老年性骨质疏松症和绝经后骨质疏松症有显著治疗效果。但对于RA的临床效果,未见明确的文献报道。因此研究双膦酸盐对RA患者的骨破坏的防治作用,对于临床工作有指导意义。
1 材料和方法
1.1 材料
1.1.1实验动物:Wistar 大鼠,40只,雌性,7~8周龄,体重160~180 g,2只/笼,分笼饲养,购买自中国科学院上海实验动物中心,饲养环境为上海交通大学医学院实验动物科学部SPF级动物房,大鼠自由饮水及进食,室温(25±1)℃,动物适应性饲养5d后进行实验。
1.1.2主要试剂和药物:牛II型胶原蛋白,购自Chondrex公司;完全弗式佐剂(CFA),美国sigma公司;不完全弗式佐剂(IFA),美国sigma公司;冰醋酸,北京化学试剂公司;自拟补肾强骨方(方剂为骨碎补、白芍、仙灵脾、豨莶草、补骨脂、青风藤、黄芪、络石藤)。此中药复方是我院已多年临床使用,并经实验验证确有控制RA炎症的作用。双膦酸盐(福善美),规格:70mg×1片/盒,国药准字J20080073,购自杭州默沙东制药有限公司;恩利注射粉剂,规格25 mg/瓶,批准文号S20100019,购自德国惠氏;MTX注射5 mg/支,批准文号H20080251,Ebewe Pharma Ges.m.b.H.Nfg.KG。
1.1.3模型建立及评定方法:(1)牛II型胶原的乳化。①配制乙酸溶液:溶解无水冰醋酸于灭菌用水,配制0.05 mol/L的乙酸。②配制胶原溶液:向牛II型胶原中加0.05 mol/L的乙酸溶液,使胶原溶液终浓度为4 mg/mL,放入4℃冰箱中避光搅拌过夜。③配制胶原乳剂:将4 mg/mL胶原溶液与CFA等体积乳化(注射器法,冰上操作),使胶原终浓度为2 mg/mL,用于初次免疫;将4 mg/mL胶原溶液与IFA等体积乳化,使胶原终浓度为2 mg/mL,用于激发免疫。(2)大鼠免疫方法。①初次免疫:用2%戊巴比妥钠溶液腹腔注射麻醉大鼠(0.3mL/只),于每只大鼠尾根部皮下注射0.12 mL胶原乳剂(含胶原240 μg)。②激发免疫:初次免疫后第7天于大鼠臀背部两侧各皮下注射0.03 mL胶原乳剂(共含胶原120 μg)。(3)模型评价方法。①观察关节形态:发病大鼠肿胀关节主要出现于双下肢踝关节和足趾各关节,可通过观察大鼠关节形态的变化判断发病情况。②关节炎症评分:大鼠关节炎症程度评价采用评分法(0~4分),分级评分及表现见表1。

表1 大鼠四肢关节炎症评分及表现Table 1 The joint inflammation score of rats
1.2 分组与给药方法
1.2.1入组标准:炎症评分≥2分即随机入组[3]。
1.2.2分组情况:空白组:灭菌用水治疗组8只。对照组:恩利+MTX治疗组8只。治疗组: BP+自拟补肾强骨方治疗组8只;BP+MTX组治疗组8只;BP治疗组8只。
1.2.3给药方法及剂量:灭菌用水3 mL/只/天,灌胃。双膦酸盐1.5 mL/只Qw (6.34 mg/Kg,1.3 mg/只),灌胃。
1.2.4自拟补肾强骨方组:按照美国FDA提出的临床等效剂量换算公式。该方水煎2次,煎液过滤,混合后加热浓缩,剂量含生药量1.3 g/mL,4℃保存备用,每只大鼠每天3 mL,分两次灌胃。MTX 0.2mL/只(1 mg/只) Qw 腹腔注射;恩利0.2 mL/只Biw(0.8 mg/只),腹腔注射。
1.3 关节炎症判定方法
从治疗的第1天开始,隔天按表1所示记录关节炎分数,每只大鼠的关节炎分数为双下肢评分的总和,共记录28天。
1.4 关节破坏程度检查方法
1.4.1胫骨上段松质骨组织形态计量学检查方法:硬组织切片制备完成,甲苯胺蓝染色后,置于带有专门骨组织形态计量学测量系统软件的半自动图像分析仪上,200倍光镜下,于胫骨上段骨骺线下1~4 mm间次级松质骨区域内每个标本随机选取5个视野,保存待分析。
在半自动图像分析仪上,测量每个视野的总面积即骨组织面积(Tissue area,T.Ar),测量每个视野下骨小梁总周长(Trabecular perimeter,Tb.Pm)、骨小梁面积(Trabecular area,Tb.Ar)。将测得的上述参数带入表2计算:骨小梁面积(Tb.Ar)、骨小梁宽度(Tb.Wi)、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)。

表2 松质骨组织形态计量学静态计算参数Table 2 Histomorphometry parameters of trabecular bone
1.4.2大鼠左侧股骨及第5腰椎骨生物力学的检查方法:治疗4周后,处死大鼠取左侧股骨全长及第5腰椎去除软组织,2 h内行骨生物力学检查,比较各组治疗后股骨及第5腰椎的生物力学的变化。处死大鼠取左侧股骨全长及第5腰椎去除软组织,修整椎体上下关节面,使上下关节面保持平行。取完标本后予以0.9%生理盐水纱布包裹标本,2 h内行骨生物力学检查,比较各组治疗后股骨及第5腰椎的生物力学的变化。测试室温控制于37℃,股骨干参数的取股骨干的中点的前后径及左右径平均值为直径,跨距为2 cm,加载速率为2 mm/min。股骨测试时均为同一方向,股骨头朝上,股骨小结节远端和股骨髁上分别为二点置于测试仪上,股骨干的中点为受力点。腰椎参数分别取:椎体前后径和左右径的平均值;椎体的高度;加载速率为2 mm/min。股骨三点弯曲实验以股骨断裂为实验终点,腰椎压缩实验以椎体被压缩1/3为实验终点。
1.5 统计学处理
采用SPSS16.0软件对实验数据进行统计学分析,数据符合正态分布,按照均数±标准差表示,若各治疗组方差齐,采用单因素的方差分析及LSD-t检验进行组间的两两比较;单独两组样本均数比较时,若方差齐,采用t-text,若方差不齐,改用t′检验,P<0.05认为差异有统计学意义。
2 结果
2.1 炎症评分
将隔日记录的关节炎症分值结果绘制成关节炎症分值曲线(见图1),从图中可以看出在治疗前7 d,所有的各治疗组都经历了一个炎症上升的阶段,在第2周左右各治疗组对胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠关节炎症分值出现较大的变化。恩利+MTX组的炎症评分快速下降,BP+自拟补肾强骨方及BP+MTX组的炎症评分则缓慢下降,而BP组的炎症则无明显降低,对照组的炎症评分仍然较高。
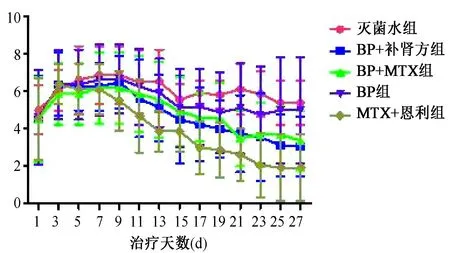
图1 治疗过程中各组大鼠关节炎症分值变化曲线Fig.1 The curve of rats’ joint inflammation score change in each group during treatment
对治疗第1天实验数据进行统计分析,在治疗第1天,4个治疗组炎症平均分值均在4.5分左右,任何两组之间比较差异均没有统计学意义,说明在治疗之初4个治疗组平均炎症分值相当。见图2。
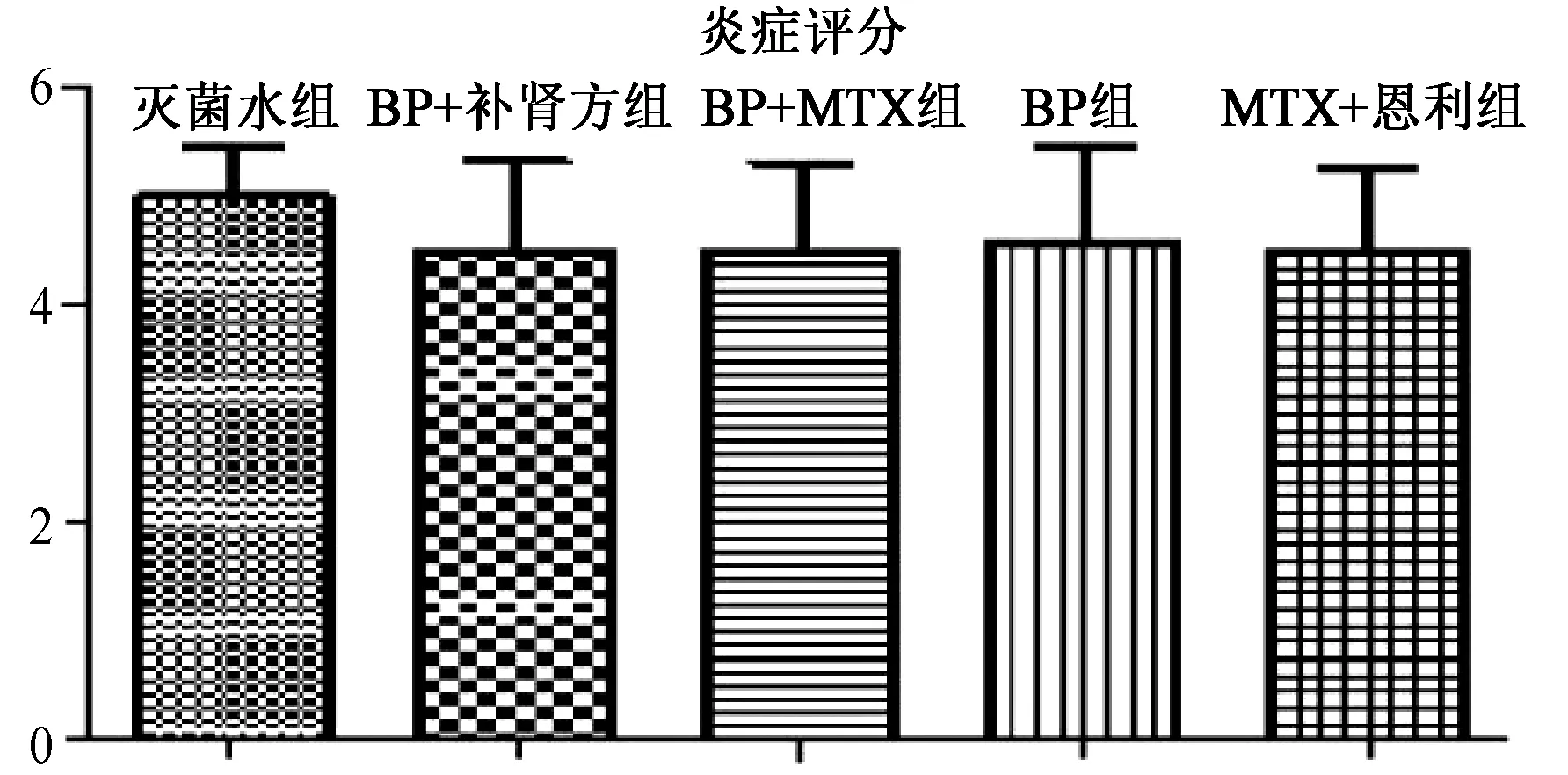
图2 治疗第1天各治疗组大鼠关节炎症分值比较Fig.2 On the first day of treatment, the comparison of rats’ joint inflammation score in each group
对治疗第28天实验数据进行统计分析,治疗28 d后,与灭菌水治疗比较,BP+自拟补肾强骨方及BP+MTX组(P<0.05)、恩利+MTX组(P<0.01)炎症平均分值显著降低,但BP组无显著变化。BP+自拟补肾强骨方、BP+MTX组及恩利+MTX组的炎症平均分值差异无统计学意义,但恩利+MTX组高于BP组炎症平均分值(P<0.05)。这说明BP+自拟补肾强骨方及BP+MTX组均对CIA大鼠炎症具有明显抑制作用,两组对CIA大鼠炎症的抑制作用相当。见图3。
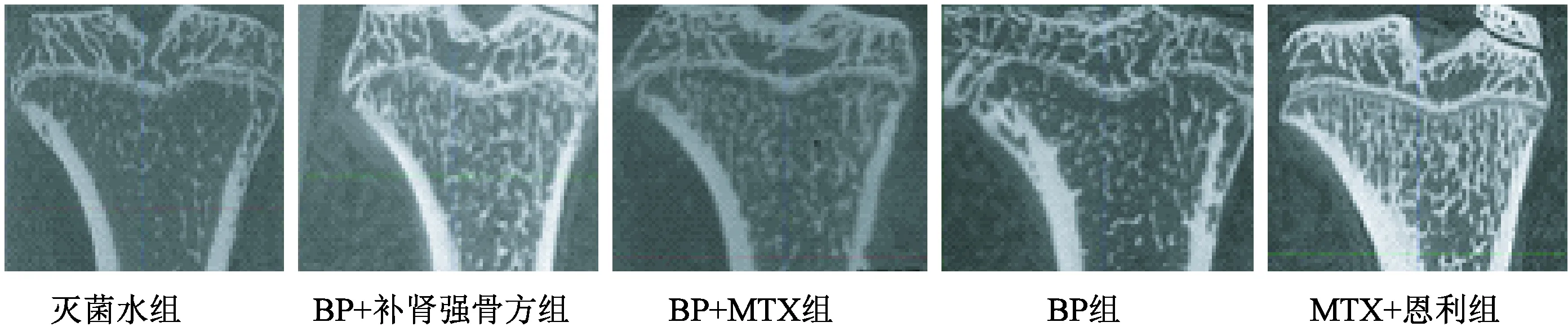
图4 大鼠胫骨上段矢状面比较(治疗4 w,Micro-CT扫描)Fig.4 The comparison of sagittal plane at rats’ proximal tibia (after 4 weeks treatment, scanned by Micro-CT)
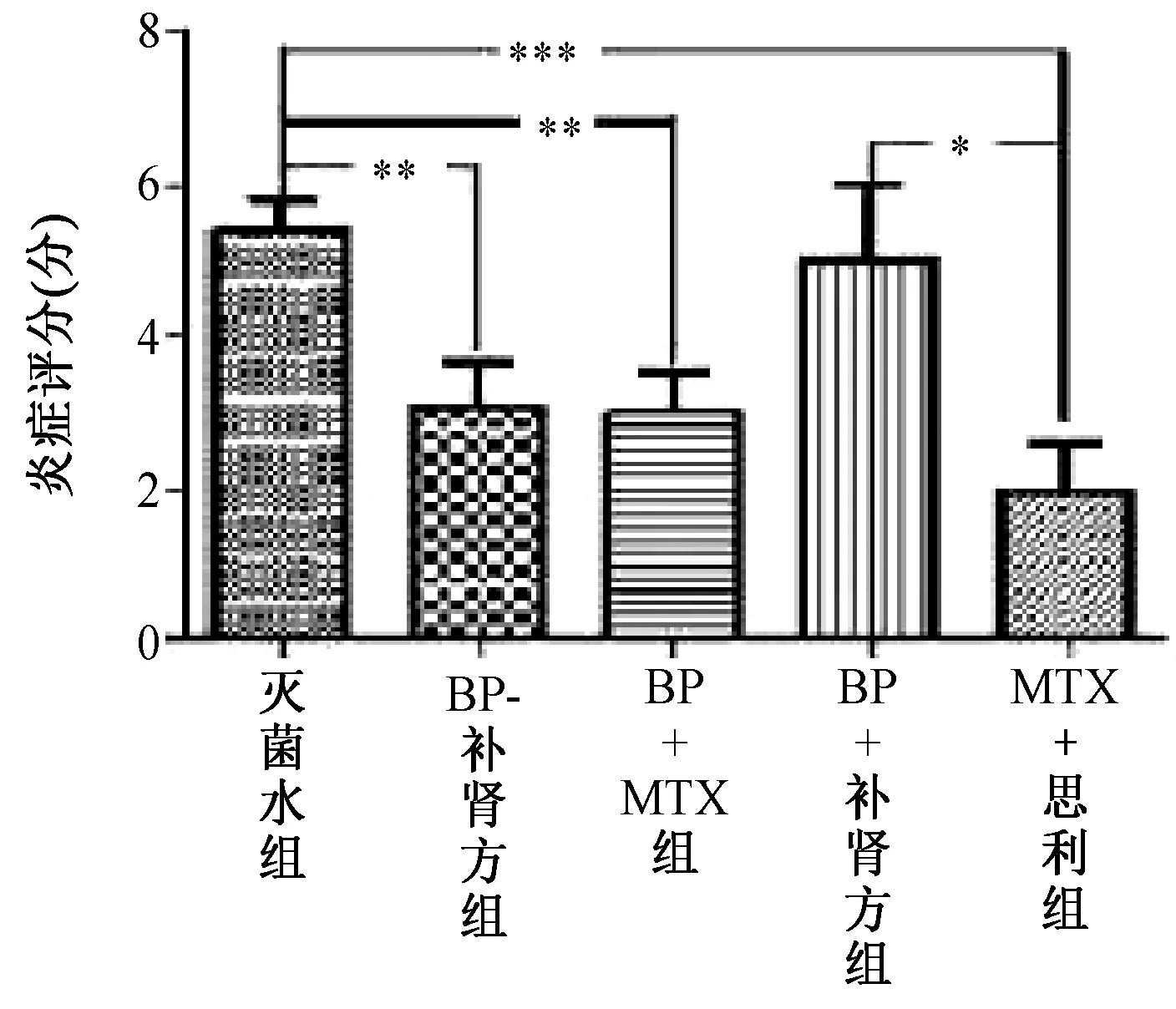
图3 治疗第28天各治疗组大鼠关节炎症分值比较(*表示P<0.05,**表示P<0.01,***表示P<0.001)Fig.3 On the 28th day of treatment, the comparison of rats’ joint inflammation score in each group (*to express P<0.05,** to express P<0.01,*** to express P<0.001)
2.2 骨组织形态计量学参数分析
2.2.1胫骨上段矢状面松质骨变化比较:药物治疗4 w后,取各治疗组大鼠胫骨上段行Micro-CT扫描,得到胫骨上段矢状面如图4所示,治疗4 w后,灭菌用水组大鼠胫骨平台前方出现塌陷,骨骺线向前倾斜,骨骺线下1~4 mm间的次级松质骨骨小梁稀少凌乱,相反BP+自拟补肾强骨方组、BP+MTX组及恩利+MTX组大鼠胫骨平台均保持正常结构形态,骨骺线呈蝶形、清晰可见,骨骺线下1~4 mm间的次级松质骨骨小梁数量明显多于灭菌用水组,骨小梁沿竖直应力方向排列较整齐。但相比较而言,BP组的骨小梁数量相对其他3个治疗组要稀疏,排列也不如其他3个治疗组整齐;而BP+自拟补肾强骨方及BP+MTX组则未见明显差异。
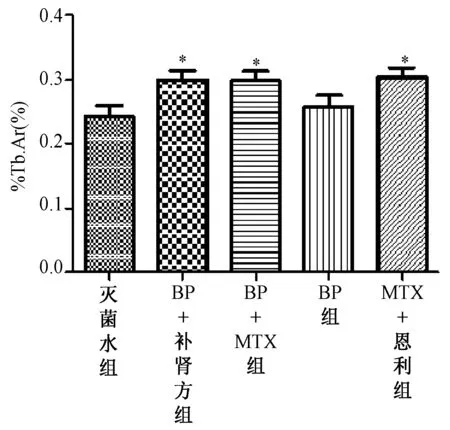
图5 各治疗组骨小梁面积百分数比较(治疗4 w,大鼠不脱钙骨组织5 μm切片,甲苯胺蓝染色,200×,**表示P<0.01,*表示P<0.05)Fig.5 Picture is the percentage of trabecular area of each treatment group compared( after 4 weeks treatment, rats’ hard tissue slices, 5um thick, toluidine blue stain,200×,**to express P<0.01,* to express P<0.05)
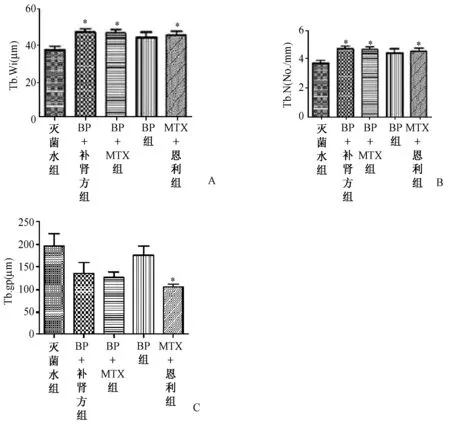
图6 骨组织形态计量学数据比较(治疗4 w后,大鼠不脱钙骨组织5 μm切片,甲苯胺蓝染色,200×)。数据经过统计学分析,图A、B、C分别代表了骨小梁宽度、骨小梁数量及骨小梁分离度之间的差异(**表示P<0.01,*表示P<0.05)Fig.6 The comparison of bone histomorphometry data (after 4 weeks treatment, rats’ hard tissue slices, 5 um thick, toluidine blue stain,200×). After statistical analysis, picture A、B、C express data different significantly among trabecular width, trabecular number and trabecular separation(**to express P<0.01,* to express P<0.05)
2.2.2胫骨近端骨组织切片参数比较:治疗4 w后,各治疗组骨组织切片制作完成后,甲苯胺蓝染色,置于带有专门骨组织形态计量学测量系统软件的半自动图像分析仪上,200倍光镜下,于胫骨上段骨骺线下1~4 mm间次级松质骨区域选取各组视野,计算出骨小梁面积百分数(见图5)。骨小梁面积百分数是评价药物对骨量影响的最重要的客观指标,统计分析后发现,BP+自拟补肾强骨方组、BP+MTX组及恩利+MTX组骨小梁面积百分数均高于灭菌用水组(P<0.05),而3组之间差异无统计学意义。 这也反映了BP+自拟补肾强骨方组、BP+MTX组、恩利+MTX组均具有明显地抑制CIA大鼠炎症关节周围骨量丢失的能力,且3组治疗药物抑制骨量丢失的能力相当。
骨小梁面积百分数是评价药物对骨量影响的最重要客观指标,从数学公式上推算,它等于骨小梁宽度与数量乘积的1/10,即骨量多少由宽度和数量两者共同决定,骨小梁宽度与数量的变化主要用于描述骨小梁形态结构,解释骨量变化。从图6A中可以看出治疗4 w后BP+自拟补肾强骨方组、BP+MTX组、恩利+MTX组骨小梁宽度与灭菌水组均高于灭菌水组(P<0.05),而3组之间差异无统计学意义。而图6B中显示BP+自拟补肾强骨方组、BP+MTX组骨小梁数量明显高于灭菌水组(P<0.05),而BP及恩利+MTX组骨小梁数量与灭菌水组差异无统计学意义。说明BP+自拟补肾强骨方组、BP+MTX组均能够明显抑制CIA大鼠炎症关节周围骨小梁数量的减少及提高骨小梁宽度;同时,也说明BP+自拟补肾强骨方组、BP+MTX组药物抑制骨量减少的作用主要是通过抑制骨小梁数量减少及提高骨小梁宽度来实现的。
骨小梁分离度是指骨小梁之间的平均距离,也是用于描述骨小梁形态结构的重要指标。分离度越大,骨小梁之间的距离就越大,意味着骨质越疏松。从图6C中可以看出,恩利+MTX组骨小梁的分离度低于灭菌水组(P<0.05);BP+自拟补肾强骨方组、BP+MTX组与灭菌水组之间骨小梁分离度差异无统计学意义。
2.3 骨生物力学参数比较
在治疗4 w后,经统计分析后发现,在腰椎压缩实验中,与灭菌水组相比较,BP+补肾强骨方组(P<0.05)、BP+MTX组(P<0.05)及MTX+恩利组(P<0.05)差异均有统计学意义,而单独使用BP组则差异无统计学意义(图7A)。在图7B股骨三点弯曲实验中,与灭菌水组相比较,BP+自拟补肾强骨方组(P<0.05)、MTX+恩利组(P<0.001)差异均有统计学意义,BP组与MTX+恩利组比较差异有统计学意义(P<0.05),余各组间比较差异无统计学意义。
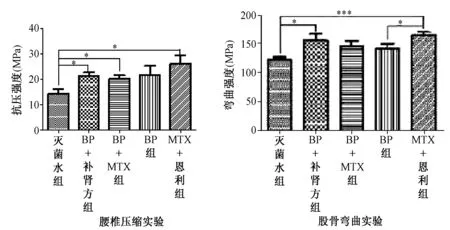
图7 大鼠股骨三点弯曲实验及腰椎压缩实验比较(治疗4 w,骨生物力学仪检查)Fig.7 The comparison of three-point bending test of femur and lumbar vertebrae compression test (after 4 weeks treatment, scanned by Bone-biomechanical device)
综上,BP联合自拟补肾强骨方与BP联合MTX对CIA大鼠关节炎症均具有明显抑制作用,且BP联合自拟补肾强骨方与BP联合MTX作用相当。但单独使用BP对于CIA大鼠关节炎症无明显缓解作用。BP联合自拟补肾强骨方、BP联合MTX与恩利联合MTX均具有明显的抑制CIA大鼠炎症关节周围骨量丢失的能力,单独使用BP则无明显缓解作用。BP联合MTX或自拟补肾强骨方均能明显抑制CIA大鼠关节炎症反应、关节侵蚀及关节周围骨丢失的作用。
3 讨论
双膦酸盐对骨骼和矿物质有很强的亲和性,可抑制羟膦灰石结晶及其总体物质的形成、生长和溶解,且抑制结晶的形成比抑制其形成和生长的需要量低,故小剂量的双膦酸盐类药物即可抑制骨吸收。临床常用的双膦酸盐类药物有依替膦酸二钠、帕米膦酸盐、阿仑膦酸钠、利塞膦酸钠、唑来膦酸等。口服双膦酸盐可增加骨密度,减少椎体骨折风险。
类风湿关节炎(RA)是一种以关节及关节周围组织的非感染性炎症为主要表现的自身免疫性疾病。我国大陆地区RA 患病率约为0.2%~0.4%[4],预后多引起关节功能障碍,影响患者生活质量。RA的两大病理表现为炎症和骨破坏,临床上一般应用缓解病情药物、激素及生物制剂治疗。含氮的双膦酸盐可以通过抑制破骨细胞的甲羟戊酸途径,从而抑制下游的包括Rho、Ras、Rab在内的蛋白合成[5],这一途径与炎症有关。Rho与炎症相关,可以促进巨噬细胞和淋巴细胞向炎症组织迁移,产生炎症应答[6]。同时双膦酸盐还可以通过其对破骨细胞的抑制作用和对软骨细胞的保护作用,减少和预防RA 产生的骨破坏[7]。
RA和骨破坏传统上认为是免疫系统和骨代谢系统两个系统的疾病,互不相干,近些年大量证据提示RANKL-RANK系统在RA骨破坏中的强大机制。RA动物模型得出一致的结论,炎症关节中RANKL表达上调[8-12],骨保护素(osteoprotegerin,OPG)水平下降,RANKL与OPG比率与破骨细胞活性及局部骨侵蚀程度呈正相关;相反RANKL抑制剂可明显减轻骨侵害,如RANKL基因敲除小鼠表现为可抵御与关节炎相关的关节侵蚀,并在关节中少见破骨细胞[13];OPG能抑制骨侵蚀及破骨细胞,也能减少关节炎大鼠关节周围的骨量丢失[14]。
因此炎症与骨质疏松是两个密切相关的问题,如果只是治疗继发骨质疏松,往往不能取得预期效果。本次研究也表明,单纯使用BP治疗RA继发骨质疏松是没有任何效果的,但如果联合具有确切疗效的缓解RA炎症的方案,对于改善骨质疏松的效果则明显显现。国外研究表明,对于女性绝经后类风湿关节炎患者的研究发现股骨骨密度与围绕近侧大腿肌肉截面积、绝经时间有差异,而单纯BP治疗对股骨骨干的骨密度没有显著效果[15]。但也有研究表明,同样对于绝经后类风湿关节炎女性患者,伴有使用皮质激素史,在维持原治疗RA方案的不变,加用阿仑膦酸钠或利塞膦酸盐治疗。12个月后腰椎和股骨颈骨密度和DAS28与原先基线相比,改善显著。对于绝经后RA女性患者,联合BP能提高骨密度与减缓疾病活动的作用[16]。另一个研究结果也表明,单独使用BP对于防治RA继发骨质疏松及继发股骨颈骨折的效果并不理想,当BP联合他汀类药物则有明显效果[17]。
RA 并发骨质疏松症已经得到了流行病学研究的证实。炎症活动是RA 骨质丢失相关的最重要因素,彻底控制炎症的前提下联合使用BP类药物是治疗继发性骨质疏松的最佳方案。

