音猬因子信号通路与骨质疏松症关系的研究进展
许周媚 王清辉 查旋 徐道华,2 *
1. 广东医科大学药理学教研室,广东 东莞 523808 2. 广东医科大学中药与新药研究所,广东 东莞 523808
骨质疏松症是一种以骨量减少、骨显微结构退化为特征,致使骨脆性增加、易于发生骨折的一种全身性骨骼疾病。其病理机制主要是成骨细胞的骨形成能力下降,成脂分化增强,破骨细胞的骨吸收活动增强,导致骨代谢平衡被打破,由此产生一系列的骨质疏松症状。 Hedgehog家族是一组分泌性的信号蛋白,最早在1980年从果蝇体内发现并分离得到,因Hedgehog的突变可使果蝇胚胎发育成毛团状,酷似刺猬,故称为刺猬基因[1]。在哺乳动物体内有3种同源Hedgehog信号,Shh在Hedgehog家族中表达最广泛,与细胞在肢体、体节、神经管发育中的分化建立有关[2],与多种器官如脑、脊髄、肺脏、毛发、眼、颌面、牙和四肢等的形态形成有关,与肿瘤发生也有关系[3-6]。研究证明,随着衰老进程的推进,骨骼中Shh信号表达水平也降低,Shh信号通路在骨质疏松发病过程中具有重要作用[7]。因此,本文拟对Shh信号通路与骨代谢的关系进行综述,为Shh信号通路在骨质疏松症防治药物的研发提供理论依据。
1 Sonic hedgehog 信号通路发生和转导
1.1 Sonic hedgehog 蛋白的自动修饰
Shh蛋白是Shh信号通路的启动蛋白,是该通路的重要组成部分之一。Shh最初被编码成一个45-kDa的前体蛋白,经过分子内裂解成Shh-C(26-kDa)和Shh-N(19-kDa)两个部分[8],其中Shh-N为活性调节部分,Shh-N经胆固醇或棕榈酸(又称软脂酸)的共价修饰成为可溶解可扩散的脂质双分子形式“M-Shh-N”,即Shh蛋白发挥诱导作用的活性形式[9-10]。
1.2 Sonic hedgehog 信号通路的激活
Shh信号通路的激活首先是“M-Shh-N”与Ptc-Smo异二聚体复合物受体结合。Patched(Ptc)是一个12次跨膜蛋白,对Hedgehog信号通路起负性调节作用;Smoothened(Smo)是一种特殊的7次跨膜蛋白,是激活 Hedgehog信号传递必需的受体。当Shh与Ptc结合时,Smo的抑制效应被解除,活化的Smo通过编码一些类似G蛋白偶联受体的跨膜蛋白启动Shh信号通路下游的一系列信号流,或者直接编码Shh信号的受体[11],其产生的细胞内信号将通过调节几种蛋白酶激活一类核内转录因子,Cubitus interrupts(Ci)蛋白和下游锌指转录因子glioblastoma(Gli) 蛋白[12],由此通路被激活。
1.3 Sonic hedgehog 信号通路的转导
Sonic hedgehog信号的转导主要通过调节以下4部分极性因子实现信号的转导,包括Ptc,丝氨酸/苏氨酸蛋白激酶Fused(Fu),类运动蛋白costal-2(Cos-2),Ci。该信号通路的靶基因是分子量为155kDa,具有细胞质锌指结构的Ci蛋白[13]。在脊椎动物中,Ci蛋白又称Gli蛋白,分Gli1,Gli2,Gli3共3种,其中Gli1和Gli2对Shh通路起正性调节作用,而Gli3起负性调节作用[14]。Cos-2是一种能与微管蛋白结合并能水解ATP的驱动蛋白样蛋白[15],当其与微管蛋白结合时,则阻止了全长Ci进入细胞核内。Fu可以磷酸化结合Cos-2,其抑制形式SuFu(suppressor of fused)可结合在Ci的SuFu结合位点上,实现对Shh通路的负性调节[16-17]。由此,当通路中编码的Shh蛋白不存在时,Fu,Cos-2分别与Ci结合成复合物并结合在微管上,其中Cos-2将全长Ci155水解为非活性形式的Ci75,导致Ci下游的转录受到抑制。当编码的Shh蛋白存在时,Shh蛋白结合Ptc受体结合,从而释放其对Smo的抑制效应,活化的Smo将与Fu, Cos-2形成复合物,同时抑制PKA的活性,使得活性形式的全长Ci155进入细胞核,激活下游靶基因(Ptch、Wg、Dpp等)的表达[18-19]。并且全长Ci还可下调原本有助于分别位于两细胞上的Hedgehog蛋白与受体Ptc结合的iHog和CDO在细胞膜上的表达,从而对Hedgehog蛋白有负反馈作用。值得注意的是,Hedgehog信号的转导需要初级纤毛的参与,因为纤毛内蛋白在该通路的跨膜蛋白Ptc和Smo的转移以及靶基因Ci的表达中也同等重要[20-21]。见图1。
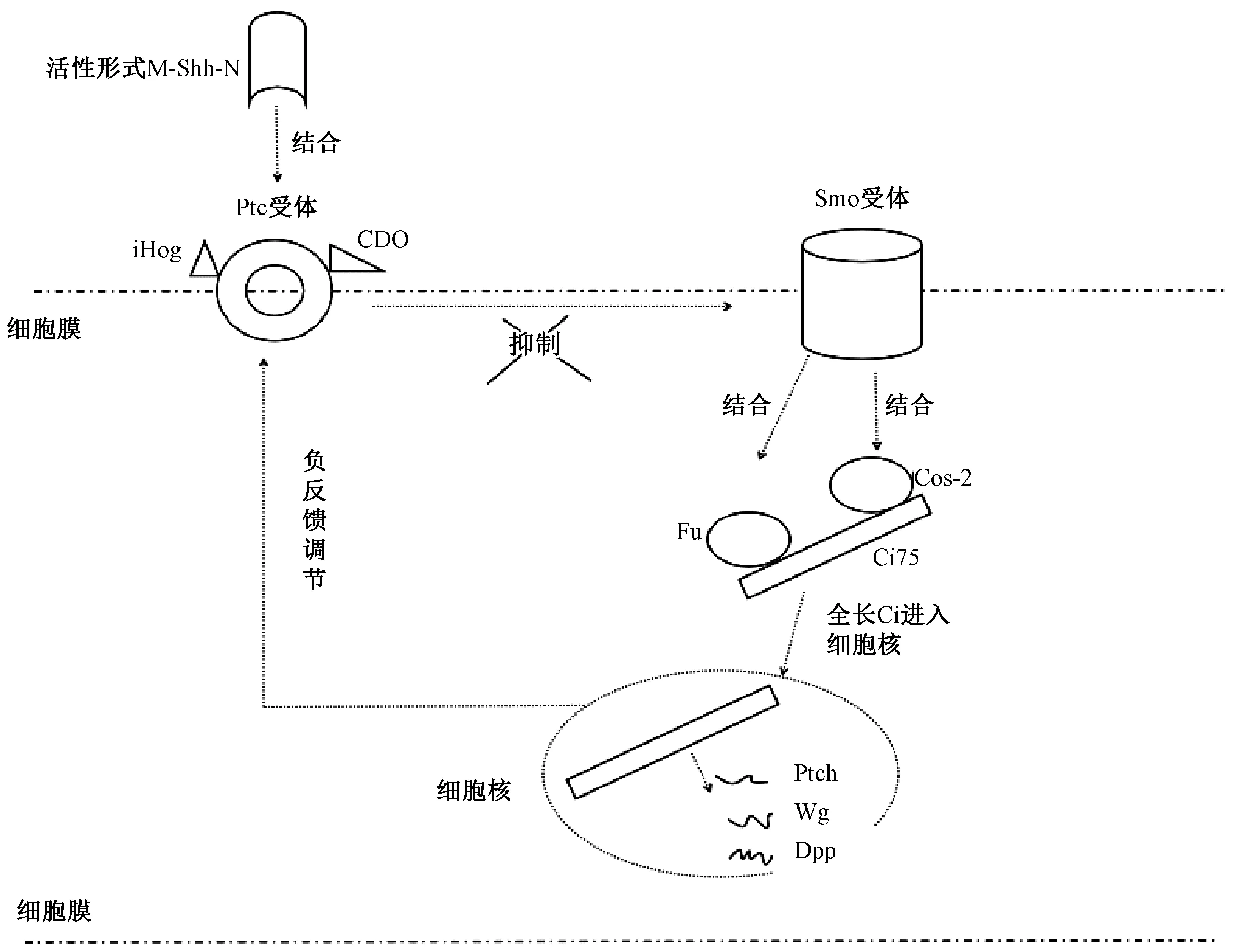
图1 Sonic hedgehog 信号通路激活与转导Fig.1 The activation and transduction of sonic hedgehog signal pathway
2 Sonic hedgehog信号通路对成骨作用的影响
2.1 Sonic hedgehog对未分化的细胞及前体成骨细胞成骨分化的影响
目前,越来越多的实验证明,Shh对多种细胞的成骨分化有促进作用,而抑制其成脂作用。如含转染能编码N-Shh基因的质粒的多能间充质细胞系C3H10T1/2细胞,其碱性磷酸酶(alkaline phosphatase, ALP)和成骨标记基因骨钙素(osteocalcin, OCN)的表达水平升高,并且这种成骨分化的促进作用主要是通过上调骨形成蛋白(bone morphogenetic protein, BMPs)产生[22]。用Shh处理C3H10T1/2细胞发现ALP表达增强,同时Hedgehog信号通路中的必需受体 Ptc、Smo以及靶基因Gli的表达明显增强[23],说明Shh信号通路参与促进C3H10T1/2细胞成骨分化的过程。研究表明[24],重组人Shh蛋白促进了未分化的KS483细胞系向成骨细胞分化。Shh也能促进前体成骨细胞MC3T3-E1的增殖和分化[25]。
2.2 Sonic hedgehog对成骨细胞成骨分化的影响
Hedgehog信号通路与成骨细胞的增殖和分化过程密切相关。韩磊等[26]在体外分离和培养新生大鼠颅顶骨成骨细胞,发现Hedgehog N端重组蛋白(N-Shh)能促进原代成骨细胞的增殖和S期细胞比例增加,增强ALP的活性并促进Hedgehog通路特异性受体Ptch和Smo的表达,该通路抑制剂环巴胺则抑制原代成骨细胞的增殖和分化。Horikiri等[25]发现,加入Shh可促使骨缺损部位进行骨重建,可能是因为Shh对成骨细胞的增殖和分化有促进作用。Jemtland等[27]在原代成骨细胞的培养基中加入N-Shh,可上调甲状旁腺相关肽(parathyroid hormone-related peptide, PTHrP)的表达及免疫PTHrP(immunoreactive parathyroid hormone-related peptide, iPTHrP)的分泌,从而诱导成骨分化;N-Shh还可以增加ALP表达, 矿化结节的形成增多,说明N-Shh可促进原代成骨细胞的骨形成作用,这个作用是通过上调PTHrP实现的。
2.3 Sonic hedgehog对人骨髓间充质干细胞(marrow mesenchymal stem cells, MSCs) 的影响
与上述实验研究结果不同,Shh对人MSCs细胞的成骨诱导作用存在争议。Warzecha 等[28]发现用Shh处理人的MSCs细胞时,细胞表达出多种软骨分化阶段特征的标志:Sox9,CEP-裂能力,并且只有经过r-Shh处理的人MSCs细胞表现出较强的分裂能力和更高的溴脱氧核苷尿嘧啶含量。Beloti等[29]也发现Hedgehog通路激动剂purmorphamine能促进人MSCs细胞的成骨分化,增强ALP活性。 然而也有研究发现Hedgehog信号的活化会抑制MSCs成骨分化。Plaisant等[30]在培养人MSCs时,发现在成骨过程中Smo受体及Gli转录因子的表达明显减少,其作用机制可能与成骨分化标记转录因子Runt-related transcription factor 2 (Runx2)的下调有关。
2.4 Sonic hedgehog对体内骨组织形成的影响
有研究证实在骨重建的位点上发现成骨细胞中的Shh信号通路被活化,Shh信号通路通过调节成骨细胞的增殖、分化以及破骨细胞的形成影响骨折的愈合[30-31]。在头顶缺陷的兔子模型中移植经Shh转换的细胞可发现缺损处骨再生[33]。Krishnan等[34]研究亦发现,Hedgehog信号通路中的Shh-N可通过BMP-4和核心结合因子(core binding factor alpha 1, Cbfa1) 介导新生小鼠跖骨中软骨内骨形成,促进骨的生长发育。史坚强[35]等证实MSCs复合Shh修饰的纳米晶胶原基骨(nano hydroxyapatite/collagen, nHAC) 修复同种异体SD大鼠股骨缺损的效果明显优于单纯的MSCs/nHAC修复的效果,前者成骨较早且骨痂生成较多,能更快更有效地促进骨缺损的愈合,其成骨方式主要为软骨内成骨。最近研究表明[36],在小鼠胫骨骨折发生后,可检测到Hedgehog信号通路的组成成分表达增加,从而增多骨痂的形成,促进骨折愈合。也有人发现Gli单倍剂量不足的小鼠表现出骨量的减少和成骨细胞分化的减弱,而破骨细胞的分化增加[37]。以上研究均表明了Shh对骨折愈合的重要性,但其具体作用机制未作具体探讨。
2.5 Sonic hedgehog信号通路影响成骨分化的作用特点
在Hedgehog信号通路中,印度刺猬因子(indian hedgehog, Ihh)及Shh是调控肢体发育及成骨细胞分化的重要信号分子。Shh是成骨细胞分化早期的关键信号之一,而Ihh主要参与分化晚期的调控,说明Shh信号的发挥是有时限性的[38-39]。Shh和Ihh都能刺激C3H10T1/2间充质细胞系向成骨细胞方向分化,但和Ihh相比,Shh的诱导活性明显较强[40]。韩磊等[26]在体外培养大鼠成骨细胞,发现在成骨细胞体外生长过程中,Shh的表达逐渐减弱,而Ihh的表达逐渐增强。进一步研究认为Hedgehog蛋白主要在成骨细胞分化的早期有促进作用,由于随着成骨细胞的成熟Hedgehog信号逐渐减弱并在成骨细胞分化的晚期出现抑制作用[29]。但是以Shh及Runx2处理MC3T3-El细胞后,其多种成骨相关蛋白的表达明显提高,而沉默Runx2基因后,这些因子的表达明显降低,表明在Runx2的介导下Shh也可促进成骨细胞的晚期成熟分化[41]。
另外,Hedgehog 蛋白的功能在不同物种间可能会存在较大差异。人类骨髓间充质干细胞的Shh信号对成骨分化作用显示出与动物种属不同的抑制效应,同一种属的细胞表现出促进或抑制的成骨分化作用,说明培养条件的不同也可能影响其作用结果。
此外,有研究表明,Shh只是Hedgehog通路中的启动因子,不是作为成骨、成软骨的诱导剂发挥作用,而在其他成骨相关因子协助下可发挥作用。有人将 Shh-N直接植入裸鼠发现植入部位既没有骨形成, 也没有软骨形成。Yuasa等[42]发现重组N-Shh是依赖BMP-2来诱导MSCs 和C3H10T1/2细胞的成骨分化,将BMP-2移植到小鼠肌肉内可产生异位成骨,而单独移植N-Shh不出现此现象,表明 N-Shh必须在BMP-2参与下才能诱发MSCs的成骨分化。进一步验证发现,加入外源性的重组鼠N-Shh能提高小鼠胚胎 C3H10T1/2细胞对BMP-2 的反应,成骨分化标记ALP活性增强;而给予 BMP 抑制剂Noggin解除BMP-2的诱导活性后,共转染 N-Shh和Noggin却对Shh诱导的ALP表达无明显影响,说明 Shh 可直接作用于成骨细胞分化,但BMP-2对N-Shh的协同诱导作用具有一定的时效性[43-45]。
3 Sonic hedgehog通路对脂肪组织形成的影响
在脂肪细胞中,Hedgehog信号通路的多种组成成员,如受体Ptc、Smo及核内转录因子Gli均有表达,而且早期研究发现激活果蝇和线虫的hedgehog信号通路,体内的脂肪生长受到抑制,脂肪量下降。经Shh转基因的果蝇,肥胖不容易发生[46]。Pospisilik等[47]通过建立sufu基因突变鼠发现激活hedgehog信号通路会特异性地抑制该鼠白色脂肪组织的发育,白色脂肪细胞的数量和大小明显下降。进一步研究发现,Shh通路的活化会抑制多种间充质干细胞向脂肪细胞方向分化成熟,而有利于成骨细胞的分化。用Shh处理鼠间充质干细胞KS384和C3H10T1/2,发现Shh能促进该细胞向成骨细胞方向分化,抑制其向脂肪细胞方向分化[40];James等[48]发现在成骨分化过程中,Hedgehog 信号通路的相关蛋白Shh, Ptc1和Gli1的表达增加,而在脂肪分化过程中,上述通路蛋白的表达减少。并且N-Shh作用于脂肪来源的基质干细胞(mouse adipose-derived stromal cells,mASCs)可通过上调成骨标记基因Runx2,最终导致ALP活性的增加和钙结节数量的增多,促使mASCs向成骨方向分化。
4 Sonic hedgehog通路对破骨细胞的影响
研究表明[49-50],激活成年大鼠成熟的成骨细胞Hedgehog通路,可同时使成骨细胞和破骨细胞增多,骨形成活跃的同时骨吸收作用也明显加强,最终出现骨质疏松;而抑制Hedgehog通路则使大鼠骨质丢失减少,表明Hedgehog信号参与调节破骨细胞的生成。Hedgehog对破骨细胞的调节可通过多种途径作用,如核因子κβ受体活化因子配体(Ligand of receptor activator of nuclear factor kappaβ, RANKL)依赖途径,RANKL是破骨细胞分化因子,Hedgehog可通过上调PTHrP来调节RANKL的表达,从而诱导破骨细胞的成熟,促进重吸收的过程[51]。另外有实验证明,Shh通过上调成骨特异性转录因子(Osterix, OSX)的表达来促进成骨细胞的形成,同时也间接地增加破骨细胞的活性,从而促进骨重吸收,导致骨强度的降低[52-53]。
5 Sonic hedgehog信号通路异常可能导致的相关骨骼疾病
大量的研究证明,Hedgehog信号通路在促进成骨细胞的增殖[54]、分化[55-57],抑制脂肪细胞的形成[58]中扮演重要的角色,这就暗示了Hedgehog通路有调节骨强度的作用并可能对骨质疏松患者起到针对性的治疗作用。而当Hedgehog信号通路中的某个组件发生了突变,各种骨骼疾病也就应运而生。Shh发生突变可能导致史李欧综合征,病人多以并指或多指为特征的骨骼畸形[59]。Patched homolog 1(Ptch1)突变可能导致多发性基底细胞痣综合征,其发病主要以多指、异位骨形成、脊柱裂为特征的骨骼畸形[60-62]。而VACTERL综合征也被证明与Gli2和Gli3突变的突变有关,该病会引起脊柱缺损,四肢畸变[63]。全基因组关联研究已经证明Hedgehog信号对人的身高起着重要的调节作用,同时揭示Shh是多指症的一个重要调节信号[64-65]。
6 Sonic hedgehog信号通路的兴奋剂和抑制剂
目前研究发现,Shh通路特异性的兴奋剂和抑制剂主要是作用于Hedgehog信号通路Smo受体及其下游的核内转录因子Gli1这两大类。20(S)-羟胆固醇和22(R)-或22(S)-羟胆固醇作用于骨髓基质干细胞表现出明显的成骨诱导作用,这种作用是通过增加成骨标记基因Runx2、OCN的表达,进而增加ALP活性以及矿化结节的形成[66-67];Hh-Ag 1.3 和Hh-Ag 1.7均能特异性地激活内生性Gli1的表达,激活Shh通路从而剂量依赖性地增加ALP活性以及成骨标记基因的表达,最终促进间充质干细胞系C3H10T1/2的成骨分化作用[68]。这些通路激活剂将有望开发成为临床上可用的治疗骨质疏松症的有效药物。
Shh通路抑制剂中研究得比较多的是环巴胺类药物。其作用机制是通过与Smo受体结合,阻止Smo的磷酸化而阻断了下游完整 Gli 蛋白的产生,从而抑制Hedgehog信号通路,因此当Smo发生突变或者Gli 蛋白下游有改变,环巴胺将无效。由于环巴胺的毒副作用比较多以及溶解度小、稳定性差等问题,限制了其在临床上的开发应用,因此人们进一步研究发现了有着更好酸稳定性和水溶性的环巴胺的半合成类似物IPI-269609,此后,又经体内活性评价和药代评价优化合成了有望进入临床试验阶段的IPI-926[69]。GDC-0449是第一个合成并在I 期临床试验中显示出良好的药效和药代动力学特征的Smo的抑制剂。在1例26岁转移性髓母细胞瘤患者治疗前获得的肿瘤样本中,发现Hedgehog信号通路被激活,而经GDC-0449治疗后,肿瘤体积缩小,症状也得到改善[70]。Hedgehog信号通路抑制剂目前主要用于该信号过度表达时导致的肿瘤的治疗。
7 其他
目前,关于Shh通路与其他骨代谢相关的通路共同影响骨代谢的研究多集中在BMPs通路,BMPs通路通常作为Sonic hedgehog信号通路的下游来调节软骨细胞的成骨分化[71]。也有人通过建立Ptch1和β-Catenin双重突变鼠发现此突变鼠的骨形成作用遭到破坏,说明作为Hedgehog信号通路下游,Wnt/β-Catenin信号通路在软骨内成骨过程中也可调节成骨分化[72]。另外,Hedgehog信号通路的活化主要通过上调包括Runx2、BMPs、SMADs、多种生长因子和整合素等与成骨分化相关的基因[73]来影响骨代谢的过程。
8 小结
总之,随着人口老龄化进程的推进,骨质疏松发病率越来越高。对Shh信号通路研究的深入,不仅阐释了骨质疏松发生、发展以及修复的机制,而且为骨质疏松症的预防与治疗提供新途径。目前Shh信号通路对于是否有利于成骨细胞的分化成熟尚存在争议,但Shh信号通路在骨代谢平衡中的重要作用毋庸置疑,这可能与实验的条件、实验对象种属来源、给药剂量等有关;另一方面其也可能促进破骨分化的进程,因此在调节骨形成作用的同时是否会影响破骨的进程,仍需要进一步研究。但是Shh信号通路作用于MSCs细胞抑制成脂分化的作用较为确定,是否可通过利用间充质干细胞作为研究载体,研制出调节间充质干细胞向成骨细胞方向分化,促进骨形成作用,使骨重建重新达到平衡的药物,可能是未来骨质疏松治疗药物研发的一个重要研究思路。这也是当前Hedgehog信号通路的一个研究热点,然而对其具体作用机制以及体内整体药效学和药动学还有待进一步研究。

