石河子地区中老年人群LRP5基因Q89R位点多态性与骨质疏松的关联性分析
陈福宇 李海涛 孟德峰 张蕾 史晨辉 王维山*
1. 石河子大学医学院第一附属医院骨科,新疆 石河子 832002 2. 石河子大学医学院第一附属医院检验科,新疆 石河子 832002
LRP5基因存在于染色体11q13区,包含23个编码外显子,编码1615个氨基酸组成的蛋白质,是骨形成和成骨细胞增殖的重要调节子[1]。LRP5基因功能缺失性突变(G171V)导致一种常染色隐性遗传性疾病,具有眼发育异常、儿童期骨折、低骨量的特点,称为骨质疏松-假神经胶质瘤综合征[2]。Little等[3]的研究提示胞外区第一个β-螺旋结构内的点突变改变局部疏水环境从而可能影响LRP5和其他蛋白质之间的相互作用,因而推测LRP5基因Q89R多态性位点可能通过改变LRP5蛋白质功能而影响了骨密度。由于新疆远离内陆地区,气候、饮食等与内陆有一定的差别,且汉族人口为中东部不同省份迁入,目前尚无针对新疆地区汉族人群LRP5基因Q89R位点基因频率的相关文献报道,因此本研究旨在探讨石河子地区中老年人群LRP5基因Q89R位点与骨质疏松的关系。
1 资料与方法
1.1 研究对象
本研究选取2015年6月至2016年5月在新疆石河子大学医学院第一附属医院骨科住院的汉族45岁及以上的中老年病人作为研究对象。纳入对象排除严重肝肾疾患、骨代谢相关疾病(糖尿病、甲状腺功能亢进、风湿性关节炎等)病史,无半年内服用影响骨代谢药物的药物史。本研究根据骨密度情况将研究对象分为三组:骨质疏松组、骨量低下组、骨量正常组。
1.2 研究方法
1.2.1采集标本:血液标本采集研究对象均空腹12~14 h,抽取肘正中静脉血6 mL置于EDTA抗凝管中,Thermo -80 ℃冰箱保存;取静脉血4 mL置于肝素抗凝管中,1 h内2 500 r/min离心10 min,取上层血清用于生化指标的检测。
1.2.2提取DNA:取全血1 mL,试剂盒法(天根公司血液基因组DNA提取试剂盒,TIANamp Blood DNA Kit,离心柱型)提取基因组DNA。取4 μL DNA产物与1 μL loading buffer(天根公司)混合,经1%琼脂糖凝胶电泳,Goldview染色,使用凝胶成像仪(Bio-rad公司)观察DNA提取是否成功。
1.2.3聚合酶链反应:LRP5基因Q89R位点引物按参考文献设计[4],序列为Upstream primer:5’-TCTGGGCATAGTGCTCCATC-3’;Downstream primer:5’-TTCCGGGATGTGCCATTGAG-3’。反应体系为25 μL,其中含Thermo Mix 12.5 μL;三蒸水9.5 μL;上游引物、下游引物各0.5 μL;模板DNA2 μL。置于PCR仪(日本Takala公司)中95 ℃预变性7 min,按下列程序循环34次,即95℃变性1 min,56℃退火1 min,72℃延伸1 min,72℃最终延伸10 min。取5 μL PCR产物,经1.5%琼脂糖凝胶(Goldview染色)电泳,使用凝胶成像仪(Bio-Rad公司)观察扩增是否成功。
1.2.4限制性酶切:PCR扩增产物10 μL(约0.3 μg)直接用1U Ava Ⅱ 酶切(快酶,Thermo公司生产)反应体系共30 μL(1 μL enzyme、Tango buffer、water、10 μL PCR product),温度为37℃,反应时间为20 min。酶切反应终止后,产物经1.5%琼脂糖凝胶(Goldview染色)电泳,以DNA marker(DNA片段的分子量为100bp、200bp、300bp、400bp、500bp、600bp的DNA片段)作为参考,凝胶成像仪(Bio-Rad公司)下观察结果并成像保存。
1.2.5基因测序:PCR产物由3730XL测序仪(北京六合华大基因科技股份有限公司)测定,并使用Chromas软件分析,结果见图4。
1.2.6生化指标的测定:采用日立7170全自动生化分析仪测定碱性磷酸酶(AKP)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、载脂蛋白A(APO-A)、钙(Ca)、磷(P)在血液中的浓度。
1.2.7骨密度(BMD)的测定:应用双能X线骨密度测量仪(美国GE公司LUNAR双能X线骨密度仪,石河子大学医院第一附属医院骨密度室)检测BMD(单位为g/cm2),测定受试者腰椎第一节、腰椎第二节、腰椎第三节、腰椎第四节、股骨颈(FN)、大转子(Troch)和Ward’s三角区、股骨干(FS)的BMD值。每日测量前均进行仪器质量控制,每月做1次腰椎模型,符合质控要求后进行检查。
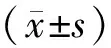
2 结果
2.1 研究对象的基本情况
研究对象各项生化指标、骨密度数据见表1。根据骨密度的差别将研究对象分为三组。
2.1.1骨质疏松组:骨科入院病人33例,平均67.7±13.4岁。男性4例,平均65.5±4.0岁;女性29例,平均68.0±12.2岁。
2.1.2骨量低下组:骨科入院病人74例,平均59.8±12.8岁。男性33例,平均59.5±15.4岁;女性41例,平均60.0±10.4岁。
2.1.3骨量正常组:骨科入院病人115例,平均54.1±10.0岁。男性73例,平均54.6±10.8岁;女性42例,平均53.4±8.6岁。
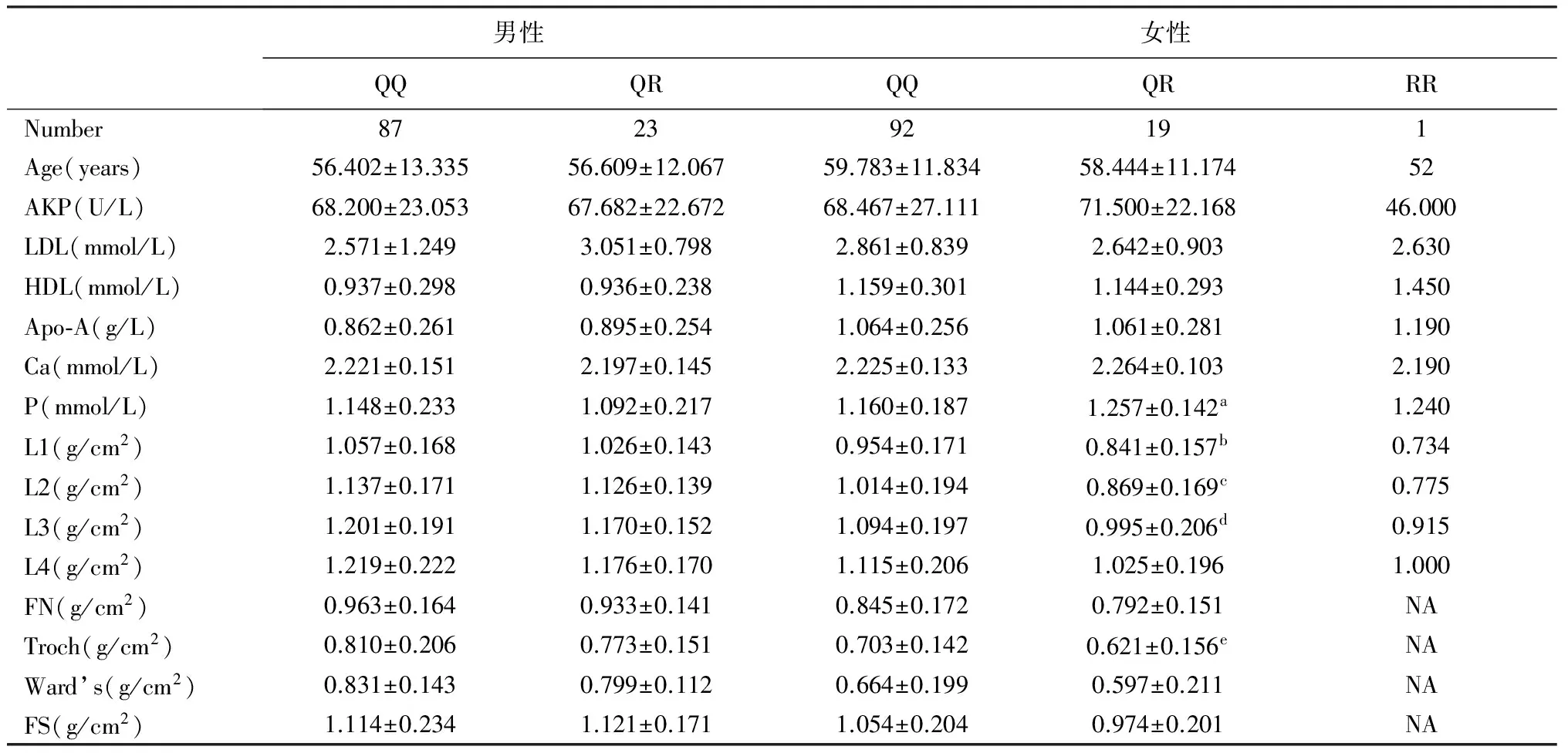
表1 石河子地区中老年人Q89R基因型之间生化指标、骨密度的比较Table 1 Comparison of biochemical indexes and BMD among Q89R genotypes in middle-aged and older people in Shihezi area
注:1.NA代表信息缺失;2.QR组数据的右上标表示,中老年女性QQ型与QR型各项指标比较,差异有统计学意义。a、b、c、d、e对应的P值依次为:0.041、0.009、0.003、0.048、0.049
Note: 1.NA represents“not applicable”;2.The right superscript in QR group data represents statistical significance where the difference was indicated between QQ genotype and QR genotype as in the middle aged and old female population. The correspondingPvalues of a, b, c, d and e respectively were 0.041, 0.009, 0.003, 0.048, 0.049 in order
2.2 LRP5基因Q89R位点多态性分布
本研究中,各组基因型及等位基因频率符合遗传学Hardy-Weinberg 定律(P>0.05),显示研究样本为遗传平衡群体。
2.3 基因型判定
从血液中提取人类基因组DNA(图1)后,再进行PCR(图2),然后酶切得出结果。LRP5基因Q89R位点酶切后分为三型:QQ型(436bp)为野生型,QR型(436bp、274bp、162bp)为杂合子,RR型(274bp、162bp)为突变型。基因型可分别由酶切结果(图3)、测序结果(图4)判定。
2.4 基因型频率分布
石河子地区中老年人群LRP5基因Q89R位点基因型频率分布依次为QQ型(80.63%)、QR型(18.92%)、RR型(0.45%),中老年女性LRP5基因Q89R位点基因型频率分布依次为QQ型(82.14%)、QR型(16.96%)、RR型(0.89%),中老年男性LRP5基因Q89R位点基因型频率分布依次为QQ型(79.09%)、QR型(20.91%)、RR型(0.00%)。
图1 用试剂盒从血液中提取的DNA的琼脂糖凝胶电泳图,M为marker,1、2、3、4、5为人类基因组DNAFig.1 The agarose gel electrophoresis of DNA extracted from the blood using TIANamp Blood DNA Kit, M stands for Marker, 1, 2, 3, 4, 5 stands for the human genome DNA
图2 经PCR产生的DNA片段的琼脂糖凝胶电泳图,M为marker,1、2、3、4为目的DNA片段,分子量大小为436bpFig.2 The agarose gel electrophoresis of objective DNA fragment generated by PCR, M for marker, 1, 2, 3, 4 for the target of DNA fragments, the molecular weight is 436bp
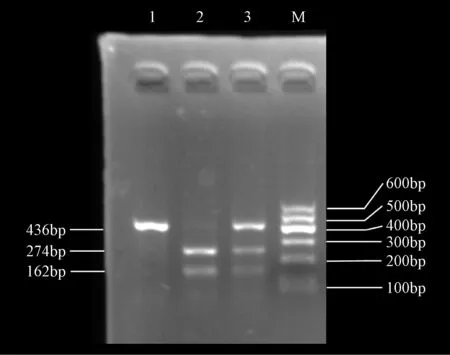
图3 经Ava Ⅱ酶切后DNA片段的琼脂糖凝胶电泳图,M为Marker,1为QQ型,2为RR型,3为QR型Fig.3 The agarose gel electrophoresis of DNA fragments digested by enzyme Ava II, M stands for Marker, 1 for QQ genotype, 2 for RR genotype, 3 for QR genotype
2.5 不同人群基因型频率分布
由表1可见,石河子地区中老年人群LRP5基因Q89R位点的等位基因频率与高加索人群[5]有较大差异,高加索人群中的Q型等位基因频率为100%,未发现R型等位基因。哈尔滨[6-7]、安徽[8]、上海[9]、韩国[10]的研究在数值上与本研究较为接近,但也有一定差别。
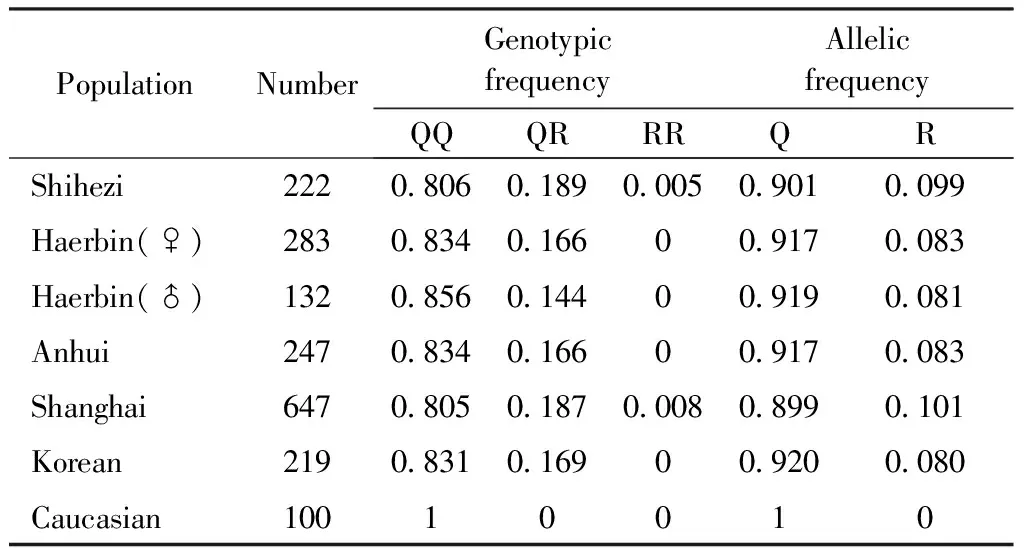
表2 不同人群LRPP5基因Q89R位点各基因型、等位基因的频率分布Table 2 The distribution frequency of LRPP5 gene Q89R site polymorphisms in different populations
2.6 基因型与生化指标的相关性
中老年女性生化指标中,只有血清磷含量与基因型显著相关(P<0.05),QR型的血清磷浓度明显低于QQ型;未见碱性磷酸酶、低密度脂蛋白、高密度脂蛋白、载脂蛋白-A与基因型相关(P>0.05)。中老年男性的各项生化指标均与基因型无关(P>0.05)。
2.7 基因型与骨密度的相关性
骨密度的衡量标准为T值:-1 在中老年女性群体中,L1、L2、L3的骨密度值与Q89R基因型相关(P<0.05),L4的骨密度值与Q89R基因型无相关性(P>0.05),并且大转子的骨密度值与Q89R基因型相关(P<0.05),未发现Ward’s三角区、股骨颈、股骨干的骨密度值与Q89R基因型具有相关性(P>0.05)。QR型的腰椎L1-L3、大转子的骨密度明显低于QQ型。中老年男性LRP5基因Q89R位点各型之间各个部位的骨密度均无统计学差异(P>0.05)。尽管中老年男性的LRP5基因Q89R位点的基因型与骨质疏松并无相关性(表3),但中老年女性的LRP5基因Q89R位点的基因型与骨质疏松呈显著相关(图6)。 图5 A、B、C分别为骨量正常者、骨量低下者、骨质疏松者的脊柱正位图;D、E、F分别为骨量正常者、骨量低下者、骨质疏松者的骨密度测量数据图Fig.5 A, B and C respectively stand for the AP spine images of normal bone density, osteopenia and osteoporosis; D, E, F respectively stands for the data of bone mineral density in the normal bone density, osteopenia and osteoporosis groups Johnston[11]指出,人群骨密度的差别20%取决于环境因素,80%取决于遗传因素。LRP5作为Wnt共受体参与Wnt信号传导,Wnt-β-粘连素途径是Wnt蛋白触发的一种主要信号转导途径,也被称为规范化Wnt信号途径。Wnt与LRP5、Fz蛋白形成复合物。激活下游信号并引起β-25粘连素稳定性增强,促使其转运至核内与Lef1/Tcf转录因子结合,继而影响基因的表达[12-13],进而调节细胞生存、增殖、分化、迁移等细胞活动。多种基因与骨密度相关,不同的基因对骨矿盐代谢的影响可能存在协同或拮抗作用。同一基因对不同地区、不同民族的BMD影响不尽相同。目前认为可能存在以下二种遗传机制影响骨量:①分子结构层面的作用 即某一基因位点发生突变可能导致相应功能蛋白的分子结构改变,如胶原蛋白基因突变会引起胶原蛋白分子结构上的变化[14];②通过影响骨代谢平衡 骨代谢是由破骨细胞的骨吸收和成骨细胞的骨形成共同协调形成的骨重建过程,骨形成速率小于骨吸收速率从而引起骨量的丢失[15]。基因层面可通过调节骨重建过程而发挥对骨量的影响作用,如维生素D受体(VDR)基因[16]、雌激素受体(ER)基因[17]等都经过此途径调节骨的代谢过程。 图6 中老年女性QQ型中骨质疏松的比例明显低于QR型(χ2=9.196,P=0.01)Fig.6 The proportion with osteoporosis in the QQ genotype was significantly lower than that in the QR genotype in middle-aged and older women(χ2=9.196, P=0.01) QQQRc2POsteoporosis(♀)18106 9320 008∗ Lowbonemass(♀)374 Osteoporosis(♀)18105 6570 017∗ Normalbonemass(♀)375 Lowbonemass(♀)3740 0990 753 Normalbonemass(♀)375 Osteoporosis(♂)401 8970 168 Lowbonemass(♂)2211 Osteoporosis(♂)400 7790 377 Normalbonemass(♂)6112 Lowbonemass(♂)22113 8180 051 Normalbonemass(♂)6112 注:*表示组间比较差异有显著性,P<0.05 Note:*indicating significant difference between groups,P<0.05 常规体检人群中,骨量正常的患者占据较大比例,因此本研究将入院病人作为研究对象,骨量正常患者的比例较常规体检人群小,利于骨量正常、骨量异常组间病人数量的均衡,更符合统计学要求。收集资料数据时,发现部分病人的载脂蛋白A数据异常,因此也将其纳入生化指标中进行分析。经过统计学分析,不同基因型之间的载脂蛋白A的浓度并未呈现差异。本研究仅检测出一例RR型病人,由于样本量过少,无法进行统计学分析,因此不确定RR型是否能作为汉族人群预测骨质疏松的基因型。以往同类研究往往将腰椎第一节、腰椎第二节、腰椎第三节、腰椎第四节合为同一变量(L1-L4)来分析,本研究则将四节腰椎分别与Q89R基因型的关联性分别进行分析,有助于研究的深化与细化。本研究显示,中老年男性与女性人群在LRP5基因Q89R位点基因型与骨密度、生化指标相关性方面有较大差异,这可能与LRP5基因调节激素有关。在中老年男性群体骨量低下、骨量正常分组中,QR型中骨量低下占47.83%,QQ型中骨量低下占26.51%,虽然差异没有统计学意义,但QR型骨量低下的比例明显高于QQ型。统计学结果可以作为重要参考,但也要考虑临床客观实际情况,不必迷信P值,因此两种基因型之间的差异仍然需要重视。以后的研究将扩大样本量,以期得到更精确的数据。本研究对骨质疏松就要采用骨密度作为评价指标,这一点存在一定的局限性。本研究进行的基因与骨密度的关联性分析,得出的是一种相关联的现象,而未必是基因与骨密度的直接决定关系,故也存在一定的局限性。 Koh等[10]对219名韩国青年男性的研究发现,LRP5基因Q89R位点多态性与Ward’s三角区及股骨颈的骨密度存在相关性。Zhang等[9]则在对647名上海绝经后妇女研究发现Q89R的QQ基因型较QR/RR型股骨颈处密度更高。Van等[5]的研究未发现高加索人中LRP5基因Q89R位点的基因多态性,提示此位点的基因多态性分布可能存在种族差异。朱翔等[8]对安徽地区247名绝经后女性的研究发现,Q89R多态性与股骨颈和大转子区骨密度显著相关,与腰椎以及 Ward’s三角区骨密度无关。本研究显示,在中老年女性群体中,L1、L2、L3、大转子的骨密度值与Q89R基因型相关(P<0.05),L4的骨密度值与Q89R基因型无相关性(P>0.05)。虽然都得出基因与骨密度相关的结论,但本研究只与朱翔的Q89R多态性与大转子区骨密度显著相关的结论相同,与其它研究的相关性所在部位并不相同。 本研究提示,LRP5基因Q89R多态性位点可能通过对骨密度、血清磷等相关因素的调控,进而影响中老年女性骨质疏松症的发生、发展。对LRP5基因Q89R位点多态性的研究,使我们从基因水平上认识不同种族间骨质疏松发病率的差异, 这对骨质疏松病因学和防治具有重要意义。今后相关基因研究可以在基因筛查实验的基础上,充分考虑基因之间的连锁不平衡以及基因之间的相互作用,以后还需要进一步扩大样本含量以提高样本代表性,使数据准确性达到更高的水平。并通过分子生物学、生物化学等各项手段来了解相关基因对骨质疏松的具体作用机制,进而探索出不同地区不同民族之间骨质疏松发病的危险因素以及积极因素,有助于为临床治疗提供更为合理治疗方案,提高骨质疏松症的预防、治疗效果,对降低骨质疏松症的发病率具有重要意义。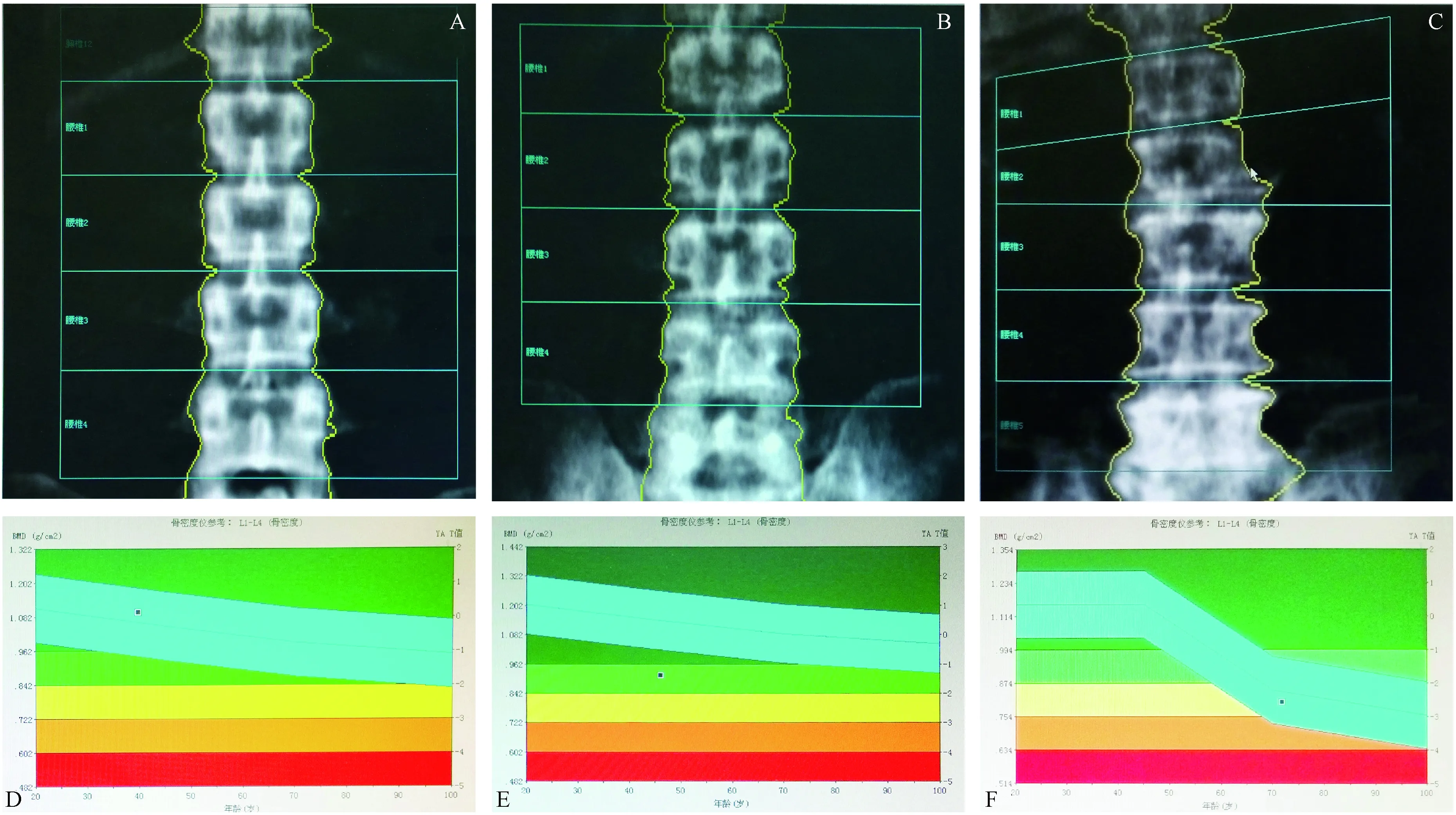
3 讨论