灯盏花素对慢性阻塞性肺疾病模型大鼠气道重塑的影响※
杜 飞 贺 刚 陈代刚 杨华军
(贵州省遵义市第一人民医院呼吸内科,贵州 遵义 563000)
灯盏花素对慢性阻塞性肺疾病模型大鼠气道重塑的影响※
杜 飞 贺 刚 陈代刚 杨华军
(贵州省遵义市第一人民医院呼吸内科,贵州 遵义 563000)
目的 观察灯盏花素对慢性阻塞性肺疾病(COPD)模型大鼠气道重塑的影响,探讨灯盏花素防治COPD模型大鼠气道重塑的机制。方法 将48只雄性Wistar大鼠随机分为空白组、模型组、灯盏花素组,每组16只,模型组、灯盏花素组采用熏烟加气管内滴入内毒素脂多糖的方法建立大鼠COPD模型,灯盏花素组予灯盏花素灌胃,空白组及模型组给予等容积0.9%氯化钠注射液灌胃。3组分别于给药第7、28 d各处死8只大鼠,行肺组织病理学观察,测定支气管厚度及支气管胶原纤维厚度,用免疫组化法测定肺组织中基质金属蛋白酶9(MMP-9)、转化生长因子β(TGF-β)蛋白阳性表达面积比率,用实时荧光定量聚合酶链式反应(PCR)法测定肺组织中Smad 3和Smad 7 mRNA水平。结果 与空白组比较,模型组及灯盏花素组第7、28 d大鼠支气管壁厚度及胶原纤维厚度均明显升高(P<0.01)。与模型组比较,灯盏花素组第7、28 d大鼠支气管壁厚度及胶原纤维厚度均下降(P<0.05,P<0.01)。灯盏花素组内7 d与28 d比较,支气管壁厚度无明显差异,28 d时支气管胶原纤维厚度下降(P<0.05)。与空白组比较,模型组第7、28 d大鼠肺组织MMP-9、TGF-β表达增强,Smad 3 mRNA水平升高(P<0.01),Smad 7 mRNA水平降低(P<0.01);灯盏花素组第7 d肺组织MMP-9、TGF-β表达增强(P<0.05),Smad 3 mRNA水平升高(P<0.01),Smad 7 mRNA水平降低(P<0.01)。与模型组比较,灯盏花素组第28 d大鼠肺组织MMP-9、TGF-β表达减少(P<0.01,P<0.05),Smad 3 mRNA水平降低(P<0.01),Smad 7 mRNA水平升高(P<0.01)。灯盏花素组内7 d与28 d比较,28 d时大鼠肺组织MMP-9、TGF-β及Smad 3 mRNA水平降低(P<0.05),Smad 7 mRNA水平升高(P<0.05)。结论 灯盏花素可抑制COPD模型大鼠支气管壁厚度及胶原纤维厚度的增加,降低COPD大鼠肺组织中的MMP-9、TGF-β及Smad 3 mRNA水平,升高Smad 7 mRNA水平,从而可以延缓或改善COPD气道重塑的疾病进程。
灯盏细辛;肺疾病,阻塞性;气管;大鼠,Wistar;模型,动物
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种严重危害人类健康的常见病、多发病,严重影响患者的生命质量,病死率较高,给患者及其家庭以及社会带来沉重的经济负担。我国对7个地区20 245名成年人进行调查,结果显示40岁以上人群中COPD的患病率高达8.2%[1],预计2030年COPD将成为全球第3位主要死亡原因[2]。对COPD目前尚无根治的措施,临床上以对症治疗、改善症状和延长生存期为主,但其疗效并不满意,且不能阻止最终的气道重塑。只有控制或逆转其气道重塑,才可能得到真正意义上的控制。灯盏花素在治疗COPD方面的作用尤其引人注目。本研究探讨灯盏花素对COPD模型大鼠气道重塑的影响。
1 材料与方法
1.1 实验动物 48只健康雄性Wistar大鼠,SPF级,标准饲养,自由饮水,日常光照。
1.2 试剂与仪器 灯盏花素购于昆明龙津药业股份有限公司(国药准字Z53020667,批号20050701);脂多糖(美国Sigma)用0.9%氯化钠注射液配制成200 μg/200 μL的溶液;香烟(焦油量15 mg,烟气烟碱量1.5 mg);转化生长因子β1(TGF-β1)检测试剂盒(美国GIBCO公司);LightCycler 2.0实时荧光定量PCR仪[罗氏诊断产品(上海)有限公司];Trizol RNA提取试剂(Invitmgen公司);M-MLV逆转录酶(Promega公司);SYBR Green I RT-PCR试剂盒(Roche公司),引物由生工生物工程(上海)股份有限公司合成;免疫组化试剂盒(武汉博士德生物工程有限公司)。
1.3 方法
1.3.1 分组及造模 将48只健康雄性Wistar大鼠随机分为3组,正常对照组(空白组)、COPD模型组(模型组)、COPD模型灯盏花素治疗组(灯盏花素组),每组16只。其中模型组、灯盏花素组采用顾延会等[3]熏烟加气管内滴入内毒素脂多糖的方法复制建立大鼠COPD模型。第1、15 d气管内注入0.2 mL脂多糖溶液,第2~28 d(第15 d除外)关在自制熏烟箱内被动吸烟2次,每次30 min×12支烟,中间间隔2 h呼吸正常空气。空白组及造模后模型组大鼠正常喂养,灯盏花素组造模后予灯盏花素[10 mg/(kg·d)]灌胃,空白组、模型组每日予等容积的0.9%氯化钠注射液灌胃。
1.3.2 制备病理切片 分别于第7、28 d每组取8只大鼠处死,迅速开胸摘取肺脏,洗净称质量,其后于10%甲醛固定液内清洗,浸泡30 min,投入40%甲醛溶液中固定备用。病理切片制备由遵义医学院病理教研室提供技术支持,取固定好的组织,选取大鼠肺脏左叶,在最大横径处切2 mm厚的组织块,常规脱水,二甲苯透明,用自动石蜡包埋机包埋,切成5 μm厚的切片,做苏木精-伊红(HE)染色、Van Gieson染色。
1.3.3 检测指标
1.3.3.1 支气管壁厚度及胶原纤维厚度 每张切片随机选取3个视野,用光学显微镜观察,以SPOT Ⅱ数码相机(美国DIAGNGSTIC公司)摄像,采用Img-Pro 6.0图像分析系统(德国Leica公司)分析支气管肺组织结构的形态学的变化,测量支气管壁厚度及支气管壁胶原纤维厚度。
1.3.3.2 肺组织基质金属蛋白酶9(MMP-9)、转化生长因子β(TGF-β)表达 用免疫组织化法(SP)测定(按试剂盒说明操作)。每例在光学显微镜下随机选择3个视野,用图像分析软件系统(美国Universallmagtng Corporation)计算阳性细胞面积比率。
1.3.3.3 肺组织Smad 3 mRNA与Smad 7 mRNA的表达 采用实时荧光定量PCR法检测(严格按试剂盒说明书操作)。总RNA的提取:取右肺组织100 mg,按照Trizol试剂说明,紫外分光光度计检测所提RNA含量和纯度。互补脱氧核糖核酸(cDNA)的合成:分别另取3 μg总RNA为模板,在加入逆转录酶后以25 μL体系下,在42 ℃条件下反应1 h合成cDNA第一链,再在94 ℃下加热3 min以灭活逆转录酶。实时定量PCR扩增:采用荧光染料技术,在20 μL反应体系中,加入cDNA 2 μL,ddH2O 13 μL,RT-PCR Mix 4 μL,引物1 μL。Smad 3上游引物5′-AAATGACAGCAGCAGGGACAC-3′,下游引物5′-GAGGTAGGACCCACAGTAGAGC-3′,扩增产物172 bp;Smad 7上游引物5′-TGGTGCGTGGTGGCATACT-3′,下游引物5′-CAGCCGATCTTGCTCCTCA-3′,扩增产物176 bp。用β-actin基因作为内参,β-actin上游引物5′-GACATCCGTAAAGACCTCTATGCC-3′,下游引物5′-CTCTGTGTGGATTGGTGGCTCTAT-3′,扩增产物170 bp。扩增条件:94 ℃ 10 min,94 ℃ 10 s,55 ℃ 10 s,72 ℃ 10 s,45个循环。反应结束后,通过琼脂糖凝胶电泳确认是否符合设计片段长度。PCR反应及数据采集在LightCycler 2.2系统上进行,记录其循环阈值(Ct),每个样品中靶基因的相对mRNA表达采用相对定量公式2-△Ct计算,其中△Ct值=靶基因Ct值-β-actin Ct值。

2 结 果
2.1 各组大鼠一般情况的观察 空白组大鼠毛发光亮,活泼好动,呼吸平稳,进食良好,无特殊不良表现。模型组、灯盏花素组大鼠造模开始的第1 d可见明显的咳嗽,挠鼻现象,少动,在造模烟熏过程中可见拱背蜷卧、频繁咳嗽、呼吸急促、口鼻潮湿等表现,在不吸烟时可见毛发光泽较差,饮水量明显增加,咳嗽频率减少,部分大鼠可见反应迟钝、行动迟缓,可闻及哮鸣音。灯盏花素组大鼠经灯盏花素治疗后,咳嗽、呼吸急促、行动迟缓及哮鸣音等症状明显减轻。
2.2 各组大鼠支气管壁厚度及胶原纤维厚度比较见表1。各组大鼠肺组织光镜下病理改变见图1。
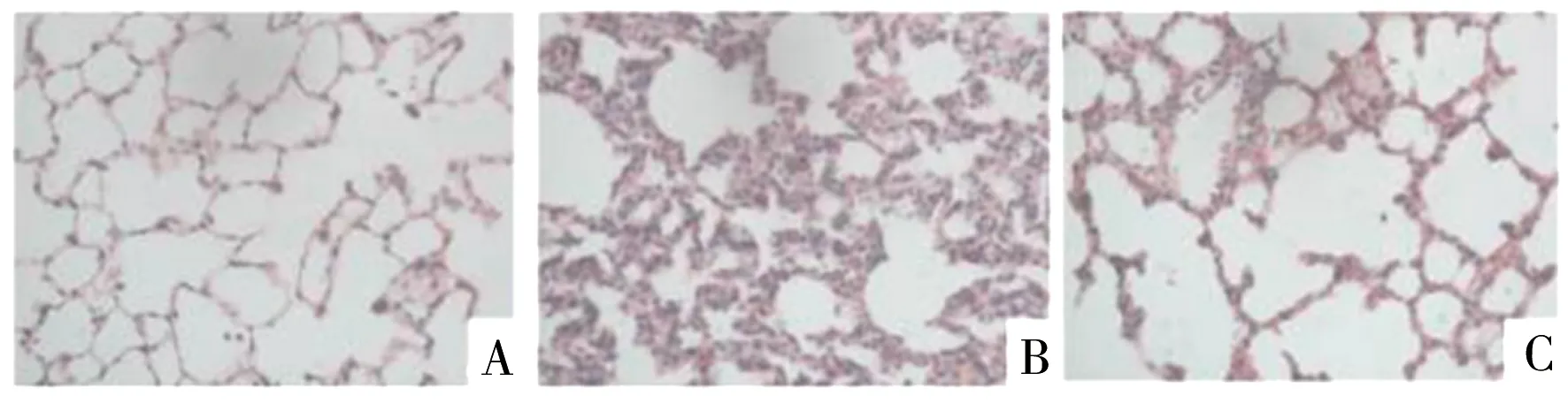
A 空白组第28 d B 模型组第28 d C 灯盏花素组第28 d
图1 各组大鼠肺组织光镜下病理改变(HE,×400)
由图1可见,空白组第28 d,肺组织无明显病理学改变;模型组第28 d,肺组织出现肺泡炎症,大量胶原纤维形成,肺泡结构紊乱;灯盏花素组第28 d,肺泡炎症明显减轻,胶原纤维明显减少,肺泡结构紊乱较模型组明显好转。

表1 各组大鼠支气管壁厚度及胶原纤维厚度比较 像素
与空白组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与本组第7 d比较,#P<0.05
由表1可见,与空白组比较,模型组及灯盏花素组第7、28 d大鼠支气管壁厚度及胶原纤维厚度均明显升高(P<0.01)。与模型组比较,灯盏花素组第7、28 d大鼠支气管壁厚度及胶原纤维厚度均下降(P<0.05,P<0.01)。灯盏花素组内7 d与28 d比较,支气管壁厚度无明显差异,28 d时支气管胶原纤维厚度下降(P<0.05)。
2.3 各组大鼠肺组织MMP-9、TGF-β、Smad 3 mRNA及Smad 7 mRNA表达比较 见表2。

表2 各组大鼠肺组织MMP-9、TGF-β、Smad 3 mRNA及Smad 7 mRNA表达比较
与空白组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与本组第7 d比较,#P<0.05
由表2可见,与空白组比较,模型组第7、28 d大鼠肺组织MMP-9、TGF-β表达增强,Smad 3 mRNA水平升高(P<0.01),Smad 7 mRNA水平降低(P<0.01);灯盏花素组第7 d肺组织MMP-9、TGF-β表达增强(P<0.05),Smad 3 mRNA水平升高(P<0.01),Smad 7 mRNA水平降低(P<0.01)。与模型组比较,灯盏花素组第28 d大鼠肺组织MMP-9、TGF-β表达减少(P<0.01,P<0.05),Smad 3 mRNA水平降低(P<0.01),Smad 7 mRNA水平升高(P<0.01)。灯盏花素组内7 d与28 d比较,28 d时大鼠肺组织MMP-9、TGF-β及Smad 3 mRNA水平降低(P<0.05),Smad 7 mRNA水平升高(P<0.05)。
3 讨 论
COPD是一种以持续气流受限为特征的可以预防和治疗的疾病,其气流受限多呈进行性发展,与气管和肺组织对烟草烟雾等有害气体或有害颗粒的慢性炎症反应增强有关[1]。COPD主要病理特点之一是气道重塑。采用中医中药的方法,是我国在COPD治疗上独特的优势。灯盏花素是从彝族药灯盏花(又名灯盏细辛)中提取的主要成分,其有效成分为二咖啡酰奎宁酸、焦炔康酸、原二茶酸等黄酮类化合物。近年来许多学者研究证实灯盏花素对COPD有一定的治疗作用。田川等[4]研究发现灯盏花素能在一定程度上抑制大鼠气道黏液高分泌,其作用是通过抑制蛋白激酶C活性而实现。柴文戍等[5-6]研究发现灯盏花素能减慢肺间质纤维化的进程,可降低TGF-β1和透明质酸含量,对肺间质纤维化有一定的保护作用。彭志文等[7]研究发现应用灯盏花素注射液治疗COPD急性加重期(AECOPD)并发呼吸衰竭的患者,发现其对病情的控制及转归起重要作用,其可改善患者血液流变学和肺功能,提高AECOPD的治疗效果。我们前期研究发现,灯盏花素治疗AECOPD有较好的临床疗效[8]。细胞外基质(ECM)过度沉积是气道重塑的主要原因,活化的成纤维细胞促进胶原沉积可导致以胶原为主的ECM过度沉积,继而其基底膜增厚、气道平滑肌增生和肥厚,管腔纤维化,而这种变化导致小气道的纤维化[9]。TGF-β1可促进细胞外基质的合成与沉积[10],也是促进纤维细胞激活向肌成纤维细胞转化的关键因子[11]。研究表明TGF-β1通过诱导纤维母细胞增生、胶原纤维及细胞外基质合成增多等多种机制参与气道重塑和不可逆的阻塞[12],据此说明肺组织结构破坏与TGF-β1表达有一定的相关性,所以抑制TGF可改善ECM的沉积。COPD气道重塑机制中,MMP-9是引起COPD的相关蛋白水解酶,TGF-β是对肺纤维化起关键作用的生长调节细胞因子,而TGF-β信号转导通路中的主要信号蛋白Smad 3的mRNA及其抑制性信号蛋白Smad 7的mRNA的水平变化决定着TGF-β的生物效应。MMP-9是基质金属蛋白酶(MMPs)家族中的重要成员,主要生理功能是降解ECM成分。MMPs增多可促使肺泡壁基底膜降解及肺气肿形成,其通过自分泌又可促进成纤维细胞和平滑肌增殖。有研究通过将COPD患者与健康吸烟者进行比较,发现COPD患者肺泡巨噬细胞释放大量活性增高的MMP-9,促使气道破坏及重塑增加,并引起第1 s用力呼气容积(FEV1)/用力肺活量(FVC)进行性下降,尤以AECOPD患者更明显[13-14]。
本研究通过灯盏花素对COPD模型大鼠灌胃,发现灯盏花素可抑制COPD大鼠支气管壁厚度及胶原纤维厚度的增加,降低COPD大鼠肺组织中的MMP-9、TGF-β及Smad 3 mRNA水平,升高Smad 7 mRNA水平,从而可以延缓或改善COPD气道重塑的疾病进程。说明应用灯盏花素可抑制COPD气道重塑,延缓或改善疾病进程。
[1] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中国医学前沿杂志:电子版,2014,6(2):67-80.
[2] Smolonska J,Wijmenga C,Postma DS,et al.Meta-analyses on suspected chronic obstructive pulmonary disease genes: a summary of 20 years' research[J].Am J Respir Crit Care Med,2009,180(7):618-631.
[3] 顾延会,欧阳瑶.烟熏联合脂多糖制备大鼠慢性阻塞性肺疾病动物模型[J].重庆医学,2012,41(13):1295-1296,封4.
[4] 田川,李琪,周向东.灯盏花素在气道黏液高分泌大鼠模型中的治疗作用[J].临床肺科杂志,2009,14(1):33-34.
[5] 柴文戍,翟声平,武素琳,等.灯盏花素对实验性肺纤维化大鼠的干预作用[J].中国药理学通报,2008,24(1):113-116.
[6] 柴文戍,李颖,张海林,等.灯盏花素对肺纤维化大鼠肺组织中TGF-β1及透明质酸含量的影响[J].中国药理学通报,2010,26(12):1613-1616.
[7] 彭志文,廖贺增.灯盏花素注射液治疗COPD急性加重期并发呼吸衰竭的疗效观察[J].光明中医,2011,26(3):506-507.
[8] 杜飞,贺刚,周国旗,等.灯盏花素对慢性阻塞性肺疾病急性加重期患者免疫功能的影响[J].中国实验方剂学杂志,2014,20(7):192-194.
[9] 辛晓峰,赵明,李子玲,等.支气管哮喘和慢性阻塞性肺疾病患者诱导痰中基质金属蛋白酶及其抑制剂与气道炎症及气流受限[J].中华结核和呼吸杂志,2007,30(3):192-196.
[10] 袁浩,罗百灵,何白梅.红霉素对慢性阻塞性肺疾病大鼠转化生长因子-β1和分泌型白细胞蛋白酶抑制剂表达水平的影响[J].中华结核和呼吸杂志,2011,34(7):523-527.
[11] Willis BC, Borok Z.TGF-beta-induced EMT: mechanisms and implications for fibrotic lung disease[J].AM J Physiol Lung Cell Mol Physiol,2007,293(3):L525-534.
[12] Chua F,Sly PD,Lament GJ.Pediatric lung disease: from proteinases to pulmonary fibrosis[J].Pediatr Pulmonol,2005,39(5):392-401.
[13] Russell RE,Culpitt SV,DeMatos C,et al.Release and activity of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 by alveolar macrophages from patients with chronic obstructive pulmonary disease[J].Am J Respir Cell Mol Biol,2002,26(5):602-609.
[14] 孔英君,霍建民,孙文学,等.慢性阻塞性肺疾病患者急性加重期血清基质金属蛋白酶抑制剂及基质金属蛋白酶9浓度与肺功能变化的关系[J].中国急救医学,2007,27(7):587-589.
(本文编辑:李珊珊)
Effects of Breviscapine on airway remodeling in rats with chronic obstructive pulmonary disease model
DUFei,HEGang,CHENDaigang,etal.
DepartmentofRespiratoryMedicine,TheFirstPeople'sHospitalinZunYiCity,GuizhouProvince,GuiZhou,ZunYi563000
Objective To observe the effects of breviscapine on airway remodeling in rat with chronic obstructive pulmonary disease (COPD) model, and to explore the mechanism of breviscapine on preventing airway remodeling in rats with COPD model. Methods 48 male Wistar rats were randomly divided into blank group, model group and breviscapine group, 16 rats in each group.The rat model of COPD was established by cigarette smoking combined with intratracheal instillation of lipopolysaccharide(LPS) in model group and breviscapine group. Breviscapine group was treated by breviscapine for gavage, and the blank group was treated by equal volume of 0.9% sodium chloride injection. 8 rats were executed at the 7thd and 28thd after administration in each group. The pathology observation in lung tissue was conducted, and the thickness of bronchi and bronchial collagen fibers were measured. The positive expression area ratio of matrix metalloproteinases 9 (MMP-9) and transforming growth factor β (TGF-β) in lung tissue were detected by immunohistochemical method, and the Smad 3 mRNA and Smad 7 mRNA were detected by real time fluorescent quantitative polymerase chain reaction (PCR). Results Compared with blank group, the thickness of bronchi wall and bronchial collagen fibers at the 7thd and 28thd significantly increased in model group and breviscapine group (P<0.01). Compared with model group, the thickness of bronchi wall and bronchial collagen fibers at the 7thd and 28thd reduced in breviscapine group (P<0.05,P<0.01). There was no statistical difference on the thickness of bronchi wall between the 7thd and 28thd in breviscapine group, and the thickness of bronchial collagen fibers at 28thd reduced (P<0.05). Compared with blank group, the expression of MMP-9 and TGF-β in lung tissue at the 7thd and 28thd increased in model group,and Smad 3 mRNA increased (P<0.01), Smad 7 mRNA decreased (P<0.01), and the expression of MMP-9 and TGF-β of lung tissue at the 7thd increased in breviscapine group(P<0.05), Smad 3 mRNA increased (P<0.01), Smad 7 mRNA decreased (P<0.01). Compared with model group, the expression of MMP-9 and TGF-β in lung tissue at the 28thd decreased in breviscapine group (P<0.01,P<0.05), Smad 3 mRNA decreased (P<0.01), Smad 7 mRNA increased (P<0.01). The expression of MMP-9 and TGF-β in lung tissue and Smad 3 mRNA at the 28thd were lower than that at the 7thd in breviscapine group (P<0.05), and Smad 7 mRNA higher (P<0.05). Conclusion Breviscapine can inhibit the increase of the thickness of bronchial wall and collagen fibers in COPD model rats, decrease the MMP-9, TGF-β and Smad 3 mRNA in lung tissue, and increase Smad 7 mRNA, thus can delay or improve the disease process of COPD airway remodeling.
Erigeron breviscapus; Lung disease; Obstructive; Trachea; Rat, Wistar; Model; Animal
10.3969/j.issn.1002-2619.2017.07.027
※ 项目来源:贵州省遵义市科技计划课题(编号:遵市科合社字(2014)11号)
杜飞(1980—),男,副主任医师,硕士。从事慢性阻塞性肺疾病的基础与临床研究。
R563;R285.5
A
1002-2619(2017)07-1069-05
2017-01-10)

