补骨脂水煎液和醇提物对斑马鱼骨骼发育的影响及其毒性作用
陈颖,王茉,宋捷,詹扬,景莉君,陈书芹,贾晓斌,韦英杰
(1.南京中医药大学第三临床医学院,江苏南京210028;2.江苏省中医药研究院国家中医药管理局中药释药系统重点研究室,江苏南京210028;3.中国人民解放军93038部队医院,吉林通化135300)
补骨脂水煎液和醇提物对斑马鱼骨骼发育的影响及其毒性作用
陈颖1,2,王茉3,宋捷1,2,詹扬2,景莉君1,2,陈书芹2,贾晓斌1,2,韦英杰1,2
(1.南京中医药大学第三临床医学院,江苏南京210028;2.江苏省中医药研究院国家中医药管理局中药释药系统重点研究室,江苏南京210028;3.中国人民解放军93038部队医院,吉林通化135300)
目的 研究补骨脂水煎液(WD)和醇提物(EE)促骨骼发育与安全性的差异。方法将受精后3 d(3 dpf)斑马鱼幼鱼暴露于泼尼松龙(PN)25 μmol·L-1和WD或EE 0.1,1,10和100 mg生药·L-1,以及依替膦酸二钠(ED)30 mg·L-1溶液中,隔天换液至9 dpf处死。茜素红染色光学显微镜观察斑马鱼头骨骨矿化面积和骨密度,荧光定量PCR法检测9 dpf斑马鱼骨保护素(OPG)和NF-κB受体活化因子配体(RANKL)mRNA表达。另将1 dpf斑马鱼胚胎置于EE 10,20,30,35,40,50和60 mg生药·L-1、WD 10,50,100,125,150,175,200和500 mg生药·L-1、补骨脂素(PS)12.5,25,50,100,200和400 μmol·L-1及补骨脂酚(BK)1,5,10,25和50 μmol·L-1溶液中,光镜检测3 dpf斑马鱼胚胎形态,观察记录给药后2~9 dpf胚胎或幼鱼死亡数,SPSS软件计算4,6和9 dpf LC50;另用速率法检测6 dpf斑马幼鱼谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性。结果 与模型组相比,EE 0.1 mg生药·L-1和WD 1 mg生药·L-1能显著增加斑马鱼头部骨骼染色面积和骨密度(P<0.01),提示增加骨矿化量;且WD和EE 1 mg生药·L-1均上调OPG mRNA、下调RANKL mRNA表达水平(P<0.01),OPG/RANKL比值显著提高(P<0.01)。EE,WD,PS和BK可致斑马鱼心包、卵黄囊肿大,GOT活性降低(P<0.01),WD和PS的LC50值分别为EE和BK的4~7倍和4.3~20倍。结论EE较WD促骨骼发育活性强,且毒性更大,提示脂溶性特征性成分可能是起效或致毒的关键成分。
斑马鱼;补骨脂;骨骼发育
DOl:10.3867/j.issn.1000-3002.2017.06.024
一直以来,中药治疗骨科疾病因安全性好且副作用相对较小而受到青睐[1]。但近年来,应用范围广、社会关注度高的壮骨中药如淫羊藿和补骨脂等的肝毒性已引起重视,为临床应用带来挑战[2]。因此早期、快速辨识这类中药的促骨骼发育活性及其安全性具有意义。传统哺乳动物促骨骼发育模型和毒性模型耗时长且成本高,不适于早期高效筛选;体外细胞毒模型不能体现在体实验的综合效果;而斑马幼鱼鱼体透明,可实时动态观察药物毒性[3-4]。斑马鱼骨骼发育模型可突破量微成分难以进行促进骨骼发育活性在体评价的技术瓶颈,实现在体化、微板化、简单和高效筛选[5-8],达到兼顾有效性和安全性的促进骨骼发育中药高效筛选目的[9]。
中药补骨脂为豆科植物补骨脂(Psoralea corylifolia L.)的干燥成熟果实,具有温肾助阳、纳气平喘、温脾止泻等功效[10]。香豆素类是补骨脂促骨骼发育主要活性成分和研究对象[11-13]。但近年来补骨脂的安全隐患逐渐显现,补骨脂及含补骨脂的知名壮骨中药如壮骨关节丸和仙灵骨葆的肝损伤不良反应日益受到重视[14-15]。补骨脂的毒性研究主要采用大鼠、小鼠在体模型或体外肝、肾细胞等模型,研究对象主要为补骨脂及不同炮制品[16-17],以及补骨脂素(psoralen,PS)和补骨脂酚(bakuchiol,BK)等成分[18-19]。本研究拟选择具有一定毒性或药效研究基础的补骨脂为代表,用斑马鱼评价补骨脂醇提取物(ethanol extract,EE)和水煎液(water decoc-tion,WD)促骨骼发育活性,观察EE和WD对骨骼发育的影响及毒性作用差异。
1 材料与方法
1.1 药物、试剂和仪器
6~10月龄斑马鱼为德国Tuebingen品系,南京大学模式动物研究所提供。补骨脂(南京松龄中药饮片有限公司,四川产地);PS和依替膦酸二钠(etidronate disodium,ED)(中国食品药品检定研究院,批号:0739-9706和101174-201001);BK(南京景竹生物科技有限公司,批号:JZ15041203);泼尼松龙(prednisolone,PN)(苏州亚科化学试剂股份有限公司,批号:YK2012020101);茜素红S(郑州四季化工产品有限公司,批号:Sj20110806);RNA提取试剂盒(美国Invitrogen公司);逆转录酶试剂盒(美国Promega公司);2×PCR混合液(美国Vazyme公司);荧光定量试剂盒(瑞士Roche公司);根据斑马鱼核因子κB受体活化因子配体(receptor activator for NF-κB ligand,RANKL)和骨保护素(osteoprotegerin,OPG)基因序列,并参考文献[20]设计引物,南京金斯瑞生物科技有限公司合成。设计内参基因β肌动蛋白作为平衡不同cDNA模板之间浓度差异的基准物。RANKL上游引物:TAGTGTTGGCGATTCTGTTGC,下游引物:ATTGGAAGGTGAGCTGATGG;OPG上游引物:GGCGTCTGAAGAAACCTCTG,下游引物:GCAGGATTGGGATGCAGTAT。Nikon Aphaphot-2 YS2显微镜(日本株式会社尼康公司);Olympus stylus TG-4相机(日本Olympus公司);ZEISS荧光倒置显微镜(蔡司光学仪器国际贸易有限公司,型号AxioVision Rel);CFX Connect荧光定量PCR检测系统和T100梯度PCR仪(美国Bio-Rad公司);MODULAR型全自动生化仪(德国罗氏公司);Milli-Q system高纯水(美国Millipore公司);Agilent 1200型系列高效液相色谱仪(美国Agilent公司)。
1.2 EE和WD制备及剂量选择
取补骨脂药材适量,加70%乙醇提取或水煎煮2次,分别合并提取液,浓缩至无醇味。参考文献[20-24]色谱条件对EE和WD进行色谱分析,分别用纯水配制成10 g生药·L-1贮备液,临用前用培养基稀释供斑马鱼实验。
给药期间,为使幼鱼尽可能存活至9 dpf,选<50%死亡率浓度作为最高给药浓度,设置3~4个剂量,观察EE和WD对骨骼发育的影响。
根据预实验结果 ,选取使斑马幼鱼0%~100%死亡的药物浓度范围,作为毒性作用观察浓度,一般设置≥5个浓度。
1.3 茜素红染色测定斑马鱼头骨骨矿化面积和骨密度
斑马鱼胚胎(0 dpf)28.5°C恒温培养箱中培养至3 dpf后,放入盛有培养基的24孔板中,每孔6个胚胎,每组3孔,分为0.4%DMSO溶媒组、PN 25 μmol·L-1模型组、PN+ED 30 mg·L-1阳性药物组、PN+EE或WD 0.1,1,10和100 mg生药·L-1组。
隔天换液培养至9 dpf置于MS-222中麻醉致死,去除MS-222溶液,置于4%多聚甲醛磷酸盐缓冲液中固定24 h,去除固定液,用中性磷酸盐缓冲液洗涤3次,加入新鲜配制的漂白剂(1.5%H2O2和1%KOH)漂白2 h,再用中性磷酸盐缓冲液洗涤3次,加入用0.5%KOH配制的茜素红染色液,24 h后去除染色液,逐步以比例为3∶1,1∶1和1∶3的0.5%KOH和甘油的混合溶液各透明6 h,最后存储在纯甘油中。
光学显微镜观察茜素红染色的斑马鱼头骨腹面,显微镜放大倍数10×10进行图像采集,所有的图像均采用相同的光强度和曝光设置。用专业图像分析软件Image pro plus 6.0计算斑马鱼头骨茜素红染色区域的面积之和及积分吸光密度,分别表示骨矿化面积和骨密度。
1.4 荧光定量PCR(Q-PCR)分析9 dpf斑马鱼OPG和RANKL mRNA表达
从9 dpf的DMSO,PN,ED以及WD和EE均为1 mg生药·L-1组的斑马幼鱼(n=120)中提取总RNA。测定其纯度和浓度。用M-MLV对RNA进行逆转录,用2×PCR Master Mix检测cDNA的质量,对cDNA样品进行荧光定量PCR分析。扩增条件为:95℃预变性10 s,1个循环;95℃变性5 s;60℃退火和延伸15 s,45个循环。以β肌动蛋白为内参,采用2-△△Ct方法计算待测基因mRNA相对表达水平。
1.5 光学显微镜观察斑马鱼脏器形态和死亡率测定
将收集到的受精卵移入培养基中,28.5℃培养箱中继续培养24 h待用。将1 dpf的斑马鱼胚胎放入盛有胚胎培养基的24孔板中,每孔18个胚胎,每组3孔,分为0.4%DMSO溶媒对照组、EE 10,20,30,35,40,50和60 mg生药·L-1组、WD 10,50,100,125,150,175,200和500 mg生药·L-1组、PS 12.5,25,50,100,200和400 μmol·L-1组以及BK 1,5,10,25和50 μmol·L-1组(DMSO适量助溶,含量<0.4%),并于给药后3 dpf在显微镜下观察各组主要脏器形态,观察并记录2~9 dpf斑马鱼胚胎或幼鱼的死亡数,在显微镜下观察和拍照。
1.6 全自动生化仪速率法测定6 dpf斑马鱼组织匀浆谷丙转氨酶(glutamic pyruvic transaminase,GPT)和谷草转氨酶(glutamic oxaloacetic transaminase,GOT)活性
于斑马幼鱼1 dpf给药,取各组6 dpf斑马幼鱼(DMSO组,EE 35,40和50 mg生药·L-1组,WD 50,100和150 mg生药·L-1组,PS 12.5,25.0和50.0 μmol·L-1组以及BK 5和10 μmol·L-1组),加生理盐水(2×104鱼·L-1)制备斑马鱼组织匀浆,冰浴匀浆取上清,罗氏800全自动生化分析仪测定GPT和GOT活性。
1.7 统计学分析
实验结果 数据用x±s表示,采用SPSS16.0软件回归方法计算半数致死浓度(LC50),采用EXCEL软件进行t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 EE和WD主要成分
由图1可知,WD主含色谱峰1~4,分别为补骨脂苷(psoralenoside)、异补骨脂苷(isopsoralenoside)、PS和异补骨脂素(isopsoralen),4个成分峰面积之和约占WD总成分峰面积之和的90.5%,却仅占EE总成分峰面积之和的19.5%;色谱峰5为BK,是EE的主要成分,色谱峰面积约占EE总成分峰面积和之的43%,而WD不含BK。
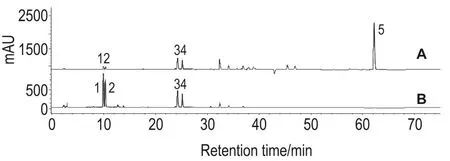
Fig.1 HPLC profile of ethanol extract(EE)(A)and water decoction(WD)(B)ofPsoralea corylifoliaL..Peaks 1-5 represent psoralenoside,isopsoralenoside,psoralen(PS),isopsoralen and bakuchiol(BK),respectively.
2.2 EE和WD对斑马鱼头骨矿化面积和骨密度的影响

Fig.2 Effect of EE and WD on skeletal development of zebrafish larvae at 9 days post fertilization(9 dpf)by ventral view of alizarin red whole-mount preparations.Zebrafish larvae(3 dpf)were placed into 24-well plate(6 larvae per well,3 wells per group)including 0.4%DMSO vehicle control group,prednisolone(PN)25 μmol·L-1model group,PN 25 μmol·L-1+ etidronate disodium(ED)30 mg·L-1(positive group),and PN 25 μmol·L-1+EE or WD 0.1,1,10 and 100 mg crude drug·L-1groups. At 9 dpf,larvae were fixed and processed for whole-mount skeletal staining.
9 dpf斑马鱼幼鱼头骨染色的显微成像(图2)和图像分析软件分析结果 (表1)显示,与DMSO组相比,PN模型组的斑马鱼头骨矿化面积和骨密度明显降低(P<0.01),表明PN 25 μmol·L-1导致斑马鱼骨量减少。与模型组比较,ED 30 mg·L-1组中头骨矿化面积和骨密度显著升高(P<0.01)。EE 0.1 mg生药·L-1组斑马鱼头骨矿化面积和骨密度与较模型组比较显著增加(P<0.01),但当浓度增加时,矿化面积和骨密度却呈降低趋势。EE 100.0 mg生药·L-1组斑马鱼全部死亡,提示毒性较大。与模型组相比,WD 1 mg生药·L-1组,斑马鱼头骨矿化面积和骨密度显著增加(P<0.01),其显效浓度为EE的10倍;WD 100 mg生药·L-1组斑马鱼正常存活,说明WD毒性低于EE。
2.3 EE和WD对9 dpf斑马鱼OPG和RANKL mRNA表达的影响
荧光定量PCR结果 显示(表2),与DMSO对照组相比,模型组RANKL mRNA表达升高(P<0.01),OPG/RANKL比值降低(P<0.05)。与模型组相比,WD和EE(1 mg生药·L-1)均显著升高OPG mRNA表达水平(P<0.05,P<0.01);WD,EE和ED均可显著降低RANKL mRNA表达水平(P<0.01),OPG/ RANKL比值显著增加(P<0.01)。
2.4 EE,WD,PS和BK对斑马鱼发育的影响
2~3 dpf的斑马鱼胚胎心血管能够发育完全,孵化成斑马鱼幼鱼,显微形态如图3所示。WD和EE均致斑马鱼脏器中毒,WD致鱼中毒的最低浓度(175 mg生药·L-1)是EE(40 mg生药·L-1)的4.38倍。在3 dpf时,WD 150 mg生药·L-1组斑马鱼胚胎未出现异常症状,与培养基对照组无差异;≥175 mg生药·L-1可以观察到斑马鱼心脏区域心包囊肿大,心膜区有出血现象,血细胞在心脏区堆积,卵黄囊明显肿大;斑马鱼对刺激不敏感,静卧于孔板底部等。在3 dpf时,EE 40和50 mg生药·L-1组未表现出中毒现象,但60 mg生药·L-1致鱼卵黄囊肿大,色斑减少,尚有部分鱼胚胎未孵出;在4 dpf时,EE 40和50 mg生药·L-1致鱼心包和卵黄囊肿大,且50 mg生药·L-1组鱼卵黄囊变黑,60 mg生药·L-1组除未孵出幼鱼外全部死亡;在5 dpf时,EE 40和50 mg生药·L-1致幼鱼全身水肿,形体模糊,60 mg生药·L-1组幼鱼全部死亡。PS致鱼脏器中毒的最低浓度(50 μmol·L-1)是BK(10 μmol·L-1)的5倍。3 dpf时,PS 50 μmol·L-1组斑马鱼胚胎表现出卵黄囊肿大,心包水肿;而BK 10 μmol·L-1组鱼卵黄囊肿大,BK 25 μmol·L-1组鱼卵黄囊肿大加重,伴脊柱弯曲。
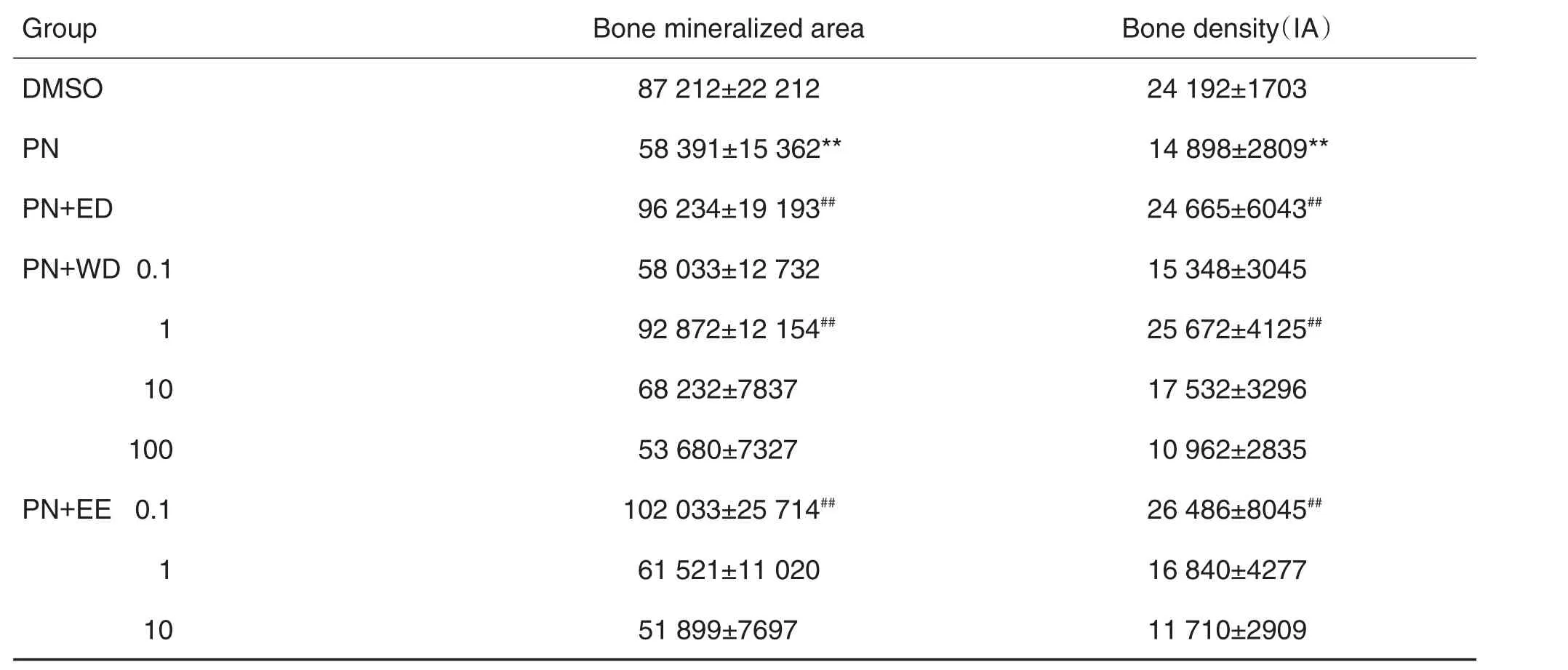
Tab.1 Effects of EE and WD on bone mineralized area and bone density of 9dpf zebrafish skeleton

Tab.2 Effect of EE and WD on mRNA expression of osteoprotegrin(OPG)and receptor activator of NF-κ B ligand(RANKL)in zebrafish(9 dpf)by Q-PCR

Fig.3 Effect of EE,WD,psoralen(PS)and bakuchiol(BK)on morphology of zebrafish 3 dpf(A),4 dpf(B)and 5 dpf(C).Arrows show yalk sac and heart of zebrafish.Zebrafish exposed to EE 60 mg·L-1had not hatched at 4 dpf.
2.5 EE,WD,PS和BK对斑马鱼的致死性
4,6和9 dpf时,WD对斑马鱼的LC50值分别为353.32,192.15和189.56 mg生药·L-1;EE的LC50值分别为53.44,49.18和49.18 mg生药·L-1,WD的LC50为EE的4~7倍,提示EE对斑马鱼的毒性远大于WD。补骨脂中水溶性较强的代表成分PS的LC50值分别为251.87,59.85和54.85 μmol·L-1,约为强脂溶性成分BK(LC50均为12.78 μmol·L-1)的4.3~20倍,提示BK对斑马鱼的毒性远大于PS(图4)。
2.6 EE,WD,PS和BK对6 dpf斑马鱼GOT和GPT活性的影响
表3结果 显示,6 dpf时,与DMSO组相比,EE,WD,PS和BK各浓度组斑马幼鱼中的GOT活性显著降低(P<0.01)。与DMSO组比,各给药组GPT值活性降低,但由于GPT值偏低,未测到精确数值,未进行差异分析。
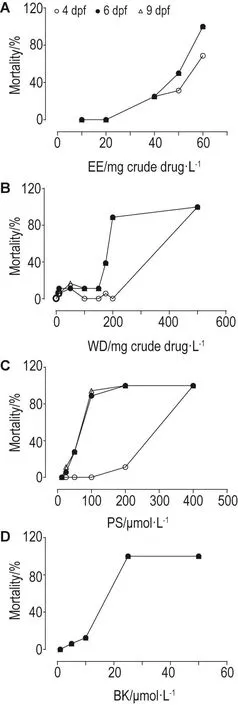
Fig.4 Effect of EE(A),WD(B),PS(C)and BK(D)on mortality of zebrafish 4,6 and 9 dpf.See Fig.3 for the treatment.x±s,n=18.
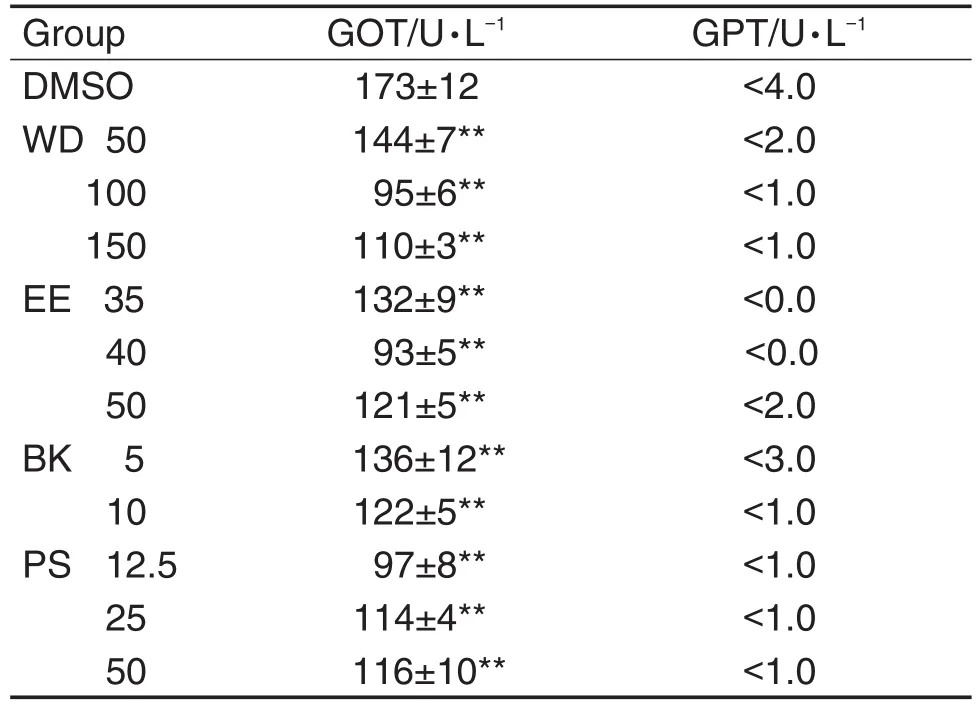
Tab.3 Effect of EE,WD,PS and BK on activities of GOT and GPT in 6 dpf zebrafish
3 讨论
本研究发现,WD和EE均能显著阻止PN诱导的斑马鱼骨量减少,但WD起效剂量为EE的10倍。
斑马鱼与哺乳动物骨骼生长发育的分子机制极为相似,含有调节骨形成和骨吸收的密切相关基因OPG和RANKL[20]。RANKL是诱导破骨前体细胞分化的关键细胞因子。OPG作为一种诱骗受体,可以竞争性地与RANKL结合,从而封闭RANKL与破骨细胞表面的核激活因子受体(receptor activator of NF-κB,RANK)结合,抑制破骨细胞的分化成熟[26]。本研究荧光定量PCR测定9dpf斑马鱼OPG和RANKL mRNA表达发现,WD和EE均可显著下调RANKL、上调OPG mRNA表达水平,并显著增加OPG/RANKL比值,提示补骨脂影响骨骼发育在于抑制骨吸收、促进骨形成。
此外,本研究采用近年来被国内外广泛关注并认可的斑马鱼毒性模型[27],在显微镜下检视3 dpf斑马鱼脏器形态,此时斑马鱼心脏等脏器基本发育完全,刚孵出不活跃,鱼体透明,易于检视。4 dpf后斑马鱼活跃,5 dpf肝发育完全,卵黄囊不断被吸收,不易侧卧捕获脏器形态。斑马鱼头部骨骼主要在3~9 dpf形成。斑马鱼卵黄囊成分的70%为中性脂质,主要在肝中代谢,因此卵黄囊大小可作为反映肝功能的指标之一[28]。斑马鱼实验检测组织匀浆液中的GPT和GOT活性,从整体动物的角度来讲,肝损伤后肝细胞合成GPT和GOT的能力降低[29]。本研究发现,WD和EE以及PS和BK均可使斑马鱼卵黄囊肿大、变形或变黑,使斑马鱼肝组织GPT和GOT活性降低,提示与肝毒性相关,但致毒浓度存在差异。WD的安全性比EE较好,其致鱼中毒剂量约为EE的4~7倍。高效液相色谱分析发现,EE和WD成分差异较大,WD中主要含有补骨脂苷、异补骨脂苷、PS和异补骨脂素,占WD总成分峰面积的90%,仅约占EE总成分峰面积的20%;而BK是EE主要特征性成分,占EE总成分峰面积的43%,但WD不含BK。综合毒性成分分析,可见补骨脂中促进骨骼发育活性更高,毒性更强的关键成分可能是以BK为代表的脂溶性成分。BK的肝毒性最近有文献报道证实[30],而一直广为关注的水溶性成分PS和异补骨脂素毒性则相对较弱[31,13]。本研究进一步用斑马鱼实验证实了BK的毒性强于PS。该研究提示,仅用补骨脂及炮制品的传统WD进行毒性研究会错失致毒关键成分的发现。
参考文献:
[1]Zhang HW,Liu F.New progress in drug therapy for osteoporosis[J].Chin J Osteoporos(中国骨质疏松杂志),2012,18(6):583-588.
[2]Wang JB,Xiao XH,Du XX,Zou ZS,Song HB,Guo XX.Identification and early diagnosis for traditional Chinese medicine-induced liver injury based on translational toxicology[J].China J Chin Mater Med(中国中药杂志),2014,39(1):5-9.
[3]Raldúa D,Piña B.In vivo zebrafish assays for analyzing drug toxicity[J].Expert Opin Drug Metab Toxicol,2014,10(5):685-697.
[4]Fuse Y,Nguyen VT,Kobayashi M.Nrf2-dependent protection against acute sodium arsenite toxicity in zebrafish[J].Toxicol Appl Pharmacol,2016,305:136-142.
[5]Barrett R,Chappell C,Quick M,Fleming A.A rapid,high content,in vivo model of glucocorticoid-induced osteoporosis[J].Biotechnol J,2006,1(6):651-655.
[6]Wei YJ,Wang CM,Cai XT,Zhan Y,Jia XB. Establishment of zebrafish osteopenia model induced by dexamethasone[J].Acta Pharm Sin(药学学报),2013,48(2):255-260.
[7]Fleming A,Sato M,Goldsmith P.High-throughput in vivo screening for bone anabolic compounds with zebrafish[J].J Biomol Screen,2005,10(8):823-831.
[8]Moon SH,Choi SW,Park SJ,Ryu SY,Hwang KS,Kim CH,et al.In vitro and in vivo bone-forming activity of saururus chinensis extract[J].Phytother Res,2015,29(7):1073-1080.
[9]Wang DD,Wei YJ,Jing LJ,Jia XB,Liu C.Antiosteoporotic activity and safety of Strong Bone Capsules based on joint evaluation of toxicity and effect on zebrafish[J].Chin Tradit Pat Med(中成药),2015,37(5):938-943.
[10]Jiao SY,Ai CH,Li AF,Li H,Wang Q.In vitro interspecies comparison of metabolism and metabolic detoxification of bakuchiol in liver microsomes[J]. Chin Pharmacol Bull(中国药理学通报),2011,27(2):216-220.
[11]Zhang X,Zhao W,Wang Y,Lu J,Chen X.The chemical constituents and bioactivities of Psoralea corylifolia Linn.:a review[J].Am J Chin Med,2016,44(1):35-60.
[12]Wong RW,Rabie AB.Effect of psoralen on bone formation[J].J Orthop Res,2011,29(2):158-164.
[13]Lu H,Zhang L,Liu D,Tang P,Song F.Isolation and purification of psoralen and isopsoralen and their efficacy and safety in the treatment of osteosarcoma in nude rats[J].Afr Health Sci,2014,14(3):641-647.
[14]Zhou K,Bi YN,Shi H.Psoralen induced bile acid accumulation and cytotoxicity by inhibiting MRP2 and MRP3 in Hep G2 cells[J].Chin Pharmacol Bull(中国药理学通报),2015,31(8):1112-1116.
[15]Zhao QH,Sun R.Research development on toxicity of Psoralea corylifolia L.related to efficacy and chemical material basis[J].Chin J Pharmacovigilance(中国药物警戒),2014,11(8):482-484.
[16]Hu CJ,Shuai XC,Yu LY,Xu ZY,Zhang R,Wang ZP.Dry toxic effects of fruit of Psoralea crylifolia L.processed with salt on normal mice and Yin deficiency mice induced by hydrocortisone[J]. J Chengdu Univ Tradit Chin Med(成都中医药大学学报),2010,33(3):66-68.
[17]Bi YN,Li Z,Lu GY,Shi H,Zhou K.Hepatoxicity of aqueous extract from Psoralea corylifolia and its effect on bile acid transportation in mice[J].Drug Eval Res(药物评价研究),2015,38(3):267-270.
[18]Jiang F,Zhou XR,Wang Q,Zhang BX.Cytotoxic effect and mechanism of bakuchiol and bakuchiol combined with psoralen on HK-2 cell[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2010,24(1):50-58.
[19]Li AF,Shen GL,Jiao SY,Li H,Wang Q.Metabolic detoxification of bakuchiol is mediated by cytochrome P450 enzymes in human liver microsomes[J].J Peking Univ(Health Sci)〔北京大学学报(医学版)〕,2012,44(3):431-436.
[20]Zhou K,Dai Z,Liu ZB,Wang YF.Aqueous extract of Psoralea corylifolia induced liver injury in rats[J].J Tianjin Univ Tradit Chin Med(天津中医药大学学报),2013,32(4):221-224.
[21]Liu YN,Wang YF,Han LF,Pan GX,Wang H. Identification of compounds in fruits of Poralea corylifolia by HPLC-MS[J].China J Chin Mater Med(中国中药杂志),2009,34(22):2898-2902.
[22]Luo JM,Xiao X,Hong L,Tian YW,Guo L,Su JK,et al.Analysis on chemical constitutes in Psoraleae Fructus by combination of HPLC/TOF-MS and HPLC/IT-MS[J].Chin Tradit Herb Drugs(中草药),2014,45(7):924-928.
[23]Tao Y,Jiang YH,Li WD,Cai BC.Effect of processing on contents of twelve constituents in Psoraleae Fructus[J].Chin J Exp Tradit MedForm(中国实验方剂学杂志),2016,22(21):6-9.
[24]Song X,QI AD,Wang YF,Jing YK,Chai X,Liu YN. Variation of 4 kinds of compounds in Psoralea corylifolia processed by different methods[J].China J Chin Mater Med(中国中药杂志),2011,36(15):2071-2075.
[25]Kitamura K,Takahira K,Inari M,Satoh Y,Hayakawa K,Tabuchi Y,et al.Zebrafish scales respond differently to in vitro dynamic and static acceleration:analysis of interaction between osteoblasts and osteoclasts[J].Comp Biochem Physiol A Mol Integr Physiol,2013,166(1):74-80.
[26]Zhong LL,Yang B,Huang XB,Sun YM.Effects of RANKL/RANK/OPG system on modulation of osteoblasts and osteoclasts[J].Chin J Osteoporos(中国骨质疏松杂志),2011,17(11):1010-1013.
[27]Sarvaiya VN,Sadariya KA,Rana MP,Thaker AM. Zebrafish as model organism for drug discovery and toxicity testing:a review[J].Veter Clin Sci, 2014,2(3):31-38.
[28]Zhang Y,Peng WB,Wang XM,Wang X,Xiao CD,Liu KC.Hepatotoxicity evaluation of acetaminophen using zebrafish model[J].Drug Eval Res(药物评价研究),2013,36(5):351-354.
[29]He QX,Peng WB,Han LW,Yuan YQ,Chen XQ,Liu KC.Studies of zebrafish liver injury induced by tetrachloromethane[J].Chin Pharmacol Bull(中国药理学通报),2012,28(8):1182-1183.
[30]Bi YN,Li Z,Zhou K,Zhao XY,Shi H,Zheng L. Influence of bakuchiol on liver function and bile acid transporters BSEP and NTCP in mouse[J].J Tianjin Univ Tradit Chin Med(天津中医药大学学报),2015,34(4):222-225.
[31]Zhai YK,Pan YL,Niu YB,Wu XL,Mei QB. Comparative studies on the differentiation and maturation of rat calvarial osteoblasts by psoralen and isopsoralen in vitro[J].Chin Pharmacol Bull(中国药理学通报),2012,28(3):355-361.
(本文编辑:沈海南,乔虹)
《中国药理学与毒理学杂志》中图的要求
论文中的各种图包括病理照片图、曲线图、柱图、电泳图及化学结构式图等,请将图直接插入word文档中不要插入图片,若不明白插入图后双击可直接进入此图的做图软件中看到此图即可。应按以下要求处理。
1.病理照片图应采用加标尺的方式表示,并在图中配上箭头指示病变区域(图1,图4)。除照片图外,其他图均用灰度图表示。曲线图图例依次为○●△▲□■等,图例字号为6磅字体为Arial。图中统计学分析符号标注依次为*#△等。
2.双栏图大小为:宽与高的比为3∶2,宽≤7.5cm,横、纵坐标的字号为8或9磅字体为Arial;条带图上标注为:M,1,2,3,4,5等。
3.通栏图大小为:宽≤15cm。字号为9或8榜。横、纵坐标的字号为8或9磅字体为Arial。
4.其他有关图表自明的要求见本刊网站http://www.cjpt.ac.cn下载中心的投稿须知中的第19条和论文模版中的举例。
Effect of extract ethanol and water decoction of Psoralea corylifolia L. on bone development and their toxicities in zebrafish
CHEN Ying1,2,WANG Mo3,SONG Jie1,2,ZHAN Yang2,JING Li-jun1,2,CHEN Shu-qin2, JIA Xiao-bin1,2,WEI Ying-jie1,2
(1.The Third Clinical School of Medicine of Nanjing University of Chinese Medicine,Nanjing 210028, China;2.Key Laboratory of New Drug Delivery System of Chinese Materia Medica,Jiangsu Provincial Academy of Chinese Medicine,Nanjing 210028,China;3.Hospital of the Chinese People′s Liberation Army 93038,Tonghua 135300,China)
OBJECTlVETo investigate the bone development activity and differences in safety of ethanol extract(EE)and water decoction(WD)of Psoralea corylifolia L.efficiently.METHODSZebrafish larvae were co-exposed to prednisolone 25 μmol·L-1and different concentrations of EE and WD(0.1, 1.0,10 and 100 mg crude drug·L-1),and etidronate disodium(ED)30 mg·L-1.All these groups were incubated at 28.5℃until 9 dpf.The medium solution was changed every other day.Zebrafish skeleton at 9 dpf was stained with alizarin red and inspected under an optical microscope,in addition,the death toll and organ toxicity of zebrafish were also observed.The mRNA expression of osteoprotegrin(OPG) and receptor activator of NF-κB ligand(RANKL)in 9 dpf zebrafish were determined with fluorescence quantitative PCR.Zebrafish embryos(1 dpf)were exposed to various concentrations of EE(10,20,30, 35,40,50 and 60 mg crude drug·L-1),WD(10,50,100,125,150,175,200 and 500 mg crude drug·L-1), psoralen(12.5,25.0,50.0,100.0,200.0 and 400.0 μmol·L-1)and bakuchiol(1,5,10,25 and 50 μmol·L-1).Embryonic morphology of zebrafish(3 dpf)was inspected with an optical microscope and the death toll of embryos or larvale was counted from 2 dpf to 9 dpf and LC50was calculated.Components of EE and WD ware analyzed by HPLC method.RESULTSBoth EE(0.1 mg crude drug·L-1)and WD (1.0 mg crude drug·L-1)groups could increase the staining area and optical density values of zebrafishskeleton compared with prednisolone group(P<0.01),indicating the increase in bone mineralization;the OPG mRNA expression in both EE and WD(1.0 mg crude drug·L-1)groups increased,while the RANKL mRNA expression decreased(P<0.01)and the ratio of OPG/RANKL improved obviously(P<0.01). Embryos exposed to EE,WD,psoralen and bakuchiol showed swelling of the heart and yalk sac,and decrease in GOT.The LC50of WD and psoralen was 5~8 and 5~21 times that EE and bakuchiol, respectively.The composition and relative content of EE and WD also varied considerably.CONCLUSlONBone development activity and toxicity of EE are both stronger than those of WD.The lipid soluble characteristic components of Psoralea corylifolia L.,may be critical components of toxicity.
zebrafish;Psoralea corylifolia L.;bone development
The project supported by National Science and Technology Major Project of China(2017ZX09301-056); Traditional Chinese Medicine Scientific Research(201507004-10);National Natural Science Foundation of China(81573833); Natural Science Foundation of Jiangsu Province(BK20141507);Natural Science Foundation of Jiangsu Province(BK2011866); Foundation for High-level Talent in Six Areas of Jiangsu Province(2013-YY006);and"333 Project"of Jiangsu Province (BRA2014348)
WEI Ying-jie,E-mail:wyj970@163.com
R285.1
A
1000-3002-(2017)06-0661-09
2016-07-06接受日期:2017-04-19)
国家科技重大专项(2017ZX09301-056);中医药行业科研专项(201507004-10);国家自然科学基金(81573833);江苏省自然科学基金(BK20141507);江苏省自然科学基金(BK2011866);江苏省六大人才高峰基金(2013-YY006);江苏省第四期“333工程”科研项目(BRA2014348)
陈颖,女,硕士研究生,主要从事中药物质基础与质量控制研究,E-mail:m18751845710@163.com,Tel:(025)85637809
韦英杰,E-mail:wyj970@163.com

