纳米氧化锌暴露对斑马鱼胚胎心脏发育的毒性效应和机制研究
徐诚,张春兰,邵文涛,顾爱华
(南京医科大学公共卫生学院,江苏南京211166)
纳米氧化锌暴露对斑马鱼胚胎心脏发育的毒性效应和机制研究
徐诚,张春兰,邵文涛,顾爱华
(南京医科大学公共卫生学院,江苏南京211166)
目的 观察纳米氧化锌暴露对斑马鱼胚胎心脏发育及大鼠心肌细胞(H9c2)的毒性作用及可能机制。方法对纳米氧化锌材料进行表征化处理。斑马鱼胚胎在受精后4 h(4 hpf)暴露纳米氧化锌颗粒0.5,2.5,5.0和10.0 mg·L-124~96 h,计算胚胎存活率,并于胚胎17 hpf时间点,收集并用实时定量PCR测定中胚层脊索同源(noto),T盒16(tbx16),过短同源a(ta)和tbx6 mRNA表达;观察斑马鱼72 hpf心率。将心肌细胞标记红色荧光蛋白Tg(cmlc2:nuc-dsRed)的斑马鱼交配取胚胎,染毒纳米氧化锌2.5和5.0 mg·L-1,计数72 hpf胚胎心肌细胞数目。大鼠心肌细胞(H9c2)与纳米氧化锌0,0.1,0.5,1,5.0和10.0 mg·L-1共培养24 h,Alamar Blue方法检测细胞活力,透射电子显微镜观察线粒体超微结构,化学发光法和Seahorse仪分别检测细胞ATP和耗氧率水平。结果 纳米氧化锌在双蒸水中的粒径分布为(331±3)nm。48 hpf的斑马鱼胚胎纳米氧化锌LC50为21.81 mg·L-1。暴露纳米氧化锌2.5 mg·L-1后,17 hpf斑马鱼胚胎的心脏发育关键基因noto,ta和tbx6表达降低(P<0.05)。72 hpf斑马鱼暴露纳米氧化锌5.0 mg·L-1,心率为153 min-1,与正常对照组相比降低12.6%(P<0.01),心肌细胞数目减少15.5%(P<0.01)。纳米氧化锌0.5 mg·L-1可引起大鼠心肌细胞(H9c2)细胞活力降低(P<0.05)以及线粒体出现空泡化现象。与细胞对照组相比,细胞ATP减少25.7%(P<0.05),耗氧率减少27.2%(P<0.01)。结论低剂量纳米氧化锌暴露对斑马鱼心脏发育有一定影响,主要表现为心率降低和心肌细胞数目减少,这些变化可能与心脏发育相关基因表达减少以及细胞线粒体结构和功能损伤有关。
氧化锌;纳米颗粒;斑马鱼;心脏发育;毒性
DOl:10.3867/j.issn.1000-3002.2017.06.023
过去几十年,纳米材料在人们日常生活中无处不在,纳米毒性研究也受到越来越多科学家们的重视。金属氧化物纳米材料因其独特的性质在工业上广泛使用[1]。尤其是纳米氧化锌在化妆品、染料、生物传感、生物成像、药物载体和抗菌剂方面应用广泛[2]。此外,食品工业中采用纳米氧化锌作为添加剂来补充锌离子也是纳米氧化锌的暴露途径。纳米氧化锌可通过呼吸道、皮肤和消化道途径进入生物体,随循环系统进入各组织器官,进而到达心脏。以往研究报道,纳米氧化锌的职业参考暴露剂量为5 mg·m-3[3]。动物实验发现,纳米氧化锌能蓄积在小鼠的心、肺、睾丸组织[4]及大鼠的心、肝、脾、胰腺和骨组织中[5],提示心脏是纳米氧化锌的潜在靶器官。
纳米氧化锌在不同细胞类型呈现细胞毒性和促炎症效应[6]。纳米氧化锌10 mg·L-1导致口腔上皮细胞(TR146)氧化应激增加[7]。急性单核细胞(THP-1)暴露于纳米氧化锌17.69 mg·L-1可释放促炎细胞因子[8]。有研究发现,人结肠癌细胞(Caco-2)暴露于纳米氧化锌6.4 mg·L-1[9]以及大鼠肾上皮细胞暴露于纳米氧化锌12.5 mg·L-1[10]均可造成DNA损伤。有关心脏毒性的研究显示,纳米氧化锌可能通过干扰钙稳态引发心脏毒性。纳米氧化锌可以影响钙渗透和导致胞质中钙的积累,进而引起心肌损伤[11]。但纳米氧化锌对于心脏发育的毒性评估迄今为止还不完善。
斑马鱼出生7 d内胚胎透明,可很清楚地观察到斑马鱼的心脏结构以及化学物对斑马鱼心脏发育的影响,因此是一种研究心脏功能损伤的理想脊椎动物模型[12]。本研究采用斑马鱼胚胎和大鼠心肌细胞系(H9c2)作为研究模型,探讨低剂量纳米氧化锌对于心脏发育的毒作用以及可能的分子机制。评价纳米氧化锌对心脏发育的毒性作用,有助于为纳米氧化锌的安全使用提供参考依据。
1 材料与方法
1.1 动物和试剂
野生型斑马鱼AB系成鱼由南京大学模式动物研究所提供,Tg(cmlc2:nuc-dsRed)鱼由中国科学院上海生命科学研究院周勇研究员惠赠。斑马鱼的养殖和繁殖如下:水温28°C,光照14 h(光亮):10 h(黑暗),湿度为80%,胚胎培养于E3培养液(mol·L-1:NaCl 5,KCl 0.17,CaCl20.33,MgSO40.33),均不含亚甲基蓝,并用NaHCO3溶液调节pH值至7.0左右。
纳米氧化锌(Sigma-Aldrich,美国,货号:677450,纯度>97%),Trizol总RNA提取试剂(Thermo Fisher Scientific,美国,货号:15596026),逆转录试剂盒(TaKaRa,日本,货号:RR037A),PCR荧光定量试剂盒(Roche,瑞士,货号:04913850001)。
纳米氧化锌以灭菌双蒸水溶解配成1 g·L-1储备液。使用时,以胚胎培养液梯度稀释储备液至需求染毒浓度。
1.2 纳米氧化锌的表征
将纳米氧化锌称重后分散于双蒸水中,经超声(40 kHz)分散20 min后制备成悬浮液,将悬浮液滴在铜网上,室温干燥后通过透射电子显微镜观察纳米氧化锌在水中分布的形态。同时将纳米氧化锌水溶液置于激光粒度仪(英国马尔文公司)进行粒度分布和Zeta电位的检测。实验重复3次。
1.3 斑马鱼胚胎染毒
实验前1 d晚间,将性成熟雌雄鱼1∶1放入交配鱼缸内。次日清晨交配取受精卵,清洗后收集于24孔板,按照每孔10个,每组3孔,置于28°C恒温培养箱中继续培养4 h。选择正常的受精卵加入纳米氧化锌(0.5,2.5,5.0和10.0 mg·L-1)观察胚胎生存状态。
1.4 荧光定量PCR仪PCR检测脊索同源(notochord homeobox,noto),T盒16(T-box 16,tbx16),tbx6和过短同源a(T,brachyury homolog a,ta)mRNA表达
4 hpf斑马鱼胚胎染毒纳米氧化锌2.5和 5 mg·L-1至17 hpf,清洗后Trizol试剂溶解,并超声处理进行匀浆加入氯仿,离心,加入异丙醇,乙醇洗涤RNA沉淀,测定浓度,-70℃保存。逆转录得到cDNA。引物序列为:noto上游:CATGGTGGGATCTGAACGCT,下游CCTGGGATCCAGGGCTTTTT;tbx16上游:GAAGGCTGAGCGATACTCCC,下游GCTGTACACGTCTCGATGGT;ta上游:ATCATCTCCTTAGCGCCGTG,下游AGCACGGGAAACATTCGTCT;tbx6上游:GTGCAACCCAACAATGACCC,下游ATGGAGGGAAGGG-AAATGCG;β肌动蛋白上游:ACTCAGGATGCGGAAACTGG,下游AGGGCAAAGTGGTAAACGCT。按照PCR荧光定量试剂盒说明书进行PCR扩增,记录Ct值,以2-△△Ct表示mRNA的相对表达水平。实验重复3次。
1.5 斑马鱼胚胎心率和心肌细胞计数
4 hpf斑马鱼胚胎暴露纳米氧化锌2.5和 5 mg·L-1至72 hpf,将72 hpf斑马鱼胚胎置于体视镜(日本奥林巴斯公司)下进行观察。记录斑马鱼胚胎在1 min内的心跳次数。每组包含10个斑马鱼胚胎。实验重复进行3次。
将心肌细胞标记红色荧光蛋白Tg(cmlc2∶nucdsRed)的斑马鱼交配得到胚胎。这些胚胎的心肌细胞核能发出红色荧光。纳米氧化锌(0,2.5和5.0 mg·L-1)染毒至72 hpf收集胚胎,采用共聚焦显微镜(德国卡尔蔡司公司)对Tg(cmlc2:nucdsRed)斑马鱼心脏进行分层扫描,获得心脏多个层面的图片。根据斑马鱼心脏解剖结构,确定心室和心房的区域,对红色荧光标记的心肌细胞进行计数。每组包含10个斑马鱼胚胎。实验重复3次。
1.6 H9c2细胞染毒和细胞存活检测
H9c2用含10%胎牛血清的DMEM细胞培养基培养。细胞培养条件为37℃,5%CO2。在96孔板中,每孔加入100 μL 5000个细胞,设置5个复孔,与纳米氧化锌(0,0.1,0.5,1.0,5.0和10.0 mg·L-1)进行共培养24 h。培养24 h后,从细胞培养箱中取出96孔板,每孔加入10%体积的Alamar Blue溶液。加完Alamar Blue后,将96孔板置于细胞培养箱内继续孵育1 h。用酶标仪检测,波长为570和600 nm,细胞存活率(%)=(117216×处理组A570nm-80586×处理组A600nm)/(117216×细胞组A570nm-80586×细胞组A600nm)×100%。实验重复3次。
1.7 透射电子显微镜观察H9c2细胞超微结构
取纳米氧化锌(0,0.1和0.5 mg·L-1)共培养的细胞,消化后离心得到细胞团块。立即浸入2.5%戊二醛。用磷酸0.1 mol·L-1漂洗,15 min×3次。用1%锇酸固定液固定3 h。经过漂洗,固定和包埋过程后,使用LKB-1型超薄切片机切片60 nm。然后用3%醋酸铀-枸橼酸铅双染色。透射电镜观察,拍片。每个组分别选取20个视野。
1.8 H9c2细胞ATP水平检测
取纳米氧化锌(0,0.1和0.5 mg·L-1)共培养的H9c2细胞,加入约200 μL裂解液。裂解后4℃下12 000×g离心5 min,取样品上清,用于后续的测定。按照0.01,0.03,0.1,0.3,1.0,3.0和10.0 μmol·L-1浓度配制标准溶液。加100 μL ATP检测工作液到检测孔或检测管内用化学发光仪测定发光值。计算出样品中ATP的浓度。同时测定每个样品蛋白浓度,将得到的结果 除以蛋白浓度来矫正误差。实验重复3次。
1.9 H9c2细胞耗氧率检测
将H9c2细胞接种在专用的96孔板上。待细胞贴壁后,加入纳米氧化锌(0,0.1和0.5 mg·L-1),每个组别至少5个复孔。在细胞培养箱中孵育24 h。分别向探针板A,B和C孔加入寡霉素、羰基氰对三氟甲氧基苯腙(trifluorometh oxycarbonyl cyanidephenyl hydrazone,FCCP)、抗霉素和鱼藤酮。将96孔板置于37℃细胞培养箱中2 h。将96孔板置于仪器上平衡20 min。待平衡结束后,使用Seahorse生物能量测定仪(美国Seahorse Bioscience公司)检测,计算耗氧率。实验重复3次。
1.10 统计学分析
实验数据结果 用x±s表示。数据分析软件为SPSS 20.0。在统计分析前,对待统计分析数据进行Shapiro-Wilk检验来评价数据的正态性。如果满足正态性,进行单因素方差分析以及多重比较采用LSD法检验。如果没有满足正态性,则进行Kruskal-Wallis秩和检验以及对于两组以上数据进行多重比较采用LSD法检验。采用Fisher精确卡方检验进行百分率的比较。P<0.05为差异有统计学意义。
2 结果
2.1 纳米氧化锌表征
纳米氧化锌在双蒸水中的粒径分布为(331±3)nm。纳米氧化锌在双蒸水中的zeta电位为(24.7±0.9)mV。
2.2 纳米氧化锌对斑马鱼胚胎存活率的影响
48 hpf的斑马鱼胚胎纳米氧化锌LC50为 21.81 mg·L-1。与正常对照组相比,<5 mg·L-1的剂量暴露下,胚胎死亡率无统计学差异(数据略)。
2.3 纳米氧化锌对斑马鱼胚胎心率的影响
与正常对照组相比,纳米氧化锌2.5 mg·L-1不会引起心率下降,5 mg·L-1可导致斑马鱼胚胎心率显著降低〔153±4vs(175±3)min-1,n=3,P<0.01〕。
2.4 纳米氧化锌对斑马鱼胚胎心肌细胞数目的影响
与正常对照组相比,纳米氧化锌2.5 mg·L-1组斑马鱼心室心肌细胞数目减少(P<0.05),5 mg·L-1组斑马鱼心房和心室心肌细胞的数目减少(P<0.05)(图1)。
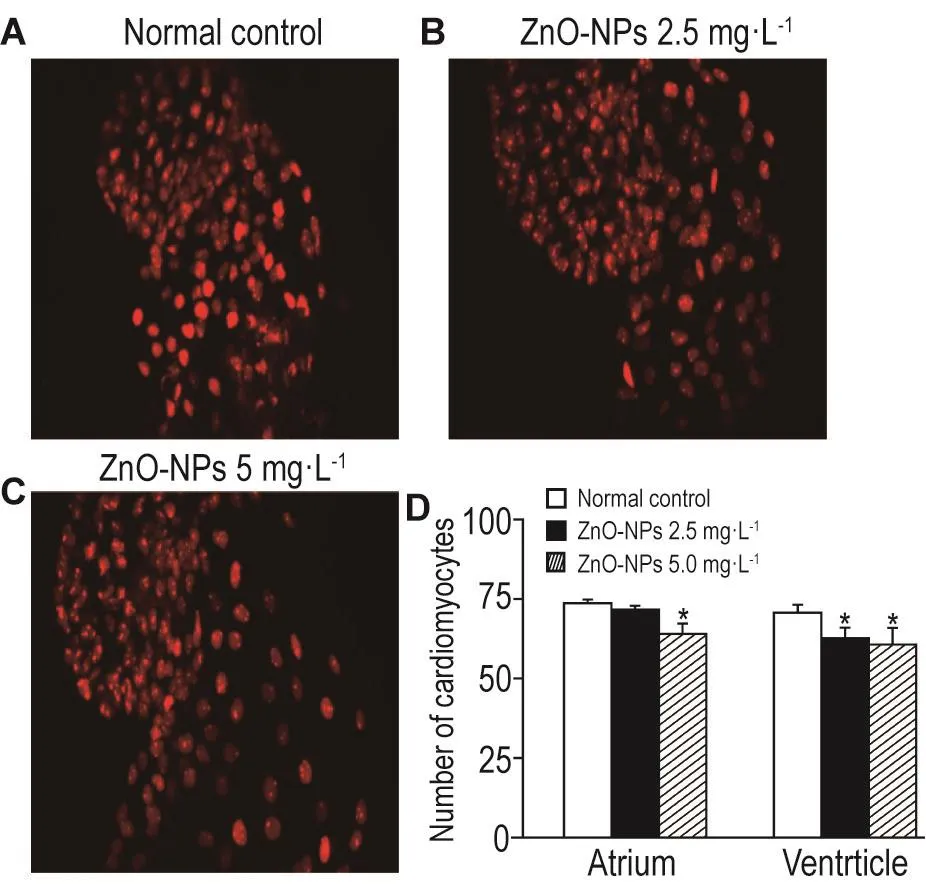
Fig.1 Effect of zinc oxide nanoparticles(ZnO-NPs)on 72 hpf zebrafish myocardial cells.(×40)Embryos were exposed to ZnO-NPs from 4 to 72 hpf.x±s,n=3.*P<0.05,compared with normal control group.
2.5 纳米氧化锌对于中胚层心脏发育noto,tbx16,ta和tbx6 mRNA表达的影响
与正常对照组相比,纳米氧化锌2.5和5 mg·L-1暴露组分别在17 hpf时引起noto,ta和tbx6 mRNA表达降低(P<0.01),对tbx16 mRNA无影响(图2)。
2.6 纳米氧化锌对H9c2细胞存活的影响
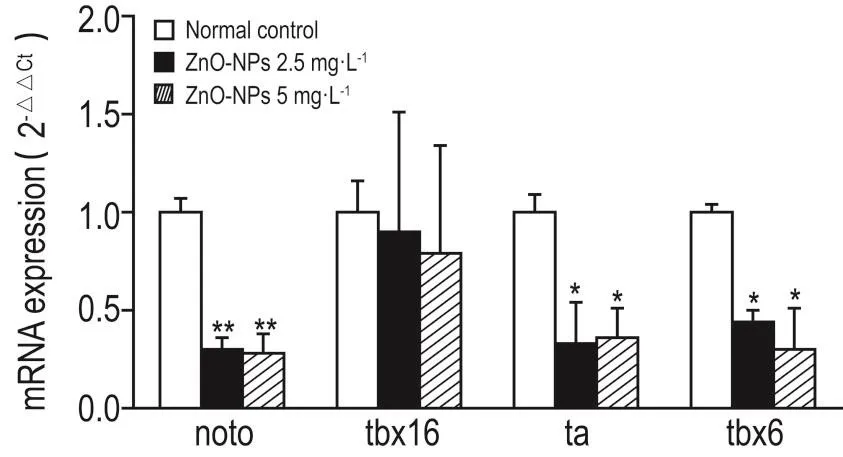
Fig.2 Effect of ZnO-NPs on mRNA expressions of notochord homeobox(noto),T-box 16(tbx16),T,brachyury homolog a(ta)and tbx6 of 17 hpf zebrafish.Embryos were exposed to ZnO-NPs from 4 to 17 hpf.x±s,n=3.*P<0.05,**P<0.01,compared with normal control group.
与细胞对照组相比,纳米氧化锌0.5 mg·L-1引起细胞活力的降低(P<0.05)。后续研究选择无细胞活力影响的0.1 mg·L-1和影响细胞活力的最低浓度0.5 mg·L-1(图3)。
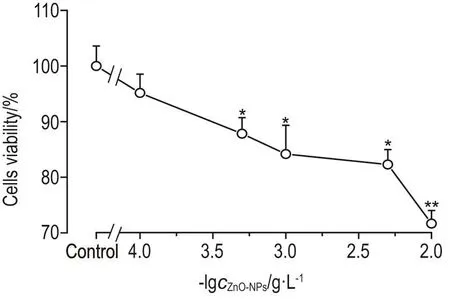
Fig.3 Effect of ZnO-NPs on H9c2 cells viability by Alamar Blue.H9c2 cells were treated with ZnO-NPs for 24 h.x±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
2.7 纳米氧化锌对H9c2细胞线粒体超微结构的影响
透射电子显微镜观察结果 (图4)表明,细胞对照组线粒体正常,纳米氧化锌0.1 mg·L-1组部分线粒体嵴消失,0.5 mg·L-1组出现较多的线粒体空泡化。
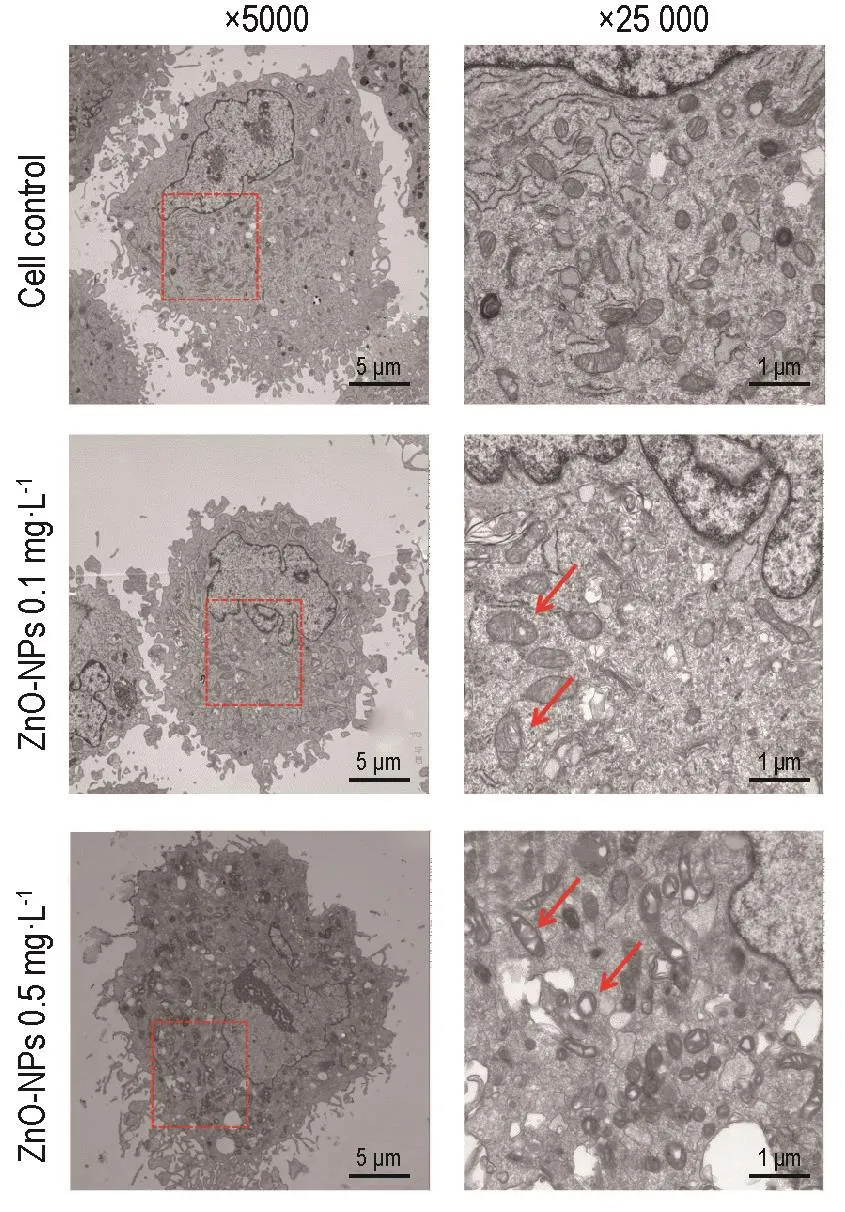
Fig.4 Effect of ZnO-NPs on H9c2 cell mitochondria organelles ultrastructure.H9c2 cells were treated with ZnO-NPs for 24 h.Arrows show mitochondrial vacuolation.
2.8 纳米氧化锌对H9c2细胞ATP和耗氧率的影响
纳米氧化锌0.1和0.5 mg·L-1可显著降低细胞ATP水平(P<0.05),减少细胞耗氧率(P<0.01)(表1)。
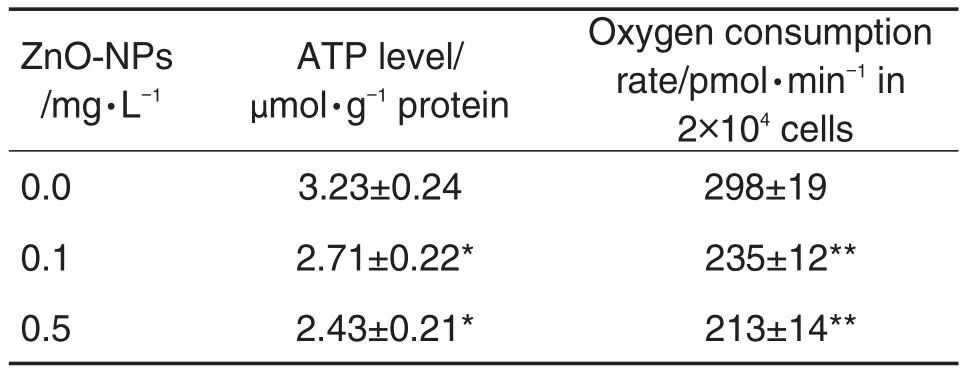
Tab.1 Effect of ZnO-NPs on ATP and oxygen consumption rate of H9c2 cells
3 讨论
本研究发现,纳米氧化锌在非致死剂量时,可引起斑马鱼胚胎心脏发育毒性,表现为胚胎心率降低以及心肌细胞数目减少,且心脏发育关键基因表达降低。纳米氧化锌还会引起心肌细胞线粒体损伤。
通过对斑马鱼胚胎染毒纳米氧化锌后,发现其心脏相关指标(心脏发育特异基因,心率,心肌细胞数目)受到影响,因此后续我们采用大鼠心肌细胞(H9c2)进行亚细胞器的研究,并发现线粒体超微结构和功能有损伤的现象。在生理情况下,线粒体可通过为钙离子转运蛋白提供能量,进而调节钙离子的转运和胞浆代谢水平,因此线粒体在心肌细胞中发挥着关键作用。线粒体的有氧糖酵解是心脏主要的能量来源和代谢形式,并且线粒体对于胚胎发育过程中的相关基因表达也起着一定的作用[13]。有研究报道,线粒体与心脏发育关系密切[14]。心肌细胞的分化过程中,线粒体的结构和功能也会动态地相应改变[15]。线粒体虽与心脏发育有关,但以往研究尚未涉及到纳米氧化锌,本研究揭示了纳米氧化锌可能通过损伤线粒体引起心脏发育毒性。
以往研究报道,纳米氧化锌可通过影响炎症和免疫相关的基因表达,导致斑马鱼胚胎的卵黄囊和心包水肿[16]。纳米氧化锌引起斑马鱼胚胎ROS升高,进而激活线粒体和胱天蛋白酶通路介导的凋亡效应[17]。纳米氧化锌还可部分通过氧化应激来损伤斑马鱼胚胎的孵化和运动能力[18]。
本研究发现,纳米氧化锌可引起斑马鱼心脏发育起始阶段3个关键基因noto,ta和tbx6 mRNA下调。已有研究发现,noto和ta mRNA与心脏循环功能有关[19]。Tbx6属于T-box家族的一员,可与sox2共同调节中胚层的分化[20],并能调节Notch通路部分基因转录,由于Notch通路是斑马鱼心脏发育中重要的通路之一,提示tbx6对斑马鱼心脏发育具一定调控作用。我们的研究还首次发现纳米氧化锌可引起心肌细胞线粒体结构发生损伤和功能受限,具体表现为ATP和耗氧率的降低。而生物体内线粒体的损伤会进一步引起胞内ROS水平增加及凋亡过程的激活。本研究或可解释之前发现的纳米氧化锌处理诱发大鼠心肌细胞凋亡的结果[21]。此外,本研究发现纳米氧化锌暴露可引起斑马鱼胚胎心率降低,心肌细胞数目减少,也是心脏潜在毒性的机制之一。
[1]Kahru A,Dubourguier HC.From ecotoxicology to nanoecotoxicology[J].Toxicology,2010,269(2-3):105-119.
[2]De Angelis I,Barone F,Zijno A,Bizzarri L,Russo MT,Pozzi R,et al.Comparative study of ZnO and TiO2nanoparticles:physicochemical characterisation and toxicological effects on human colon carcinoma cells[J].Nanotoxicology,2013,7(8):1361-1372.
[3]Sarac ES,Girgin G,Palabiyik SS,Charehsaz M,Aydin A,Sahin G,et al.A pilot study on neopterin levels and tryptophan degradation in zinc-exposed galvanization workers[J].Biol Trace Elem Res,2013,151(3):330-334.
[4]Li CH,Shen CC,Cheng YW,Huang SH,Wu CC,Kao CC,et al.Organ biodistribution,clearance,and genotoxicity of orally administered zinc oxide nanoparticles in mice[J].Nanotoxicology,2012,6(7):746-756.
[5]Pasupuleti S,Alapati S,Ganapathy S,Anumolu G,Pully NR,Prakhya BM.Toxicity of zinc oxide nanoparticles through oral route[J].Toxicol Ind Health,2012,28(8):675-686.
[6]Saptarshi SR,Duschl A,Lopata AL.Biological reactivity of zinc oxide nanoparticles with mammalian test systems:an overview[J].Nanomedicine(Lond),2015,10(13):2075-2092.
[7]Giovanni M,Tay CY,Setyawati MI,Xie J,Ong CN,Fan R,et al.Toxicity profiling of water contextual zinc oxide,silver,and titanium dioxide nanoparticles in human oral and gastrointestinal cell systems[J]. Environ Toxicol,2015,30(12):1459-1469.
[8]Sahu D,Kannan GM,Vijayaraghavan R.Sizedependent effect of zinc oxide on toxicity and inflammatory potential of human monocytes[J].J Toxicol Environ Health A,2014,77(4):177-191.
[9]Zijno A,De Angelis I,De Berardis B,Andreoli C,Russo MT,Pietraforte D,et al.Different mechanisms are involved in oxidative DNA damage and genotoxicity induction by ZnO and TiO2nanoparticles in human colon carcinoma cells[J].Toxicol In Vitro,2015,29(7):1503-1512.
[10]Uzar NK,Abudayyak M,Akcay N,Algun G,Özhan G.Zinc oxide nanoparticles induced cytoand genotoxicity in kidney epithelial cells[J].Toxicol Mech Methods,2015,25(4):334-339.
[11]Hasenfuss G.Alterations of calcium-regulatory proteins in heart failure[J].Cardiovasc Res,1998,37(2):279-289.
[12]Lal H,Kolaja KL,Force T.Cancer genetics and the cardiotoxicity of the therapeutics[J].J Am Coll Cardiol,2013,61(3):267-274.
[13]Cao X,Chen Y.Mitochondria and calcium signaling in embryonic development[J].Semin Cell Dev Biol,2009,20(3):337-345.
[14]Griffiths EJ.Mitochondria and heart disease[J]. Adv Exp Med Biol,2012,942:249-267.
[15]Jin J,Xuan QK,Zhou LJ,Shi CM,Song GX,Sheng YH,et al.Dynamic mitochondrial changes during differentiation of P19 embryonic carcinoma cells into cardiomyocytes[J].Mol Med Rep,2014,10(2):761-766.
[16]Choi JS,Kim RO,Yoon S,Kim WK.Developmental toxicity of zinc oxide nanoparticles to zebrafish(Danio rerio):a transcriptomic analysis[J].PLoS One,2016,11(8):e0160763.
[17]Zhao X,Ren X,Zhu R,Luo Z,Ren B.Zinc oxide nanoparticles induce oxidative DNA damage and ROS-triggered mitochondria-mediated apoptosis in zebrafish embryos[J].Aquat Toxicol,2016,180:56-70.
[18]Chen TH,Lin CC,Meng PJ.Zinc oxide nanoparticles alter hatching and larval locomotor activity in zebrafish(Danio rerio)[J].J Hazard Mater,2014,277:134-140.
[19]North TE,Zon LI.Modeling human hematopoietic and cardiovascular diseases in zebrafish[J].Dev Dyn,2003,228(3):568-583.
[20]Kondoh H,Takemoto T.Axial stem cells deriving both posterior neural and mesodermal tissues during gastrulation[J].Curr Opin Genet Dev,2012,22(4):374-380.
[21]Baky NA,Faddah LM,Al-Rasheed NM,Al-Rasheed NM,Fatani AJ.Induction of inflammation,DNAdamage and apoptosis in rat heart after oral exposure to zinc oxide nanoparticles and the cardioprotective role of α-lipoic acid and vitamin E[J].Drug Res(Stuttg),2013,63(5):228-236.
Effect and mechanism of zinc oxide nanoparticle on cardiac development of zebrafish embryos
XU Cheng,ZHANG Chun-lan,SHAO Wen-tao,GU Ai-hua
(School of Public Health,Nanjing Medical University,Nanjing 211166,China)
OBJECTlVETo explore the toxic effects of zinc oxide nanoparticls(ZnO-NPs)on cardiac development of zebrafish embryos and rat myocardial cell lines(H9c2),as well as potential molecular mechanisms.METHODSZnO-NPs were characterized.Zebrafish embryos were exposed to different doses of ZnO-NPs(0,0.5,2.5,5.0 and 10.0 mg·L-1)for 24 to 96 h at 4 h post fertilization (4 hpf).The embryo mortality was observed.The expressions of notochord homeobox(noto),T-box 6 (tbx16),T,brachyury homolog a(ta),and tbx6 which were related to cardiac mesoderm were investigated using real-time PCR at 17 hpf.The heart rate and number of cardiomyocytes of embryos〔Tg(cmlc2:nucdsRed)〕exposed to 0,2.5 and 5 mg·L-1ZnO-NPs were detected at 72 hpf.Rat myocardial cell lines (H9c2)were treated with ZnO-NPs(0.1,0.5,1.0,5.0 and 10.0 mg·L-1)for 24 h.Cell viability was measured with Alamar Blue method.Mitochondrial ultrastructure was observed by transmission electron microscopy.Cellular ATP was detected using chemiluminescence,and oxygen consumption rate(OCR) was examined with Seahorse instrument.RESULTSThe particle size of ZnO-NPs was(331±3)nm. The ZnO-NPs LC50of zebrafish embryos at 48 hpf was 21.81 mg·L-1.The mRNA expressions of noto, ta and tbx6 were reduced after ZnO-NPs 2.5 mg·L-1treatment at 17 hpf.The heart rate of 72 hpf zebrafish was 153 min-1in the ZnO-NPs 5 mg·L-1group,12.6%lower than that in the cell vehicle group (P<0.01),and the number of cardiomyocytes decreased by 15.5%(P<0.01)compared with the cell vehicle group.Reduced cell viability and mitochondrial vacuolation were observed in H9c2 after ZnO-NPs 0.5 mg·L-1exposure.Compared with the cell vehicle group,the cell ATP decreased by 25.7%(P<0.05),and OCR decreased by 27.2%(P<0.01).CONCLUSlONLow-dose ZnO-NPs exposure has effect on the cardiac development of zebrafish,mainly due to reduced heart rate and decreased number of cardiomyocytes.These changes may be related to the decreased expressions of cardiac development-related genes and the impairment of mitochondrial structure and function.
zinc oxide;nanoparticls;zebrafish;cardiac development;toxicity
The project supported by National Natural Science Foundation of China(81573174);Outstanding Youth Fund of Jiangsu Province(SBK2014010296);and Open Project Program of State Key Laboratory of Environmental Chemistry and Ecotoxicology(KF2015-01)
GU Ai-hua,E-mail:aihuagu@njmu.edu.cn
R99
A
1000-3002-(2017)06-0655-06
2017-03-25接受日期:2017-05-10)
(本文编辑:乔虹)
国家自然科学基金(81573174);江苏省杰出青年基金(SBK2014010296);环境化学与生态毒理学国家重点实验室开放课题(KF2015-01)
徐诚,男,博士研究生,主要从事环境危险因素对胚胎发育的危害及机制研究。
顾爱华,E-mail:aihuagu@njmu.edu.cn

