儿童1型糖尿病血清T细胞亚群与胰岛功能的相关性
张改秀,王 蕾,杜 建,胡东阳,张明衬,郭婷婷,张晓盼
(1山西省儿童医院内分泌科,太原 030013;2山西医科大学儿科学教研室;*通讯作者,E-mail:2651024846@qq.com)
儿童1型糖尿病血清T细胞亚群与胰岛功能的相关性
张改秀1*,王 蕾1,杜 建1,胡东阳2,张明衬2,郭婷婷2,张晓盼2
(1山西省儿童医院内分泌科,太原 030013;2山西医科大学儿科学教研室;*通讯作者,E-mail:2651024846@qq.com)
目的 分析1型糖尿病初发患儿外周血T细胞亚群(CD4+、CD8+、CD4+/CD8+)变化特点;探讨1型糖尿病初发患儿外周血T细胞亚群与胰岛功能的关系。 方法 选择2010-05~2013-12山西省儿童医院确诊的T1DM初发患儿43例,25例健康体检儿童为对照组。采用流式细胞技术测定血清CD4+、CD8+、CD4+/CD8+T细胞亚群,并对两组结果进行比较。对T1DM初发患儿T细胞亚群与糖化血红蛋白、C肽(C-P)水平进行相关性分析。 结果 T1DM组患儿外周血CD4+T细胞、CD4+/CD8+T细胞明显高于对照组(P<0.05),CD8+T细胞明显低于对照组,差异有统计学意义(P<0.05)。T1DM患儿外周血CD4+T细胞与HbA1c呈正相关(r=0.261,P<0.05),与C-P呈负相关(r=-0.270,P<0.05);CD8+T细胞与HbA1c无明显相关性(r=-0.156,P>0.05),与C-P水平呈正相关(r=0.162,P<0.05);CD4+/CD8+T细胞与HbA1c无明显相关性(r=0.200,P>0.05),与C-P水平呈负相关(r=-0.243,P<0.05)。 结论 T1DM的发病过程存在T淋巴细胞亚群失衡, CD4+T细胞异常激活、CD8+T细胞缺陷和CD4+/CD8+T细胞比值增高。CD4+及CD4+/CD8+T细胞与C肽呈负相关,CD8+T细胞与C肽呈正相关。
1型糖尿病; T细胞亚群; 胰岛功能; 糖化血红蛋白; C肽
糖尿病(diabetes mellitus,DM)是由于内源性胰岛素绝对或相对缺乏,导致血糖增高而引起的全身慢性代谢性疾病[1]。儿童期常见1型糖尿病(type 1 diabetes,T1DM)。多数学者认为T1DM是在遗传易感性基因的基础上,受到病毒感染等外界环境因素的影响,引起自身免疫功能紊乱,导致胰岛β细胞的损伤和破坏,最终引起胰岛β细胞的功能衰竭而发病[2]。T淋巴细胞对胰岛的浸润和破坏是1型糖尿病发病的中心环节。
本课题采用免疫荧光标记和流式细胞技术测定43例T1DM初发患儿(T1DM组)及25例正常儿童(对照组)血清T细胞亚群。对T1DM初发患儿T细胞亚群的变化与糖化血红蛋白(glycosylated hemoglobin A1c,HbA1c)、空腹胰岛素(Fins)及空腹C肽(C-peptide,C-P)水平进行相关性分析,旨在探讨T1DM初发患儿T细胞亚群的变化特点及与胰岛功能之间的关系。
1 对象和方法
1.1 研究对象
1.1.1 实验组 收集2010-05~2013-12山西省儿童医院确诊的T1DM初发患儿共43例,男19例,女24例,年龄1.5-15岁,平均年龄(7.65±3.87)岁,均参照1999年世界卫生组织(WHO)的糖尿病诊断标准[3],同时依据以下临床特征作出诊断[4]:①起病年龄较小(<20岁);②起病较急,“三多一少”症状明显,可有脱水、循环衰竭或昏迷等酮症酸中毒症状;③空腹血糖≥7.0 mmol/L,餐后2 h血糖或任意血糖≥ 11.1 mmol/L;④C肽反应低下并依赖胰岛素治疗。排除原发性心、肝、脑、肾等疾病或自身免疫性疾病,未使用激素、免疫调节剂及胰岛素治疗。
1.1.2 对照组 选取同期本院体检的健康儿童25例,其中男11例,女14例,年龄1.5-14岁,平均年龄(6.84±3.60)岁。对照组均无糖尿病家族史,糖化血红蛋白及空腹血糖检测排除糖尿病。
1.2 研究方法
1.2.1 临床资料收集 入院时详细记录患儿年龄、性别、病程、身高、体质量、父母文化程度。
1.2.2 生化检查 常规送检空腹血糖、糖化血红蛋白(HbA1c)、C肽(C-P)水平、胰岛素(Fins)。所有血样均在早晨空腹状态下抽取。
1.2.3 外周血T细胞亚群(CD4+,CD8+,CD4+/CD8+)检测 采用美国Beckman Coulter公司FC 500系列流式细胞分析仪及其提供的试剂等进行T细胞亚群的检测。实验方法严格按照试剂盒说明书进行操作。采用 EXPO32v1.2 Analysis 软件分析CD4+T及CD8+T细胞的表达,从 FSC/SSC 双参数散点图中圈出T淋巴细胞群体设门并计数细胞,根据所占T淋巴细胞的百分比得出结果。
1.3 统计学处理
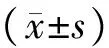
2 结果
2.1 一般情况
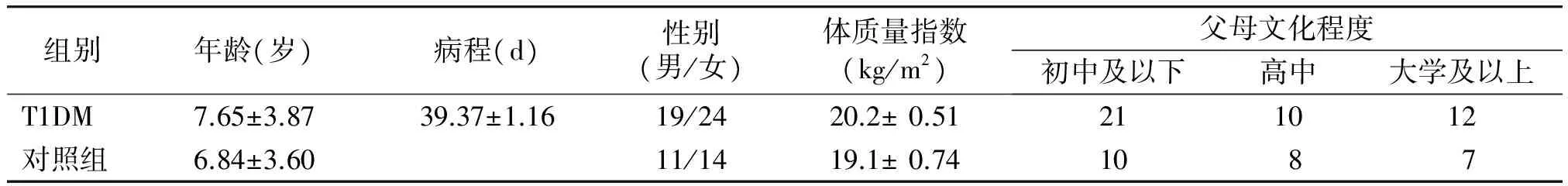
与对照组相比,T1DM组患儿年龄、病程、性别比例、体质量指数等指标差异无统计学意义(P>0.05);患儿父母文化程度亦无统计学意义(P>0.05,见表1),具有可比性。
表1 两组研究对象一般情况比较
Table 1 Comparison of general clinical data between two groups
组别年龄(岁)病程(d)性别(男/女)体质量指数(kg/m2)父母文化程度初中及以下高中大学及以上T1DM7.65±3.8739.37±1.1619/2420.2±0.51211012对照组6.84±3.6011/1419.1±0.741087
2.2 实验组与对照组CD4+T、CD8+T、CD4+/CD8+T细胞比较
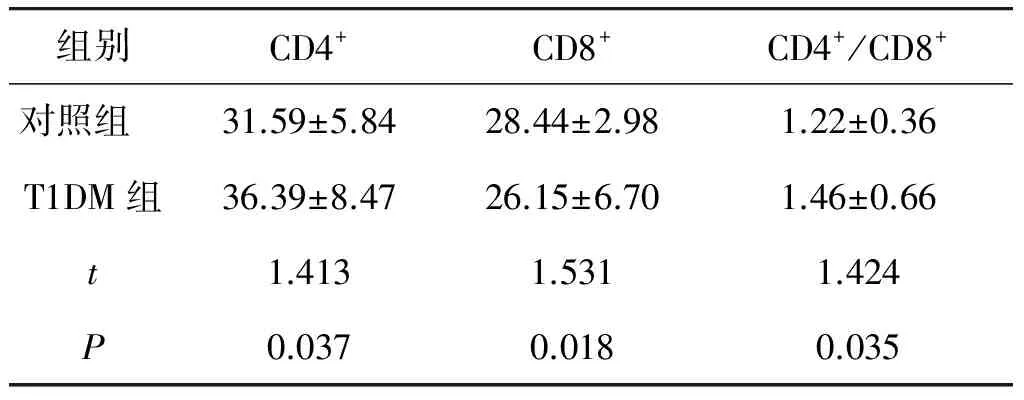
T1DM组CD4+T细胞及CD4+/CD8+T细胞较对照组增高,差异有统计学意义(P<0.05),CD8+T细胞低于对照组,差异有统计学意义(P<0.05,见表2)。
2.3 T1DM组T细胞亚群与胰岛功能的相关性分析
T1DM组患儿CD4+T细胞与HbA1c呈正相关(r=0.261,P<0.05),与C-P呈负相关(r=-0.270,P<0.05);CD8+T细胞与HbA1c无明显相关性(P>0.05),CD8+T细胞与C肽水平呈正相关(r=0.162,P<0.05);CD4+/CD8+T细胞与HbA1c无明显相关性(r=0.200,P>0.05),与C-P水平呈负相关(r=-0.243,P<0.05, 见表3)。
表2 对照组与T1DM组CD4+、CD8+、CD4+/CD8+的比较 (%)
Table 2 Comparison of CD4+, CD8+and CD4+/CD8+between control group and T1DM group (%)
组别CD4+CD8+CD4+/CD8+对照组 31.59±5.8428.44±2.981.22±0.36T1DM组36.39±8.4726.15±6.701.46±0.66t1.4131.5311.424P0.0370.0180.035
表3 CD4+T、CD8+T、CD4+/CD8+T细胞与HbA1c及C肽的相关性分析
Table 3 Correlation analysis of CD4+T, CD8+T and CD4+/CD8+T cells with HbA1c and C peptide

指标C⁃PHbA1crPrPCD4+-0.2700.0260.2610.031CD8+0.1620.108-0.1560.205CD4+/CD8+-0.2430.0460.2000.102
3 讨论
1型糖尿病(T1DM)是自身免疫性疾病,遗传因素和环境因素共同参与发病过程,儿童及青少年发病人数约占DM患者的5%[5]。我国儿童T1DM校正发病率为每年0.59/10万,按全国人口年龄构成的标化发病率为每年0.57/10年,是世界上T1DM发病率最低的国家之一[6]。王克安等[5]对我国儿童T1DM发病率调查结果显示:中国儿童1型糖尿病的发病率在逐年上升;发病率随年龄的增长而增加;发病率在不同地区之间呈现明显的南低北高现象。
T淋巴细胞包括CD4+T细胞和CD8+T细胞两个功能亚群,在T1DM发病过程中发挥十分重要的作用。CD4+细胞是胰岛β细胞早期主要的浸润细胞,Th1/Th2主要通过自身或其他免疫细胞分泌的细胞因子进行自我调节和相互调节,以维持机体免疫平衡[7]。当Th1和Th2两种细胞功能失衡时,主要组织相容性复合物(major histocompatibility complex,MHC)基因编码的Ⅱ类抗原HLA-DR3,DR4与胰岛β细胞抗原相结合,与T细胞表面受体(T cell receptor,TCR)构成“抗原-HLA Ⅱ类抗原-TCR复合物”,激活Th1细胞分泌大量细胞因子,进一步诱导自身反应性T淋巴细胞浸润胰岛,对胰岛β细胞产生毒性作用,从而引起胰岛β细胞的损伤和衰竭[8]。施毕渂[9]对37例T1DM外周血T细胞亚群等分子的表达试验结果提示患者外周血CD4+T细胞数明显增加,CD8+T细胞数明显降低(P<0.01)。邹晓蕾等[10]通过实验发现STZ诱导的T1DM模型小鼠血清CD4+Th1细胞分泌的细胞因子IFN-γ水平明显高于正常对照小鼠,认为T1DM发病过程中存在CD4+Th1细胞优势分化,其产生的细胞因子IFN-γ、TNF-α、IL-2等对胰岛β细胞发挥直接毒性效应。支涤静等[11]研究表明,病程<2年的T1DM患儿IFN-γ水平高于病程>2年者,认为Th细胞的反应与病程密切相关,并随着T1DM病程的进展,残留胰岛β细胞的减少,Th1细胞的表达也趋于稳定。本实验结果显示T1DM初发患儿的外周血CD4+值与正常健康儿童相比,其CD4+T细胞所占百分比明显增加(P<0.01),说明Th1细胞在T1DM发病初期中被异常激活,与文献报道一致。本组病例均为T1DM初发患儿,对于Th1细胞是否随病程发展而趋于稳定,尚不能得出结论。
CD8+T细胞是细胞免疫的主要效应细胞,通过MHC-Ⅰ类限制性的方式识别靶细胞表面的多肽抗原,代表抑制性T细胞(suppressor T cell,Ts)和细胞毒性T细胞(cytotoxic T cell,CTL)[12]。Ts细胞主要抑制CD4+T细胞增殖活化,维持自身免疫耐受;CTL能特异性杀伤靶细胞,在抗病毒感染和抗肿瘤免疫中起到重要作用[13]。有报道表明,CD4+T细胞等通过Fas/FasL通路诱导了胰岛β细胞凋亡的起始,而CD8+T细胞识别胰岛β细胞表面的MHC-I类蛋白后,通过分泌穿孔素、Fas/FasL的相互作用等途径,贯穿于胰岛β细胞凋亡的整个过程[14]。一般认为,Ts细胞减少或失活,引起免疫失衡,进一步诱导Th细胞对胰岛β细胞免疫的损伤作用,促进T1DM的发生和发展;CTL激活并介导对胰岛β细胞的直接杀伤作用,则加速T1DM的发生[15]。乔凌燕等[16]对23例儿童1型糖尿病患儿研究发现,CD8+T淋巴细胞减少,其原因可能是CD8+毒性T淋巴细胞因介导胰岛β细胞的破坏而大量消耗,或免疫功能调节不平衡所致。本研究检测结果显示,T1DM初发患儿的CD8+T细胞所占百分比明显降低(P<0.01),与文献报道一致,CTL参与胰岛β细胞的直接杀伤作用被大量消耗,最终引起CD8+T细胞的减少。
糖化血红蛋白(HbA1c)与血糖水平的高低及持续时间呈正相关,通常可反映DM患者近2-3个月血糖的综合平均浓度,是判断和衡量DM患者长期血糖控制情况的金标准[17]。有研究表明,T1DM初发期CD4+/CD8+比值与HbA1c呈正相关(P<0.05),也有学者将T1DM患儿的IFN-γ、IL-4值与HbA1c进行比较,差异无统计学意义,认为T1DM患儿CD4+T细胞免疫状态与血糖控制程度无相关性[18]。本研究对CD4+、CD8+、CD4+/CD8+与HbA1c水平的相关性进行分析,结果显示CD4+与HbA1c呈正相关(r=0.261,P<0.05),而CD8+、CD4+/CD8+与HbA1c水平无明显相关性。研究表明CD4+T细胞免疫活性增强促进了患儿血糖水平的升高,而CD8+T细胞的免疫状态与患儿血糖水平无明显相关性。
C-P是反应胰岛β细胞功能的有力指标[19]。本研究显示CD8+T细胞与C-P水平呈正相关,CD4+、CD4+/CD8+T细胞与C-P水平呈负相关。C-P反映胰岛β细胞的储备和分泌功能,C-P水平越低,胰岛β细胞的储备将越少,分泌功能也越弱,而CD8+T细胞的Ts及CTL以自身消耗为代价介导胰岛β细胞的凋亡过程,CD8+T细胞的减低间接反映了胰岛β细胞的进一步减少。因此,我们认为CD8+与C肽水平在一定程度上呈正相关性。CD4+Th1细胞分泌大量细胞因子,可直接促进胰岛β细胞凋亡,并促进CD8+T细胞分化成熟,介导对胰岛β细胞的损伤作用,故CD4+及CD4+/CD8+T与C-P水平呈负相关。
综上所述,T1DM患儿血清T细胞亚群的变化及其与胰岛功能的相关性涉及内容广泛且复杂。T淋巴细胞及细胞因子具有多效性、网络性的特点,一种细胞因子不是单一起作用,而与其他细胞因子相互联系起到协同或拮抗作用。深入研究每一种细胞、细胞因子及它们相互作用的机制,进一步揭示T细胞与胰岛功能的关系,将为明确1型糖尿病的免疫学机制,为T1DM的治疗提供新的思路和策略。
[1] 李蕴,赵文明. 1型糖尿病发病及防治的免疫学研究进展[J]. 微生物学免疫学进展, 2004, 32(1):43-47.
[2] 李敏,宋陆军,秦新裕. 1型糖尿病(T1DM)的细胞免疫学发病机制的研究进展[J]. 复旦学报(医学版),2012,39(5):525-530.
[3] World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complication: report of a WHO consultation[DB/DL]. WHO, 1999. [2011-11-26]. http://www.staff.ncl.ac.uk/philip.home/who dmg.pdf.
[4] 中华医学会糖尿病分会.中国1型糖尿病诊治指南(节选)[J]. 糖尿病天地·临床:下旬,2013,7(3):108-114.
[5] 王克安,李天磷,李新华,等. 中国儿童1型糖尿病发病率的研究[J]. 中华内分泌代谢杂志,1999,15(1):3-7.
[6] Knip M,Siljander H. Autoimmune mechanisms in type 1 diabetes[J]. Autoimmun Rev,2008,7(7):550-557.
[7] 唐晴琴,秦保东,仲人前.microRNA调控CD4+T淋巴细胞分化与成熟的机制研究进展[J].细胞与分子免疫学杂志,2016,32(1):125-128.
[8] Noble J A,Erlich H A. Genetics of type 1 diabetes[J]. Cold Spring Harb Perspect Med,2012,2(l):a007732.
[9] 施毕渂.1型糖尿病免疫病理机制的探讨[D].苏州:苏州大学,2002.
[10] 邹晓蕾,向明. CD4+/CD8+T细胞分型及T-bet/GATA3基因表达与1型糖尿病相关性研究[D].武汉:华中科技大学,2008.
[11] 支涤静,王晓川,沈水仙,等.儿童1型糖尿病Th1/Th2免疫应答状况研究[J].中华儿科杂志,2001,39(3):148-150.
[12] Umeshappa CS,Huang H,Xie Y,etal. CD4+Th-APC with acquired peptide/MHC class I and II complexes stimulate type 1 helper CD4+and central memory CD8+T cell responses[J]. J Immunol,2009,182(1):193-206.
[13] Haseda F,Imagawa A,Murase-Mishiba Y,etal. Low CTLA-4 expression in CD4+helper T-cells in patients with fulminant type 1 diabetes[J]. Immunol Lett,2011,139(1-2):80-86.
[14] Hamilton-Williams EE,Palmer SE,Charlton B,etal. Beta cell MHC class Ⅰ is a late requirement for diabetes[J].Proc Natl Acad Sci U S A,2003,100(11):6688-6693.
[15] Mallone R,van Endert P. T cells in the pathogenesis of type 1 diabetes[J]. Curr Diab Rep,2008,8(2):101-106.
[16] 乔凌燕,陈志红,田飞,等.23例1型糖尿病初发患儿免疫学改变与胰岛β细胞功能的关系[J].现代生物医学进展,2011,5(11) :922-925.
[17] 覃彦平.糖化血红蛋白检测及临床应用研究进展[J].白求恩军医学院学报,2011,9(1):48-49.
[18] 王学通,刘礼乐,蔡亦斌. 糖化血红蛋白在糖尿病诊治中的应用研究[J].当代医学,2012,18(12):16-17.
[19] 缪海韬,张娟娟,顾彬,等.年轻1型糖尿病患者残余β细胞功能的预测[J].中华内分泌代谢杂志, 2016, 32(9):728-733.
Relationship between the serum levels of T cell subgroup and pancreatic islet function in children with type 1 diabetes
ZHANG Gaixiu1*, WANG Lei1, DU Jian1,HU Dongyang2, ZHANG Mingchen2,GUO Tingting2,ZHANG Xiaopan2
(1DepartmentofEndocrinology,Children’sHospitalofShanxiProvince,Taiyuan030013,China;2DepartmentofPediatrics,ShanxiMedicalUniversity;*Correspondingauthor,E-mail:2651024846@qq.com)
ObjectiveTo investigate the changes of T lymphocyte subsets (CD4+, CD8+, CD4+/CD8+) in peripheral blood of untreated children with type 1 diabetes mellitus, and to explore its relationships with islet function.MethodsForty-three children with T1DM in Shanxi Children’s Hospital from May 2010 to December 2013 were selected as experimental group, and 25 healthy children were chosen as control group. The expression of CD4+, CD8+, and CD4+/CD8+T cell subsets in two groups was measured by flow cytometry, and the results were compared. Correlation between T cell subsets and glycated hemoglobin, C peptide levels in T1DM children was analyzed.ResultsThe levels of CD4+T cells and CD4+/CD8+T cells in peripheral blood were significantly higher in T1DM group than in control group (t=1.413, 1.424,P<0.05), while the level of CD8+T cells was significantly lower(t=1.531,P<0.05). The level of CD4+T cells in peripheral blood was positively correlated with HbA1c (r=0.261,P<0.05), but negatively correlated with C-P (r=-0.270,P<0.05). The level of CD8+T cells was not significantly correlated with HbA1c (r=-0.156,P>0.05), but positively correlated with C-P (r=0.162,P<0.05). The level of CD4+/CD8+T cells was not significantly correlated with HbA1c(r=0.200,P>0.05), but negatively correlated with C-P(r=-0.243,P<0.05).ConclusionT lymphocyte subsets imbalance,such as abnormal activation of CD4+T cells, CD8+T cell deficiency and the increase of CD4+/CD8+T cell, is involved in the process of the onset of T1DM. CD4+and CD4+/CD8+T cells are negatively correlated with C-P, and CD8+T cells are positively correlated with C-P.
type 1 diabetes; T cell subset; pancreatic islet function; glycosylated hemoglobin; C peptide
张改秀,女,1966-05生,博士,副主任医师, E-mail: 2651024846@qq.com
2017-03-06
R587.1
A
1007-6611(2017)06-0615-04
10.13753/j.issn.1007-6611.2017.06.023

