FOXP1在结直肠癌中的表达及意义
郑一鸣,郭建昇
(山西医科大学第一临床医学院普外科,太原 030001;*通讯作者,E-mail:1713789732@qq.com)
FOXP1在结直肠癌中的表达及意义
郑一鸣,郭建昇*
(山西医科大学第一临床医学院普外科,太原 030001;*通讯作者,E-mail:1713789732@qq.com)
目的 探讨FOXP1(fork-head box protein 1)蛋白在结直肠癌中的表达及意义。 方法 采用免疫组化染色方法检测120例结直肠癌及20例癌旁组织中FOXP1蛋白的表达水平。 结果 FOXP1蛋白在结直肠癌中表达率为68.3%(82/120),显著高于其在癌旁组织的表达[10.0%(2/20),P<0.05];FOXP1蛋白表达率分别在淋巴结转移更多、肿瘤分化程度更低、TNM分期更高的结直肠癌分组阳性率更高,差异有统计学意义(P<0.05);FOXP1蛋白表达率在不同性别、年龄、肿瘤大小和肿瘤部位的结直肠癌分组间差异无统计学意义(P>0.05)。 结论 FOXP1蛋白表达与结直肠癌发生发展密切相关,FOXP1蛋白高表达提示肿瘤恶性程度高,预后差。
FOXP1蛋白; 结直肠癌; 免疫组化
结直肠癌是我国最常见的消化道恶性肿瘤之一,每年结直肠癌新增及死亡病例均呈上升趋势[1]。结直肠癌患者治疗方式仍以手术为主,术后辅以化疗、靶向药物治疗,但患者术后复发率较高,每年仍有60余万人死于该病[2]。FOXP1(叉头框蛋白)是FOXP亚家族成员,在免疫B细胞不同分化阶段均出现表达,参与机体的免疫调控[3]。有学者研究证实FOXP1蛋白与弥漫大B细胞淋巴瘤[4]及乳腺癌[5]发生密切相关,其在结直肠癌中研究未见报道。本实验通过免疫组织化学方法,研究120例CRC患者肿瘤组织中FOXP1蛋白表达水平,探讨其与结直肠癌发生发展及预后的相关性。
1 材料与方法
1.1 组织标本
随访2008-04~2012-04在山西医科大学第一医院普外科住院的150名结直肠癌(CRC)患者病例,收集其中120例Ⅰ-Ⅳ期患者病例资料。纳入标准:患者入院前未行任何抗肿瘤治疗,且为首发肿瘤排除其他肿瘤病史。男58例,女62例;年龄40-80岁,中位年龄60岁。结肠癌77例,直肠癌43例。根据2000年WHO消化系肿瘤分类标准,高分化腺癌25例,中分化腺癌62例,低分化腺癌33例。TNM分期采用UICC(国际抗癌联盟)2009年发布的第7版分期统一标准。选取20例癌旁正常组织,所有患者入院前均未接受任何抗肿瘤治疗,无其他恶性肿瘤病史。
1.2 试剂
浓缩型兔抗人FOXP1多克隆抗体购自武汉博士德公司。
1.3 免疫组织化学
所有石蜡标本,切片厚度4 μm。采用EnVision法检测FOXP1的表达情况。加入兔抗人FOXP1多克隆抗体(浓度1 ∶100)。4 ℃冰箱过夜,滴加50 μl的辣根过氧化物酶HRP标记的二抗,DAB显色。
结果判定:FOXP1蛋白表达定位于胞核内,胞质或胞膜呈棕黄色或棕褐色颗粒为阳性信号。按染色强度进行分类及评分。在40倍镜下观察着色强度:细胞未着色(0分)、淡黄色(1分)、棕黄色(2分)、棕褐色(3分);在400倍镜下判定阳性细胞百分比率:随机观察10个视野,阳性细胞百分比率为视野下阳性细胞数占所有瘤细胞的比值,取平均值,<5%(0分)、5%-25%(1分)、>25%-50%(2分)、>50%-75%(3分)、>75%(4分)。将着色强度与阳性细胞百分率的得分相乘,乘积为染色指数(SI)。SI>4为高度表达,≤4为低度表达。染色结果由2名高年资病理医生判定。
1.4 统计学分析
采用 SPSS 19.0进行统计数据,计数资料数据间比较采用χ2检验和Fisher确切概率法进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 FOXP1蛋白在癌旁和肿瘤组织中的表达
FOXP1蛋白在结直肠癌中的表达明显高于癌旁组织(见图1),结直肠癌组织的高表达阳性表达率为68.3%,癌旁组织为10.0%,差异有统计学意义(P<0.05,见表1)。
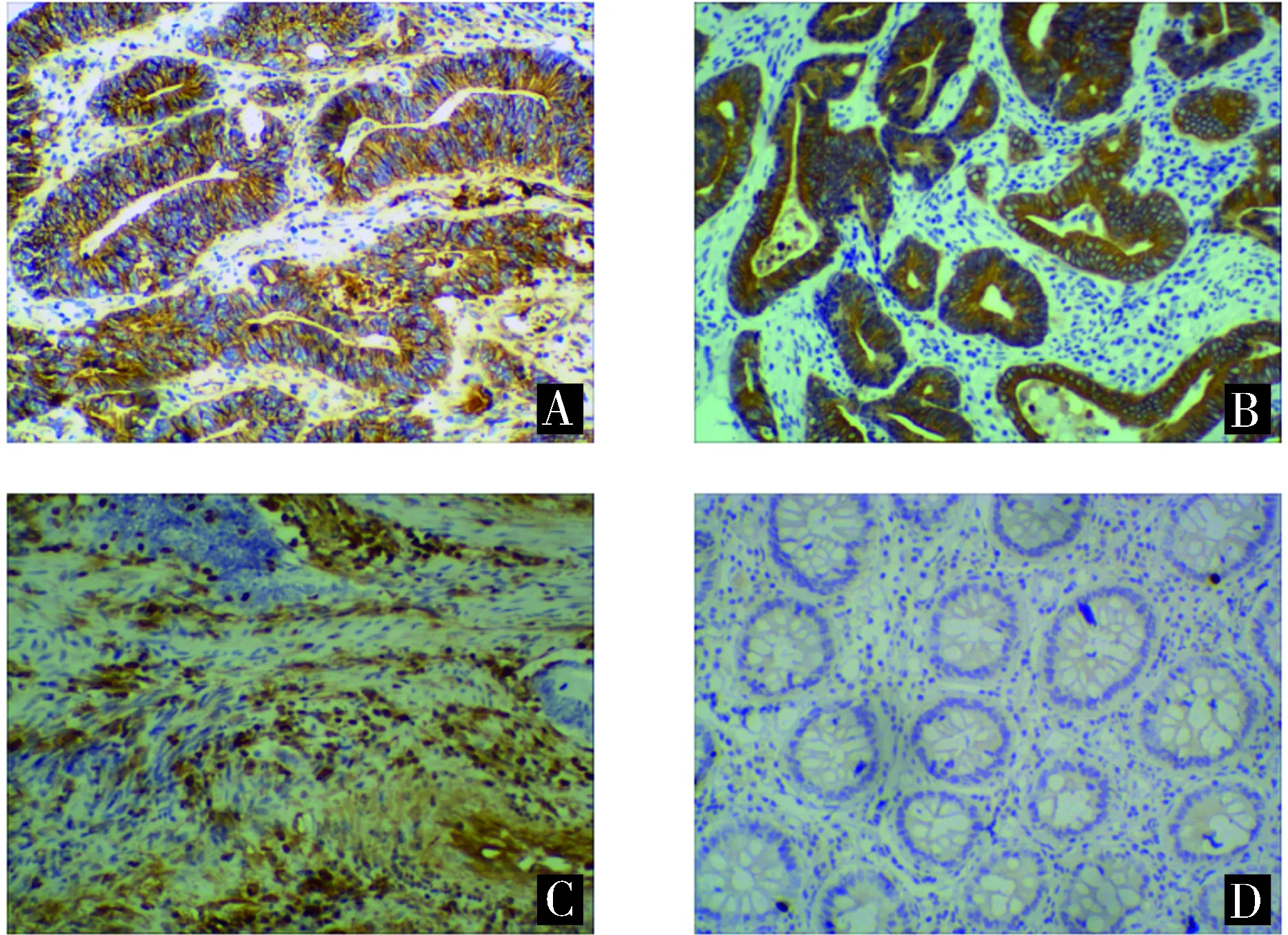
A.高分化结直肠腺癌组织;B.中分化结直肠腺癌组织;C.低分化结直肠腺癌组织;D.癌旁组织(FOXP1低表达)图1 FOXP1蛋白免疫组化结果在结直肠癌中的表达 (EnVision,×100)Figure 1 Expression of FOXP1 in colorectal cancer (EnVision,×100)
表1 FOXP1蛋白在组织中的表达 (例)
Table 1 Expression of FOXP1 in colorectal tissues (cases)
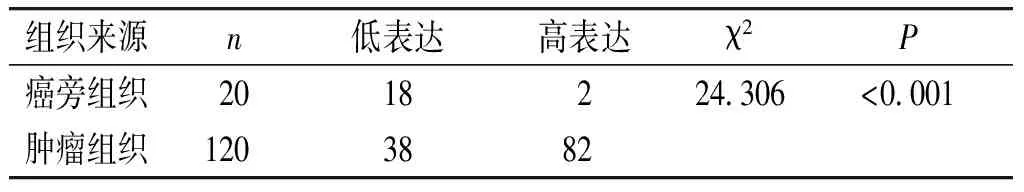
组织来源n低表达高表达χ2P癌旁组织2018224306<0001肿瘤组织1203882
2.2 FOXP1蛋白表达情况与临床病理特征的关系
120例CRC患者中,在男性CRC病例中FOXP1蛋白高表达为70.7%,低表达29.3%;女性CRC患者中FOXP1蛋白高表达率为66.1%,低表达率为33.9%,不同性别之间比较差异无统计学意义(P>0.05)。>55岁与≤55岁年龄组间FOXP1蛋白高表达率差异无统计学意义(P>0.05)。120例CRC中FOXP1蛋白在结、直肠高表达和低表达差异无统计学差异(P>0.05,见表2)。
120例CRC患者中,高分化腺癌FOXP1蛋白高表达率低于中分化、低分化腺癌,差异有统计学意义(P<0.05)。不同淋巴结转移组间FOXP1蛋白高表达率差异亦有统计学意义(P<0.05)。FOXP1蛋白高表达与CRC的TNM分期亦存在密切关系,Ⅰ+Ⅱ期与Ⅲ+Ⅳ期FOXP1蛋白高表达差异有统计学意义(P<0.05)。
表2 FOXP1蛋白表达情况与临床病理特征的关系
Table 2 Comparison of the expression of FOXP1 in colorectal cancer patients with different clinicopathologic parameters
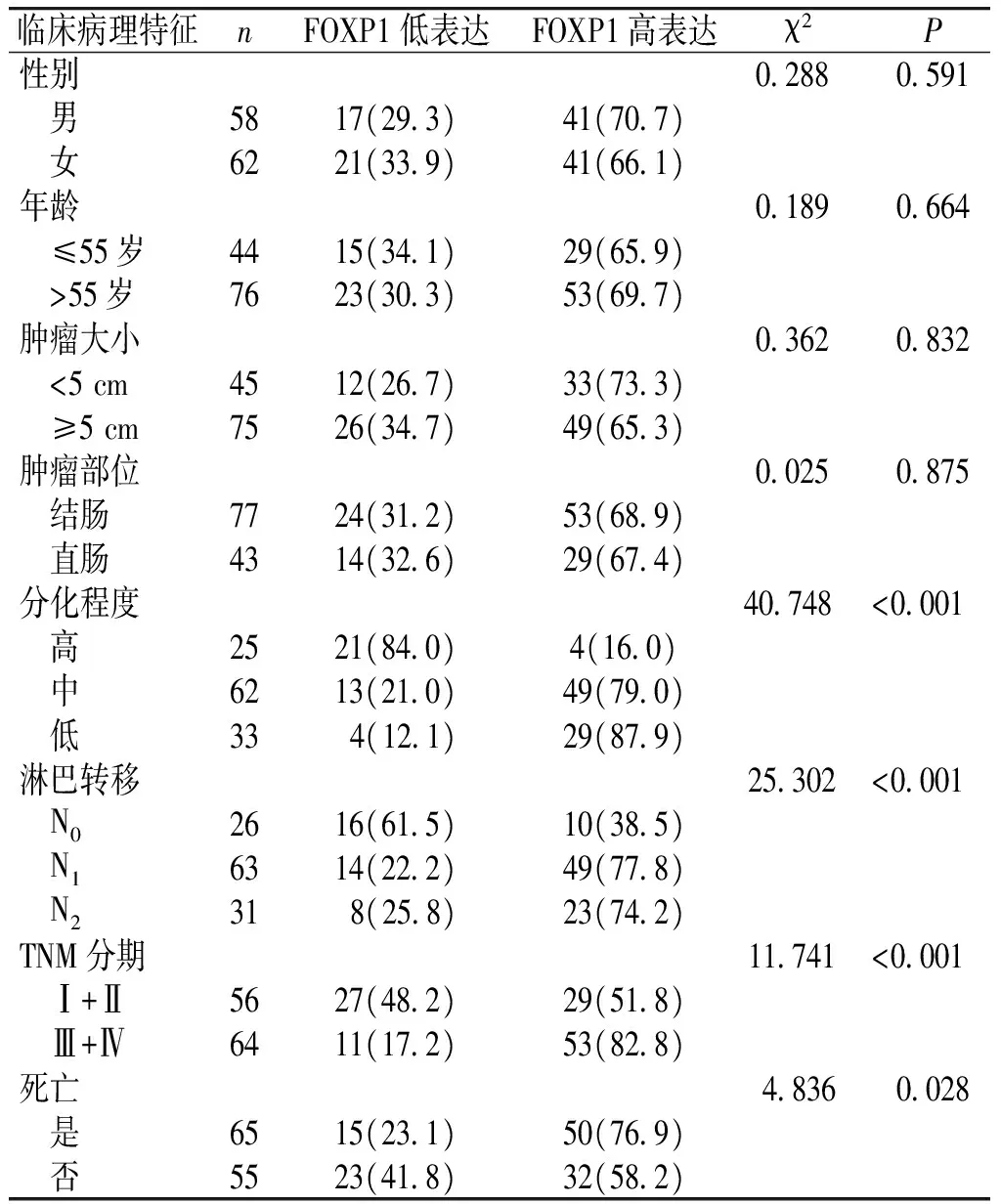
临床病理特征nFOXP1低表达FOXP1高表达χ2 P性别0288 0591 男5817(293)41(707) 女6221(339)41(661)年龄0189 0664 ≤55岁4415(341)29(659) >55岁7623(303)53(697)肿瘤大小0362 0832 <5cm4512(267)33(733) ≥5cm7526(347)49(653)肿瘤部位0025 0875 结肠7724(312)53(689) 直肠4314(326)29(674)分化程度40748<0001 高2521(840)4(160) 中6213(210)49(790) 低334(121)29(879)淋巴转移25302<0001 N02616(615)10(385) N16314(222)49(778) N2318(258)23(742)TNM分期11741<0001 Ⅰ+Ⅱ5627(482)29(518) Ⅲ+Ⅳ6411(172)53(828)死亡4836 0028 是6515(231)50(769) 否5523(418)32(582)
3 讨论
在我国,结直肠癌患者发病率和死亡人数逐年上升,目前临床上以手术治疗为主要手段,术后辅助化疗、分子靶向药物等多模式参与治疗以提高患者生存率。患者术后复发率及生存率个体差异较大,可能与机体免疫功能不同有关[6]。 FOXP1蛋白是FOXP亚家族的转录因子成员,其家族成员庞大,生理功能尚不完全明确。有研究表明FOXP1蛋白与转录抑制、B细胞发育的转录调节有关,从而与机体的免疫功能密切相关[7-9]。还有研究显示FOXP1蛋白通过多种信号转导通路在多种癌症组织中调控机体细胞分化、分裂、迁移以及代谢等[10-12]。
张凤梅等[13]通过免疫组化SP法检测FOXP1在正常膀胱黏膜、低分化膀胱癌组织中的表达,证实FOXP1在低分化膀胱癌中高表达,提示FOXP1蛋白可能发挥致癌作用促进膀胱癌的发生与发展。张亚楠等[14]收集40例弥漫性大B细胞淋巴瘤,通过免疫组化方法检测FOXP1蛋白的阳性表达率为50%,FOXP1阳性表达者的中位无病生存期(PFS)和中位总生存期(OS)较阴性表达者缩短,证实FOXP1高表达于non-GCB型DLBCL,且可能是DLBCL的一个独立预后指标,提示预后不良。本研究采用免疫组化Envision法检测FOXP1蛋白在CRC组织及癌旁正常组织的表达情况,结果显示FOXP1蛋白在CRC组织高表达率明显高于癌旁组织,提示FOXP1蛋白可能与CRC的发生进展有关。癌旁组织为无异型细胞组织,其免疫微环境与肿瘤组织明显不同。FOXP1蛋白作为重要的免疫调控因子在细胞异型性明显的肿瘤组织中高表达可能因为肿瘤细胞微环境刺激免疫细胞表达的上调所致。研究发现在临床分期Ⅲ期+Ⅳ期CRC患者比Ⅰ期+Ⅱ期患者FOXP1蛋白的高表达率更高,在死亡组比非死亡组间高表达率更高,淋巴结转移N1、N2比N0高表达率更显著,提示FOXP1蛋白可能与CRC的恶性程度及预后不良有关。结直肠癌随着临床分期越高,恶性程度亦明显增高,可能趋化更多的免疫细胞进入癌组织,导致FOXP1蛋白的更高表达。
张小伟等[15]收集60例乳腺癌手术标本及癌旁乳腺组织60例,通过免疫组化方法检测FOXP1蛋白在乳腺癌的高表达,与乳腺癌的临床分期、组织学分级、雌激素受体 (ER)表达显著相关。乳腺癌为激素依赖性肿瘤,FOXP1的表达与激素受体状态(包括雌激素受体α和孕激素受体)呈正相关。FOXP1通过调节雌激素信号传导在乳腺癌细胞的增殖中起重要作用,FOXP1的免疫反应性可能与临床乳腺癌的雌激素依赖性相关,这可能揭示了用他莫昔芬治疗的患者有利的预后。以上研究可能提示FOXP1蛋白与多种肿瘤的发生进展密切相关,FOXP1蛋白检测可能对结直肠癌(CRC)患者预后指导存在潜在价值,可以在今后的治疗措施中开发新的免疫干预途径。
[1] Korac P,Peran IA.FOXP1 expression in monoclonal gammopathy of undetermined significance and multiple myeloma[J].Pathol Int,2009,59(5):354-358.
[2] Wang B,Lin D,Li C,etal.Multiple domains define the expression and regulatory properties of Foxp1 forkhead transcriptional repressors[J].J Biol Chemil,2003,278(27):24259-24267.
[3] Yu BH,Zhou XY,Li BZ,etal.FOXP1 expression and its clinicopathologic significance in nodal and extranodal diffuse large B-cell lymphoma[J].Ann Hematol,2011,90(6):701-708.
[4] Barrans SL,Fenton JA,Banham A,etal.Strong expression of FOXP1 identifies a distinct subset of diffuse large B-cell lymphoma (DLBCL) patients with poor outcome[J].Blood,2004,104(9):2933-2935.
[5] Halacli SO,Dogan AL.FOXP1 regulation via the PI3K/Akt/p70S6K signaling pathway in breast cancer cells[J].Oncol Lett,2015,9(3):1482-1488.
[6] Ling X,Marini F,Konopleva M,etal.Mesenchymal stem cells overexpressing IFN-β inhibit breast cancer growth and metastases through Stat3 signaling in a syngeneic tumor model[J].ICMS,2010,3(1):83-95.
[7] Van KM,Grüneberg LJ,Mokry M,etal.FOXP1 directly represses transcription of proapoptotic genes and cooperates with NF-κB to promote survival of human B cells[J].Blood,2014,124(23):3431-3440.
[8] Sollis E,Graham SA,Vino A,etal.Identification and functional characterization of de novo FOXP1 variants provides novel insights into the etiology of neurodevelopmental disorder[J].Hum Mol Genet,2016,25(3):119-125.
[9] Spaeth JM,Hunter CS,Bonatakis L,etal.The FOXP1,FOXP2 and FOXP4 transcription factors are required for islet alpha cell proliferation and function in mice[J].Diabetologia,2015,58(8):1836-1844.
[10] Takayama KI,Suzuki T,Tsutsumi S,etal.Integrative analysis of FOXP1 function reveals a tumor-suppressive effect in prostate cancer[J].Mol Endocrinol,2014,28(12):2012-2024.
[11] Gomez GG,Volinia S,Croce CM,etal.Suppression of MicroRNA-9 by mutant EGFR signaling upregulates FOXP1 to enhance glioblastoma tumorigenicity[J].Cancer Res,2014,74(5):1429-1439.
[12] Hu Z,Zhu L,Tan M,etal.The expression and correlation between the transcription factor FOXP1 and estrogen receptors in epithelial ovarian cancer[J].Biochimie,2015,109:42-48.
[13] 张凤梅,李胜水,许华,等.低分化前列腺癌和膀胱癌中FOXP1的表达[J].临床与实验病理学杂志,2016,32(3):326-328.
[14] 张亚楠,刘汉锋.FOXP1蛋白在弥漫性大B细胞淋巴瘤中的表达及预后意义[J].重庆医学,2015,44(17):2368-2370.
[15] 张小伟,吴丹丹,徐婷婷.叉头框蛋白P1在乳腺癌中的表达及其临床意义[J].中华实验外科杂志,2015,32(10):2447-2448.
Expression and implication of FOXP1 in human colorectal cancer
ZHENG Yiming,GUO Jiansheng*
(DepartmentofGeneralSurgery,FirstClinicalMedicalCollege,ShanxiMedicalUniversity,Taiyuan030001,China;*Correspondingauthor,E-mail:1713789732@qq.com)
ObjectiveTo investigate the expression of FOXP1 in human colorectal cancer and its significance.MethodsExpression of FOXP1 was detected with immunohistochemistry assay in 20 cases of cancer adjacent tissues and 120 cases of colorectal cancer tissues.ResultsThe positivity rate of FOXP1 protein expression in human colorectal cancer tissues was significantly higher than that of cancer adjacent tissues(68.3%vs10.0%,P<0.05).The expression of FOXP1 in colorectal cancer was higher in the more lymph node metastasis,the poorer tumor differentiation and the higher TNM staging colorectal cancer tissues(P<0.05),and there was no significant difference between patients with different sex,age,tumor size and tumor location(P>0.05).ConclusionThe expression of FOXP1 protein is closely related to the occurrence and development of colorectal cancer.The high expression of FOXP1 protein may predict a high degree of malignancy and poor prognosis.
FOXP1; colorectal cancer; immunohistochemistry
郑一鸣,男,1987-07生,在读硕士,E-mail:297198478@qq.com
2017-03-02
R735.3
A
1007-6611(2017)06-0602-03
10.13753/j.issn.1007-6611.2017.06.020

