FAM83B的表达与食管鳞癌临床病理特征及预后的相关性
李泓漪,程彩霞,翟元芳,崔鹤洋,毕炀辉,马燕春,杨健,孔鹏洲*
(1山西医科大学转化医学研究中心,太原 030001;2山西医科大学第一医院病理科;3山西医科大学基础医学院;*通讯作者,E-mail:kongpzh@163.com)
FAM83B的表达与食管鳞癌临床病理特征及预后的相关性
李泓漪1,程彩霞2,翟元芳3,崔鹤洋3,毕炀辉3,马燕春1,杨健1,孔鹏洲1*
(1山西医科大学转化医学研究中心,太原 030001;2山西医科大学第一医院病理科;3山西医科大学基础医学院;*通讯作者,E-mail:kongpzh@163.com)
目的 探讨FAM83B蛋白表达与食管鳞癌临床病理特征和预后的关系。 方法 采用组织芯片和免疫组织化学法检测不同恶性程度食管鳞癌组织中和70例患者食管鳞癌及对应癌旁组织中FAM83B的表达;应用SPSS软件分析食管鳞癌组织中FAM83B的表达水平及其与临床病理特征、预后的相关性。 结果 FAM83B主要表达在食管鳞癌细胞的胞质中;FAM83B在食管鳞癌组织中的表达量约为其癌旁正常组织1.5倍。FAM83B表达与患者的年龄、肿瘤的浸润深度相关(P<0.05);单因素生存分析显示,当食管鳞癌患者年龄小于60岁或者患者TNM分期为Stage Ⅰ阶段时,FAM83B的表达量均与患者的生存时间呈负相关(P<0.05)。 结论 FAM83B可能参与食管鳞癌的发生、发展和浸润,FAM83B的表达水平可能成为食管鳞癌预后强有力的预测因子。
食管鳞癌; FAM83B; 组织芯片; 免疫组织化学; 预后
食管癌是全球第八大癌症,其致死率世界排名第6位[1-3]。食管鳞癌主要发生在亚洲地区,同时也是我国食管癌主要的病理学类型,占到80%以上[2-4]。由于早期缺乏特异症状导致诊断不易,就诊时70%-80%的患者已经进入临床中晚期,5年总生存率在15%-25%之间[3],Ⅲ期患者3年生存率仅10%左右,Ⅳ期患者3年生存率在5%左右[5]。因此亟需对食管癌癌变机制、肿瘤标志物、治疗靶点等进行深入研究。
本课题组前期通过全基因组学测序发现了大量与食管鳞癌相关的遗传变异[6,7],以及一系列与病理特征和临床特征相关的基因,可以作为潜在的肿瘤分子标志物,并可对患者的预后和治疗反应做预测[8,9],FAM83B基因即是其中发生遗传变异的基因之一。
FAM83B基因被认为是一种能够促进永生化人乳腺上皮细胞转化的原癌基因[10]。有研究表明,FAM83B在多种人类肿瘤中不仅表达水平显著提高,并且表现出了原癌基因的作用[11,12]。来自CCLE (cancer cell line encyclopedia)数据库的数据也同样表明FAM83B的表达水平在多种人类肿瘤组织中有显著增高,且在食管癌组织中的增高最为明显。然而,FAM83B的表达与食管鳞癌发生发展的关系尚无研究报道。本研究用免疫组化的方法对石蜡包埋组织样本和组织芯片进行检测,通过检测正常食管组织、非典型增生、原位癌以及G1-G3级食管鳞癌中FAM83B的表达,分析FAM83B的表达与食管鳞癌临床病理特征的关系,探讨FMA83B作为食管鳞癌的诊断和预后预测的分子标志物的价值。
1 材料与方法
1.1 样本来源
本研究所用的食管鳞癌组织芯片包括两部分:一部分为商品化组织芯片,包含正常食管黏膜组织10例、非典型增生10例、原位癌13例以及根据肿瘤的恶性程度分为三级(G1-G3)的食管浸润鳞癌39例(G1、G2、G3各13例),购自上海芯超生物科技有限公司。另一部分为实验室自制的验证病例组织芯片,验证病例选取来自山西医科大学第一医院和河南省肿瘤医院的食管鳞癌术后肿瘤组织及其癌旁正常组织的石蜡标本作为研究对象,其中食管鳞癌组织70例,对应癌旁组织70例(经HE染色证实均无癌细胞),所有病例经病理确诊均为鳞癌,所有患者的肿瘤样本至少有40%-50% 的肿瘤细胞的含量,依据美国癌症联合委员会癌症分期标准(第七版)进行分期。70例食管鳞癌患者均为男性,平均年龄为59岁(44-78岁)。所有病例术前均未进行放化疗等治疗。
1.2 伦理声明
本研究经由山西医科大学伦理委员会(批准号2009029)和河南省肿瘤医院伦理委员会(批准号2009xjs12)批准。所有获得的样本在治疗前均依据当地伦理委员会的指导以书面知情同意书的形式告知所有参与者。
1.3 主要试剂
兔抗人FAM83B抗体(艾博抗上海贸易有限公司,Abcam上海办事处),抗体封闭用正常山羊血清(北京索莱宝科技有限公司),辣根过氧化物酶标记的二抗(羊抗兔)(福州迈新生物技术开发有限公司),DAB 显色试剂盒(北京中杉金桥生物技术有限公司)。
1.4 验证病例组织芯片的制备
组织芯片蜡块制备仪制备10×6孔的组织芯片受体蜡块,各孔间距1 mm、内径2.2 mm。调取石蜡标本对应HE染色玻片,选取病变典型部位并在供体石蜡标本上做好相应标记,打孔套针穿取直径为2.2 mm的蜡块组织芯放入受体蜡块孔内,每个受体蜡块左上角留2个空白孔用于定位。对制成的芯片蜡块常规4 μm厚连续切片,敷贴在3-氨丙基-3-甲氧基硅烷处理的载玻片上,70 ℃过夜。
1.5 蛋白印迹杂交试验检测新鲜组织中FAM83B的表达情况
将3对验证病例的新鲜组织从-80 ℃低温冰箱中取出放入无菌研磨器内,加入适量含有终浓度为1 mmol/L PMSF的RIPA裂解液,冰上充分研磨,静置1 h,于1.5 ml EP管中 4 ℃、14 000 r/min离心15 min,取上清置于另一1.5 ml EP管中,按比例加入上样缓冲液,煮沸10 min。20 μg处理后的蛋白样品进行SDS-PAGE电泳并电转移至PVDF膜,5 g/L脱脂奶封闭1 h,分别与适当稀释后的一抗4 ℃过夜孵育,PBST 洗膜,然后与1 ∶4 000二抗室温孵育1 h,PBST 洗膜后加入发光底物孵育1 min,暗室中用X线片曝光、显影、定影。
1.6 免疫组织化学检测组织芯片中FAM83B的表达量
以PBS作阴性对照。标本经二甲苯脱蜡,梯度乙醇水化,3%H2O2消除内源性过氧化物酶,PBS漂洗3遍,柠檬酸盐修复液高压修复,山羊血清37 ℃封闭20 min,滴加一抗(FAM83B抗体浓度1 ∶100)4 ℃过夜,PBS漂洗3次,加入HRP标记羊抗鼠/兔二抗,37 ℃孵育15 min,PBS漂洗3次,DAB显色液显色,苏木素复染3 min,盐酸乙醇分化,脱水后封片保存。
以上免疫组化方法同时适用于商品化组织芯片和验证病例蜡块组织芯片。
1.7 结果判断标准
每张切片高倍镜(×100)下随机选取5个视野,通过Aperio Cytoplasma 2.0软件进行分析FAM83B的表达水平(用H值表示),FAM83B的表达量越高,H值越大。
1.8 统计学分析
数据分析采用SPSS 17.0统计软件进行。FAM83B表达量的最终数据以均数±标准差表示。采用配对t检验分析食管鳞癌和其癌旁正常组织之间的差异。对两组以上数据进行单因素方差分析。χ2检验用于分析FAM83B的表达与患者临床病理因素之间的关系。生存分析采用Kaplan-Meier生存分析并进行Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 FAM83B在不同分级食管鳞癌组织中的表达和定位
利用FAM83B多克隆抗体对商品化的食管鳞癌组织芯片进行免疫组化检测,结果所示,无论从正常食管组织、非典型增生、原位癌还是G1到G3级食管鳞癌组织,FAM83B的阳性染色均主要出现在食管正常/鳞癌组织的细胞质中(见图1),说明FAM83B主要在细胞胞质中表达。
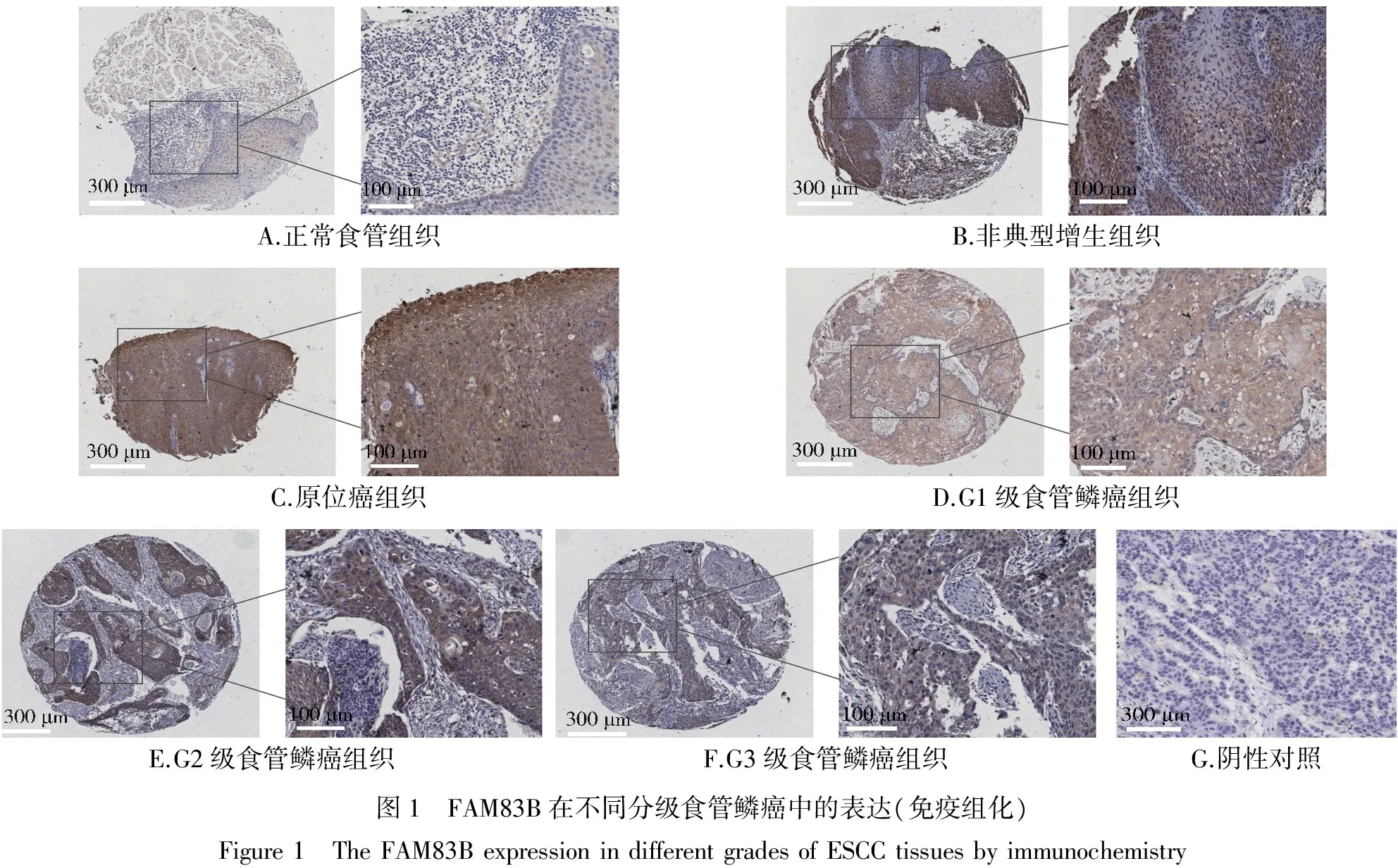
A.正常食管组织B.非典型增生组织C.原位癌组织D.G1级食管鳞癌组织E.G2级食管鳞癌组织F.G3级食管鳞癌组织G.阴性对照图1 FAM83B在不同分级食管鳞癌中的表达(免疫组化)Figure1 TheFAM83BexpressionindifferentgradesofESCCtissuesbyimmunochemistry
2.2 不同分级食管鳞癌组织中FMA83B表达差异
通过Aperio Cytoplasma 2.0软件对FAM83B的免疫组化结果进行定量分析。与正常食管组织相比,非典型性增生、原位癌以及G1-G3级食管浸润鳞癌组织中FAM83B的表达水平均有显著性增高(P<0.01或P<0.05,见图2)。在G1-G3三个级别的食管鳞癌组织之间,FAM83B的表达水平差异没有统计学意义。
2.3 FAM83B在食管鳞癌及其癌旁正常组织中的表达
为了再次确认FAM83B的表达水平,对所收集的70例配对的石蜡包埋组织样本进行了免疫组化检测,并在其中选取了3对病例的新鲜组织,提取蛋白后进行蛋白印迹杂交试验。结果显示食管鳞癌组织中的FAM83B的表达水平显著高于癌旁正常组织,且至少为癌旁正常组织1.5倍(见图3,4)。
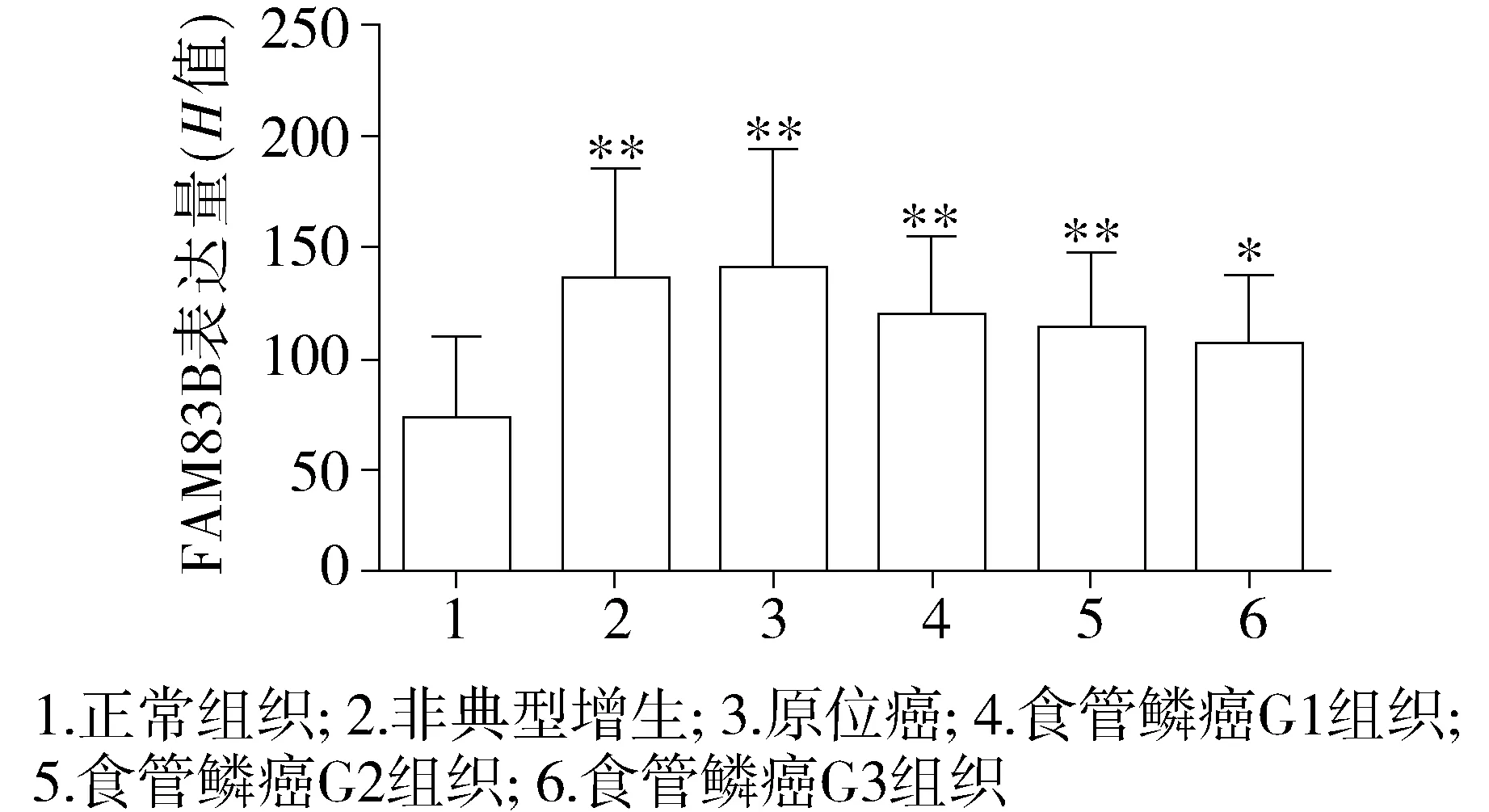
与正常组织比较,*P<0.05,**P<0.01图2 不同分级食管鳞癌组织中FAM83B的表达水平Figure 2 The expression levels of FAM83B in different grades of ESCC tissues
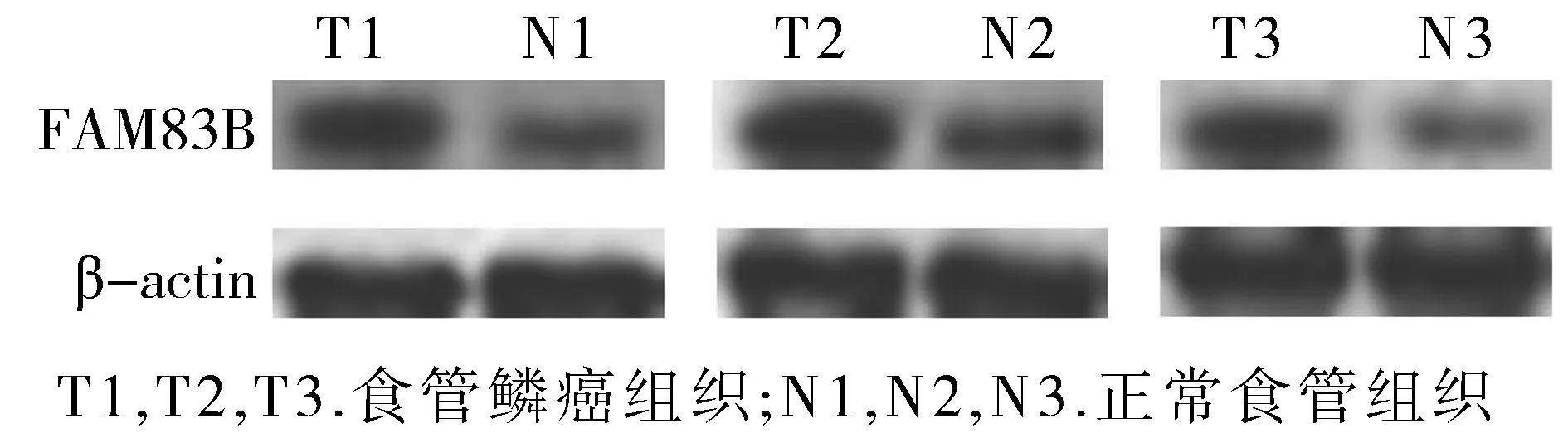
图3 食管鳞癌和癌旁正常组织FAM83B的表达水平Figure 3 The FAM83B expression of ESCC and adjacent normal tissue
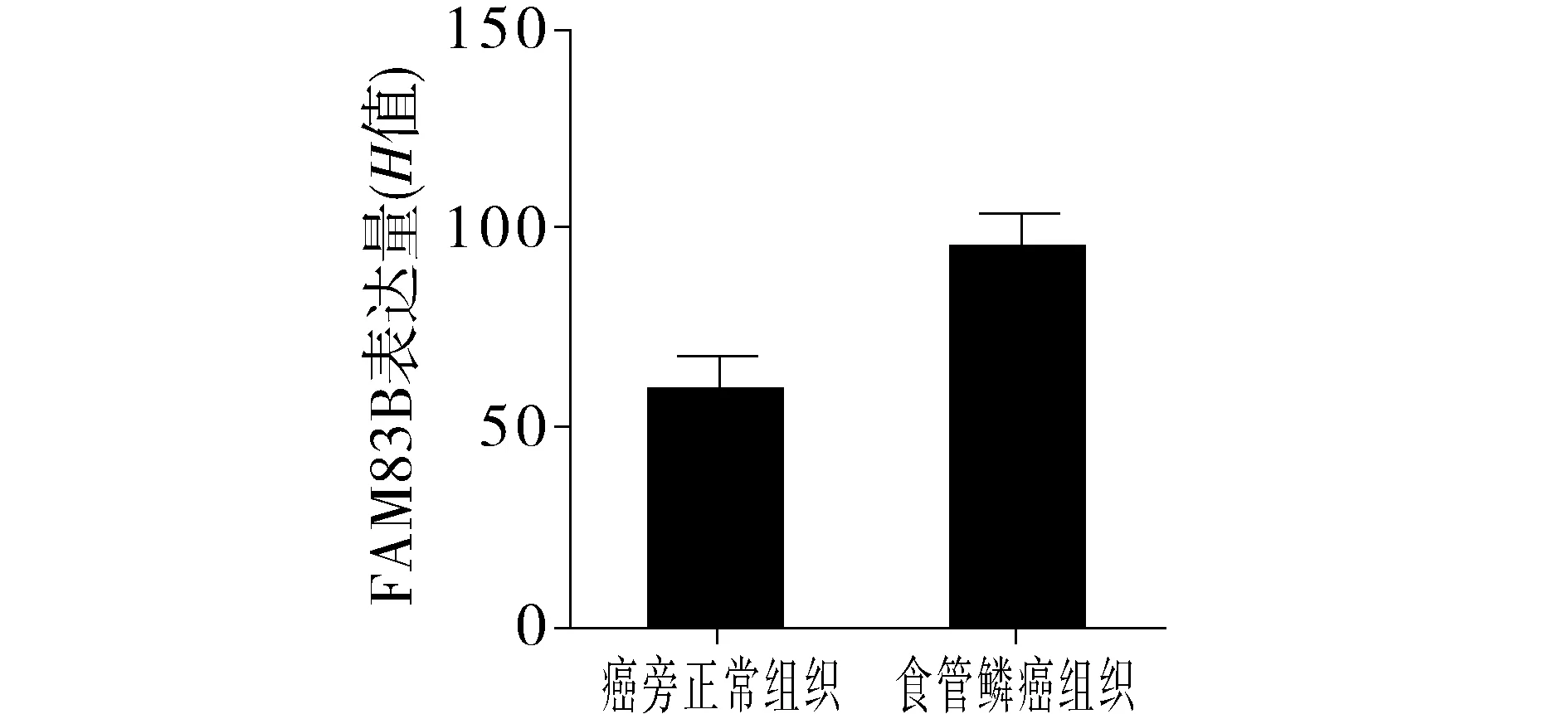
图4 食管鳞癌和癌旁正常组织的FAM83B的表达水平Figure 4 The FAM83B expression levels of ESCC and adjacent normal tissue
2.4 食管鳞癌中FAM83B的表达与患者临床病理特征的关系
FAM83B在不同年龄和肿瘤浸润深度间的差异具有统计学意义(P<0.05),在肿瘤分级、TNM分期、淋巴结转移和肿瘤位置中的差异无统计学意义(P>0.05,见表1)。
2.5 FAM83B的表达以及患者年龄对食管鳞癌患者预后的影响
70例食管鳞癌患者中有完整随访信息61例,中位生存期为27(2-71)个月。61例食管鳞癌患者按年龄以60岁为临界值分为两组,<60岁的共有30例,其中FAM83B低表达的17例,FAM83B高表达的13例;在<60岁的患者中,FAM83B表达量的高低对患者的生存率有显著影响,Log-rank检验显示FAM83B低表达组总体生存率大于FAM83B高表达组(χ2=7.016,P=0.008,见图5A)。≥60岁的共有31例,其中FAM83B低表达的11例,FAM83B高表达的20例,FAM83B表达量的高低对于≥60岁的患者的生存率没有影响(χ2=1.198,P=0.274,见图5B)。
表1 食管鳞癌组织中FAM83B的表达量与食管鳞癌患者临床特征的关系
Table 1 Association between the expression level of FAM83B in ESCC tissue and clinicopathological variables of ESCC patients
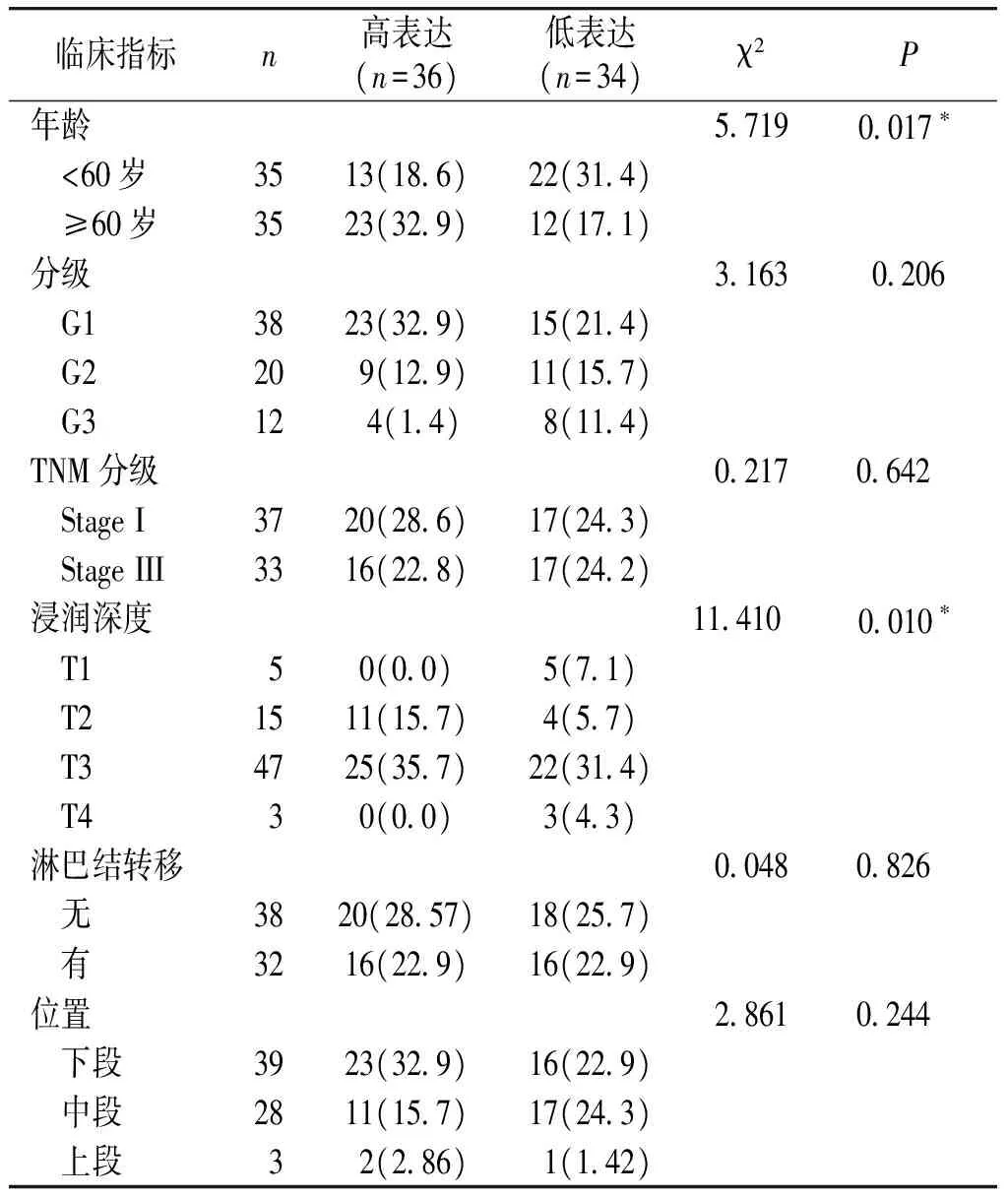
临床指标n高表达(n=36)低表达(n=34)χ2P年龄57190017∗ <60岁3513(186)22(314) ≥60岁3523(329)12(171)分级31630206 G13823(329)15(214) G2209(129)11(157) G3124(14)8(114)TNM分级02170642 StageI3720(286)17(243) StageIII3316(228)17(242)浸润深度11410 0010∗ T1 50(00)5(71) T21511(157)4(57) T34725(357)22(314) T4 30(00)3(43)淋巴结转移00480826 无3820(2857)18(257) 有3216(229)16(229)位置28610244 下段3923(329)16(229) 中段2811(157)17(243) 上段 32(286)1(142)
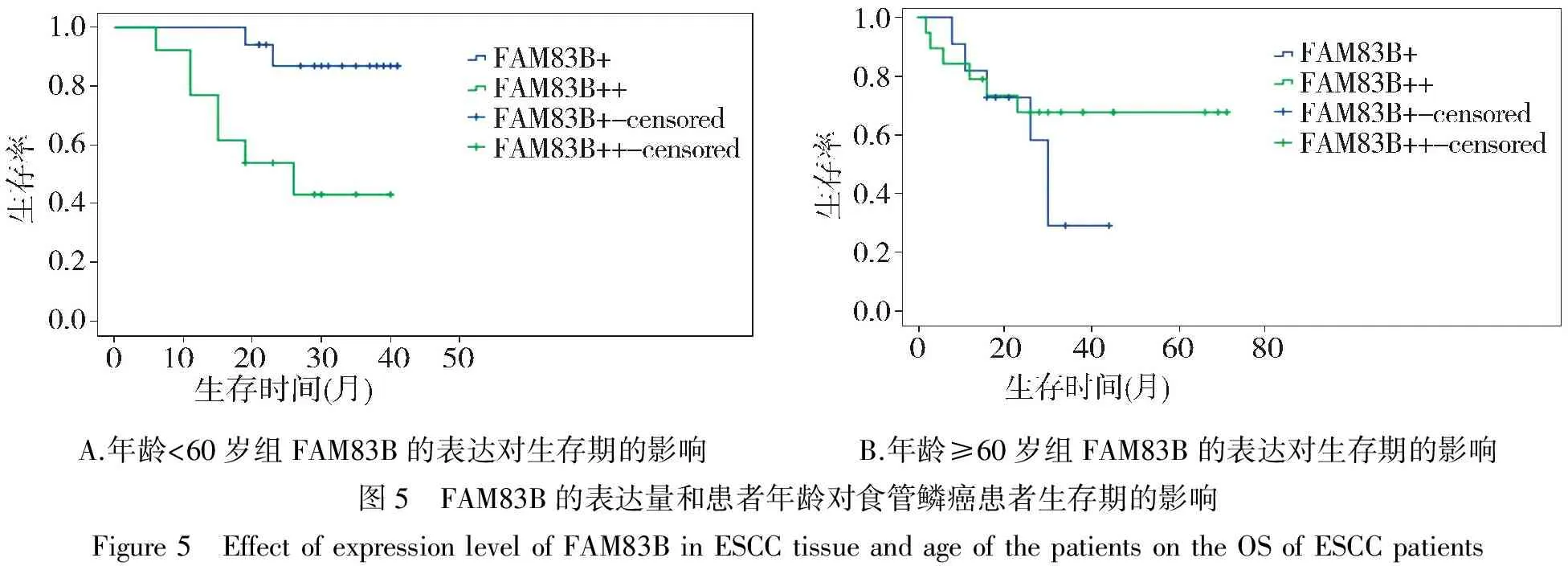
A.年龄<60岁组FAM83B的表达对生存期的影响 B.年龄≥60岁组FAM83B的表达对生存期的影响图5 FAM83B的表达量和患者年龄对食管鳞癌患者生存期的影响Figure5 EffectofexpressionlevelofFAM83BinESCCtissueandageofthepatientsontheOSofESCCpatients
2.6 FAM83B的表达及TNM分期对食管鳞癌患者预后的影响
随访的61例患者按TNM分期分为两组,Stage Ⅰ和Stage Ⅲ。Stage Ⅰ组共有33例,其中FAM83B低表达的16例,FAM83B高表达的17例;Stage Ⅲ组共有28例,其中FAM83B低表达的16例,FAM83B高表达的12例;当TNM分期为Stage Ⅰ时,FAM83B的表达量的高低对患者的生存率有影响,FAM83B低表达组总体生存率大于FAM83B高表达组(χ2=2.602,P=0.011,见图6A);而当TNM分期为Stage Ⅲ时,FAM83B表达量的高低对患者的生存率的影响无统计学差异(χ2=0.011,P=0.915,见图6B)。
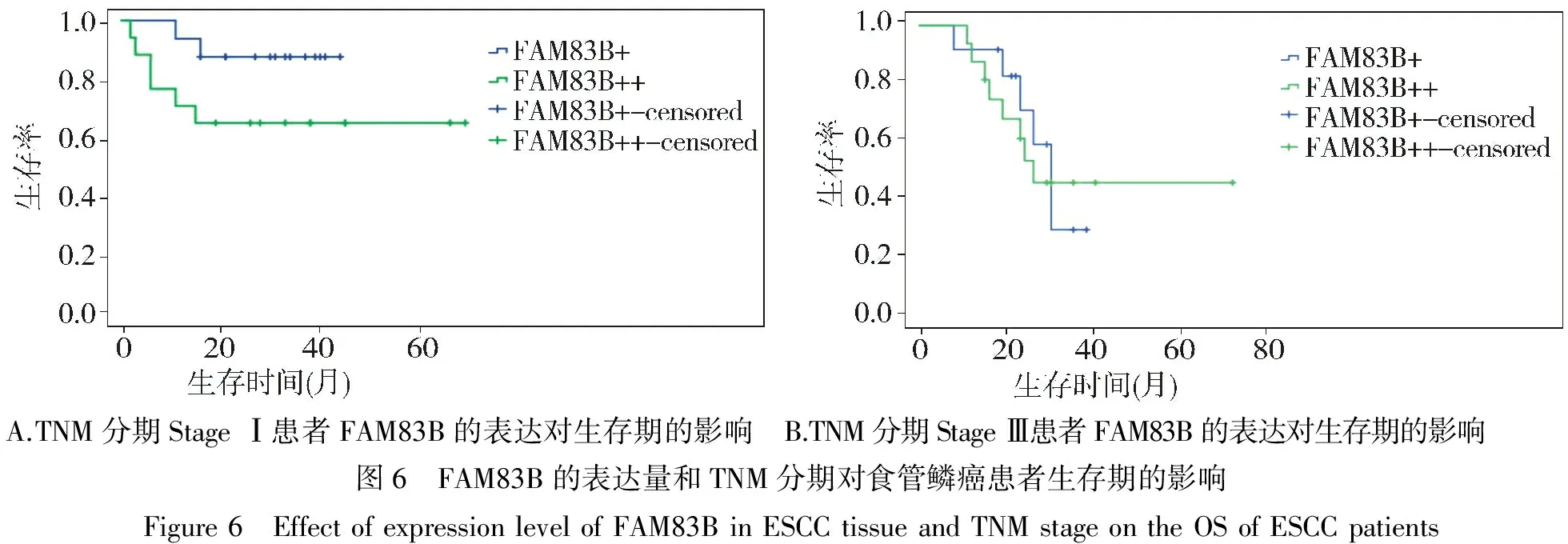
A.TNM分期StageⅠ患者FAM83B的表达对生存期的影响 B.TNM分期StageⅢ患者FAM83B的表达对生存期的影响图6 FAM83B的表达量和TNM分期对食管鳞癌患者生存期的影响Figure6 EffectofexpressionlevelofFAM83BinESCCtissueandTNMstageontheOSofESCCpatients
3 讨论
食管癌是世界第八大肿瘤,每年新增病例约456 000例[1-3]。食管鳞癌是食管癌中影响我国以及其他亚洲国家的主要病理类型。食管癌的发生受到多方面因素的影响,如区域因素引起的不同的生活习惯、遗传因素和环境因素等,饮酒、过度吸烟以及蔬菜水果摄入量不足都会增加食管鳞癌的患病风险[13-17]。食管鳞癌的发展是一个复杂的过程,它是从一个正常的鳞状上皮开始,发展为一个低级别的上皮内瘤变,然后是一个高级别上皮内瘤变,最终形成浸润性癌。由于食管鳞癌早期没有特异性症状且缺少相应的诊断方法,大多数食管鳞癌患者发现时已经处于中晚期阶段[18-22],并且大多数患者在治疗后临床效果不佳,5年内的复发率高,死亡率高。文献显示,仅有15%-20% 的食管鳞癌患者在诊断后能够生存5年以上[23,24]。因此探究食管鳞癌发生发展的分子机制,鉴定食管鳞癌早期诊断、预后和药物靶点的新型分子标志物,对提高食管鳞癌患者的生存率具有重要意义。
FAM83B基因是本课题组前期食管鳞癌基因组测序筛选得到的显著差异基因之一。目前对其功能研究较少。乳腺癌里的研究表明FAM83B能够激活PI3K/AKT[10]和EGFR/RAS/MAPK[11]信号通路促进永生化人乳腺上皮细胞恶性转化。有研究表明,FAM83B在乳腺癌、卵巢癌、肺癌等多种人类肿瘤中均表现出原癌基因的作用且表达水平显著增高[11,12]。
据报道,FAM83B通过激活MAPK和mTOR信号通路来促进永生化人乳腺上皮细胞的转化,同时FAM83B的表达能够激活PI3K/AKT信号通路,而针对MAPK和Akt/mTOR信号通路的靶向治疗目前已应用于多种肿瘤的临床试验[10],因此,当应用针对MAPK和Akt/mTOR信号通路的靶向治疗时,FAM83B的表达水平可作为一个很重要的参考因素[25]。
本研究采用免疫组化的方法检测了不同恶性程度食管鳞癌组织中以及食管鳞癌及对应癌旁组织中FAM83B的表达情况,并应用SPSS分析软件对免疫组化的结果进行分析,来探讨食管鳞癌组织中FAM83B的表达情况及其与临床病理特征、预后的关系。结果发现,不同恶性程度的食管鳞癌组织中,FAM83B主要表达在食管鳞癌细胞的胞质中且在原位癌组织中表达水平最高,并且食管鳞癌组织中的表达量是其癌旁正常组织1.5倍。对免疫组化的检测结果进行分析后,发现FAM83B表达与患者的年龄、肿瘤的浸润深度相关,并且当食管鳞癌患者年龄小于60岁或者患者TNM分期为Stage Ⅰ阶段时,FAM83B的表达均与患者的生存时间呈负相关。
综上所述,本研究表明FAM83B在食管鳞癌组织中的高表达与食管鳞癌的发生、发展浸润关系密切,可作为评估食管鳞癌临床进展和预后的重要参考指标,FAM83B也有可能成为食管鳞癌靶向治疗新的潜在靶点。但以上结果仍需要大样本的临床病例及功能学实验进一步的验证。
[1] Pennathur A,Gibson MK,Jobe BA,etal.Oesophageal carcinoma[J].Lancet,2013,381(9864):400-412.
[2] Kamangar F,Dores GM,Anderson WF.Patterns of cancer incidence,mortality,and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world[J].J Clin Oncol,2006,24(14):2137-2150.
[3] Ferlay J,Soerjomataram I,Dikshit R,etal.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-E386.
[4] Rakhimova S,Akilzhanova A,Zhukov Y,etal.Esophageal cancer in Kazakhstan:Multiomic research challenges[J].Cent Asian J Glob Heal,2014,3:3-4.
[5] González-Plaza JJ,Hulak N,García-Fuentes E,etal.Oesophageal squamous cell carcinoma (ESCC):Advances through omics technologies,towards ESCC salivaomics[J].Drug Discov Ther,2015,9(4):247-257.
[6] Zhang L,Zhou Y,Cheng C,etal.Genomic analyses reveal mutational signatures and frequently altered genes in esophageal squamous cell carcinoma[J].Am J Hum Genet,2015,96(4);597-611.
[7] Cheng C,Zhou Y,Li H,etal.Whole-genome sequencing reveals diverse models of structural variations in esophageal squamous cell carcinoma[J].Am J Hum Genet,2016,98(2);256-274.
[8] Cohen AL,Piccolo SR,Cheng L,etal.Genomic pathway analysis reveals that EZH2 and HDAC4 represent mutually exclusive epigenetic pathways across human cancers[J].BMC Med Genomics,2013,6(35):1-13.
[9] Kandoth C,McLellan MD,Vandin F,etal.Mutational landscape and significance across 12 major cancer types[J].Nature,2013,502(7471):333-339.
[10] Cipriano R,Graham J,Miskimen KL,etal.FAM83B mediates EGFR- and RAS-driven oncogenic transformation[J].J Clin Invest,2012,122(9):3197-3210.
[11] Cipriano R,Miskimen KL,Bryson BL,etal.FAM83B-mediated activation of PI3K/AKT and MAPK signaling cooperates to promote epithelial cell transformation and resistance to targeted therapies[J].Oncotarget,2013,4(5):729-738.
[12] Cipriano R,Miskimen KL,Bryson BL,etal.Conserved oncogenic behavior of the FAM83 family regulates MAPK signaling in human cancer[J].Mol Cancer Res,2014,12(8):1156-1165.
[13] Pickens A,Orringer MB.Geographical distribution and racial disparity in esophageal cancer[J].Ann Thorac Surg,2003,76(4):S1367-S1369.
[14] Bosetti C,Levi F,Ferlay J,etal.Trends in oesophageal cancer incidence and mortality in Europe[J].Int J Cancer,2008,122(5):1118-1129.
[15] Yokoyama A,Omori T,Yokoyama T.Risk appraisal and endoscopic screening for esophageal squamous cell carcinoma in Japanese populations[J].Esophagus,2007,4(4):135-143.
[16] Cheng KK,Day NE.Nutrition and esophageal cancer[J].Cancer Causes Control,1996,7(1):33-40.
[17] Takezaki T,Shinoda M,Hatooka S,etal.Subsite-specific risk factors for hypopharyngeal and esophageal cancer (Japan)[J].Cancer Causes Control,2000,11(7):597-608.
[18] Bosman FT,Carneiro F,Hruban RH,etal.WHO classification of tumours of the digestive system[M].Lyon,France:IARC Press,2010:1-314.
[19] Vaughan TL.From genomics to diagnostics of esophageal adenocarcinoma[J].Nat Genet,2014,46(8):806-807.
[20] Xie GX,Chen TL,Qiu YP,etal.Urine metabolite profiling offers potential early diagnosis of oral cancer[J].Metabolomics,2012,8(2):220-231.
[21] Zhang A,Sun H,Wang P,etal.Salivary proteomics in biomedical research[J].Clin Chim Acta,2013,415:261-265.
[22] Takeshita N,Hoshino I,Mori M,etal.Serum microRNA expression profile:miR-1246 as a novel diagnostic and prognostic biomarker for oesophageal squamous cell carcinoma[J].Br J Cancer,2013,108(3):644-652.
[23] Enzinger PC,Mayer RJ.Esophageal cancer[J].N Engl J Med,2003,349(23):2241-2252.
[24] Pennathur A,Farkas A,Krasinskas AM,etal.Esophagectomy for T1 esophageal cancer:outcomes in 100 patients and implications for endoscopic therapy[J].Ann Thorac Surg,2009,87(4):1048-1054.
[25] Cipriano R,Miskimen KL,Bryson BL,etal.FAM83B-mediated activation of PI3K/AKT and MAPK signaling cooperates to promote epithelial cell transformation and resistance to targeted therapies[J].Oncotarget,2013,4(5):729-738.
Expression of FAM83B in esophageal squamous cell carcinoma and its association with clinicopathological characteristics and prognosis
LI Hongyi1,CHENG Caixia2,ZHAI Yuanfang3,CUI Heyang3,BI Yanghui3,MA Yanchun1,YANG Jian1,KONG Pengzhou1*
(1TranslationalMedicineResearchCenter,ShanxiMedicalUniversity,Taiyuan030001,China;2DepartmentofGeneralSurgery,FirstHospitalofShanxiMedicalUniversity;3CollegeofBasicMedicalSciences,ShanxiMedicalUniversity;*Correspondingauthor,E-mail:kongpzh@163.com)
ObjectiveTo explore the expression of FAM83B in esophageal squamous cell carcinoma(ESCC) and its relationships with clinicopathological characteristics and prognosis.MethodsThe expression of FAM83B was detected in esophageal tissues with diffe-rent degrees of malignancy and 70 cases of ESCC and corresponding para-carcinoma tissues by tissue microarray and immunohistoche-mistry.The relationships between the expression of FAM83B and the clinicopathological variables of ESCC patients were analyzed by SPSS analysis software.ResultsFAM83B positive staining was primarily observed in the cytoplasm of the ESCC cells.FAM83B expression level of ESCC was 1.5-fold as much as that of the corresponding para-carcinoma tissues.The expression of FAM83B was statistically associated with the age of the patient and the depth of tumor invasion(P<0.05).Univariate factor survival analysis showed that the expression level of FAM83B was negatively correlated with the survival time when the ESCC patients were less than 60 years old or TNM stage Ⅰ (P<0.05).ConclusionFAM83B may be involved in the occurrence,development and invasion of ESCC,and the expression of FAM83B may be a powerful predictor for the prognosis of ESCC.
esophageal squamous cell carcinoma; FAM83B; tissue microarray; immunohistochemistry; prognosis
国家自然科学基金资助项目(81602175)
李泓漪,女,1987-01生,硕士,助教,E-mail:me_lhy@126.com
2017-02-15
R735.1
A
1007-6611(2017)06-0583-06
10.13753/j.issn.1007-6611.2017.06.016

