去氢骆驼蓬碱在秀丽隐杆线虫体内代谢研究
袁 将,姬瑞芳,全庆华,王加利,郭晓宇,张伽妹,谭 鹏,韩 静,刘永刚
(北京中医药大学,北京 100102)
去氢骆驼蓬碱在秀丽隐杆线虫体内代谢研究
袁 将,姬瑞芳,全庆华,王加利,郭晓宇,张伽妹,谭 鹏,韩 静,刘永刚
(北京中医药大学,北京 100102)
去氢骆驼蓬碱是一种β-咔啉类生物碱,能够显著地抑制秀丽隐杆线虫let-60(n1046gf)的多产卵器表型,具有治疗胰腺癌的潜在能力。本研究采用超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF MS)法分析去氢骆驼蓬碱,确定其可能的裂解途径及特征碎片离子,同时研究其单体在线虫体内的代谢产物,并对给药后不同时间点的线虫成虫体内去氢骆驼蓬碱的含量进行半定量分析。结果显示,去氢骆驼蓬碱的裂解途径主要为RDA裂解,包括甲基、羟基等基团的丢失以及吲哚环的开裂。在电喷雾正离子模式下,检测到去氢骆驼蓬碱(m/z213)的去甲基化(m/z199)、羟基化(m/z229)的代谢产物。半定量分析结果表明:0~5 h,线虫代谢旺盛,线虫体内去氢骆驼蓬碱的含量下降约80%;5 h后,代谢速率减慢。该方法适用于去氢骆驼蓬碱在线虫体内代谢产物的研究,能够为去氢骆驼蓬碱治疗胰腺癌的新药研发提供数据支持。
去氢骆驼蓬碱;秀丽隐杆线虫;代谢;裂解机制;超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF MS)
去氢骆驼蓬碱(harmine),又称肉叶芸香碱,是一种β-咔啉类生物碱,其基本母核是由吲哚和吡啶骈和而成的,主要来源于多年生草本蒺藜科骆驼蓬(PeganumharmalaL.),在植物、海洋生物、昆虫、哺乳动物、人体组织、体液中也有分布。去氢骆驼蓬碱的药理作用广泛,包括抗菌、抗疟原虫、抗炎、抗氧化、抗肿瘤、抗诱变、致幻等,对消化道肿瘤的治疗效果显著[1-4]。由于去氢骆驼蓬碱较好的抗肿瘤活性,许多学者对其结构进行了修饰,发现9位N原子上的氢被苯丙基、苄基等取代时,其抗肿瘤活性显著增强,IC50值在10 μmol/L以下时,应用前景广泛[5-6]。
秀丽隐杆线虫(Caenorhabditiselegans),以下简称“线虫”,属于线形动物门线虫纲动物,具有结构简单、生命周期短、身体透明、易于镜下观察、遗传背景清楚、体型细小、易于高通量筛选、造模简单等特点,在代谢综合征疾病(如糖尿病、衰老、脂肪代谢疾病等)和神经退行性疾病(如阿兹海默病、帕金森疾病、亨廷顿舞蹈症等)的药物筛选、药物新靶点的发现和证实、药物作用机制、化学基因组学和毒理学研究中应用广泛[7-8]。许多哺乳细胞中的信号通路,如Wnt、Notch和Ras三条信号通路,在线虫体内是非常保守的。其中,Ras/MAPK信号通路在哺乳细胞中控制着细胞的分裂,而在线虫中控制线虫产卵器的形成,当这条通路上的基因发生突变时,如突变频率较高的ras基因(翻译产生Ras蛋白,在线虫中的同源蛋白是Let-60),线虫将会形成除正常产卵器外的多个假产卵器,let-60(n1046gf)线虫株就是根据此突变构建的模型[9]。利用let-60(n1046gf)线虫株筛选Ras蛋白的抑制剂-抗肿瘤药物时,产卵器的个数成为判定筛选结果的依据,当药物有效时,线虫会形成一个正常的产卵器,恢复为野生型。线虫身体结构简单,有完善的神经系统和肌肉系统,但没有肝脏等器官,能否像哺乳动物一样代谢药物有待进一步研究。近年来研究发现,线虫体内含有多种酶,比如精氨酸酶[10](代谢精氨酸和部分含氮化合物,如尿素、甲酰胺等)、壳多糖酶[11](线虫中有其同源蛋白)、乙醛脱氢酶[12](能够抑制氧化应激)、细胞色素P450酶[13](能够代谢内源性和外源性物质)、乙醇脱氢酶[14]等代谢酶,为药物的体内代谢研究提供了可能。
本课题组前期研究表明,去氢骆驼蓬碱能够有效地抑制let-60(n1046gf)线虫多产卵器株表型,并且呈现剂量依赖性,浓度为80 μmol/L时的抑制率接近90%,但是去氢骆驼蓬碱能否在线虫体内发生代谢有待研究。基于此,本研究将采用超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF MS)联用技术分析去氢骆驼蓬碱在线虫体内的代谢产物,并考察代谢速率,丰富完善其在电喷雾正离子模式下的质谱裂解规律,为去氢骆驼蓬碱乃至于β-咔啉类生物碱的研究和线虫在中药筛选中的应用奠定基础。
1 实验部分
1.1仪器及试剂
ACQUITY 超高效液相色谱仪:美国Waters公司产品;DH3600电热恒温培养箱:上海森信实验仪器有限公司产品;体式显微镜:上海普丹光学仪器生产公司产品;去氢骆驼蓬碱:纯度>98%,实验室自制;1-乙基吲哚-3-甲酸:纯度>98%,实验室自制;let-60(n1046gf)线虫株:美国Caenorhabditis Genetics Center(CGC)产品;NGM培养基、M9溶液:实验室配制;甲酸、乙腈:均为质谱级,美国Fisher公司产品;蒸馏水:屈臣氏公司产品;其他试剂均为分析纯。
1.2实验条件
1.2.1色谱条件 Waters BEH C18色谱柱(2.1 mm×100 mm×1.7 μm);洗脱系统:0.1%甲酸水(A)和乙腈(B);梯度洗脱程序:0~2 min(2%B),2~10 min(2%~98%B),10~12 min(98%B),12~12.1 min(98%~2%B),12.1~14 min(2%B);流速0.3 mL/min;进样量2 μL;柱温40 ℃;样品室温度4 ℃。
1.2.2质谱条件 采用ESI正离子模式检测,亮氨酸脑啡肽作为校正液;毛细管电压3.0 kV;锥孔电压40 V;离子源温度100 ℃;脱溶剂气温度400 ℃;锥孔气体流速50 L/h;脱溶剂气流速800 L/h;低能通道碰撞电压6 V,高能通道碰撞电压10~80 V;质量扫描范围m/z100~1 200;Continuum模式下的3D数据采集模式;数据分析采用MassLynx V4.1数据处理工作站及以中药数据库为基础的UNIFI 1.7软件。
1.3NGM培养基的配制
用二甲亚砜(DMSO)将去氢骆驼蓬碱配制成50 mmol/L溶液,按照文献[15]的方法,另外加入去氢骆驼蓬碱溶液(加药组)或DMSO(对照组),配制成每板含80 μmol/L去氢骆驼蓬碱或DMSO的培养基,备用。
1.4秀丽隐杆线虫的培养与加药处理
挑取let-60(n1046gf)线虫株成虫置于配制好的22 ℃ NGM培养基中产卵2 h,然后将成虫挑走,加入含有80 μmol/L去氢骆驼蓬碱或DMSO的OP50大肠杆菌作为食物,置于22 ℃生化培养箱中培养至成虫。用M9溶液将线虫成虫从培养基中洗下,收集在EP管中,置于培养箱中饥饿,分别在0、2、4、6、8、10、16 h时将其取出;以4 000 r/min离心2 min,沉淀部分用甲醇-水混合溶液(3∶1,V/V)振摇清洗3次,每次10 min,除去线虫体表的杂质;然后用300 μL混合溶液将沉淀部分重新混悬,用研磨器充分研磨,将研磨液以13 000 r/min高速离心15 min;取200 μL上述样品与5 μL内标溶液混合(0.01 g/L甲醇),漩涡振荡1 min,吸取上清液,进行液相色谱-质谱分析。
各取10 μL上述不同时间点的样品溶液混合作为质控样本(QC),进行半定量方法学考察。
1.5对照品溶液及内标溶液的配制
分别精密称取1.00 mg去氢骆驼蓬碱对照品和内标,加甲醇超声溶解,定容至10 mL容量瓶中,配制成浓度为0.1 g/L的对照品和内标贮备液,储存于4 ℃冰箱中。精密吸取适量的该储备液,用甲醇稀释,配制成浓度为0.01 g/L的对照品和内标溶液。
2 结果与讨论
2.1碰撞能优化
去氢骆驼蓬碱是一种β-咔啉类生物碱,该类成分在正离子模式下容易离子化、裂解碎片规律性较强、响应值高于负离子模式,因此选择在正离子模式下进行。本实验吸取2 μL 80 μmol/L去氢骆驼蓬碱注入液相色谱-质谱联用仪,考察在电喷雾正离子模式下,不同高能通道10~15、20~25、30~35、40~45、60~65、80~85、100~120、120~140和10~80 V碰撞能量下的碎片离子信息,其质谱图示于图1。其中,100~120 V和120~140 V高碰撞能量的碎片响应值非常低,仅为e3;而10~15、20~25和30~35 V低碰撞能量的母离子响应值较高,不易裂解且碎片信息较少。因此,最终选择10~80 V碰撞能量阶梯,产生的碎片信息最丰富,响应值较高,且能显示β-咔啉类生物碱的裂解特征。
2.2去氢骆驼蓬碱的质谱裂解机制
去氢骆驼蓬碱是由一分子甲氧基吲哚和一分子甲基吡啶骈和而成,分子式为C13H12N2O,相对分子质量为212,其结构式示于图2。将去氢骆驼蓬碱标准品溶液进行UPLC-Q-TOF MS分析,主要产生m/z213、198、170、155、144、140、130和115等碎片离子。其中,m/z213是去氢骆驼蓬碱的准分子离子[M+H]+;m/z198是准分子离子丢失1个甲基形成的碎片离子[M+H—CH3]+;m/z170是m/z198丢失1个CO(28 u)中性碎片形成的,而丢失CO的前提是在苯环上形成羟基,然后异构化形成羰基,所以m/z198是由吲哚环上甲氧基中甲基丢失形成的;m/z155是m/z170中性丢失15 u形成的碎片离子[M+H—CH3—CH3]+;m/z144是m/z170发生RDA裂解,丢失1个乙炔分子形成的;m/z140是由m/z155发生2次α裂解丢失原吲哚环上的亚胺基(15 u)而形成的碎片离子[M+H—CH3—CH3—NH]+;m/z130是在m/z144的基础上丢失1个CH2中性碎片形成的;而m/z115是由m/z155发生RDA和α裂解形成的碎片离子。去氢骆驼蓬碱可能的裂解途径示于图3。综合来看,在电喷雾正离子模式下,去氢骆驼蓬碱发生裂解行为时吡啶环比较稳定,吲哚环易裂解,裂解方式主要是RDA裂解和α裂解。
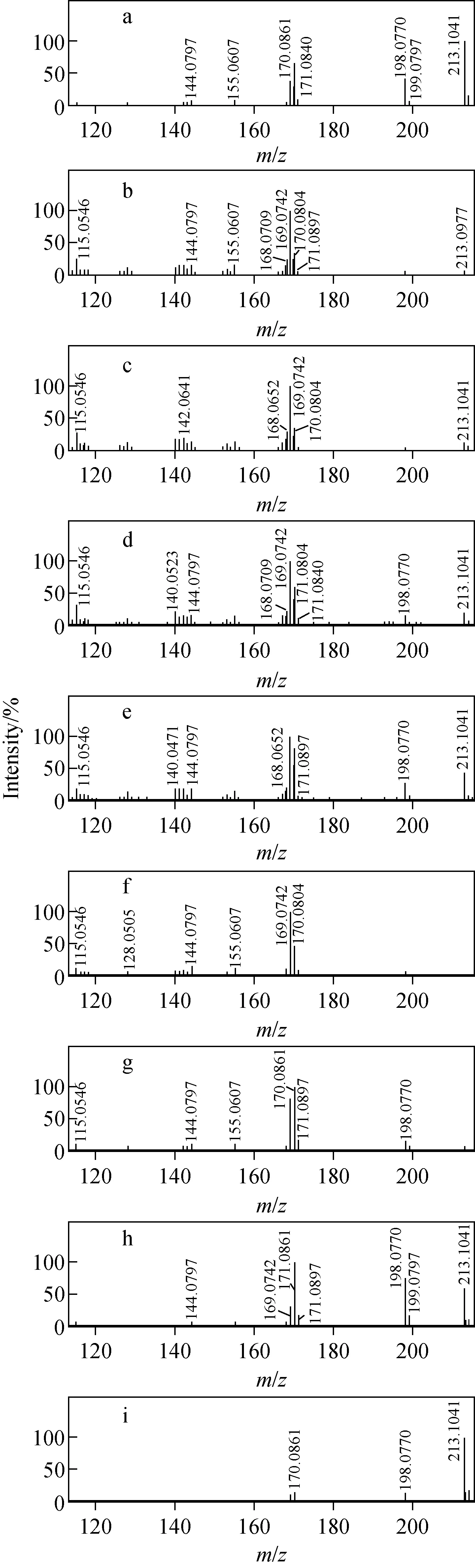
注:a.10~80 V;b.60~65 V;c.80~85 V; d.100~120 V;e.120~140 V;f.40~45 V; g.30~35 V;h.20~25 V;i.10~15 V图1 不同碰撞能量下去氢骆驼蓬碱的高能通道质谱数据Fig.1 MS spectras in high energy scan under different collision energies

图2 去氢骆驼蓬碱的化学结构式Fig.2 Chemical structure of harmine
2.3去氢骆驼蓬碱在线虫体内代谢物
本研究基于高分辨液相色谱-质谱联用技术,并借助UNIFI药物代谢解决方案的策略,首先将化合物去氢骆驼蓬碱的名称、分子式、结构式(结构式保存为.mol格式的文件)导入UNIFI数据库;第二步将采集的Continuum原始数据导入UNIFITM定性分析软件,将DMSO空白对照组设置为“Reference”,将给药线虫组设置为“Unknow”,通过设置可能的代谢途径及适当的采集参数对各主要分子离子峰进行识别、校正,并与已建立的目标数据库自动匹配;第三步是结合特征离子、色谱保留时间、精确分子质量、分子碎片峰、对照品信息和相关文献进一步验证所有匹配化合物的结构,排除假阳性结果。通过初步筛查发现去氢骆驼蓬碱在线虫体内的代谢产物。

图3 去氢骆驼蓬碱可能的质谱裂解途径Fig.3 Possible fragmentation pathway of harmine

图4 去氢骆驼蓬碱(a)、线虫对照组(b)、线虫加药组(c)的BPI图,以及M0高能通道质谱图(d)Fig.4 BPI chromatograms of harmine (a), nematode control (b), drug administration (c), and MS spectra in high energy scan of M0 (d)
2.3.1M0母药的确定 通过比较给药线虫组和DMSO空白对照组发现,给药组在5.04 min出现了独有的峰(图4c中*表示该峰),其准分子离子峰为m/z213.108 0[M+H]+,分子式为C13H12N2O。M0的高能通道质谱图示于图4d,主要的裂解碎片为m/z198、170、155、144、140、130和115,这与标准品的保留时间及裂解碎片一致,确定M0为去氢骆驼蓬碱,表明去氢骆驼蓬碱确实能进入线虫体内并且可被质谱检测到。
2.3.2羟基化产物的鉴定 代谢产物M1的准分子离子为m/z229.096 1[M+H]+,比去氢骆驼蓬碱的准分子离子m/z213[M+H]+高16 u,并且其裂解碎片离子m/z214.072 8[M1—CH3]+和m/z186.077 9[M1—CH3—CO]+均比去氢骆驼蓬碱相应的碎片离子高16 u。根据色谱保留行为、精确质量数及质谱裂解碎片,推断M1可能为去氢骆驼蓬碱的羟基化产物,其可能的裂解碎片信息示于图5。
2.3.3去甲基化产物的鉴定 代谢产物M2的准分子离子是m/z199.085 7[M+H]+,比电喷雾正离子模式下去氢骆驼蓬碱的准分子离子低14 u,并且其裂解碎片离子m/z184.064 0[M2—CH2]+和m/z156.073 1[M2—CH2—CO]+均比去氢骆驼蓬碱相应的碎片离子低14 u。此外,碎片离子m/z156.073 1[M2—CH2—CO]+和m/z131.048 0[M2—CH2—CO—CH3]+表明,M2右侧吡啶环上可能存在甲基。因此,根据色谱保留行为、精确质量数及质谱裂解碎片,推断M2为去氢骆驼蓬碱丢失吲哚环中甲基后形成的去甲基化代谢产物,其可能的裂解碎片信息示于图6。

图5 M1的高能质谱图Fig.5 MS spectra in high energy scan of M1

图6 M2的高能质谱图Fig.6 MS spectra in high energy scan of M2
2.4去氢骆驼蓬碱在线虫体内代谢速率的考察
为了全面了解去氢骆驼蓬碱在线虫体内的含量变化趋势,本实验建立了给药后不同时间点的线虫成虫体内去氢骆驼蓬碱含量的质谱半定量分析方法。1-乙基吲哚-3-甲酸的化学结构与去氢骆驼蓬碱相似,且分子质量与目标化合物不同,因此选择1-乙基吲哚-3-甲酸作为内标化合物,以目标生物碱与内标化合物的相对峰面积比值代表去氢骆驼蓬碱的相对含量。采用UPLC-Q-TOF MS中的MRM数据采集模式对给药后不同时间点的线虫成虫体内去氢骆驼蓬碱含量进行半定量分析,通过绘制相对峰面积比-时间曲线获得给药后的线虫成虫体内去氢骆驼蓬碱含量随时间的变化情况。
2.4.1半定量分析的方法学考察 正离子模式下选取0.87、5.04、7.15、9.46、12.03 min所对应的m/z192.160 4、213.103 4、274.460 0、149.023 5、338.342 5离子进行半定量分析方法学考察,具体结果列于表1。可以看出,5个提取离子色谱峰峰面积的重复性、精密度和系统稳定性的RSD分别在1%~4%、1%~8%、2%~8%之间,均在可以接受的范围内,可用于半定量分析。

表1 重复性、精密度和系统稳定性结果Table 1 Results of repeatability, precision and system stability

图7 去氢骆驼蓬碱在线虫体内含量的变化图Fig.7 Changes of harmine content in vivo of nematode
2.4.2数据的采集与处理 按1.4节方法处理线虫,进行3次重复实验,采用 UPLC-Q-TOF MS中的MRM数据采集模式对不同时间点的样品进行高分辨质谱数据的采集。用MassLynx V4.1软件计算目标化合物和内标化合物的峰面积,然后用GraphPad Prism5软件进行统计绘图,分别得到给药后不同时间点的线虫成虫体内去氢骆驼蓬碱的相对含量。其中,横坐标为给药后不同时间点,纵坐标为不同时间点相对峰面积比(与0 h相比),绘制的相对峰面积比-时间曲线示于图7。可见,在0~5 h内,线虫代谢旺盛,去氢骆驼蓬碱能够被线虫代谢掉80%左右;5 h后线虫代谢速率减慢;10 h后基本趋于稳定。
3 结论
本工作总结了电喷雾正离子模式下去氢骆驼蓬碱可能的质谱裂解规律,并在活性筛选结果的指导下考察了去氢骆驼蓬碱在秀丽隐杆线虫let-60(n1046gf)体内的代谢情况,发现线虫能够代谢去氢骆驼蓬碱生成去甲基化(m/z199)、羟基化(m/z229)代谢产物,同时半定量分析结果证明,线虫在给药后不同时间点的代谢速率是不同的。本工作为去氢骆驼蓬碱的后续研究和秀丽隐杆线虫在中药活性筛选、机制研究奠定了基础。此外,代谢速率研究可为今后药物机制研究中给药时间、取样时间的设定以及治疗胰腺癌的新药研发提供参考。
[1] 付瑾,赵爽,王贝贝,等. 骆驼蓬种子及其炮制品中去氢骆驼蓬碱的含量测定[J]. 现代中药研究与实践,2015,(4):35-36.
FU Jin, ZHAO Shuang, WANG Beibei, et al. Determination of harmine in seeds of ethnic medicine and its processed products ofPeganumharmala[J]. Research and Practice of Chinese Medicines, 2015, (4): 35-36(in Chinese).
[2] 顾帆,顾月清. 去氢骆驼蓬碱通过诱导凋亡发挥抗肿瘤药理作用研究进展[J]. 中成药,2014,36(6):1 277-1 280.
GU Fan, GU Yueqing. Research progress on antitumor pharmacological effects of harmine through inducing apoptosis[J]. Chinese Traditional Patent Medicine, 2014, 36(6):1 277-1 280(in Chinese).
[3] 王锦军,张秀梅,罗磊. 去氢骆驼蓬碱体外抗消化道肿瘤活性和对小鼠脾细胞增殖反应的抑制作用[J]. 中国现代应用药学,2008,25(s1):607-608.
WANG Jinjun, ZHANG Xiumei, LUO Lei. In vitro anti tumor activity and inhibition of proliferation of splenocytes in mice induced by hydrogen peroxide[J]. Chinese Journal of Modern Applied Pharmacy, 2008, 25(s1): 607-608(in Chinese).
[4] PATEL K, GADEWAR M, TRIPATHI R, et al. A review on medicinal importance, pharmacological activity and bioanalytical aspects of beta-carboline alkaloid ‘Harmine’[J]. Asian Pacific Journal of Tropical Biomedicine, 2012, 2(8): 660-664.
[5] 宋红健. 天然产物骆驼蓬碱和去氢骆驼蓬碱及其衍生物的合成、生物活性和构效关系研究[D]. 天津:南开大学,2014.
[6] 郭亮,孙洁,范文玺,等. 去氢骆驼蓬碱衍生物的合成和抗肿瘤活性研究[J]. 中国现代应用药学,2012,(5):385-388.
GUO Liang, SUN Jie, FAN Wenxi, et al. Synthesis and antitumor activities of harmine derivatives[J]. Chinese Journal of Modern Applied Pharmacy, 2012, (5): 385-388(in Chinese).
[7] 周雨朦,陈代杰. 秀丽隐杆线虫在药物筛选中的应用[J]. 上海医药,2011,32(11):566-571.
ZHOU Yumeng, CHEN Daijie. Applications of Caenorhabditis elegans in drug screening[J]. Shanghai Medical & Pharmaceutical Journal, 2011, 32(11): 566-571(in Chinese).
[8] 杨再昌,杨小生. 秀丽隐杆线虫(Caenorhabditis elegans)在药物筛选中的应用[J]. 生命科学,2009,21(4):593-598.
YANG Zaichang, YANG Xiaosheng. An application of Caenorhabditis elegans for drug screening[J]. Chinese Bulletin of Life Sciences, 2009, 21(4): 593-598(in Chinese).
[9] KOBET R A, PAN X, ZHANG B, et al. Caenorhabditis elegans: a model system for anti-cancer drug discovery and therapeutic target identification[J]. Biomolecules & Therapeutics, 2014, 22(5): 371-383.
[10]PEROZICH J, HEMPEL J, Jr M S. Roles of conserved residues in the arginase family[J]. Biochimica et Biophysica Acta, 1998, 1 382(1): 23-37.
[11]FUNKHOUSER J D, Jr A N. Chitinase family GH18: evolutionary insights from the genomic history of a diverse protein family[J]. BMC Evolutionary Biology, 2007, 7(1): 96.
[12]SINGH S, BROCKER C, KOPPAKA V, et al. Aldehyde dehydrogenases in cellular responses to oxidative/electrophilic stress[J]. Free Radical Biology & Medicine, 2013, 56(3): 89-101.
[13]AARNIO V, LEHTONEN M, STORVIK M, et al. Caenorhabditis elegans mutants predict regulation of fatty acids and endocannabinoids by the CYP-35A gene family[J]. Frontiers in Pharmacology, 2011, 2: 12.
[15]STIERNAGLE T. Maintenance of C. elegans[J]. Wormbook the Online Review of C Elegans Biology, 2006: 1-11.
[16]李娜,李圣坤,张前亮,等. 骆驼蓬中主要生物碱的电喷雾多级质谱裂解行为研究[J]. 西北大学学报:自然科学版,2013,43(6):909-911.
LI Na, LI Shengkun, ZHANG Qianliang, et al. Fragmentation pathway of main alkaloids fromPeganumharmalaL. by electrospray ionization tandem mass spectrometry[J]. Journal of Northwest University, 2013, 43(6): 909-911(in Chinese).
MetabolismResearchofHarmineinvivoofCaenorhabditiselegans
YUAN Jiang, JI Rui-fang, QUAN Qing-hua, WANG Jia-li, GUO Xiao-yu, ZHANG Jia-mei, TAN Peng, HAN Jing, LIU Yong-gang
(BeijingUniversityofChineseMedicine,Beijng100102,China)
Harmine is one ofβ-carboline alkaloid that significantly inhibits the multivulva phenotype oflet-60(n1046gf), a worm calledCaenorhabditiselegans. Therefore, harmine has an important potential application in pancreatic cancer. Metabolic researchinvivois one of the important ways of pharmacodynamic substance research, which can illuminate the existent form medicineinvivoand confirm the real active constituent of medicine. The fragmentation pathway of harmine was analyzed by ultra performance liquid chromatography-quadrupole-time of flight mass spectrometry (UPLC-Q-TOF MS), and the possible fragmentation pathways and characteristic fragment ions were determined. The metabolites of harmane inCaenorhabditiseleganswere studied by UPLC-Q-TOF MS. The MRM data acquisition model was used to study the content of harmine in the nematode worms at different time after administration by the semi-quantitative analysis. The results show that the fragment pathways of harmine are mainly RDA cleavage, including the loss of methyl groups and hydroxyl groups, and the cracking of indole ring. The metabolites of demethylated (m/z199) and hydroxylated (m/z229) of harmine (m/z213) were detected in positive ion mode. The results of semi-quantitative study show that the metabolism of nematodes is strong in 0-5 h, and the content of harmine is decreased by about 80%, the metabolism rate slows down after 5 h. The study can lay the foundation for the development of new drugs for the treatment of pancreatic cancer.
harmine;Caenorhabditiselegans; metabolism; fragmentation mechanism; ultra performance liquid chromatography-quadrupole-time of flight mass spectrometry (UPLC-Q-TOF MS)
2017-02-09;
2017-03-30
北京中医药大学校级课题(2016-JYB-QNJSZX003)资助
袁 将(1991—),男(汉族),山东临沂人,硕士研究生,中药化学专业。E-mail: bucmyj2015@163.com
刘永刚(1981—),男(汉族),山东临沂人,副教授,从事中药药效物质基础研究。E-mail: liuyg0228@163.com
韩 静(1977—),女(汉族),河北人,副研究员,从事中药活性研究。E-mail: hanjing8585@163.com
O657.63
:A
:1004-2997(2017)04-0478-08
10.7538/zpxb.2017.0025

