烟气暴露对大鼠代谢轮廓谱的影响
应旭辉,苏加坤,谢媛媛,王义明,罗娟敏,罗国安,郭 磊,蔡继宝
(1.珠海清大弘瑞生物科技有限公司,广东 珠海 519085;2.清华大学化学系,北京 100084;3.江西中烟工业有限责任公司,江西 南昌 330096)
烟气暴露对大鼠代谢轮廓谱的影响
应旭辉1,2,苏加坤3,谢媛媛2,王义明1,2,罗娟敏3,罗国安2,郭 磊3,蔡继宝3
(1.珠海清大弘瑞生物科技有限公司,广东 珠海 519085;2.清华大学化学系,北京 100084;3.江西中烟工业有限责任公司,江西 南昌 330096)
运用基于液相色谱-质谱联用技术的代谢组学方法研究了不同卷烟烟气暴露对大鼠内源小分子代谢物组的影响。分别建立了大鼠血清和尿液的代谢轮廓谱,分析了烟气暴露7天、14天和30天时对照组大鼠、普通卷烟暴露组大鼠及含有天然本草添加剂的某品牌卷烟暴露组大鼠的血浆和尿液样本,采用偏最小二乘判别分析(PLS-DA)对数据进行模式识别。结果表明,普通卷烟和天然本草添加卷烟均会影响大鼠整体代谢状态,干扰大鼠磷脂、能量代谢,并对其造成氧化损伤,但天然本草添加卷烟对大鼠的损伤程度低于普通卷烟。在烟气暴露30天时,一些重要标志物在各组相对含量的变化进一步证实了天然本草添加卷烟可降低烟气对大鼠整体代谢的影响,减轻烟气造成的损伤。因此,在烟草中加入天然本草添加剂可在一定程度上减少烟气对机体的伤害,改善体内因烟气干扰而紊乱的磷脂和能量代谢。
液相色谱-质谱(LC/MS);代谢组学;天然本草添加卷烟;血清;尿液;生物标志物
随着吸烟与健康问题的日益突出,烟草减害技术已成为国际烟草界研究的热点问题[1-2]。积极改进卷烟产品生产工艺,最大限度地降低吸烟对人体的伤害,是烟草行业对消费者的责任。传统的烟草减害研究主要以降低焦油释放量为主。
从烟草的本质与起源看,烟草本身就是一种特殊的天然植物药,是茄科植物烟草NicotianatabacumL.的全草。中医药书籍中很早就有记载将天然本草燃烧后闻吸烟气来治疗疾患,例如清代赵学敏《串雅外编》记载了运用“烟熏疗法”治疗“水肿上气”、“冬月喉痹”等疾病。受“烟熏疗法”等理论启发,我国科研人员将天然本草与卷烟结合,探索天然本草在卷烟减害中的应用,通过在卷烟中加入天然本草等添加剂以达到减害目的[5]。
烟气危害主要来自卷烟燃烧过程中形成的多环芳烃(PAHs)和自由基。其中,多环芳烃是烟气中最主要的致癌物[6];自由基一方面在高温条件下可转化为多环芳烃[7],另一方面对机体造成氧化损伤而引起各种疾病[8-10]。目前,已有文献报道,添加天然本草的卷烟可降低卷烟燃烧产生的多环芳烃和自由基的含量[11-12]。某品牌卷烟作为天然本草添加卷烟的代表之一,在其烟草中添加了一些补益肺肾的天然本草,显著地改善了烟气暴露小鼠的呼吸道刺激反应、机体抗氧化损伤、免疫抑制等危害,其机理可能是卷烟燃烧时产生了一些具有清除自由基、抗氧化功能的生物活性物质[13]。但是,目前对天然本草降害的生物学机理仍缺乏深入系统的研究。因此,有必要阐明天然本草添加卷烟减害过程的相关机理,为天然本草在烟草减害中的应用提供依据。
代谢组学是近年来生命科学领域研究的一大热点。通过研究生物体因外界干预等因素而产生的代谢物质和量的变化,从整体角度评价生物体的代谢状态,以更好地理解生命过程[14]。液相色谱-质谱(LC/MS)是代谢组学研究的常用技术之一,它具有灵敏度高、分辨率高、选择性好等优点。基于该技术的代谢组学方法已经应用于疾病诊断[15-16]、药效研究[17]、毒理研究[18]等领域。在烟气减害研究方面,石先哲等[19]将代谢组学方法用于薄荷烟对大鼠尿液代谢影响的研究,认为烟草中添加薄荷醇可改善烟草对大鼠代谢的影响。
本工作拟将LC/MS技术与偏最小二乘判别分析(PLS-DA)等多元统计分析方法结合,用于研究烟气对大鼠代谢的影响。通过查找生物标志物,希望更好地解释烟气暴露引发的机体损伤及添加天然本草减害的机理,这将对吸烟潜在危险及低危害烟的评价具有重要意义。
1 实验部分
1.1仪器与试剂
Waters AcquityTM超高效液相色谱系统:美国Waters公司产品,配有高压二元梯度泵、可控温自动进样器(最低4 ℃)和二极管阵列检测器; Waters Premier TOF飞行时间质谱检测器:美国Waters公司产品,配有ESI电离源接口和Lock-spray接口。
LC/MS级乙腈和HPLC级甲醇:美国Fisher公司产品;甲酸:纯度98%,比利时Acros公司产品;亮氨酸-脑啡肽标准品(leucine-enkephalin, LE):纯度≥97%,美国Sigma公司产品;LPC(16∶0)、LPC(18∶0):美国Avanti Polar Lipids公司产品;花生四烯酸 (C20∶4)、亚油酸 (C18∶2)、油酸(C18∶1)、棕榈油酸、棕榈酸、甲基马尿酸:美国Sigma-Aldrich公司产品;柠檬酸: 分析纯,北京化学试剂公司产品;超纯水:电阻率18.2 MΩ·cm-1,由Milli-Q超纯水系统制备;普通卷烟和某品牌卷烟:均由江西中烟工业有限责任公司提供。
1.2动物实验及样本前处理
1.2.1动物实验 将90只Wistar大鼠分成 对照组(不暴露于烟气中)、普通卷烟暴露组、某品牌天然本草添加卷烟暴露组,每组30只,并将每组再分成3个小组,每个小组10只,分别烟气暴露7天、14天和30天。每只大鼠每天分别暴露20 min,控制卷烟烟气遮光率为70%,温度为(22±2) ℃,湿度为(21±0.5)%,氧气浓度为(21±0.5)%,压力为(101 325±40) Pa。在烟气暴露7天、14天及30天时,称大鼠质量,在代谢笼中收集大鼠24 h尿液,经麻醉后在肝门静脉处取血约6~8 mL,放入经肝素钠处理过的10 mL离心试管中,迅速以3 000 r/min离心10 min,取上层血浆。各生物样品均于-80 ℃下保存。
1.2.2血浆及尿液样本前处理 取100 μL冻融后的样品(血浆或尿液),加入400 μL甲醇,涡旋1 min,充分混匀沉淀蛋白,于4 ℃下以13 000 r/min离心15 min,取上清液,加入300 μL超纯水稀释,经0.22 μm滤膜过滤。
QC样本制备方法:取等量部分烟气暴露14天的所有待测大鼠血浆样本,混合均匀后按上述方法处理样品;尿液QC样品的制备与血浆样本相同。
1.3实验条件
1.3.1色谱条件 色谱柱:AcquityTM-BEH C18反相分析柱(100 mm×2.1 mm×1.7 μm);柱温:40 ℃;流速:0.4 mL/min;自动进样器温度:4 ℃;进样量:4 μL;流动相:A为纯乙腈,B为0.1%甲酸水溶液;梯度洗脱,各样品梯度设置如下:1)血浆样本:0~3 min(5%~50%A),3~7 min(50%~60%A),7~10 min(60%~70%A),10~14 min(70%~95%A),14~17 min(95%A),17~19 min(95%~5%A),19~24 min(5%A);2)尿液样本:0~8 min(5%~50%A),8~10 min(50%~95%A),10~13 min(95%A),13~15 min(95%~5%A),15~19 min(5%A)。
1.3.2质谱条件 电喷雾离子源(ESI),分析采用V模式,在负离子模式下采集数据。检测参数设置如下:脱溶剂气流量600 L/h,脱溶剂气温度350 ℃,锥孔气流量40 L/h,离子源温度120 ℃,毛细管电压2 500 V,锥孔电压30 V,质量扫描范围m/z100~1 500,扫描时间0.2 s,扫描间隔0.02 s。采用2 μg/L亮氨酸-脑啡肽溶液为锁定质量校准液进行实时质量校准,选择“DRE”模式,流速2 μL/min;质量轴校准采用0.05 mol/L甲酸钠溶液。
1.4数据处理
1.4.1色谱数据的提取和前处理 采用Waters公司Markerlynx软件进行色谱峰自动识别和峰匹配,将所得数据导入SIMCA-P软件。在SIMCA-P软件中先对数据进行Mean-centering以及Pareto-scaling处理以减少大面积色谱峰带来的分析偏差,随后进行模式识别。用t检验分析两组间差异,p<0.05认为有显著性差异。
1.4.2多元统计分析 首先采用无监督的PCA方法观察样本的聚集和离散状态以及离群点。为了进一步区分烟气暴露组和对照组之间的差异,采用有监督的PLS-DA分析来判定对于造成这种聚集和离散的主要差异变量,根据PLS-DA分析中VIP(variable importance in projection)值(VIP>1)和PCA分析中的重要性(significance),结合t检验方法,筛选各组中具有明显差异的化合物(p<0.05)。
1.5差异表达代谢物的鉴定
运用MassLynx软件中的i-Fit功能,对所筛查到的具有差异的代谢物进行分析,计算其可能的分子式,并根据得到的质荷比和分子式检索数据库。查阅HMDB、KEGG等在线数据库,对比标志物的一级、二级质谱信息,完成代谢物的鉴定。其中,将花生四烯酸 (C20∶4)、亚油酸 (C18∶2)、油酸(C18∶1)、棕榈油酸、棕榈酸、甲基马尿酸等生物标志物的鉴定结果与对照品分析结果进行了比对确证。
2 实验结果
2.1生物样品的UPLC-Q-TOFMS分析
分别用QC样本考察血浆和尿液样本在正、负离子模式下的响应情况,其中血浆样本的检测结果示于图1。可以发现,各样本在正离子模式下基线本底较高,灵敏度降低,导致低丰度化合物检测不到;而在负离子模式下可得到更为丰富的信息。因此,本研究选用负离子检测模式。
为了保证分析方法的可靠性,在实际样品的整个分析过程中,穿插了6个QC样品,从各样品的基峰强度(BPI)色谱图中选取8个典型的色谱峰,统计保留时间和峰强度的变化情况,考察方法和样品的稳定性,QC样本的BPI图示于图2,方法考察结果列于表1。结果显示,各色谱峰的保留时间RSD在0.07%~0.63%之间,峰强度RSD在3.01%~6.65%之间,均小于10%,仪器的精密度及化合物的稳定性符合代谢组学研究的要求[15]。
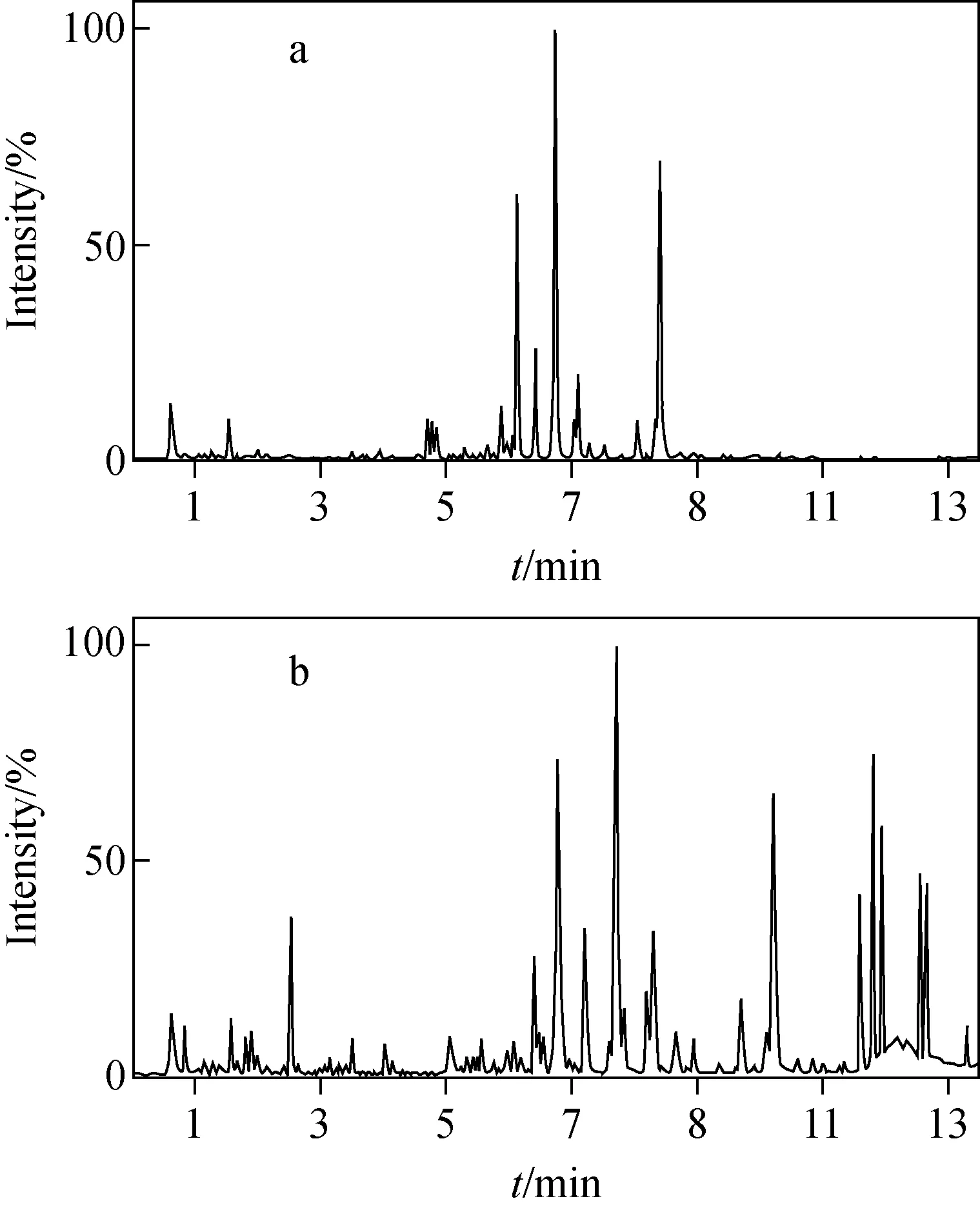
图1 正(a)、负(b)离子模式下,大鼠血浆样本质谱BPI图Fig.1 Base peak intensity (BPI) chromatograms of QC samples of rat plasma in positive (a) and negative (b) ion modes
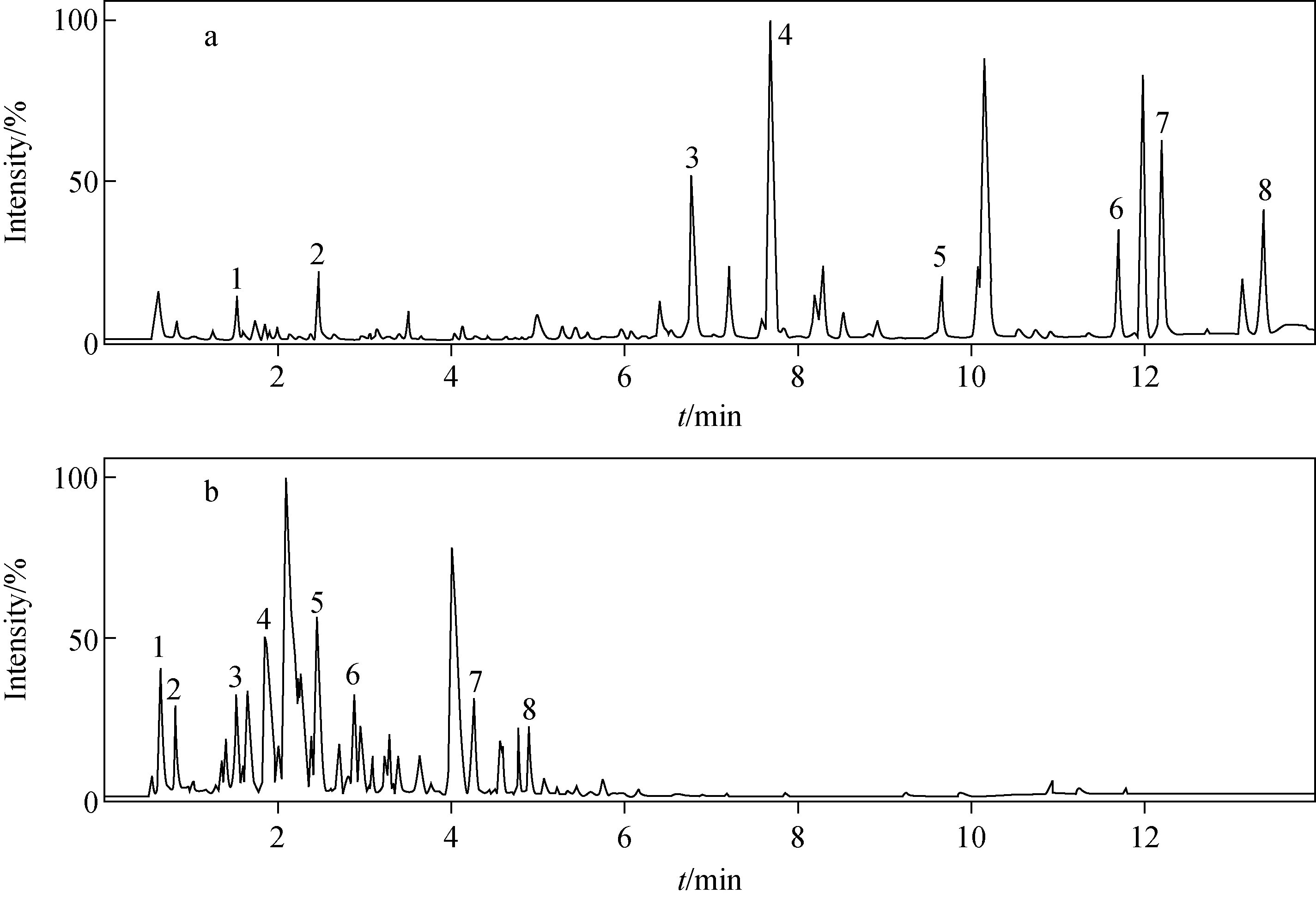
注:a.血浆;b.尿液图2 QC样品质谱BPI图Fig.2 Base peak intensity (BPI) chromatograms of QC samples

2.2烟气暴露大鼠血浆及尿液代谢组学分析
采用 PCA方法对对照组、普通卷烟暴露组和某品牌卷烟暴露组大鼠的血浆和尿液样本的代谢谱数据,按不同暴露时间分别进行模式识别。结果显示,虽然对照组和实验组能基本分开,但是组内样品间的离散较为严重,说明组内的个体差异较大,因此采用PLS-DA对各组样本进行判别分析。结果显示,各样品组内聚集情况较好,组间也能得到较好地分离。以烟气暴露7天大鼠的血浆样品为例,其结果示于图3。
将所有样品用PLS-DA模式进行识别分析,结果示于图4。可以看出,血浆样本组内聚集情况较好,而尿液的同组样品离散程度较高,这可能是因为尿液相比于血液的个体代谢差异更显著;各组样品间均能得到有效分离,且对照组和实验组也有较好地分离,说明吸烟对机体的代谢有一定的影响,可造成代谢紊乱;某品牌天然本草添加卷烟和普通卷烟两组间也具有较好的分离,说明两者对机体的影响有一定的差异。随着烟气暴露时间的增长,血浆和尿液样本PLS-DA分析图中某品牌卷烟组和对照组逐步靠拢,具有一定的回调趋势,而普通卷烟组和对照组始终保持一定的分离,说明在长期干预下,添加天然本草的某品牌卷烟可能对机体受到的损伤具有一定的保护作用,减缓机体损伤的进一步加重。

图3 烟气暴露7天,大鼠血浆样本PCA(a)与PLS-DA(b)模式识别比较Fig.3 PCA (a) and PLS-DA (b) results of plasma samples from three groups of rats exposed in smoke for 7 days

注:a.第7天血浆样本;b.第14天血浆样本;c.第30天血浆样本;d.第7天尿液样本;e.第14天尿液样本;f.第30天尿液样本图4 烟气暴露大鼠各时期3组样品PLS-DA分析结果Fig.4 PLD-DA results for three groups of rats suffering different smoke exposed times
2.3潜在生物标志物的鉴定及分析
根据PLS-DA分析中的VIP值,筛选各组中具有明显差异的化合物,共发现15个具有差异的化合物,结果列于表2。以m/z303.23(保留时间12.01 min)的代谢物为例说明其鉴定过程。在负离子模式下,得到准分子离子峰m/z303.231 0[M-H]-,经计算,其可能的分子式为C20H31O2(计算值303.233 3),质量偏差为7.58 ppm;在HMDB上检索,推测其可能为花生四烯酸,与对照品花生四烯酸比对后确定其结构。其中,血浆样本得到的标志物以磷脂及脂肪酸代谢为主,而尿液样本中得到的大多是与能量代谢和氧化损伤相关的标志物。

表2 潜在生物标志物鉴定结果Table 2 Identification results of the potential biomarkers
注:与对照组相比,↑表示上调,↓表示下调;*表示经标准品确认;P表示血浆样品,U表示尿液样品
几种已用标准品鉴定的重要代谢物在对照组大鼠、普通卷烟组大鼠和某品牌卷烟组大鼠生物样本中的相对含量变化示于图5。在烟气暴露第7天时,与对照组大鼠相比,各标志物在普通卷烟组和某品牌卷烟组大鼠中均具有显著差异,说明两种卷烟烟气暴露均会对机体造成损害;烟气暴露14天时,与对照组大鼠相比,各标志物在普通卷烟中仍具有显著性差异,但是某品牌卷烟组大鼠的各标志物显著性有所降低,甚至没有显著性,所以普通卷烟和某品牌卷烟的烟气暴露对机体造成的损伤程度不同。某品牌卷烟造成的损害相对较小,可能是其中天然本草成分高温裂解后,产生了可清除自由基的物质,从而减少了氧化损伤等伤害[12];当烟气暴露30天时,普通卷烟与对照组相比,仍具有显著性差异,但是某品牌卷烟暴露组大鼠的部分标志物水平有向正常水平回调的趋势,并且与普通卷烟相比,标志物的差异具有显著性。

注:a.血浆花生四烯酸;b.血浆LPC(18∶0);c.血浆LPC(16∶0);d.尿液柠檬酸;e.尿液甲基马尿酸;与对照组相比,*表示p<0.05,**表示p <0.01,***表示p<0.001;与对照组大鼠相比,Δ表示p <0.05图5 生物标志物在3组大鼠不同烟气暴露时期的相对含量Fig.5 Relative concentrations of the important metabolites in plasma and urine of the three groups of rats exposed to smoke for different times
3 讨论
由于血浆和尿液基质中化学成分的差异,本研究采用不同色谱条件分析血浆和尿液样品代谢轮廓谱,并依据峰形和重现性对分析条件进行优化。
卷烟烟气中含有大量自由基,会对机体造成较为严重的氧化损伤,在所得的标志物中,去氢抗坏血酸、3-羟基-3-甲基-2-羟基吲哚、硫酸吲哚酚、甲酚硫酸盐和甲基马尿酸均与氧化损伤相关,其中甲基马尿酸是脂肪酸β氧化的产物。在血浆样本中得到了多个与磷脂代谢相关的标志物,已有文献报道吸烟会引起磷脂降解[20],体内磷脂代谢异常可能与烟气中氧化性物质的吸入对机体细胞膜、脂蛋白、脂质等产生影响有关[20-22],磷脂代谢异常会增加心血管疾病的风险[23],特别是花生四烯酸水平的升高是心血管疾病的重要标志物之一[24],同时也是机体发生炎症反应的重要标志物之一[20],而炎症的发生与心血管疾病、癌症等疾病相关[25-26]。在尿液中得到了一些与能量代谢相关的标志物,其中磷酸胍基乙酸是体内合成肌酸的主要内源性物质,而肌酸是细胞内能量新陈代谢的重要分子和能量暂时存储的场所[27]。磷酸胍基乙酸和柠檬酸在体内水平降低说明吸烟对大鼠的能量代谢有一定的影响。
标志物中,花生四烯酸、LPC(18∶0)和LPC(16∶0)均与磷脂代谢有关,在烟气暴露30天时,某品牌卷烟暴露组大鼠体内的花生四烯酸水平降低而磷脂类的成分升高,说明大鼠的磷脂代谢有所好转,同时花生四烯酸作为心血管疾病的重要标志物,其在体内水平的降低,也说明了相比于普通卷烟,吸食某品牌卷烟可以在一定程度上降低引起心血管疾病的风险;柠檬酸与能量代谢相关,烟气暴露30天时,某品牌卷烟暴露组大鼠体内的柠檬酸相比于普通卷烟暴露组大鼠有显著地提升,说明大鼠体内的能量代谢有一定的好转;甲基马尿酸是脂肪酸β氧化的产物,与氧化损伤有关,在烟气暴露30天时,某品牌卷烟暴露组大鼠体内的甲基马尿酸水平有所降低,说明大鼠机体受到的氧化损伤也有一定程度的好转。
在早期,大鼠可能因接触烟气而有一定的应激反应,从而出现损伤;而在后期,某品牌卷烟暴露组大鼠有慢慢恢复的趋势,说明添加天然本草的卷烟对机体有一定的保护作用。但是,目前对于天然本草添加剂在卷烟中的作用机理有多种说法,一般认为,当含有天然本草添加剂的卷烟在燃烧时,该天然本草添加剂经挥发和升华等形成微粒相和气相成分,该类物质可捕获烟气中的自由基,降低多环芳烃类物质的生成,同时作用于呼吸系统或被肺泡吸收进入血液,从而对局部或全身起作用,减轻吸烟所引起的不良反应,使机体慢慢恢复[5]。
4 结论
本研究采用超高效液相色谱-高分辨质谱联用技术结合PLS-DA分析方法,对不同烟气暴露时期的对照组大鼠、普通卷烟暴露组和某品牌卷烟暴露组大鼠的血浆和尿液的代谢谱数据进行了模式识别。结果表明,普通卷烟和天然本草添加卷烟均会对大鼠造成损害,但是天然本草添加卷烟对大鼠的损伤程度要低于普通卷烟。一些重要标志物在各组相对含量的变化,特别是在烟气暴露后期的变化,说明了天然本草添加卷烟可能会减少烟气对机体的损伤并降低烟气对体内代谢的影响。但是,对于添加天然本草卷烟中的哪些天然本草成分,以什么形式,通过什么方式改善了烟气对体内代谢的影响,仍需进一步的研究和探讨。同时,天然本草添加剂随烟草燃烧时也会发生一系列的化学反应,需进一步通过毒理等实验来确定是否会产生新的有害物质。
[1] BRELAND A B, ACOSTA M C, EISSENBERG T. Tobacco specific nitrosamines and potential reduced exposure products for smokers: a preliminary evaluation of advance[J]. Tobacco Control, 2003, 12(3): 317-321.
[2] FROST-PINEDA K, ZEDLER B K, OLIVERI D, et al. 12-week clinical exposure evaluation of a third-generation electrically heated cigarette smoking system (EHCSS) in adult smokers[J]. Regulatory Toxicology & Pharmacology, 2008, 52(52): 111-117.
[3] KOZLOWSKI L T, FRECKER R C, KHOUW V, et al. The misuse of ‘less-hazardous’ cigarettes and its detection: hole-blocking of ventilated filters[J]. American Journal of Public Health, 1980, 70(11): 1 202-1 203.
[4] KOZLOWSKI L T, POPE M A, LUX J E. Prevalence of the misuse of ultra-low-tar cigarettes by blocking filter vents[J]. American Journal of Public Health, 1988, 78(6): 694-695.
[5] 孟冬玲,刘绍华. 天然本草添加剂在中国卷烟中的应用研究进展[J]. 中国烟草科学,2006,27(3):19-21.
MENG Dongling, LIU Shaohua. The development and application of herbal medical additions to Chinese cigarettes[J]. Chinese Tobacco Science, 2006, 27(3): 19-21(in Chinese).
[6] SCHERER G, FRANK S, RIEDEL K, et al. Biomonitoring of exposure to polycyclic aromatic hydrocarbons of nonoccupationally exposed persons[J]. Cancer Epidemiol Biomarkers Prev, 2000, 9(4): 373-380.
[7] 占新华,周立祥. 多环芳烃(PAHs)在土壤-植物系统中的环境行为[J]. 生态环境学报,2003,12(4):487-492.
ZHAN Xinhua, ZHOU Lixiang. Environmental behavior of PAHs in soil-plant system[J]. Ecology and Enviroment, 2003, 12(4): 487-492(in Chinese).
[8] CHURCH D F, PRYOR W A. Free-radical chemistry of cigarette smoke and its toxicological implications[J]. Environmental Health Perspectives, 1986, 64(3): 111-126.
[9] PRYOR W A, STONE K, ZANG L Y, et al. Fractionation of aqueous cigarette tar extracts: fractions that contain the tar radical cause DNA damage[J]. Chemical Research in Toxicology, 1998, 11(5): 441-448.
[10]HUSSAIN S P, HOFSETH L J, HARRIS C C. Radical causes of cancer[J]. Nature Reviews Cancer, 2003, 3(4): 276-85.
[11]柯亨林,赵殊,朱瑞瑞,等. 降低卷烟烟气中多环芳烃和自由基的中草药添加剂[J]. 华东理工大学学报,2002,28(1):74-78.
KE Henglin, ZHAO Shu, ZHU Ruirui, et al. A new additive for reducing free radicals and polycyclic aromatic hydrocarbons in cigarette smoke[J]. Journal of East China University of Science and Technology, 2002, 28(1): 74-78(in Chinese).
[12]祁俊生. 天然本草添加剂对烟气相自由基的影响[J]. 西南民族学院学报:自然科学版,1998,24(1):35-37.
QI Junsheng. Effect of the Chinese herbal medicines additive on the free radicals in gas-phase smoke[J]. Journal of Southwest University for Nationalities: Natural Science Edition, 1998, 24(1): 35-37(in Chinese).
[13]米娜. 中草药金圣香降低卷烟危害及机理研究[D]. 北京:中国人民解放军军事医学科学院,2007.
[14]许国旺,杨军. 代谢组学及其研究进展[J]. 色谱,2003,21(4):316-320.
XU Guowang, YANG Jun. Recent advances in metabonomics[J]. Chinese Journal of Chromatography, 2003, 21(4): 316-320(in Chinese).
[15]JIANG Z, SUN J, LIANG Q, et al. A metabonomic approach applied to predict patients with cerebral infarction[J]. Talanta, 2011, 84(2): 298-304.
[16]王勇,江芝婷,梁琼麟,等. 代谢组学法研究三聚氰胺对儿童尿液代谢的影响[J]. 高等学校化学学报,2010,31(1):57-60.
WANG Yong, JIANG Zhiting, LIANG Qionglin, et al. Metabonomics research of the influence of melamine to the urine metabolism of the children based on UPLC/TOF-MS[J]. Chemical Journal of Chinese Universities, 2010, 31(1): 57-60(in Chinese).
[17]LIANG X, CHEN X, LIANG Q, et al. Metabonomic study of Chinese medicine Shuanglong formula as an effective treatment for myocardial infarction in rats[J]. Journal of Proteome Research, 2011, 10(2): 790-799.
[18]梁晓萍,张政,胡坪,等. 蟾酥急性毒性的代谢组学研究[J]. 高等学校化学学报,2011,32(1):38-43.
LIANG Xiaoping, ZHANG Zheng, HU Ping, et al. Metabonomics study on the acute toxicity of Toad Venom[J]. Chemical Journal of Chinese Universities, 2011, 32(1): 38-43(in Chinese).
[19]石先哲,何智慧,窦阿波,等. 基于液相色谱-质谱联用技术的代谢组学方法研究薄荷烟对大鼠代谢的影响[J]. 色谱,2010,28(8):765-768.
SHI Xianzhe, HE Zhihui, DOU Abo, et al. Effect of menthol cigarette on rats for metabonomics by liquid chromatography-mass spectrometry[J]. Chinese Journal of Chromatography, 2010, 28(8): 765-768(in Chinese).
[20]VULIMIRI S V, MISRA M, HAMM J T, et al. Effects of mainstream cigarette smoke on the global metabolome of human lung epithelial cells[J]. Chemical Research in Toxicology, 2009, 22(3): 492-503.
[21]KAPLAN M, AVIRAM M. Oxidized low density lipoprotein: atherogenic and proinflammatory characteristics during macrophage foam cell formation. An inhibitory role for nutritional antioxidants and serum paraoxonase[J]. Clinical Chemistry & Laboratory Medicine, 1999, 37(8): 777-787.
[22]VAYSSIER-TAUSSAT M, CAMILLI T, ARON Y, et al. Effects of tobacco smoke and benzo[a]pyrene on human endothelial cell and monocyte stress responses[J]. Ajp Heart & Circulatory Physiology, 2001, 280(280): H1293-H1300.
[23]陆宗良. 血脂异常与心血管病危险因素控制[J]. 中华心血管病杂志,2001,29(5):62-64.
LU Zongliang. Dyslipidemia and cardiovascular disease risk factors control[J]. Chinese Journal of Cardiology, 2001, 29(5): 62-64(in Chinese).
[24]YALCIN M, AYDIN C. Cardiovascular effects of centrally administered arachidonic acid in haemorrhage-induced hypotensive rats: investigation of a peripheral mechanism[J]. Clinical & Experimental Pharmacology & Physiology, 2009, 36(4): 447-453.
[25]COUSSENS L M, WERB Z. Inflammation and cancer[J]. Nature, 2002, 420(6 917): 860-867.
[26]WILLERSON J T, RIDKER P M. Inflammation as a cardiovascular risk factor[J]. Circulation, 2004, 109(1): 2-10.
[27]王连生,张圆圆,单安山. 胍基乙酸的体内代谢及在动物生产中的应用[J]. 中国畜牧兽医,2010,37(6):13-16.
WANG Liansheng, ZHANG Yuanyuan, SHAN Anshan. Metabolism of guanidine acetic acid and application in animal production[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(6): 13-16(in Chinese).
InfluenceofCigaretteSmokeExposureonMetabolicProfilinginRats
YING Xu-hui1,2, SU Jia-kun3, XIE Yuan-yuan2, WANG Yi-ming1,2, LUO Juan-min3, LUO Guo-an2, GUO Lei3, CAI Ji-bao3
(1.ZhuhaiQingdaHongruiBiotechnologyCo.,Ltd.,Zhuhai519085,China; 2.DepartmentofChemsitry,TsinghuaUniversity,Beijing100084,China;3.TobaccoJiangxiIndustrialCo.,Ltd.,Nanchang330096,China)
The influences of different cigarette smoke exposure on endogenous small molecular metabolome were evaluated by metabolomics research on the basis of liquid chromatography-mass spectrometry (LC/MS). Plasma and urine samples from normal control rats, ordinary cigarette smoked rats and a certain commercial cigarette with herbal additives smoked rats were analyzed respectively to obtain the metabolic profiling. The rats were exposed to cigarette smoke for one week, half a month and one month. The data were processed by the method of partial least squares discriminant analysis (PLS-DA). The potential biomarkers were screened out according to VIP (variable importance in the projection) and identified by database and standards. The PLS-DA results at different cigarette smoke exposing periods showed that the metabolism of rats was affected by both ordinary cigarette smoke exposed group and the certain commercial cigarette smoke exposed group, mainly including phospholipid metabolism, energy metabolism and oxidative damage. However, the damage of the commercial cigarette smoked rats was lower than that of ordinary cigarette smoked rats. The relative concentration changes of some important biomarkers among the three groups, especially in one month, further confirmed that the herbal additives in the cigarette may relieve the influence of cigarette smoke on the holistic metabolome of rats, and improve their interfered metabolism, such us phospholipid and energy metabolism.
liquid chromatography-mass spectrometry (LC/MS); metabonomics; cigarette with herbal additives; serum; urine; biomarkers
2016-11-14;
2017-05-08
中国烟草总公司重大专项(110201401025(JH-03))资助
应旭辉(1985—),男(汉族),浙江杭州人,博士研究生,药学专业。E-mail: yxhtv@163.com
王义明(1945—),女(汉族),上海人,教授,从事生命分析化学研究。E-mail: wangyiming1688@163.com
蔡继宝(1973—),男(汉族),安徽含山人,研究员,从事烟草化学研究。E-mail: jbcai@ustc.edu.cn
O657.63
:A
:1004-2997(2017)04-0468-10
10.7538/zpxb.2016.0183

