基于超高效液相色谱-质谱联用技术的人参皂苷体外Ⅰ相代谢研究
冯桂芳,刘 舒,皮子凤,宋凤瑞,刘志强
(1.中国科学院长春应用化学研究所,吉林 长春 130022;2.中国科学技术大学,安徽 合肥 230026)
基于超高效液相色谱-质谱联用技术的人参皂苷体外Ⅰ相代谢研究
冯桂芳1,2,刘 舒1,皮子凤1,宋凤瑞1,刘志强1
(1.中国科学院长春应用化学研究所,吉林 长春 130022;2.中国科学技术大学,安徽 合肥 230026)
口服药物必须经过胃肠道的吸收代谢等过程才能进入体内发挥疗效,但是药物体内代谢的复杂性使其研究相对困难。因此,建立药物的体外代谢模型研究其代谢产物及代谢规律是简单且必要的实验手段。本研究采用离体肠道菌厌氧培养法对人参皂苷提取物进行体外培养,利用超高效液相色谱-质谱联用法(UPLC/MS)检测分析肠内菌代谢产物。通过比较代谢前后的化学指纹图,共检测到25种三醇型、15种二醇型人参皂苷体外肠内菌代谢物和1种齐墩果酸型体外肠内菌代谢物,这些代谢物主要通过去糖基作用产生,同时包括部分氧化还原反应。实验进一步对人参皂苷的主要肠内菌代谢物(包括Rh1、Rh2、Compound K、F1)进行体外肝细胞色素P450酶(CYP450)代谢研究,均检测到氧化还原反应代谢产物。结果表明,人参皂苷类成分在肠道菌群作用下主要产生去糖基化产物,而在CYP450作用下主要产生羟基化等氧化还原反应产物。该结果可为人参皂苷类成分的体内代谢研究提供重要参考。
人参皂苷;肠内菌代谢;肝细胞色素P450酶(CYP450);超高效液相色谱-质谱(UPLC/MS)
药物代谢是指药物分子被机体吸收后,在机体作用下发生化学结构改变的过程。一方面药物代谢对机体产生药效或者毒性等作用,另一方面机体也对药物产生作用,包括吸收、分布、排泄和代谢等,研究药物代谢能够更好地阐明药理作用的特点、结构的转变及发挥药效的成分[1-2]。药物体内代谢是一个复杂庞大的系统,不仅有各种内源性物质的参与,如脂质、氨基酸等,同时还有一系列的酶解过程,给药物代谢研究带来了巨大的挑战。传统的药物代谢研究方法[3-4]是通过给大鼠灌胃给药,然后检测不同时间点的血液、尿液等成分。但是存在一些问题,首先,大鼠的给药剂量是一定的,能够进入体内被吸收的物质是痕量的;其次,血液和尿液基质干扰较大[5-6],包括各种磷脂、蛋白等,无法分辨外源性和内源性物质;最后,代谢样品分析对检测器的相关性能,如选择性及灵敏度要求较高。因此,进行体外预实验对代谢产物定性,阐明代谢途径是必要的。
肠道是口服药的必经之路,也是药物代谢的重要组织器官,肠道内丰富的厌氧菌群对口服药物起主要的代谢作用。20世纪80年代药物体外肠内菌代谢研究技术开始兴起,采用的主要研究方法为:将离体大鼠的粪便在厌氧条件下与药液共同温孵,在不同的时间点用有机试剂终止反应,对孵育物经过一定的处理提取药物成分,利用液相色谱、液相色谱-质谱联用方法等检测。如Hattori, Akao等[7-8]利用人体肠内菌研究了甘草酸和芍药苷等一系列化合物的代谢;Kida, Wang, Xie等[9-11]对柴胡总皂苷、苷木酚、牛蒡子等一系列化合物进行了分析。随着肠内菌技术发展越来越成熟,对肠道菌群代谢的认识也越来越深入,体外肠道菌的孵育法已经成为一种普适的研究方法。
肝脏是药物代谢的主要器官,肝细胞色素P450酶(CYP450)简称肝药酶,人体内75%的代谢都是通过CYP450代谢完成的,包括一系列的亚酶CYP1A2、CYP2A6、CYP2C9、CYP2C19、CYP2D6、CYP2E1和CYP3A4等,参与了各种氧化还原反应及水解作用等[12]。国内外采用的研究方法众多,其中肝微粒体体外温孵法最常见,采用差速离心方法制备肝微粒体,辅以氧化还原型辅酶,在模拟生理温度及生理条件下进行生化反应[13],反应一定时间后,检测相应的代谢产物,从而确定其代谢特征及代谢途径。
人参皂苷是五加科人参属植物人参(PanaxginsengC. A Meyer)的主要成分。现代研究证明,人参皂苷具有多种药理作用,几乎可以作用于人体的各个生命系统,在抗炎、降血压、抗肿瘤、提高免疫力等方面均有一定的疗效。Kong等[14]对红参提取物进行了肠内菌代谢的研究;Wan等[15]对西洋参进行了肠内菌的研究,但是并没有对其代谢物进行深入地探讨及研究;而一些对人参皂苷CYP450的研究仅限于针对某个单一化合物的代谢行为[16-17]。
本工作拟采用离体实验的代谢研究方法,结合超高效液相色谱-四极杆-飞行时间高分辨质谱(UPLC-Q-TOF MS)及超高效液相色谱-离子阱多级串联质谱(UPLC-IT-MSn)技术对人参皂苷的代谢物进行研究,首先用富含肠内菌的粪便悬浮液与人参皂苷提取物在厌氧条件下温孵,然后利用LC/MS技术从温孵物中得到代谢产物,构建人参皂苷的肠内菌代谢指纹图,同时对主要的代谢产物进行体外CYP450代谢研究,该类化合物可能为主要的入血成分。通过对代谢物进行定性分析,推测其代谢途径,进一步阐明人参皂苷类成分在体内可能发生的代谢机制,以及形成系统的肠道-肝脏代谢体系,希望为体内代谢研究提供理论基础和依据。
1 实验部分
1.1仪器与试剂
Q-TOF SYNAPT G2超高效液相色谱-质谱联用仪:美国Waters公司产品,配有电喷雾离子源(ESI)及Waters MassLynx V4.1数据处理系统;Optima L-100xP制备型超速离心机、Allegra X-30R台式高速冷冻离心机:贝克曼库尔特实验系统(苏州)有限公司产品;MDF-382E型超低温冰箱:日本Sanyo公司产品;DY89-Ⅱ型电动玻璃匀浆机:宁波新芝生物科技股份有限公司产品;Sanorius BSl10S分析天平:北京赛多利斯有限公司产品;HZQ-X100振荡培养箱:黑龙江省哈尔滨市东联电子技术有限公司产品;SCHVTZ手套式厌氧培养箱:美国Thermo公司产品;KQ-500DE 数控超声波清洗器:昆山市超声仪器公司产品。
人参:购于吉林抚松参场,经长春中医药大学王淑敏教授鉴定为五加科人参的干燥根;人参皂苷标准品Rh1、Rh2、Compound K、F1、F2、Re、Rg1、Rg2、Rg3、Rf、Rb1、Rb2、Rb3、Rc和Rd:购于吉林大学药学院;还原型烟酰胺腺嘌呤二核苷酸磷(NADPH):罗氏制药有限公司产品;胰蛋白胨、牛肉膏、牛肝浸出粉、消化血清粉、大豆蛋白胨、可溶性淀粉:北京双旋微生物培养基制品厂产品;月示蛋白胨:青岛高科园海博生物技术有限公司产品;酵母浸膏和胰蛋白酶:英国Oxoid公司产品;硫代乙醇酸钠(分析纯):北京化学试剂公司产品;L-半胱氨酸盐酸盐:北京鼎国生物技术有限责任公司产品;磷酸二氢钾、氢氧化钠、六水合氯化镁:均为分析纯,北京北化精细化学品公司产品;甲醇、乙腈:均为色谱纯,美国Fisher公司产品;甲酸:色谱纯,美国ROE公司产品;水:超纯水,电导率为18.2 MΩ·cm-1;甲酸钠、亮氨酸脑啡肽:美国Milford公司产品。
雄性SD大鼠:批号SCXK-(辽)2010-0001,体重(200±20) g,由大连医科大学提供。
1.2实验条件
1.2.1色谱条件 ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm×1.7 μm);流动相:A相为0.1%甲酸-水溶液,B相为乙腈;流速0.3 mL/min;柱温30 ℃;进样量5 μL。肠内菌样品液相梯度:0~20 min(10%~30%B),20~40 min(30%~32%B),40~48 min(32%~100%B),48~50 min(100%B);CYP450样品液相梯度:0~5 min(10%~35%B),5~10 min(35%~50%B);10~20 min(50%~100%B);20~21 min(100%B)。
1.2.2质谱条件 电离源温度110 ℃;去溶剂气温度350 ℃;锥孔气和去溶剂气均为氮气,流速分别为50 L/h和600 L/h;负离子模式扫描;毛细管电压2.2 kV,锥孔电压40 V,萃取锥孔电压5.0 V,质量扫描范围m/z100~2 000。以亮氨酸脑啡肽(m/z554.261 5)进行实时质量校正,以甲酸钠作为标准液建立质量标准曲线。
1.3样品制备
1.3.1样品处理过程 称取20 g人参粉末,加入160 mL 75%乙醇溶液中,浸泡1 h,加热回流提取2次,每次2 h,过滤,合并滤液;以10 000 r/min离心10 min,取上清液,抽滤,滤液于60 ℃旋转蒸发浓缩至30 mL,冻干,保存于干燥器中;培养液溶解用于肠内菌代谢底物。
1.3.2培养基的配制 取1 g胰蛋白胨、1 g月示蛋白胨、0.5 g酵母浸膏、1.35 g消化血清粉、1.2 g牛肝浸出粉、0.22 g牛肉膏、0.5 g可溶性淀粉、0.5 g NaCl、0.3 g葡萄糖、0.25 g磷酸二氢钾、0.03 gL-半胱氨酸盐、0.03 g硫代乙醇酸钠,溶于100 mL水中,调至pH 7.1~7.2,高压灭菌,待用。
1.3.3肝微粒体的制备[18]选取200 g雄性SD大鼠,保持12 h明暗交替,在实验环境下适应5天以上,然后连续4天通过大鼠腹腔注射苯巴比妥诱导大鼠肝脏表达CYP3A4。实验前动物禁食18 h,将所用器具、试剂置于4 ℃预冷。动物脱臼处死后迅速用注射器以4 ℃生理盐水由门静脉灌洗,至肝脏呈土黄色,取出肝脏,然后用生理盐水洗净表面的血渍,将肝脏剪碎,加入TMS缓冲液,冰浴中匀浆,超声分散30 s。匀浆液在4 ℃以15 000 r/min离心20 min,上清液用4层纱布过滤除去漂浮脂类物;再将上清液于4 ℃以100 000 r/min离心60 min,弃上清液,向沉淀中加入TMS缓冲液重新混悬;最后于4 ℃以100 000 r/min离心60 min,沉淀部分即微粒体,加入Tris-HCl储存液,重悬微粒体,冰浴,玻璃匀浆管手动研磨使微粒体均匀分散,分装微粒体,于-80 ℃保存。
1.3.4肠内菌液收集与制备 实验组:称取2 g大鼠新鲜粪便,向其中加入已灭菌的GAM培养基,以5 000 r/min离心5 min,取上清液,每5 mL菌液中加入4 mL GAM液及1 mL人参提取物,生药量为0.3 g。厌氧培养,分别于0、2、8、24、48、72、96 h各取出500 μL培养液(其中0 h为对照组),用等体积的水饱和正丁醇萃取,以10 000 r/min离心10 min后,吸出上层溶液,蒸干溶剂,残渣用甲醇复溶,再以12 000 r/min离心10 min后,取上清液,用于LC/MS检测。
空白组:1 mL GAM液代替1 mL人参提取物溶液,其它操作同实验组。
1.3.5微粒体孵育反应体系 实验组:微粒体孵育采用150 μL酶反应体系,即pH 7.4的100 mmol/L磷酸钾缓冲溶液、0.5 g/L微粒体蛋白(从-80 ℃冰箱中取出后于冰上解冻),1 mmol/L NADPH、4 mmol/L氯化镁和20 μmol/L的底物(反应中所用有机试剂终体积不超过1%),于37 ℃摇床中预孵5 min,反应由NADPH溶液启动。分别于0、30、60、90、120 min时用冰乙腈溶液终止(其中0 min为对照组),然后将孵育混合物于12 000 r/min离心10 min,取上清液,用于UPLC/MS分析。
空白组:用等量的磷酸钾缓冲溶液代替底物溶液,其它操作同实验组。
2 结果与讨论
2.1人参皂苷肠内菌代谢研究
对人参提取物进行体外肠内菌培养,设置对照组和空白组用于排除大鼠粪便中其它基质物质和厌氧培养液残留成分的干扰。对照组,即代谢时间为0 h代谢组,用于确定原型药物的出峰时间及含量变化,其总离子流图示于图1a。人参皂苷在肠内菌作用下代谢48 h的代谢产物最为丰富,其总离子流图示于图1b。空白组,即不含底物的孵育组,排除肠内菌基质干扰,其总离子流图示于图1c。所有组别的质谱检测数据通过Masslynx V4.1软件处理,找到代谢差异物,并提取其精确分子质量及保留时间信息,再通过多级串联质谱碎裂方式得到碎片离子信息,结合文献报道等信息推测可能的结构。
以组分M31和M32为例,在质谱负离子模式下,它们具有相同的准分子离子峰m/z667.443 6,保留时间分别为44.16 min和44.54 min,推测两者为同分异构体。由于其色谱出峰时间相对靠后,推测极性相对较小,可能为人参三醇型或齐墩果酸型的代谢产物,根据准分子离子峰的精确质量信息得到其可能的元素组成为C37H63O10。通过进一步多级串联质谱分析,检测到碎片离子m/z621、459,说明准分子离子m/z667为代谢产物的甲酸加合峰,其实际分子式为C36H62O8,这些碎片离子是人参三醇型的特征碎片离子,根据以上信息可初步判断M31和M32分别为化合物Rh2和Compound K。结合文献[15,19]报道,Compound K出峰时间靠前,因此推断M31为化合物Compound K,M32为化合物Rh2。

图1 人参皂苷提取物的肠内菌代谢0 h(a)、48 h(b)及空白对照组(c)的基峰色谱图Fig.1 Base peak UPLC-Q-TOF MS chromatogram of ginseng extract intestinal microflora metabolism of 0 h (a), 48 h (b) and blank group (c)
此外,还检测到3个准分子离子m/z665.428 8(M7、M22、M30),它们的质量数比Compound K和Rh2少2 u,并且它们的特征碎片离子质量数与Rh2和Compound K的特征碎片离子也相差2 u,精确离子质量信息得到的元素组成为C37H61O10,比C37H63O10减少了2个氢,推断可能为Rh2或Compound K的去氢氧化产物。结合色谱保留时间,发现M7出峰时间比M22和M30靠前。M7可能为三醇型代谢物,Rh1的脱水代谢产物;M22和M30为人参二醇型代谢物。基于以上思路,推测出部分氧化还原产物,如羟基化产物M1、M2、M5及M11等,去氢产物M7、M22及M30等,共鉴定出32种代谢物,其质谱信息列于表1。
根据得到的代谢指纹图推测主要人参皂苷的代谢途径,包括人参二醇型皂苷、齐墩果酸型皂苷及人参三醇型皂苷,它们的代谢途径分别示于图2~4。其中,黑色实线代表文献已有报道的代谢途径,主要通过去糖基化作用代谢;黑色虚线代表鲜有报道的代谢途径。
2.2人参皂苷CYP450代谢研究
药物肠内菌代谢物通过小肠上皮细胞吸收进入体内后,经门静脉系统进入肝脏,并在肝脏中进一步发生代谢反应。因此,需要选取主要的人参肠内菌代谢物进行进一步的体外CYP450代谢研究,包括Compound K、Rh1、Rh2和F1,这些代谢物为主要的入血成分及在体内发挥主要药理作用的成分。通过LC/MS技术分析了所选人参皂苷化合物经CYP450孵育代谢前后的溶液,得到总离子流图,导入Masslynx V4.1软件中分析,鉴定各个皂苷类成分经CYP450代谢的产物。
其中,化合物Rh1孵育样品检测到3个代谢物峰,准分子离子峰均为m/z699.426 6,元素组成为C37H63O12,初步推测是单加氧代谢物。通过进一步串联质谱分析,检测到碎片离子m/z653、491等,它与化合物Rh1的碎片离子均相差16 u。结合相关文献[20]报道,发现氧原子首先进攻-24/25位,形成环氧结构,但是由于-20位羟基的存在,这个化合物不稳定,会进一步发生异构化,即-20位的羟基进攻-24位,形成五元杂环的稳定结构,并以24-R/S异构体的形式同时存在,过程示于图5。
化合物F1孵育样品检测到明显的代谢物峰,出峰时间在原型化合物后面,准分子离子峰相差2 u,初步推测为去氢氧化产物。通过串联质谱分析,检测到相似规律的碎片离子m/z635、473等,且相差2 u,均为糖苷键碎裂后产生的碎片离子,推测化合物F1是通过去氢氧化作用代谢,化合物F1的20位为葡萄糖基,发生单加氧的可能性较小,检测到的代谢产物符合化合物F1的结构特点。由于化合物F1母核为五环三萜结构,非常稳定,在多级串联质谱中不易产生碎片离子,因此无法推测化合物F1具体的氧化位置,仍需进一步研究。

表1 负离子模式下,人参皂苷肠内菌代谢物的LC/MS信息数据Table 1 LC/MS data of metabolites identified in the ginseng extract at the negative ion mode
注:PPD为人参二醇型皂苷代谢物,PPT为人参三醇型皂苷代谢物;*表示同分异构体
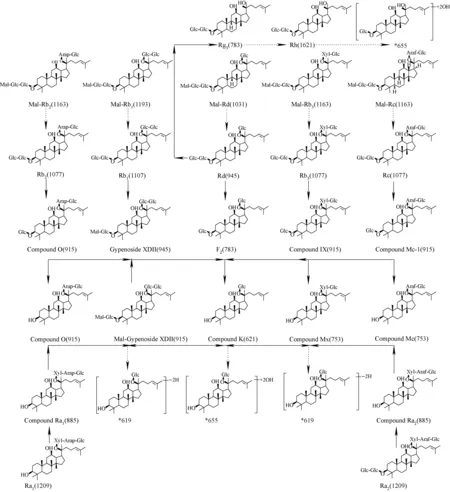
图2 人参二醇型皂苷可能的肠内菌代谢途径Fig.2 Proposed metabolic pathways of protopanoxadiol-type saponins

图3 齐墩果酸型皂苷可能的肠内菌代谢途径Fig.3 Proposed metabolic pathways of ginseng including oleanane-type saponins

图4 人参三醇型皂苷可能的肠内菌代谢途径Fig.4 Proposed metabolic pathways of protopanaxatriol-type saponins
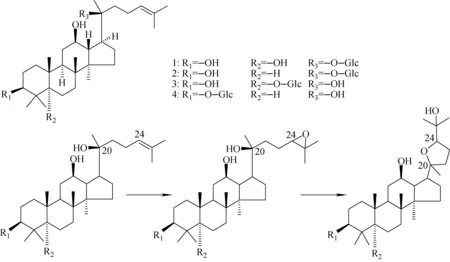
图5 人参皂苷肠内菌的主要代谢物结构及CYP450羟基化代谢过程Fig.5 Chemical structural of main metabolites via intestinal microflora and the specific pathways of hydroxylation via CYP450
3 结论
根据口服药物的首过效应原理,本工作采用体外肠内菌代谢和CYP450代谢研究模型结合超高效液相色谱-质谱联用法分析人参皂苷的主要代谢产物及代谢途径。结果发现,人参皂苷类成分在肠道菌群作用下主要产生去糖基化产物,生成更易吸收的弱极性成分。肠内菌代谢的主要产物在CYP450作用下,主要产生羟基化等氧化还原反应产物。该方法初步阐明了人参皂苷I相代谢的循序渐进及系统性,可为后续的人参皂苷类成分的体内代谢研究提供重要参考。
[1] YANG X D, YANG Y Y, OUYANG D S, et al. A review of biotransformation and pharmacology of ginsenoside compound K[J]. Fitoterapia, 2015, (100): 208-220.
[2] CHEN X P, LIN Y P, HU Y Z, et al. Phytochemistry, metabolism, and metabolomics of ginseng[J]. Chinese Herbal Medicines, 2015, 7(2): 98-108.
[3] 张松,曹峻华,刘文文. 固相萃取-液相色谱-串联质谱法检测血液中海洛因及其代谢产物[J]. 质谱学报,2015,36(4):367-371.
ZHANG Song, CAO Junhua, LIU Wenwen. Determination of heroin and its metabolites in addict’s blood by solid phase extraction and LC MS/MS[J]. Journal of Chinese Mass Spectrometry Society, 2015, 36(4): 367-371(in Chinese).
[4] 李文兰,白晶,臧宝珊,等. HPLC-ESI-Q-TOF MS/MS分析肉苁蓉拟雌激素活性部位入血成分[J]. 质谱学报,2015,36(3):223-228.
LI Wenlan, BAI Jing, ZANG Baoshan, et al. Analysis of absorbed components in rat plasma after oral adminstranstion of quasi estrogen fraction of cistanche by HPLC-ESI-Q-TOF MS/MS[J]. Journal of Chinese Mass Spectrometry Society, 2015, 36(3): 223-228(in Chinese).
[5] SCHIMEK D, FRANCESCONI K A, MAUTNER A, et al. Matrix removal in state of the art sample preparation methods for serum by charged aerosol detection and metabolomics-based LC-MS[J]. Analytica Chimica Acta, 2016, (915): 56-63.
[6] ESTEVE-ROMERO J, ALBIOL-CHIVA J, PERIS-VICENTE J. A review on development of analytical methods to determine monitorable drugs in serum and urine by micellar liquid chromatography using direct injection[J]. Analytica Chimica Acta, 2016, (926): 1-16.
[7] HATTORI M, SAKAMOTO T, YAMAGISHI T, et al. Metabolism of glycyrrhizin by human intestinal flora. Ⅱ. Isolation and characterization of human intestinal bacteria capable of metabolizing glycyrrhizin and related compounds[J]. Chemical and Pharmaceutical Bulletin, 1985, 33(1): 210-217.
[8] AKAO T, ZHONG SHU Y, MATSUDA Y, et al. Metabolism of paeoniflorin and related compounds by human intestinal bacteria[J]. Chemical and Pharmaceutical Bulletin, 1985, 36(8): 3 043-3 048.
[9] KIDA H, AKAO T, MESELHY M, et al. Enzymes responsible for the metabolism of saikosaponins from Eubacterium sp. A-44, a human intestinal anaerobe[J]. Biological and Pharmaceutical Bulletin, 1997, 20(12): 1 274-1 278.
[10]WANG L Q, MESELHY M R, LI Y, et al. Human intestinal bacteria capable of transforming secoisolariciresinoldiglucoside to mammalian lignans, enterodiol and enterolactone[J]. Chemical and Pharmaceutical Bulletin, 2000, 48(11): 1 606-1 610.
[11]XIE L H, AHN E M, AKAO T, et al. Transformation of arctiin to estrogenic and antiestrogenic substances by human intestinal bacteria[J]. Chemical and Pharmaceutical Bulletin, 2003, 51(4): 378-384.
[12]李晓宇,刘皋林. CYP450酶特性及其应用研究进展[J]. 中国临床药理学与治疗学,2008,13(8):942-946.
LI Xiaoyu, LIU Haolin. Research advance on the characteristics and application of CYP450 metabolic enzymes[J].Chin J Clin Pharm Therap, 2008, 13(8): 942-946(in Chinese).
[13]ZHANG X, ZHANG J, LI W, et al. In vitro metabolism of 20(R)-25-methoxyl-dammarane-3, 12, 20-triol fromPanaxnotoginsengin human, monkey, dog, rat, and mouse liver microsomes[J]. Plos One, 2014, 9(4): e94962.
[14]KONG H, WANG M, VENEMA K, et al. Bioconversion of red ginseng saponins in thegastro- intestinal tract in vitro model studied by high-performance liquid chromatography-high resolution Fourier transform ion cyclotron resonance mass spectrometry[J]. Journal of Chromatography A, 2009, 1 216(11): 2 195-2 203.
[15]WAN J Y, LIU P, WANG H Y, et al. Biotransformation and metabolic profile of American ginseng saponins with human intestinal microflora by liquid chromatography quadrupole time-of-flight mass spectrometry[J]. Journal of Chromatography A, 2013, 1 286(8): 83-92.
[16]CHIU N T, TOMLINSON GUNS E S, ADOMAT H, et al. Identification of human cytochrome P450 enzymes involved in the hepatic and intestinal biotransformation of 20(S)-protopanaxadiol[J]. Biopharmaceutics & Drug Disposition, 2014, 35(2): 104-118.
[17]HAO H, LAI L, ZHENG C, et al. Microsomal cytochrome P450-mediated metabolism of protopanaxatriol ginsenosides: metabolite profile, reaction phenotyping, and structure-metabolism relationship[J]. Drug Metabolism and Disposition, 2010, 38: 1 731-1 739.
[18]毕云枫,郑重,皮子凤,等. 川乌与白芍配伍对 CYP450 酶活性影响及其代谢指纹的研究[J]. 药学学报,2014,49(12):1 705-1 710.
BI Yunfeng, ZHENG Zhong, PI Zifeng, et al. The metabolic fingerprint of the compatibility of Radix Aconite and Radix Paeoniae Alba and its effect on CYP450 enzymes[J]. Acta Pharmaceutic Sinica, 2014, 49(12): 1 705-1 710(in Chinese).
[19]WANG H Y, HUA H Y, LIU X Y, et al. In vitro biotransformation of red ginseng extract by human intestinal microflora: metabolites identification and metabolic profile elucidation using LC-Q-TOF/MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 98(10): 296-306.
[20]KASAI R, HARA K, DOKAN R, et al. Major metabolites of ginseng sapogenins formed by rat liver microsomes[J]. Chemical & Pharmaceutical Bulletin, 2000, 48(8): 1 226-1 227.
StudyontheIPhaseMetabolismofGinsenosideinvitrobyUltraPerformanceLiquidChromatographyCoupledwithMassSpectrometry
FENG Gui-fang1,2, LIU Shu1, PI Zi-feng1, SONG Feng-rui1, LIU Zhi-qiang1
(1.ChangchunInstituteofAppliedChemistry,ChineseAcademyofSciences,Changchun130022,China; 2.UniversityofScienceandTechnologyofChina,Hefei230026,China)
All the drugs taken orally must undergo the process of absorption and metabolism of gastro-intestinal tract. It is difficult to conduct simply operated experimentinvivoconsidering the complexity of drug metabolism, such as matrix effect, individual difference and so on. Therefore, it is necessary to establish the model of drug metabolisminvitroand to study the metabolites and rules of metabolism. Drug metabolism is usually divided into 2 phases: Ⅰphase and Ⅱ phase metabolism. Ⅰ phase metabolism was taken via functionalization reactions. This study mainly researched I phase metabolism of ginseng.Invitrobiotransformation of ginseng extract by intestinal flora and liver cytochrome (CYP450) in turn was performed. Firstly, ginsenoside extract wasinvitrocultured with isolated intestinal bacteria under anaerobic conditions, and the incubation samples were analyzed by ultra-performance liquid chromatography tandem mass spectrometry (UPLC/MS). And then, the chemical fingerprint before and after metabolism were compared to identify the metabolites. 25 panaxatriol-type saponins metabolites, 15 protopanoxadiol-type saponins metabolites and one oleanane-type saponins metabolites were detected from the incubation samples, among of which were biotransformed mainly through deglycosylation and a few through oxidation reduction reaction. The metabolic profile of ginseng saponins biotransformed via intestinal flora was described based on the information of metabolites. The main intestinal bacteria metabolites (including Rh1, Rh2, Compound K, F1) were studied further via rat liver cytochrome P450 enzyme (CYP450)invitro. The CYP450 was obtained through a series of differential centrifugation steps. The incubation was under 37 ℃ in shaker incubator. All of these compounds were metabolized by redox reaction detected by UPLC/MS. The results showed that ginsenosides mainly produced deglycosylation products under the action of intestinal bacteria, and oxidation reduction reaction products under the action of CYP450. I phase metabolism plays a role in promoting drug absorption and increasing the polarity of the compounds. The results can provide an important reference forinvivometabolism studies of ginsenosides in further.
ginsenoside; intestinal bacteria metabolism; CYP450; ultra-performance liquid chromatography tandem mass spectrometry (UPLC/MS)
2016-12-28;
2017-03-07
国家自然科学基金重点项目(81530094);国家自然科学基金面上项目(81573574、81473537)资助
冯桂芳(1991—),女(汉族),湖北潜江人,博士研究生,物理化学专业。E-mail: mslab25@ciac.jl.cn
刘志强(1962—),男(汉族),吉林白城人,研究员,从事中药药效物质基础及作用机制研究。E-mail: liuzq@ciac.jl.cn
O657.63
:A
:1004-2997(2017)04-0450-10
10.7538/zpxb.2016.0212

