结直肠癌原发肿瘤部位对术后患者生存的影响
刘静 李文雅 曲秀娟 曲晶磊 陈颖 赵婉聿 李智 刘云鹏
结直肠癌原发肿瘤部位对术后患者生存的影响
刘静 李文雅 曲秀娟 曲晶磊 陈颖 赵婉聿 李智 刘云鹏
目的 探讨大肠癌原发肿瘤部位与临床病理特征的关系,以及原发肿瘤部位对生存的影响。方法 纳入2000年9月至2016年4月就诊于中国医科大学附属第一医院肿瘤内科的I~III期根治性切除术后大肠癌患者,分析大肠癌原发肿瘤部位与临床病理特征的关系,以及对预后的影响。结果 1 345例大肠癌患者根据原发肿瘤部位不同,分为直肠、左半结肠、右半结肠3组。结果显示,原发肿瘤部位与性别(χ2=10.943;P=0.004)、组织学分级(χ2=12.402;P=0.015)、病理T分期(χ2=49.794;P<0.001)、TNM分期(χ2=30.102;P<0.001)显著相关。生存分析结果显示,3组间的生存时间差异未见明显统计学意义(χ2=4.806;P=0.09)。单因素分析发现,原发肿瘤位置与预后未见显著相关性(χ2=2.938;P=0.088),而淋巴结转移数目(χ2=39.739)及TNM分期(χ2=23.872)与预后显著相关,P值均<0.001;多因素分析结果显示,仅淋巴结转移数目与预后显著相关(95%CI:1.210~2.317;P=0.002)。结论 根治性切除术后结直肠癌的原发肿瘤部位不同,其临床病理特征有所不同。原发肿瘤部位与预后未见显著相关性,仅淋巴结转移数目可作为独立预后因素。
结直肠肿瘤; 预后; 原发肿瘤部位; 临床病理特征
结直肠癌是全世界最常见的恶性肿瘤之一,在世界范围内其发病率居所有癌症的第三位。每年有超过120万新发病例,超过6万患者死于结直肠癌[1]。发展中国家的发病率一直呈上升趋势,其中包括亚洲大部分地区,部分南美洲国家和东欧[2]。近些年来,随着对大肠癌的不断深入研究,发现原发肿瘤位置不同,其临床病理特征、预后及生物标记物等方面也会有所不同。1990年,Buf i ll第一个提出将结肠癌分为左半结肠癌及右半结肠癌,原发癌肿的不同位置可能会通过不同的生物学途径导致疾病[3]。为何会出现此种不同的原因至今仍不能确定,近些年来,很多研究针对左、右半结肠癌做了大量回顾性分析,证实左右半结肠癌在很多方面存在差异,甚至可以说是不同疾病。深入分析不同部位肿瘤的不同生物学特征,进而明确其对预后和疗效的影响,是实现个体化精准治疗的重要前提。
本研究拟对根治性切除术后结直肠癌患者的原发肿瘤部位与临床病理特征进行分析,并分析原发肿瘤部位对预后的影响。
资料与方法
一、一般资料
选取2000年9月至2016年4月就诊于中国医科大学附属第一医院肿瘤内科的1 345例根治术后大肠癌患者,所有患者均经病理学证实。回顾性收集临床资料,进行大肠癌原发肿瘤位置与临床病理特征及预后的关系分析。根据住院病历、随访表、电话或来院随访确定患者生存时间。末次随访时间为2016年8月1日。
二、统计学处理
运用SPSS 21.0软件处理数据,组间差异的计数资料使用卡方检验;原发肿瘤位置与总生存期(overall survival,OS)的关系应用Kaplan-Meier生存曲线分析;COX模型进行单因素及多因素分析;P<0.05为差异有统计学意义。
结 果
一、原发肿瘤部位与临床病理特征的关系
将1 345名大肠癌患者按照原发肿瘤部位的不同分为直肠癌,左半结肠癌和右半结肠癌3组,各组例数及临床病理特征见表1。分析原发肿瘤部位与性别、年龄、组织学类型、病理T分期、淋巴结转移数目、TNM分期的关系,其中性别(χ2=10.943;P=0.004)、组织学分级(χ2=12.402;P=0.015)、病理T分期(χ2=49.794;P<0.001)、TNM分期(χ2=30.102;P<0.001)在3组间显示出明显差异:三组间,右半结肠癌女性比例高于其他两组;病理类型中右半结肠癌黏液性癌的比例较高;右半结肠癌病理T分期中T4分期较多见;I期患者直肠癌所占比例较高,而III期患者直肠及右半结肠所占比例高于左半结肠。而年龄(χ2=5.081,P=0.079)和淋巴结转移数目(χ2=10.213;P=0.116)与肿瘤部位无关。

表1 原发肿瘤部位与临床病理特征的关系(例,%)
二、原发肿瘤部位与预后的关系
分析不同部位原发肿瘤与预后的关系,结果显示根治性切除大肠癌患者3年生存率为92.8%,5年生存率为91.3%,总生存期3组间未见显著性差异(χ2=4.806;P=0.09)(图1)。将原发肿瘤部位与性别、年龄、组织学类型、病理T分期、淋巴结转移数目、TNM分期等临床病理特征进行单因素分析,结果见表2。原发肿瘤位置与预后未见明显相关性(χ2=2.938;P=0.088),而淋巴结转移数目(χ2=39.739)及TNM分期(χ2=23.872)与预后可见显著相关性,P值均<0.001;将原发肿瘤部位、淋巴结转移数目及TNM分期进行COX多因素分析,结果显示淋巴结转移数目与预后可见显著相关性(95%CI:1.210~2.317;P=0.002)(表2)。

图1 原发肿瘤部位与OS关系
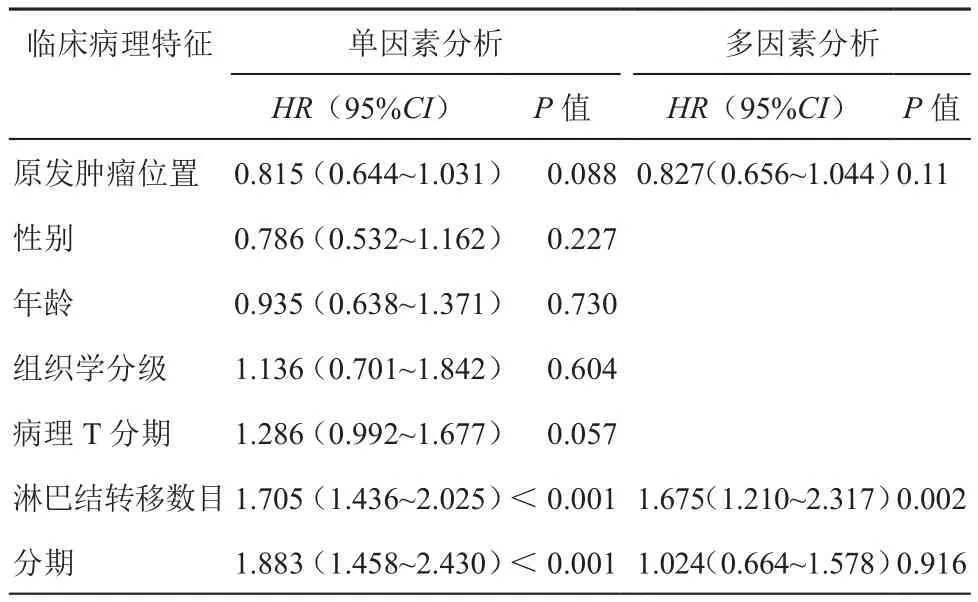
表2 结直肠癌临床病理特征与预后的单因素及多因素分析
讨 论
科技日益发展的今天,针对肿瘤患者的个体化诊治越来越受到重视,大肠癌患者临床病理特征、生物标记物与预后的分析也越来越受到学者的关注。近些年来,很多学者致力于研究大肠癌原发肿瘤位置与临床病理特征的关系,以及在判断预后及预测疗效方面所起的作用。而导致左右半结直肠癌临床病理特征的不同,可能是因为两者生物起源、微环境、血液供应的不同[4]。近端结肠(即右半结肠)起源于中肠,解剖特点是肠腔较大、肠壁较薄、血液供应较丰富;远端结肠(即左半结直肠)起源于后肠,其解剖特点为肠腔窄,肠系膜下动脉为其营养血管,动脉血管较肠系膜上动脉细,而且血管弓较小,血供较差[5]。现有研究发现,左半结肠癌多见于男性,诊断时患者较年轻,合并症相对少见,诊断时临床分期一般较早期,病理类型多为平坦型,分化程度较好,预后较好。右半结肠癌多见于女性,诊断时年龄较大,临床分期较晚,淋巴结转移较多见,这可能与其临床症状较隐匿有关,病理类型以粘液癌更多见,预后较差[6-8]。
单独研究原发肿瘤位置与临床病理特征及预后的文献较少,大多数在不同研究的亚组分析中提及,结论也不尽相同。本研究在以往研究的基础上对大肠癌患者原发肿瘤部位与临床病理特征及预后的关系进行了分析。在临床病理特征方面,大部分欧洲研究结果较一致,女性在右半结肠癌比例高于直肠及左半结肠癌[9-14]。但也有部分研究在性别方面不同原发肿瘤部位之间未见显著差异[15]。本研究中纳入分析的患者性别所得出的结论与大部分欧洲研究结果相一致,即右半结肠癌女性所占比例高于直肠及左半结肠。对于肿瘤的组织学类型与原发肿瘤位置的关系,日本的一项研究,将大肠癌分为左半及右半,研究结果显示黏液性癌在右半所占比例较高,这与本研究的结果相一致[16]。对于原发肿瘤部位与病理T分期的关系的研究中,大部分研究结论为右半结肠T4所占比例要高于左半结肠及直肠[17],但也有一部分研究虽有此趋势,却未得到阳性结果[18]。
近些年关于原发肿瘤部位与预后的关系虽然尚无统一定论,但目前的趋势是左半结肠癌的预后要好于右半结肠癌[19-20]。然而,根据大肠癌不同的分期或者根据基因状态不同进行分类,所得出的左、右半结肠癌的预后不同。在几项大样本的研究中,根据分期的不同对原发肿瘤部位与预后进行分析,I期患者左半结肠与右半结肠差别不大,II期患者右半结肠癌预后显示出明显优势,而在III期和IV期患者,结论却与II期患者相反[21-22]。本研究针对I~III期大肠癌原发肿瘤部位与预后的关系分析,三组间未见显著差异。本研究针对所有临床病理特征、原发肿瘤部位与预后的关系进行了单因素及多因素COX回归分析,结果显示淋巴结转移数目与预后有显著相关性,为结直肠癌患者的独立预后因素。
本研究的意义在于结直肠癌患者的原发肿瘤部位的不同,其临床病理特征存在差异,根据不同的部位作为独立的疾病进行诊治;而其可否作为预测预后的指标,有待进一步研究证实。
[ 1 ] Jemal A, Bray F, Center MM, et al.Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[ 2 ] Center MM, Jemal A, Ward E.International trends in colorectal cancer incidence rates [J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(6):1688-1694.
[ 3 ] Buf i ll JA.Colorectal cancer: evidence for distinct genetic categories based on proximal or distal tumor location [J]. Ann Intern Med, 1990, 113(10): 779-788.
[ 4 ] Brule SY, Jonker DJ, Karapetis CS, et al.Location of colon cancer (right-sided versus left-sided) as a prognostic factor and a predictor of benef i t from cetuximab in NCIC CO.17 [J]. European Journal of Cancer, 2015, 51(11): 1405-1414.
[ 5 ] Iacopetta B.Are there two sides to colorectal cancer? [J]. Int J Cancer, 2002, 101(5):403-408.
[ 6 ] Jess P, Hansen IO, Gamborg M, et al.A nationwide Danish cohort study challenging the categorisation into right-sided and left-sided colon cancer [J]. BMJ Open, 2013, 3(5): pii: e002608.
[ 7 ] Ishihara S, Nishikawa T, Tanaka T, et al.Prognostic impact of tumor location in stage IV colon cancer: a propensity score analysis in a multicenter study [J]. Int J Surg, 2014, 12(9): 925-930.
[ 8 ] Benedix F, Meyer F, Kube R, et al. Inf l uence of anatomical subsite on the incidence of microsatellite instability, and KRAS and BRAF mutation rates in patients with colon carcinoma [J]. Pathol Res Pract, 2012 , 208(10): 592-597.
[ 9 ] Hurwitz H, Fehrenbacher L, Novotny W, et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer [J]. N Engl J Med, 2004, 350(23): 2335–2342.
[ 10 ] Hansen IO, Jess P. Possible better long-term survival in left versus right-sided colon cancer - a systematic review [J]. Danish Medical Journal, 2012, 59(6): A4444.
[ 11 ] Clark S.Outcome of right - and left-sided colonic and rectal cancer following surgical resection [J]. Colorectal Dis, 2012, 14(3): 386.
[ 12 ] Christodoulidis G, Spyridakis M, Symeonidis D, et al. Clinicopathological differences between right - and left-sided colonic tumors and impact upon survival [J]. Techniques in coloproctology, 2010, 14 (Suppl 1): S45-47.
[ 13 ] Benedix F, Kube R, Meyer F, et al. Comparison of 17,641 patients with right - and left-sided colon cancer: differences in epidemiology, perioperative course, histology, and survival [J]. Dis Colon Rectum, 2010 , 53(1): 57-64.
[ 14 ] Cassidy J, Clarke S, Díaz-Rubio E, et al. XELOX vs FOLFOX-4 as fi rst-line therapy for metastatic colorectal cancer: NO16966 updated results [J]. Br J Cancer, 2011, 105(1): 58–64.
[ 15 ] Saltz LB, Clarke S, Díaz-Rubio E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study [J]. J Clin Oncol, 2008,26(12):2013–2019.
[ 16 ] Moritani K, Hasegawa H, Okabayashi K, et al. Difference in the recurrence rate between right - and left - sided colon cancer: a 17-year experience at a single institution [J]. Surgery today, 2014, 44(9): 1685-1691.
[ 17 ] Huang CW, Tsai HL, Huang MY, et al. Different clinicopathologic features and favorable outcomes of patients with stage III left-sided colon cancer [J]. World J Surg Oncol, 2015, 13: 257.
[ 18 ] Nitsche U, Stögbauer F, Späth C, et al. Right Sided Colon Cancer as a Distinct Histopathological Subtype with Reduced Prognosis [J]. Digestive Surgery, 2016, 33(2): 157-163.
[ 19 ] von Einem JC, Heinemann V, von Weikersthal LF, et al.Left-sided primary tumors are associated with favorable prognosis in patients with KRAS codon 12/13 wild-type metastatic colorectal cancer treated with cetuximab plus chemotherapy: an analysis of the AIO KRK-0104 trial [J]. J Cancer Res Clin Oncol, 2014, 140(9):1607-1614.
[ 20 ] He WZ, Xia LP. RE: Primary Tumor Location as a Prognostic Factor in Metastatic Colorectal Cancer [J]. J Natl Cancer Inst, 2015, 107(9).
[ 21 ] Meguid RA, Slidell MB, Wolfgang CL, et al. Is there a difference in survival between right - versus left-sided colon cancers? [J]. Ann Surg Oncol, 2008, 15(9): 2388-2394.
[ 22 ] Weiss JM, Pfau PR, O'Connor ES, et al.Mortality by stage for right- versus left-sided colon cancer: analysis of surveillance, epidemiology, and end results--Medicare data [J]. J Clin Oncol, 2011, 29(33): 4401-4409.
Association of primary tumor location with prognosis in postoperative colorectal cancer patients
Liu Jing, Li Wenya, Qu Xiujuan, Qu Jinglei, Chen Ying, Zhao Wanyu, Li Zhi,Liu Yunpeng. Department of Medical Oncology, The First Hospital of China Medical University, Shenyang 110001, China
Liu Yunpeng, Email: cmuliuyunpeng@hotmail.com
Objective To investigate the association of primary tumor location with clinical pathologic features and prognosis in postoperative colorectal cancer patients. Methods Patients with stage I~III colorectal cancer treated in the First Hospital of China Medical University from September 2000 to April 2016 were collected, and the relationship between primary tumor location and clinical pathological features was analyzed. The effect of primary tumor location on the prognosis was also investigated. Results In total, 1 345 patients with colorectal cancer were grouped according to primary tumor location: the rectum, left-sided, and right-sided colon group. The primary tumor location was associated with gender ( (χ2=10.943; P=0.004), histological grade (χ2=12.402; P=0.015), pathological T stage (χ2=49.794; P<0.001) and TNM stage (χ2=30.102; P<0.001) . Survival analysis showed no significant difference in three groups (χ2=4.806; P=0.09). Cox univariate analysis did not show any correlation between primary tumor location and survival (χ2=2.938; P=0.088) , but showed a significant correlation between positive lymph nodes、TNM stage and prognosis (χ2=39.739, χ2=23.872; P<0.001). Multivariable analyses showed a signif i cant correlation between positive lymph nodes and survival (95%CI: 1.210~2.317; P=0.002). Conclusion In postoperative colorectal cancer, different primary tumor location correlated with different clinical pathological characteristics. There was no relationship between primary tumor location and prognosis. Number of positive lymph nodes was an independent prognostic factor for survival.
Colorectal neoplasms; Prognosis; Primary tumor location; Clinicopathological characteristics
2017-04-16)
(本文编辑:杨明)
10.3877/cma.j.issn.2095-3224.2017.04.007
辽宁省科学技术计划项目(No.2014226033,2014225013);辽宁省中央引导地方科技发展专项资金(No.2016007010);中医药临床学(专)科能力建设项目
110001 沈阳,中国医科大学附属第一医院肿瘤内科
刘云鹏,Email:cmuliuyunpeng@hotmail.com
刘静, 李文雅, 曲秀娟, 等.结直肠癌原发肿瘤部位对术后患者生存的影响[J/CD].中华结直肠疾病电子杂志, 2017, 6(4): 301-304.

