瑞舒伐他汀对急性心肌梗死患者血清内皮细胞特异性分子-1水平的影响
邱崇荣,付幼林,钟武,黄军,杨忠明,罗骏
瑞舒伐他汀对急性心肌梗死患者血清内皮细胞特异性分子-1水平的影响
邱崇荣1,付幼林1,钟武2,黄军1,杨忠明1,罗骏1
目的 探讨瑞舒伐他汀对急性心肌梗死(AMI)患者血清内皮细胞特异性分子-1(ESM-1)表达水平影响并分析其相关性。方法 入选赣州市人民医院心内科于2015年7月~2016年12月间住院的AMI患者100例,随机平均分为常规治疗组和瑞舒伐他汀组,常规治疗组给予常规治疗,瑞舒伐他汀组在此基础上应用瑞舒伐他汀口服治疗,选取同期体检中心40例健康患者为对照者。治疗前后分别抽取患者外周静脉血检测血清ESM-1表达水平。同时检测超敏C反应蛋白(hs-CRP)水平,并对ESM-1进行相关性分析。结果 与健康对照组比较,常规治疗组及瑞舒伐他汀组ESM-1水平、hs-CRP水平均升高,差异有统计学意义(P<0.05),瑞舒伐他汀组ESM-1治疗后明显降低(P<0.05)。AMI患者ESM-1与hs-CRP呈正相关(r=0.37,P<0.05)。结论 在AMI患者中,ESM-1与炎症指标关系密切,瑞舒伐他汀能降低血清ESM-1水平。
急性心肌梗死;瑞舒伐他汀;内皮细胞特异性分子-1;内皮功能紊乱;生物标记物
急性心肌梗死具有高致死、致残的特点,严重危害人类健康。内皮功能紊乱贯穿于其发病的整个过程,内皮功能紊乱具有可逆性,在其发生的任何环节进行干预,将可能阻止或延缓其发病过程[1-3]。因此,内皮功能紊乱的评估及逆转紊乱的内皮功能是当前心血管疾病研究的热点问题。内皮细胞特异性分子-1(ESM-1)为近年来发现的新型内皮功能紊乱生物标记物,研究发现急性心肌梗死患者ESM-1水平明显升高[4,5]。然而,他汀类药物对血清ESM-1表达水平的影响目前尚不清楚,瑞舒伐他汀对急性心肌梗死患者血清ESM-1表达水平亦鲜见文献报道。本研究通过研究观察瑞舒伐他汀对急性心肌梗死患者内皮细胞特异性分子-1表达水平的影响,同时观察炎症指标的变化并分析其相关性,为急性心肌梗死治疗提供新的策略。
1 研究对象和方法
1.1 研究对象 序贯入选赣州市人民医院心内科2015年7月至2016年12月住院的AMI患者100例,其中男性60例,女性40例,年龄33~84岁,平均(62.62±11.59)岁。其发病至我院就诊时间中位数为6.0 h,最短30 min,最长12 h。体检中心纳入健康成年对照组40例,其中男性20例,女性20例,年龄48~75岁,平均(61.42±6.42)岁,既往无任何病史。纳入研究对象均已签署知情同意书,本研究经赣州市人民医院伦理委员会批准。
入选标准:急性心肌梗死根据ESC/ACCF/AHA/ WHF第三次全球急性心肌梗死定义[6]:肌钙蛋白升高合并至少以下一项:①缺血症状:胸痛持续30 min或更长的时间;②心电图提示两个或两个以上肢体导联ST段抬高≥0.1 mV,或两个或两个以上胸导联≥0.2 mV;新出现的左束支传导阻滞;③心电图已形成病理性Q波;④影像学新发现心肌活力丧失或新发现的室壁运动异常;⑤冠状动脉造影或尸检发现冠状动脉内血栓形成。排除标准:①既往服用他汀类药物治疗;②重度贫血;③甲状腺疾病;④严重瓣膜疾病;⑤严重肾功能不全(CKD 4期、CKD5期)需要肾透析治疗;⑥自身免疫性疾病及感染性疾病;⑦恶性肿瘤。
1.2 研究方法
1.2.1 收集资料 收集所有研究对象的年龄、性别、身高、体重(计算体质指数)、吸烟史及既往史,入院收缩压及舒张压,入院次晨查总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖、肌酐(Cr)。
1.2.2 分组方法 急性心肌梗死患者予以阿司匹林、低分子肝素、β受体阻滞剂及肾素-血管紧张素-醛固酮受体拮抗剂等治疗,根据接受不同他汀药物随机分为常规治疗组和瑞舒伐他汀组,每组50例,常规治疗组予以20 mg阿托伐他汀治疗,瑞舒伐他汀组10 mg瑞舒伐他汀,4周后抽取两组外周静脉血液检测ESM-1及hs-CRP水平。
1.2.3 检测血清ESM-1表达水平 采血清晨7~8时,空腹12 h以上,平卧20 min,急性心肌梗死患者入院次晨抽血,无需抗凝,立即置于4℃冰箱中凝聚1 h,4℃ 3000 r/min 离心15 min,EP管提取血清分装,置于-80℃冰箱保存备用。采用酶联免疫法检测血清ESM-1表达水平,试剂盒由上海酶联生物科技有限公司提供,检测下限为0.2 ng/mL,灵敏度为0.02 ng/mL,批内变异系数7.2%,批间变异系数9.8%,检测步骤严格按照试剂盒说明进行。
1.2.4 生化指标的检测 血糖、血脂、肌酐等生化指标的测定使用我院全自动生化仪7600,生产地日本。超敏C反应蛋白(hs-CRP)MAGLUMI2000全自动化学发光免疫分析仪检测,试剂为机器配套试剂。
1.3 统计学方法 应用SPSS 19.0软件建立数据库并进行统计分析,正态分布的计量资料用均数±标准差(±s)表示,非正态分布计量资料用中位数(四分位数)[M(Q1,Q3)]表示;正态分布资料两组间比较用t检验,非正态分布的计量资料采用秩和检验;计数资料以百分数(%)表示,组间比较采用χ2检验;ESM-1水平与hs-CRP相关分析应用Spearman相关分析;P<0.05为差异有统计学意义。
2 结果
2.1 比较各组之间ESM-1和hs-CRP的水平 急性心肌梗死患者瑞舒伐他汀治疗组、常规治疗组与对照组基线资料存在差异,差异无统计学意义,见表1。与对照组比较,瑞舒伐他汀治疗组ESM-1水平较高(1.22±0.49)mg/L vs. (1.06±0.07)ng/mL,差异有统计学意义(P=0.02),hs-CRP水平较高14.60(0.33,198.00) mg/L vs. 0.48(0.16,2.32) mg/L,差异有统计学意义(P =0.00);常规治疗治疗组ESM-1水平较高(1.21±0.44)ng/mL vs. (1.06±0.07) ng/mL,差异有统计学意义(P=0.03),hs-CRP水平较高11.35(0.76,155.00) mg/L vs. 0.48(0.16,2.32)mg/L,差异有统计学意义(P=0.00)。
与治疗前比较,瑞舒伐他汀治疗组治疗后ESM-1水平降低(1.09±0.12) mg/L vs. (1.22± 0.49) ng/mL,差异有统计学意义(P=0.03)、hs-CRP水平降低0.70(0.15,2.30)mg/L vs. 14.60(0.33,198.00) mg/L,差异有统计学意义(P=0.00);常规治疗组治疗后hs-CRP水平降低1.01(0.18,2.33) mg/L vs. 11.35(0.76,155.00) mg/L, 差异有统计学意义(P=0.00),见表2。
2.2 相关性分析 Spearman相关分析表明,急性心肌梗死患者ESM-1水平与hs-CRP(r=0.37,P=0.00)呈正相关。
3 讨论
随着社会的进步,人们生活方式改变及人口老龄化加速,心血管疾病已经成为全球主要死亡原因。2014年美国心脏协会(AHA)发布的一份科学报告显示:美国每天至少有2150人死于心血管疾病,2010年心血管疾病总死亡率是0.235%,其中因冠心病死亡379 559例,约总死亡人数1/6。每年初发无症状心肌梗死患者约150 000例,每年因急性心肌梗死住院患者620 000例,约295 000例再发心肌梗死住院治疗[7]。
表1 各组研究对象基线资料比较[±s,n(%)]
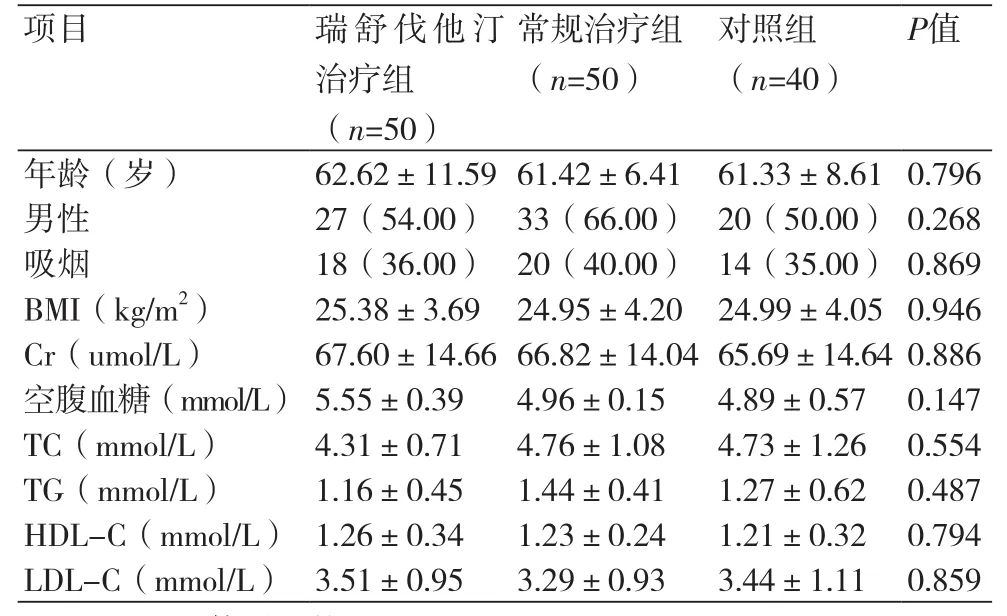
表1 各组研究对象基线资料比较[±s,n(%)]
注:BMI:体质指数;TC:总胆固醇;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇
年龄(岁)62.62±11.5961.42±6.41 61.33±8.610.796男性27(54.00)33(66.00)20(50.00)0.268吸烟18(36.00)20(40.00)14(35.00)0.869 BMI(kg/m2)25.38±3.6924.95±4.2024.99±4.050.946 Cr(umol/L)67.60±14.6666.82±14.04 65.69±14.640.886空腹血糖(mmol/L)5.55±0.394.96±0.154.89±0.570.147 TC(mmol/L)4.31±0.714.76±1.084.73±1.260.554 TG(mmol/L)1.16±0.451.44±0.411.27±0.620.487 HDL-C(mmol/L)1.26±0.341.23±0.241.21±0.320.794 LDL-C(mmol/L)3.51±0.95 3.29±0.933.44±1.110.859
表2 各组研究对象ESM-1和hs-CRP水平比较[±s,M(Q1,Q3)]

表2 各组研究对象ESM-1和hs-CRP水平比较[±s,M(Q1,Q3)]
注:与健康对照组比较,aP<0.05;与治疗前比较,bP<0.05
健康对照组1.06±0.070.48(0.16,2.32)常规治疗组治疗前1.21±0.44a11.35(0.76,155.00)a治疗后1.12±0.281.01(0.18,2.33)b瑞舒伐他汀治疗组治疗前1.22±0.49a14.60(0.33,198.00)a治疗后1.09±0.12b0.70(0.15,2.30)b
内皮功能紊乱是冠心病发病的始动环节并贯穿于冠心病发病整个过程。紊乱的内皮促使脂质及细胞的渗透、脂质蛋白的氧化、炎症反应、平滑肌细胞的增殖,细胞外基质的沉积和溶解,血小板激活以及血栓形成,从而促使动脉粥样硬化的形成。动脉粥样斑块突然破裂,则导致急性心肌梗死[8]。急性心肌梗死高致死、致残,已成为全球严重经济负担,急性心肌梗死病理过程及发病机制包括:斑块破裂、内皮功能紊乱、血栓形成,其中,内皮功能紊乱是急性心肌梗死发病的重要因素之一[9]。内皮细胞特异性分子-1(ESM-1),亦称Endocan,由法国科学家Lassale等1996年首次发现并报道[10]。研究表明,ESM-1可能是内皮功能紊乱新型生物标记物,其生物活性广泛,对调节细胞粘附、迁移、增殖起了重要作用[10,11]。
本研究显示,急性心肌梗死患者血清ESM-1表达水平明显高于对照组,提示ESM-1可能为急性心肌梗死患者内皮功能紊乱生物标记物,与相关文献报道一致[4,12]。ESM-1主要由内皮细胞分泌,当内皮功能紊乱时,其分泌入外周血液,因此,内皮功能紊乱时ESM-1表达水平升高[13]。
他汀是治疗急性心肌梗死患者重要药物之一,他汀药物具有多效性,其除降脂;还包括抗炎、改善内皮等作用[14,15]。本研究显示,急性心肌梗死患者血清ESM-1水平治疗后均降低,瑞舒伐他汀治疗后ESM-1明显降低,ESM-1水平的下降提示内皮功能得到改善[16],表明瑞舒伐他汀具有改善内皮功能作用。
在我们的研究中还发现,急性心肌梗死患者hs-CRP水平亦随ESM-1水平呈升高趋势,炎症与急性心肌梗死关系密切。相关性分析表明。ESM-1与炎症指标hs-CRP呈正相关,ESM-1作为内皮功能紊乱指标之一,可能与炎症介质通过一系列复杂机制参与急性心肌梗死的发病过程,其可能的机制为:①ESM-1分泌增加可能促进血管平滑肌细胞(VSMC)的迁移和增殖[17],ESM-1在粥样斑块中高表达,当斑块突然破裂,ESM-1释放入血,其表达水平明显升高[4];②ESM-1由血管内皮细胞分泌,在血管内皮细胞的增殖分化中起了重要作用,血管内皮细胞在急性心肌梗死发病的过程中充当重要角色,因此,ESM-1可能参与急性心肌梗死发病的病理生理过程[3,4,18,19];③ESM-1是血管内皮细胞分泌的一种硫酸素蛋白多糖,在血液凝固及血栓形成中发挥重要作用,可能与急性心肌梗死高血栓状态密切相关[4,20]。
本研究中ESM-1与炎症介质hs-CRP具有相关性,与国外文献报道一致[21]。亦有文献报道,ESM-1与hs-CRP无明显相关性[4]。ESM-1与心血管疾病炎症关系仍不明确,Lassale等[10]研究发现,炎症介质与ESM-1存在相互影响,炎症介质对促进ESM-1的表达有一定的作用,不同的炎症介质对ESM-1可能存在不同的影响。肿瘤坏死因子α(TNF-α)及E-选择素均可以上调ESM-1的表达,表现为时间依赖性,TNFα上调表达程度呈倍数增加,作用后2 h表达上升,18 h达高峰。而E-选择素上调作用是迅速而短暂的,而高峰却出现在加入TNF-α后第3 h。其他炎症介质,如IL-1β对ESM-1表达的效应与TNF-α相似。然而当TNF-α、IFNγ同时作用时却抑制TNF-α对ESM-1的表达。因此,ESM-1与炎症介质关系有待于进一步研究。
内皮功能紊乱贯穿于动脉粥样硬化形成的整个发病过程,在动脉粥样硬化每一个阶段都具有可逆性,因而内皮细胞功能靶点治疗在心血管疾病的治疗中是可行的、有效的策略,具有非常重大的意义。能否找到一种ESM-1类似物或抑制物,早期对内皮功能紊乱患者进行干预,从而,可以延缓或逆转冠心病发病的进程,提高冠心病患者生存率,减少致残率、降低住院费用,改善总体生活质量,降低全球心血管疾病负担[22]。国内朱宗成等通过ESM-1预处理的骨髓间充质干细胞用于AMI大鼠的治疗观察研究发现,预处理后的骨髓间充质干细胞可明显改善心脏功能、减少心肌梗死面积以及抑制心室重构[23]。因此ESM-1用于治疗AMI具有广阔的前景,对ESM-1与AMI关系的进一步研究可能对寻求治疗AMI提供新的思路。
[1] 潘力健,刘磊,尚文静,等. 瑞舒伐他汀对冠心病患者内皮功能的影响[J]. 中国老年学杂志,2015,35(6):1463-4.
[2] Balta S,Demirkol S,Celik T,et al. Association between coronary artery ectasia and neutrophil-lymphocyte ratio[J]. Angiology,2013,64(8):627-32.
[3] Celermajer DS. Endothelial dysfunction: does it matter? Is it reversible?[J]. J Am Coll Cardiol,1997,30(2):325-33.
[4] Qiu CR,Fu Q,Sui J,et al. Serum Endothelial Cell-specific Molecule 1 (Endocan) Level in Patients with Acute Myocardial Infarction and Its Clinical Significance[J]. Angiology, 2017,68(4):354-9.
[5] 邱崇荣,罗骏,吴佳健. 急性ST段抬高型心肌梗死内皮细胞特异性分子-1与冠状动脉病变的相关性研究[J]. 中国循证心血管医学杂志,2017,9(3):353-9.
[6] Thygesen K,Alpert JS,Jaffe AS,et al. Third universal definition of myocardial infarction[J].J Am Coll Cardiol,2012,60(16):1581-98.
[7] Go AS,Mozaffarian D,Roger VL,et al. on behalf of the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics--2014 update: a report from the American Heart Association[J]. Circulation,2014,129(3):e28-292.
[8] Radecke CE,Warrick AE,Singh GD,et al. Coronary artery endothelial cells and microparticles increase expression of VCAM-1 in myocardial infarction[J]. Thromb Haemost,2015,113(3):605-16.
[9] Pedersen F,Butrymovich V,Kelbæk H,et al. Short- and long-term cause of death in patients treated with primary PCI for STEMI[J]. J Am Coll Cardiol,2014,64(20):2101-8.
[10] Lassalle P,Molet S,Janin A,et al. ESM-1 is a novel human endothelial cell-specific molecule expressed in lung and regulated by cytokines[J]. J Biol Chem,1996,271(34):20458-64.
[11] Béchard D,Gentina T,Delehedde M,et al. Endocan is a novel chondroitin sulfate/ dermatan sulfate proteoglycan that promotes hepatocyte growth factor/scatter factor mitogenic activity[J]. J Biol Chem,2001,276(51):48341-9.
[12] 邱崇荣,付强,眭建,等. 急性ST段抬高型心肌梗死患者中性粒细胞与淋巴细胞比值、内皮细胞特异性分子-1表达水平及与近期预后的关系[J]. 江苏大学学报:医学版,2016,26(1):61-4.
[13] Tok D,Ekiz F,Basar O,et al. Serum endocan levels in patients with chronic liver disease[J]. Int J Clin Exp Med,2014,7(7):1802-7.
[14] Marenzi G,Cosentino N,Cortinovis S,et al. Myocardial Infarct Size in Patients on Long-Term Statin Therapy Undergoing Primary Percutaneous Coronary Intervention for ST-Elevation Myocardial Infarction[J]. Am J Cardiol,2015,116(12):1791-7.
[15] Henriksbo BD,Schertzer JD. Is immunity a mechanism contributing to statin-induced diabetes?[J]. Adipocyte, 2015,4(4):232-8.
[16] Tadzic R,Mihalj M,Vcev A,et al. The effects of arterial blood pressure reduction on endocan and soluble endothelial cell adhesion molecules (CAMs) and CAMs ligands expression in hypertensive patients on Ca-channel blocker therapy[J]. Kidney Blood Press Res,2013,37(2-3):103-15.
[17] Menon P,Kocher ON,Aird WC. Endothelial cell specific molecule-1 (ESM-1), a novel secreted proteoglycan stimulates vascular smooth muscle cell proliferation and migration[J]. Circulation,2011,124(21): A15455.
[18] Carrillo LM,Arciniegas E,Rojas H,et al. Immunolocalization of endocan during the endothelial-mesenchymal transition process[J]. Eur J Histochem,2011,55(2):e13.
[19] Rocha SF,Schiller M,Jing D,et al. ESM1 modulates endothelial tip cell behavior and vascular permeability by enhancing VEGF bioavailability [J]. Circ Res,2014,115(6):581-90.
[20] Béchard D,Scherpereel A,Hammad H,et al. Human endothelialcell specific molecule-1 binds directly to the integrin CD11a/CD18 (LFA-1) and blocks binding to intercellular adhesion molecule-1[J]. J Immunol,2001,167(6):3099-106.
[21] Balta S,Mikhailidis DP,Demirkol S,et al. Endocan--a novel inflammatory indicator in newly diagnosed patients with hypertension: a pilot study[J]. Angiology,2014,65(9):773-7.
[22] Barton M. Prevention and endothelial therapy of coronary artery disease[J]. Curr Opin Pharmacol,2013,13(2):226-41.
[23] 朱宗成,惠杰,沈振亚,等. 内皮细胞特异性分子-1预处理干细胞用于心肌梗死治疗的实验研究[J]. 心脏杂志,2014,26(2):147-51.
本文编辑:陈亚磊,田国祥
Effect of rosuvastatin on serum endothelial cell specific molecule-1 level in patients with acute myocardialinfarction
QIU Chong-rong*, FU You-lin, ZHONG Wu, HUANG Jun, YANG Zhong-ming, LUO Jun.*Department of Cardiology, Ganzhou People's Hospital, Ganzhou 341000, China
LUO jun, Email: Luoabccom@sina.com
Objective To investigated the relationship between serum endothelial cell specific molecule-1 (ESM-1) level and Rosuvastatin in patients with acute myocardial infarction(AMI) and analysis its correlation. Methods 100 patients with AMI were randomly divided into conventional treatment group and Rosuvastatin group, 70 controls were selected as control group. We measured expression of serum ESM-1 levels in patients with AMI before and after treatment and conducted correction analysis. High-sensitivity C-reactive protein (hs-CRP) were also measured. Results Compared with control group, serum ESM-1 level and hs-CRP were significant higher in conventional treatment group and Rosuvastatin group (P<0.05). After treatment, serum ESM-1 level in Rosuvastatin group was significant lower (P<0.05). Serum ESM-1 level were positive correlated with hs-CRP (r=0.37,P<0.05). Conclusion Rosuvastatin could decrease serum ESM-1 level, ESM-1 may be a novel biomarker of endothelial dysfunction and may be associated with inflammation in patient with AMI.
Acute myocardial infarction; Rosuvastatin; Endothelial cell specific molecule-1; Endothelial dysfunction; Biomarker
R541.4
A
1674-4055(2017)06-0696-04
赣州市指导性科技计划项目(GZ2016ZSF158)
1341000 赣州,江西省赣州市人民医院心内科;2341000 赣州,赣州市人民医院普外科
罗骏,E-mail:Luoabccom@sina.com
10.3969/j.issn.1674-4055.2017.06.15

