大脑胶质瘤病临床分析(1例报告并文献复习)
高丹宇, 赵迎春, 袁 菲, 陈 晟
短篇与个案报告
大脑胶质瘤病临床分析(1例报告并文献复习)
高丹宇1, 赵迎春1, 袁 菲2, 陈 晟3
大脑胶质瘤病(gliomatosis cerebri,GC),又称弥漫性星形细胞瘤,是一种原发性脑肿瘤,以神经胶质细胞弥漫性增生而原有大体解剖结构保持相对完整为特征[1],是神经胶质瘤的一种少见形式。其临床表现复杂多样,目前对该疾病的研究仍处于探索阶段。近年来随着影像技术的进步,临床检出率有所提高,但仍属少见疾病。而以脑炎症状急性起病,病程中出现肿瘤卒中的病例则更为少见。现报道我院神经内科收治的1例以类似脑炎症状急性起病的脑胶质瘤病伴瘤卒中的病例,同时通过计算机检索万方数据库,收集1990年1月-2016年12月在我国期刊公开发表的关于“大脑胶质瘤病”的病例报告。分析该疾病的病理特点、临床表现、影像学特征及治疗,从而提高对该疾病的认识。
1 资料与方法
1.1 文献检索 通过计算机检索万方数据库,收集1990年1月-2016年12月期间在我国各种期刊公开发表的关于大脑胶质瘤病的病例文献。以检索词为“大脑胶质瘤病”与“病例”,英文为“gliomatosis cerebri”与“case”进行检索。检出后通过手工检索对重复报告、无法提供详细完整资料的予以排除。
1.2 病例报告 患者,男,62岁。2014年6月曾因“感冒后发热、癫痫发作伴精神异常2 d”在瑞金医院神经内科就诊。既往有高血压病史,否认中毒及放射性物质接触史。入院时查体:嗜睡、双侧瞳孔等大等圆直径0.3 cm,对光反射存在,颈软,四肢可见自主活动,四肢腱反射(),双侧病理征阴性。行头部CT未见明显异常,行头部MRI提示右侧额颞叶、左侧额叶及右侧侧脑室旁异常信号(见图1A~1C)。腰穿检查:170 mmH2O,脑脊液蛋白629 mg/L,糖4.0 mmol/L,细胞4.0×106/L,诊断为病毒性脑炎,给予抗病毒、甲强龙、卡马西平抗癫痫等治疗后,症状明显缓解后出院。出院后停用激素,继续服用抗癫痫药物。患者出院后3 m再次发生双上肢阵发性抽动伴意识障碍于2014年10月再次收入我科。复查头部MRI提示右侧颞叶、岛叶、双侧额叶异常信号灶,T1稍低信号,T2FLAIR高信号,DWI右侧颞叶、岛叶、双侧额叶略高信号,皮质肿胀。增强后提示:右侧颞叶、岛叶病灶呈点片样强化(见图1D)。复查腰穿提示压力正常,糖、氯化物正常,蛋白较前有增高。患者自身免疫性脑炎,副肿瘤综合征相关抗体均阴性。第2次发病后,患者症状进行性加重,癫痫发作频繁,意识障碍进行性加重。患者首次系急性起病,经过抗病毒、激素治疗后有好转,考虑颅内感染;但患者总体病情呈进展趋势,复查脑脊液蛋白较前有增高,考虑原发中枢淋巴瘤可能,不除外大脑胶质瘤病、血管炎可能。12月15日患者出现意识障碍加重、左侧肢体活动减少。急查头部MRI提示右颞叶出血,双侧额叶异常信号,与前片有进展(见图1E、1F)。2015年3月16日脑出血吸收后行脑活检。术后病理回报:颅内占位病变,CD56(+),GFAP(+),诊断为星型胶质瘤WHO Ⅲ级,结合患者影像学表现,诊断为大脑胶质瘤病 (见图2)。家属自动出院,出院时患者浅昏迷状态,呼吸浅快。
2 结 果
2.1 一般资料 按照研究目的检索文献后,共检出15例病例,连同文中报告的病例一共16例为研究对象(本文病例为第16例)。本组病例中男性8例,女性7例,男女发病性别上无明显差异。发病年龄从15岁~62岁,16例大脑胶质瘤病的一般资料及临床表现(见表1)。
2.2 临床表现 16例病例自发病到确诊期间病程由数天到数年不等。16例患者起病方式复杂多样,其中以头痛起病的有7例(43%),以癫痫发作起病的有3例(18%),以肢体无力起病的有4例(25%),以认知功能及智力减退起病的4例(25%)。该组病例中8人行腰穿检查,其中5人脑脊液压力升高,3人脑脊液压力正常。其中有8例患者在疾病初期曾诊断为病毒性脑炎、脱髓鞘疾病、自身免疫性脑炎、蛛网膜下腔出血等疾病。
2.3 影像学检查 所有病例在MRI上均表现为弥漫性改变,T1低信号,T2FLAIR高信号,表现为2个或者2个以上脑叶受累,其中以额颞叶最为常见。本组病例的16例患者中15例有额颞叶受累(占93%),其他受累及部位为海马、胼胝体、顶叶、枕叶、丘脑及岛叶。增强后,呈多发不规则斑片状强化或者强化不明显。
3 讨 论
脑胶质瘤病为一种少见的中枢神经系统原发性肿瘤,其发病率低,临床少见,早期诊断相对困难。目前该病病因尚不明确,其中最为公认的一种假说是由Nevin提出的,他认为由于大脑胶质细胞的发育不完全而导致脑内存在原始神经胶质细胞弥漫性生长,所以先天性因素被认为是导致该病的主要原因[2]。脑胶质瘤病一般多呈弥漫浸润性扩散,这和普通的星形胶质瘤不同,它至少累及两个脑叶,大部分累及三、四个脑叶。双侧大脑半球白质、深部灰质、脑干、小脑甚至脊髓都可以受累[3]。脑胶质瘤病分为Ⅰ型和Ⅱ型, Ⅰ型主要表现为弥漫性浸润性生长,一般无明显肿块、结节、囊变等;Ⅱ型可能由Ⅰ型发展而来,表现为在Ⅰ型基础上出现肿块、结节、等密度变化区,有高级别胶质瘤特点。肿瘤浸润区一般表现为:脑组织肿胀,灰质和白质及浸润区和非浸润区分界不清。可见各类分化程度不同的瘤细胞沿神经束及血管周围浸润性生长,呈椭圆形或梭形,体积小,胞质少,核形态多样但分裂少见[4]。本文报道的病例病理学分型为星型胶质瘤WHOⅢ级,分析是由Ⅰ型基础上出现肿块、坏死、出血,从而演变成Ⅱ型。
大脑胶质瘤病可见于各年龄段,以40至50岁多见,男性患者居多。临床表现依据肿瘤侵犯的不同部位而表现多样,无明显规律性。其临床表现与损害部位有关,其中以头痛、癫痫和中枢神经系统局部的神经功能缺损为常见,大多伴有认知功能损害[5]。Taillibert等[6]从ANOCEF的数据库里抽取了90例及参考文献中回顾了296例大脑胶质瘤病患者,根据发生频率由高到低的次序,常见的临床症状包括有癫痫、高颅压、行为认知异常及局灶神经损害。 Jennings等[7]对85例大脑胶质瘤病患者进行回顾性分析,最常见的临床症状依次是皮质脊髓束受损(58%)、认知功能下降(44%)、头痛(39%)、癫痫(38%)、颅神经损害(37%)、高颅压(34%)、脑脊液异常(33%)。如果基底节区受累,患者还可出现运动迟缓、肌强直等帕金森综合征的症状,且进展迅速。钱若兵等[8]统计了26例大脑胶质瘤病患者,头痛为主要临床表现的有16例,神志淡漠的有11例。该组文献报道中病例以头痛起病的比例最高,其次为智力减退及肢体无力。其中年龄最小的患者以突发呕吐、失语、呼之不应为主诉,当时就诊时曾诊断为蛛网膜下腔出血,以蛛网膜下腔出血样起病的大脑胶质瘤病例较罕见。该组文献报告中5例患者颅内压增高,3例患者的颅内压正常,颅内压正常的患者考虑可能和应用脱水剂及糖皮质激素有关。本例病例报告的患者额叶、颞叶、岛叶均受累及。以感冒发热后癫痫及精神障碍等类似脑炎症状作为首发表现的起病,这种形式较为少见。随着肿瘤进展,该患者出现了瘤卒中的表现,在大脑胶质瘤病中则更罕见。该病例也提醒神经科医生对于脑炎的患者不能忽略长期随访,尤其对于影像学发现有颅内多灶病变的患者。

表1 16例大脑胶质瘤病的临床资料

A~C:2014年6月T2FLAIR中右侧额颞叶、左侧额叶及右侧侧脑室旁高信号;D:2014年10月增强MRI中右侧颞叶呈点片样强化;E、F:2014年12月T1FLAIR右侧颞叶瘤卒中,左侧额叶病变范围较6 m增大
图1 核磁共振片示大脑胶质瘤病例
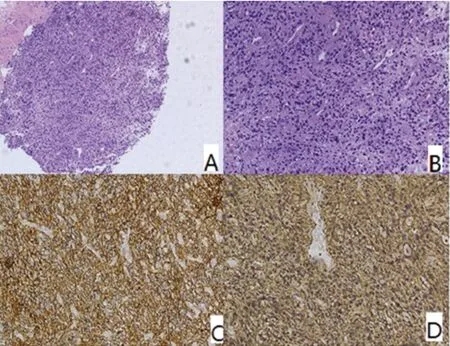
A、B:肿瘤细胞异性型明显,细胞密集,核分裂象可见HE染色×200、染色×400;C: 免疫组化CD56(+)×400;D:免疫组化GFAP(+)×400
图2 右侧颞叶活检所见病理
在影像学检查方面,大脑胶质瘤病变弥漫,皮质及皮质下白质均可受累及,无明显的占位效应,CT可以表现为正常,或病变区域密度略低或者脑组织肿胀等间接征像。MRI具有特异性征象,在常规图像上病灶主要表现为弥散分布的异常信号,病灶可以累及2个或者2个以上的脑叶。T1呈均匀的低信号;T2FLAIR呈均匀性高信号,提示肿瘤浸润性生长及继发性的脱髓鞘损害,这时肿瘤的占位效应轻,增强扫描可无强化或者轻度强化。随着肿瘤的发展,少数病例可出现结节样强化,多为继发性病变,也有文献提出这是恶性改变的标志,预后较差。张绿明等[9]收集10例胶质瘤病患者,其中9人行MRI检查,5人行增强MRI检查。9人均见累及多个脑叶的大片异常信号,其中4人未见明显强化,1人见部分区域斑片状强化影。本文报道病例中,患者入院时头部MRI提示右侧额颞叶、左侧额叶及左侧侧脑室旁异常信号。4 m后患者症状加重,出现癫痫时复查头部MRI提示右侧颞叶、岛叶、双侧额叶多发异常信号灶伴脑回肿胀。增强后提示:右侧颞叶、岛叶病灶呈点片样强化。该患者累及双侧额叶、颞叶及岛叶,符合病变特点与大脑胶质瘤脑病影像学表现。随着病情的进展,患者右侧颞叶病灶出现占位效应,内部出现条状强化。分析患者从Ⅰ型转化为Ⅱ型,恶性程度提高。
由于大脑胶质瘤病有多灶性及广泛性的特点,早期诊断较为困难,误诊率较高[10]。本组文献中的病例有一半初诊为其他疾病。本例患者以脑炎症状急性起病,早期更容易被忽略。在诊断该类疾病注意和以下疾病相鉴别。(1)颅内转移瘤:多位于灰白质交界区,呈环形或实性强化。病灶周围水肿明显,且患者多有原发性肿瘤病史,不难诊断。(2)中枢淋巴瘤病:罕见,多表现为弥漫对称的脑白质病变,无明显强化,笔者曾通过病理诊断1例,临床特征与影像表现与胶质瘤病极为相似,鉴别困难,需要借助病理明确。(3)中枢神经系统脱髓鞘疾病:多发性硬化病程可多有复发、缓解,影像学多位于侧脑室,T2呈高信号,结节状不完整环形或马蹄形强化是其特征[11]。视神经脊髓炎可以出现脑室周围大片异常信号,但病灶不会进行性增大,血清AQP-4抗体测定有助于鉴别。(4)自身免疫性脑炎:是一类累及海马、岛叶、及扣带回皮质的自身免疫性炎症,临床表现以记忆力下降、癫痫、精神异常的一类疾病。血清和脑脊液特异性抗体测定可以确诊。自身免疫性脑炎颅内受累多对称,如病灶不对称,需要排除肿瘤[12]。该病例早期考虑脑炎分析可能有如下原因:患者起病前曾有感冒发热,第一次发病为急性起病的精神症状和癫痫,头部MRI提示颞叶、额叶皮质肿胀,异常信号,且第一次应用抗病毒及糖皮质激素治疗后症状迅速好转,均符合脑炎的特点。由于大脑胶质瘤病发病率低,临床表现缺乏特异性,早期极易被忽略。对于弥漫性病变的患者,病灶不对称,无论有无皮质受累均要密切随访,必要时病理活检,以免贻误病情。
目前,国内外对大脑胶质瘤病的治疗尚处于探索阶段,关于疾病的治疗尚存争议,没有共识。其治疗手段主要包括手术、药物疗法、放射疗法[13]。但手术在大脑胶质瘤病治疗中作用有限。因为多数大脑胶质瘤病病变范围广,肿瘤浸润了大脑半球而且没有明确的边界。因此,进行瘤体切除且不引起严重并发症是不可能的。Kim等[14]报道15例大脑胶质瘤病患者经外放射治疗后,其平均生存期为38.4 m。Wang 等[15]还发现,放疗相对于化疗可以更快地降低高颅压。随着放射治疗技术的发展,其已成为治疗大脑胶质瘤病的主要手段。化疗也是对大脑胶质瘤病有效的治疗手段。在放射治疗基础上加用替莫唑胺可以将患者2 y的存活率提高到46%。替莫唑胺同步放疗联合辅助化疗有望成为新诊断大脑胶质瘤病的标准治疗方案[16]。结合放化疗治疗、分子靶向治疗、免疫治疗等综合治疗,大脑胶质瘤病的疗效得到一定改善[17]。
最后,由于大脑胶质瘤病临床症状复杂多样、预后差,因此当患者出现精神及性格改变、癫痫、颅内压升高等表现,MRI提示颅内多发弥漫性病变时应考虑大脑胶质瘤病的可能,必要时行活检术。早诊断、早治疗,以提高患者生存质量和延长生存期。
[1]Gerstner ER,Batchelor TT.Imaging and response criteria in gliomas[J].Current Opinion in Oncology,2010,22(6):598-603.
[2]Santos S,Lopez-Garcia E,Rios C,et al.Cerebral gliomatosis.A report of three cases and review of the literature[J].Revista De Neurologia,2002,34(3):248-252.
[3]Chen S,Tanaka S,Giannini C,et al.Gliomatosis cerebri:clinical characteristics,management,and outcomes[J].Journal of Neuro-Oncology,2013,112(2):267-275.
[4]亢志强,钱若兵.脑胶质瘤病的诊疗进展[J].国际神经病学神经外科学杂志,2014,41(5):436-440.
[5]王雅杰,马晓丽,朴月善,等.大脑胶质瘤病37例临床病理学分析[J].中华神经科杂志,2014,47(3):159-162.
[6]Taillibert S,Chodkiewicz C,Laigle-Donadey F,et al.Gliomatosis Cerebri:A Review of 296 Cases from the ANOCEF Database and the Literature[J].Journal of Neuro-Oncology,2006,76(2):201-205.
[7]Jennings MT,Frenchman M,Shehab T,et al.Gliomatosis cerebri presenting as intractable epilepsy during early childhood[J].Journal of Child Neurology,1995,11(1):151-152.
[8]钱若兵,吴 旻,魏祥品,等.脑胶质瘤病的影像学诊断特点及不同手术方式的疗效分析[J].中华医学杂志,2014,21:1639-1642.
[9]张绿明,韩国庆,杨 旭,等.大脑胶质瘤病10例临床特点分析[J].疑难病杂志,2014,3:245-248.
[10]Herrlinger U.Gliomatosis cerebri[J].Handbook of Clinical Neurology,2012,105(3782):507-515.
[11]庞其军,赵 颖,段世博,等.特殊感染的颅内多发病灶1例[J].河北医药,2016,5:797-800.
[12]张慧芳,武远鹏,徐宗荣,等.新型自身免疫性脑炎一边缘性脑炎的研究进展[J].中华神经医学杂志,2016,5(5):533-535.
[13]张熠丹,马文斌,王任直.等.恶性胶质瘤化疗的过去、现在和未来[J].协和医学杂志,2012,3(3):344-349.
[14]Kim DG,Yang HJ,Park IA,et al.Gliomatosis cerebri:clinical features,treatment,and prognosis[J].Acta Neurochirurgica,1998,140(8):755-762.
[15]Wang JF,Jiang T,Qiu XG,et al.An initial exploration of surgery following radiotherapy for the treatment of gliomatosis cerebri[J].中华医学杂志(英文版),2012,125(24):4526-4527.
[16] 赛 克,陈忠平.中国胶质瘤化疗现状及问题分析[J].中国神经肿瘤杂志,2012,1:38-44.
[17] 陈 波,刘立军.脑胶质瘤诊治技术新进展[J].医学综述,2016,22(14):2765-2768.
1003-2754(2017)06-0548-03
R739.41
2017-04-05;
2017-06-04
国家自然科学基金面上项目(No.81671241);上海市青年科技启明星(No.15Q1403000)
(1.上海交通大学附属第一人民医院松江分院神经内科,上海 201600;2.上海交通大学附属瑞金医院病理科,上海 200025;3.上海交通大学附属瑞金医院神经内科,上海 200025)
陈 晟,E-mail:MZTCS@163.com

