岛叶到伏隔核通路对小鼠痛觉的影响
阚延鹏, 张婷婷, 王 琪, 赵 璇, 林福清
(1. 皖南医学院,安徽 芜湖 241002; 2. 同济大学附属第十人民医院麻醉科,上海 200072; 3. 上海交通大学基础医学院解剖学与生理学系,上海 200025)
疼痛被列为第五大生命体征,受到越来越多的关注,消除患者的疼痛在临床上也有了越来越高的呼声和需求。2016年的一项研究显示,每年美国因疼痛造成的经济损失高达六千多亿美元,远超排名第2的心脏疾病[1]。疼痛对人们的生活造成了巨大的社会经济负担,所以对疼痛的基础研究刻不容缓。岛叶又称脑岛,位于大脑外侧沟的深部,是大脑皮质的一部分,与和痛觉有关的中央扣带回相连。岛叶是一个整合结构,参与多种感觉和认知过程,如学习、记忆和感知感觉[2-5]。近些年随着对岛叶研究的深入,发现岛叶与慢性痛[6]、神经病理性疼痛[7]、痛觉超敏[8]、疼痛调控[9-10]、情绪[11]密切相关。最近的研究发现岛叶有不同类群的投射神经元分别参与不同的神经传导通路[11]。前扣带回皮质到伏隔核的通路调控了共情所产生的疼痛[12],并且神经病理性疼痛会增加伏隔核TRPA1的表达[13],因此本研究探讨投向伏隔核的岛叶神经元对痛觉是否具有调控作用。
1 材料与方法
1.1 实验动物

1.2 试剂
实验所使用腺相关病毒(AAV-Syn-DIO-TetTox-mCherry/-mCherry,血清型AAV2/9;AAV-Syn-DIO-ChR2-mCherry/-mCherry,血清型AAV2/9;AAV-Syn-DIO-NpHR-mCherry/-mCherry,血清型AAV2/9)购买自上海和元生物技术股份有限公司;病毒(AAV-Syn-Cre-EGFP,血清型AAV2/Retro)购买自上海生博生物医药科技有限公司。光纤购买自南京千奥星科生物技术有限公司[长度4 mm,直径200 μm,光纤数值孔径(NA)为0.37,陶瓷插芯直径为2.5 mm]。无线光纤购买于武汉纽顿科技有限公司。辣椒素(Capsaicin)购买于Sigma公司,溶于生理盐水+7% Tween-80,使浓度为2 μg/μL。
1.3 病毒注射及光纤埋置

1.4 急性疼痛模型以及缩足阈值检测
在病毒注射3周充分表达后,进行缩足阈值检测以及急性疼痛的造模。在缩足阈值测试时,小鼠被放在透明盒子(10 cm×10 cm×5 cm)中置于架空的铁丝网上,适应30 min,再使用校准的Von-Frey细丝,参照up-and-down的方法[15],进行缩足阈值的检测。在缩足阈值检测后的第3天,进行急性疼痛的模型建立及行为学观察。将小鼠放在不透明盒子(10 cm×10 cm×15 cm)中置于透明玻璃板上,相机位于玻璃板下进行录像,小鼠在该环境适应30 min 后取出,擦净玻璃板,在小鼠右后足底皮下注射15 μL辣椒素,再放回盒子中,录像10 min,对录像进行人工统计5 min内的舔爪时间和抬脚时间。为了适应环境,所有小鼠在进行缩足阈值测试以及急性疼痛模型建立之前会经历连续2 d的5 min抚触及30 min的环境适应。所有行为学实验均在白天进行。
1.5 数据分析与绘图
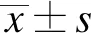
2 结 果
2.1 毁损投向伏隔核的岛叶神经元引起小鼠痛阈上升
首先进行了破伤风毒素的沉默实验,在双侧岛叶皮质注射腺相关病毒AAV-Syn-DIO-TetTox-mCherry/-mCherry,在双侧伏隔核注射腺相关病毒AAV-Syn-Retro-Cre-EGFP,这样保证岛叶投射到伏隔核的神经元表达破伤风轻链毒素,阻止其神经递质的释放,达到沉默这条投射的效果。在病毒表达3周后,进行缩足阈值的检测,实验组小鼠的痛阈较对照组有明显的升高(图1B,P=0.01)。在实验结束后,灌流染色确认了病毒的表达位置(图1C)。
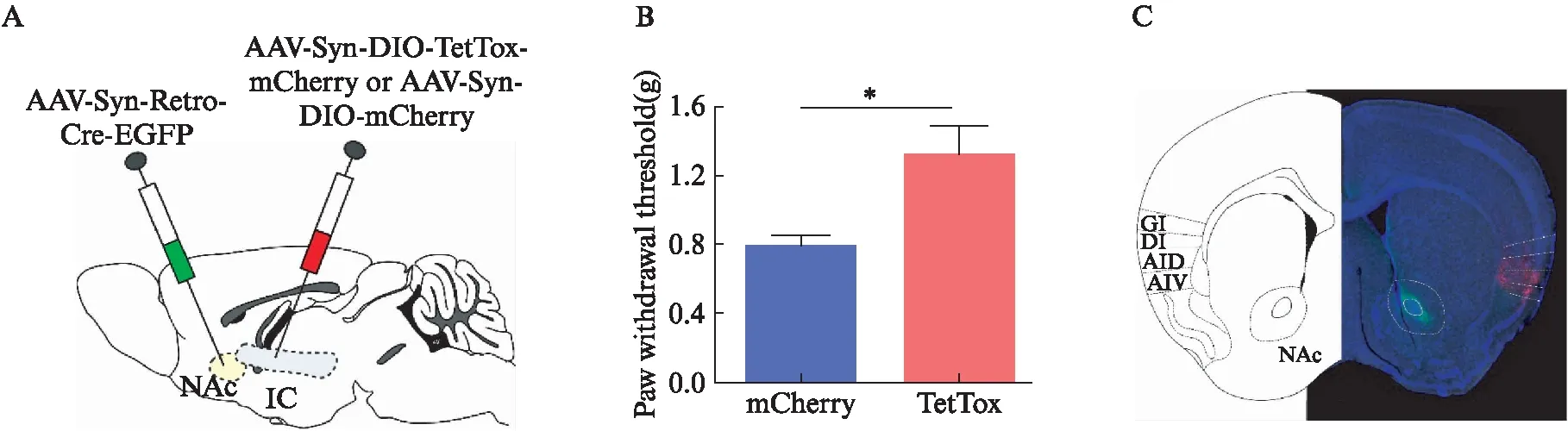
图1 毁损投向伏隔核的岛叶神经元引起小鼠缩足阈值上升
2.2 光遗传学抑制投向伏隔核的岛叶神经元引起小鼠痛阈上升
为了能更加实时观察到投向伏隔核的岛叶神经元对痛觉的影响,接下来使用了光遗传学技术进行光抑制的实验。病毒注射的策略与之前相似,在双侧岛叶皮质注射腺相关病毒AAV-Syn-DIO-NpHR-mCherry/-mCherry,在双侧伏隔核注射腺相关病毒AAV-Syn-Retro-Cre-EGFP,使投向伏隔核的岛叶神经元表达会被黄光抑制的光敏感蛋白NpHR,NpHR表达于神经元表面可以被590 nm的黄色激光照射通道开放,通透氯离子,抑制神经元活性,将会特异性的实时抑制投向伏隔核的岛叶神经元。在埋置光纤的2周后,进行缩足阈值的检测,与沉默该群神经元相同,在给予黄光抑制双侧岛叶投射神经元后,小鼠的缩足阈值也出现了上升(图2B,P=0.02)。检测完缩足阈值后,放回笼盒饲养,给予小鼠3 d的休息时间,后进行急性疼痛的行为观察。在小鼠右足底注射辣椒素并给予黄光,小鼠出现了因为疼痛导致的舔爪和抬脚的行为,进行10 min的录像,统计小鼠在前5 min的舔爪和抬脚的时间。在实验组小鼠观察到了舔脚时间和抬脚时间的缩短(图2C,P=0.04;图2D,P=0.02)。实验结束后,灌流染色确认病毒表达及光纤埋置位置正确(图2E)。

图2 光遗传学抑制投向伏隔核的岛叶神经元引起小鼠痛阈上升
2.3 光遗传学激活投向伏隔核的岛叶神经元仅引起小鼠缩足阈值降低
在沉默和抑制投向伏隔核的岛叶神经元之后都观察到了机械痛阈的上升,并且在光抑制该通路后还观察到了小鼠对辣椒素造模产生的急性疼痛的耐受程度增加,接下来继续验证激活该通路后对小鼠痛觉的影响。在左侧岛叶皮质注射腺相关病毒AAV-Syn-DIO-ChR2-mCherry/-mCherry,在左侧伏隔核注射腺相关病毒AAV-Syn-Retro-Cre-EGFP,使左侧投向伏隔核的岛叶神经元表达可以被蓝光激活的光敏感蛋白ChR2,ChR2表达于神经元可以被480 nm的蓝色激光激活,通透阳离子,提高神经元活性。待病毒表达后,埋置无线光纤。在实验中,给予480 nm的蓝光,进行缩足痛阈的检测,发现在激活此通路后,小鼠会出现极显著的痛阈下降的现象(图3B,P=0.000 8)。但同样在蓝光激活的情况下,在急性疼痛模型中,小鼠的舔舐时间和抬脚时间没有出现显著的差异(图3C,P=0.95;图3D,P=0.46)。在实验结束后,灌流染色确认病毒表达及光纤埋置位置正确(图3E)。

图3 光遗传学激活投向伏隔核的岛叶神经元仅引起小鼠缩足阈值下降
3 讨 论
如前所述,岛叶属于皮质的一部分,参与多种信息的处理包括认知、感觉以及情绪,尤其是疼痛方面。文献曾经报道大脑皮质和岛叶皮质是对外周疼痛输入反应潜伏期最短的区域[16],而实验动物的电生理[17-18]和人类受试者的脑成像研究[19-21]证实了岛叶在疼痛处理中的重要作用[6]。有研究人员对后岛叶进行毁损后发现其可以阻止机械异常性疼痛,但对焦虑样症状的发展没有影响[22],这些研究都说明岛叶皮质可以感受多种体感信息,并且参与自身状态的感受,而疼痛就是重要的本体感受之一。但是这些研究都是从整个岛叶层面进行的研究,随着实验手段的进展和脑区功能探索的越来越精细,2015年,Peng等[23]发现调控甜味和苦味的岛叶皮质完全分离;2019年,研究发现了岛叶有两种不共标的神经元亚群,分别投射向伏隔核和中央杏仁核,并且岛叶有部分神经元对疼痛、甜味、苦味和恐惧有响应[11],说明岛叶皮质可能存在精细的神经元亚群参与疼痛反应。而伏隔核在疼痛中的作用也逐渐被发现。2015年,研究发现激活前额叶皮质介导的镇痛效应是由伏隔核介导的[24];而2018年,研究发现抑制前额叶皮质到伏隔核的通路会加重大鼠在急性疼痛中的感觉和情感状态[25]。
本研究选取了岛叶到伏隔核的投射通路,即岛叶投射向伏隔核的神经元亚群进行研究,在病毒的帮助下,本研究特异性的感染了投射向伏隔核的岛叶神经元,发现在沉默和抑制这群岛叶神经元后,小鼠的缩足阈值有所上升,沉默和抑制时都从0.8 g左右的阈值上升到了1.2 g左右,说明小鼠对纤维丝造成的机械疼痛产生了更强的耐受能力。而在急性疼痛的模型中,小鼠在足底注射辣椒素后,因为疼痛会出现舔舐足底和注射足不敢落地的行为,15 μL辣椒素注射会引起小鼠约5 min内的急性疼痛状态。在急性疼痛的时间内光抑制投射向伏隔核的岛叶神经元,实验组小鼠显示出了明显相对于对照组更少的舔爪时间和更少的抬爪时间,所以本研究认为在抑制投射向伏隔核的岛叶神经元会产生镇痛的效应。而在特异性的光激活投射向伏隔核的岛叶神经元时,在机械痛阈上,实验结果与预期相符,产生了与抑制该通路相反的现象,小鼠的机械痛阈出现了下降,小鼠忍受疼痛的程度有所下降,出现了痛觉敏化。但是在光遗传学激活投射向伏隔核的岛叶神经元时,急性疼痛的实验组小鼠并没有展现出相对于对照组小鼠更长的舔爪时间和更长的抬脚时间,对于这一点,本研究认为是地板效应所导致的,即小鼠在5 min内已经达到了痛觉感受的峰值,环路激活所带来的痛觉敏化并不能被很好地检测出来。
本研究的优势在于在岛叶使用了Cre重组酶依赖的腺相关病毒,结合下游伏隔核注射的包含Cre重组酶片段的腺相关病毒,特异性的标记以及操控岛叶皮质投射向伏隔核的神经元亚群,以神经元亚群作为研究对象,更精准地展示了岛叶皮质投射向伏隔核的神经元亚群对疼痛的调控,为以后实现更精准的通过环路调控小鼠的痛觉感受做出了铺垫。本结果显示,不论在正常状态还是急性疼痛的状态下,岛叶到伏隔核的通路都参与了痛觉的传递以及处理,沉默和抑制通路会使小鼠疼痛耐受增加和镇痛,激活通路会使小鼠产生痛觉敏化,说明在岛叶皮质内存在精细的投射依赖的神经元对疼痛响应,对于疼痛的信息岛叶皮质的神经元可能有更精细的调控策略,后续将继续深入探究另一群投射向中央杏仁核的岛叶神经元对于痛觉的影响,探究两群投射向不同下游的岛叶神经元对疼痛的调控和传递是协同一致还是相互拮抗亦或是投射向中央杏仁核的神经元对疼痛没有响应。当然,本研究也存在一些不足,如对疼痛的检测手段较为单一,仅使用了缩足阈值检测以及辣椒素产生的急性痛觉的行为观察,在后续的实验中,将使用更多的疼痛检测手段如完全弗氏佐剂局部注射造成的炎性痛、冷热板、慢性疼痛模型等,以及检测干预岛叶神经元亚群对慢性疼痛所造成的焦虑样行为是否有所改善。
总之,本研究发现了投射到伏隔核的岛叶神经元参与了疼痛信息的传递以及处理,在阻断通路之后,会产生镇痛的效果,而激活之后,在机械疼痛中小鼠展现出痛觉的敏化。
致谢:
本研究特别感谢上海交通大学医学院徐天乐教授课题组在研究平台和技术上的大力支持!本研究同时感谢复旦大学脑科学转化研究院李伟广研究员在课题方向和研究思路方面的悉心指导!

