磁响应交联糖化酶聚集体的制备及催化特性
张双正,陈国,2,3,苏鹏飞
(1华侨大学化工学院生物工程与技术系,福建 厦门 361021;2福建省生物化工技术重点实验室(华侨大学),福建 厦门361021;3华侨大学分析测试中心,福建 厦门 361021)
磁响应交联糖化酶聚集体的制备及催化特性
张双正1,陈国1,2,3,苏鹏飞1
(1华侨大学化工学院生物工程与技术系,福建 厦门 361021;2福建省生物化工技术重点实验室(华侨大学),福建 厦门361021;3华侨大学分析测试中心,福建 厦门 361021)
提出了一种采用羧基磁性纳米粒子制备杂化磁响应交联酶聚集体(M-CLEAs)的方法。表面羧基修饰的约10 nm的磁性纳米粒子与酶分子表面的氨基位点通过静电相互作用,形成复合物,在磁场作用下可将磁性纳米粒子-酶复合物从溶液中分离,经戊二醛交联即形成M-CLEAs。传统的表面氨基修饰的磁性纳米粒子与酶需在沉淀剂作用下,从溶液中分离,而后采用戊二醛共交联,而本方法无须沉淀剂,过程更为简化。以糖化酶为对象,对该过程的影响因素(交联时间、pH、酶浓度、戊二醛浓度等条件)进行了探索,并对制得的M-CLEAs的酶学性质进行了较为详细考察。结果表明,最优制备条件为:酶浓度 1 mg·ml-1,磁流体浓度 10 mg·ml-1,戊二醛浓度0.25%(质量体积比),在pH 6.0下交联反应6 h,最终载酶量可达80 mg·g-1、比活为50 U·mg-1。制得的固定化酶pH稳定性、热稳定性和储存稳定性均显著改善,可实现糖化酶重复使用10次,仍保留接近60%的酶活。
生物催化;酶;固定化;磁交联酶聚集体;制备方法;糖化酶;酶学特性
引 言
酶是一种反应条件温和、环境友好的生物催化剂,具有高效催化、高特异性和高选择性等优点,但其较低的热稳定性和难回收的特点限制了其在工业上的应用。通过酶固定化可有效提高酶的稳定性,并增加酶的重复使用次数[1]。交联酶聚集体(CLEAs)是由Sheldon等发展出来的一种无载体酶固定化技术,具有对酶纯度要求低、无须载体、单位体积活性高、空间效率高、操作简便等优点,表现出良好的应用前景[2-3]。然而,CLEAs 在离心和过滤回收的过程中,存在机械强度较差、易破碎、回收烦琐等问题[4-5]。在制备CLEAs的过程中,加入磁性纳米粒子(MNP),形成杂化的磁响应交联酶聚集体(M-CLEAs),可实现交联酶聚集体在磁场下快速回收利用[6-8]。吴星涛等[9]将3-氨丙基三乙氧基硅烷处理后的稳定磁性铁氧化物颗粒加入葡萄糖苷酶酶液,以1,4-二氧六环作沉降剂和戊二醛作交联剂制备了磁性交联β-葡萄糖苷酶聚集体。Sojitra等[10]采用同样的磁性纳米粒子,与淀粉酶、果胶酶和纤维素酶混合后,直接采用戊二醛交联,制备了磁响应的交联三酶聚集体并用于果汁澄清。Liu等[11]采用同样的方法,使用硫酸铵作沉淀剂,对淀粉酶进行固定化并用于分析淀粉酶的抑制物。Kumar等[12]采用同样的磁性纳米粒子,通过异丙醇先将漆酶沉淀在磁性粒子表面,然后戊二醛交联制得漆酶CLEAs,用于染整污水的脱色。同样的氨基修饰的磁性纳米粒子亦被用于脂肪酶[13]、青霉素G酰基转移酶[14]、纤维素酶[15]和糖化酶[16]等的固定化。目前,所有的磁响应交联酶聚集体的制备均是采用氨基修饰的磁性纳米粒子,在沉淀剂作用下与酶共沉淀后,通过交联剂作用,将磁性粒子表面氨基与酶表面氨基共交联后形成M-CLEAs。
本研究提出一种采用羧基修饰的磁性纳米粒子直接与酶相互作用,在磁场作用下使酶快速从溶液中分离,然后直接进行交联制备M-CLEAs。该方法可以不使用沉淀剂,省略沉淀后的离心和过滤操作,可大大简化M-CLEAs的制备过程。本文将以糖化酶[17]为对象,对这一固定化酶过程进行研究。
1 实验材料和方法
1.1 材料
六水合三氯化铁(FeCl3·6H2O)、四水合氯化亚铁(FeCl2·4H2O)、油酸、氨水、高锰酸钾、戊二醛、氢氧化钠、氯化钠、磷酸二氢钾、磷酸氢二钾、磷酸、乙醇等购于广东汕头西陇化工有限公司,均为分析纯;糖化酶购于湖南鸿鹰翔生物工程股份有限公司;实验用水为去离子水。
1.2 羧基磁性纳米粒子的制备
参考本实验室制备方法[18-19]。称取FeCl3·6H2O 8.1 g溶于142.5 ml去离子水,转移到三口烧瓶中,搅拌加热至70℃。称取FeCl2·4H2O 4.4 g溶于10 ml去离子水中,过滤后取7.5 ml加入三口烧瓶。在400 r·min-1剧烈搅拌条件下,快速加入 18 ml浓氨水(250 g·L-1),1 min后,逐滴加入4.66 g油酸,70℃下继续搅拌1 h。反应结束后,得黑色溶胶状溶液,磁分离后从反应体系中获得胶状沉淀。用无水乙醇洗涤 2次除去多余的油酸,再用去离子水洗涤至pH=7。然后加入160 ml浓度为10 mg·ml-1的高锰酸钾溶液,宁波新芝超声波清洗仪 SB-3200DT(180 W)超声振荡8 h(每超声20 min停20 min),磁分离后用去离子水洗涤3次,得磁流体。真空冷冻干燥40 h,得到表面修饰有羧基的磁性纳米粒子粉末。
1.3 M-CLEAs的制备
在10 ml试样瓶中加入3 ml的 2 mg·ml-1的糖化酶酶液(浓度200 mmol·L-1、pH 5.0的醋酸盐缓冲液配制),及一定量的浓度为20 mg·ml-1的磁流体。在6℃摇床中,200 r·min-1转速下振荡20 min后,磁分离得聚集体,加入一定量的戊二醛(0.25%,质量体积比,后同),6℃下,150 r·min-1继续振荡6 h后,磁分离得固形物,去离子水洗涤数次后得到M-CLEAs,并加入醋酸缓冲液(200 mmol·L-1,pH5.0)重悬待用。
1.4 酶活测定方法
取一定量游离酶或固定化酶,分散在3 ml的醋酸缓冲液(200 mmol·L-1, pH5.0)中,加入5 ml的预糊化淀粉(20 g·L-1),60℃水浴振荡5 min,加1 ml的2 mol·L-1氢氧化钠溶液终止反应,DNS法测反应液中还原糖浓度(若为固定化酶需磁分离后测定),计算酶活。

1.5 载酶量、相对酶活、残余酶活的计算

1.6 酶稳定性及最适条件测定
1.6.1 最适pH和最适温度 平行取6份10 mg的固定化糖化酶样品或1 ml的游离糖化酶酶液(0.55 mg·ml-1),分别分散到 3 ml的醋酸缓冲液(200 mmol·L-1)中,加入 5 ml的预糊化淀粉(20 g·L-1),反应5 min后终止反应,计算酶活。测最适pH时,温度设定为60℃,醋酸缓冲液pH分别为3.0、3.6、4.2、4.8、5.4、6.0;测最适温度时,pH设定为4.8,反应温度分别为30、40、50、60、70、80℃。
1.6.2 pH稳定性、温度稳定性和储存稳定性 平行取6份10 mg固定化糖化酶或1 ml的游离糖化酶酶液(0.55 mg·ml-1),分别分散到3 ml的醋酸缓冲液(200 mmol·L-1)中,一定温度下放置5 h,然后在60℃下测其酶活。测pH稳定性时,放置温度设定为30℃,醋酸缓冲液pH分别为3.0、3.6、4.2、4.8、5.4、6.0;测温度稳定性时,pH设定为4.8,放置温度分别为30、40、50、60、70、80℃。
考察储存稳定性时,将固定化糖化酶和游离糖化酶分别在30℃下放置1、2、4、6、8、10、15、20、25、30 d,然后将固定化糖化酶在pH 4.8和60℃测酶活,游离糖化酶在pH 4.2和60℃测酶活。
1.7 分析与表征
红外分析使用 Shimadzu 8400S型傅里叶变换红外仪,溴化钾压片法测定;热重分析用DTG-60H型热重分析仪在N2氛围下,以10℃·min-1的加热速度,加热至1000℃测定。
2 实验结果与讨论
2.1 M-CLEAs的制备及表征

图1 羧基修饰磁性纳米粒子与酶的共交联Fig.1 M-CLEAs prepared from carboxyl modified MNP and enzyme
文献报道的磁响应聚集体的制备[2]一般采用表面氨基修饰的磁性纳米粒子与酶混合,磁性纳米粒子和酶相互作用力较弱,需加入沉淀剂辅助将磁性纳米粒子和酶共沉淀,然后加入交联剂共交联形成杂化磁响应性酶聚集体(M-CLEAs)。戊二醛在酶分子表面的氨基之间、酶分子与磁性纳米粒子表面的氨基之间、磁性纳米粒子表面的氨基之间进行交联,在形成的酶聚集体中磁性纳米粒子参与了交联反应。本研究提出的磁响应聚集体的制备机理如图1所示,表面羧基修饰的磁性纳米粒子与酶分子表面的氨基发生静电相互作用,由于酶分子的尺寸(约10 nm)与磁性纳米粒子的尺寸(约10 nm)相当,可发生如图 1中一个磁性粒子与多个酶分子作用(Type1)或一个酶分子与多个磁性粒子作用(Type2)两种情况的静电吸附,无须加入沉淀剂,通过外磁场可直接将磁性纳米粒子与酶分子的复合体从溶液中分离出来,之后加入的戊二醛仅在酶分子之间交联,交联的过程中将磁性纳米粒子包覆在酶聚集体中形成M-CLEAs。在图1的机理中,磁性纳米粒子并未参与交联反应。
图2是对糖化酶及M-CLEAs的红外分析,在3435 cm-1处为—OH的伸缩振动引起的强吸收峰,2961 cm-1和2926 cm-1处的峰是CH2的伸缩振动吸收峰,1655 cm-1是C O的伸缩振动吸收峰,1420 cm-1是酰胺键中的C—N伸缩振动的吸收峰,这些特征峰在谱带a与b中均存在,为糖化酶中的特征峰,谱a中的465 cm-1和588 cm-1为Fe3O4的特征峰,由此可知糖化酶已成功与磁性纳米粒子形成了复合物。图3是M-CLEAs的热重分析,热失重峰分别在48.6、262.6、341.8、646.4和754.4℃。从初始至97.0℃的热失重来自体系中的水;其后的两个失重峰分别是通过吸附作用和戊二醛交联作用结合在磁性纳米粒子表面上的糖化酶,各为 9.0%和4.7%,共13.7%,最后两个热失重峰,共 10.0%的失重为磁性纳米粒子表面的壬二酸,与已有研究一致[18-19]。M-CLEAs的总的热失重为 28%,除去其中水、戊二醛和壬二酸的热失重19%,酶的热失重约为 9%,与后续通过交联前后蛋白浓度差测定的固定化量接近。

图2 M-CLEAs的红外谱图Fig.2 FT-IR spectra of M-CLEAs (a) and free glucoamylase(b)
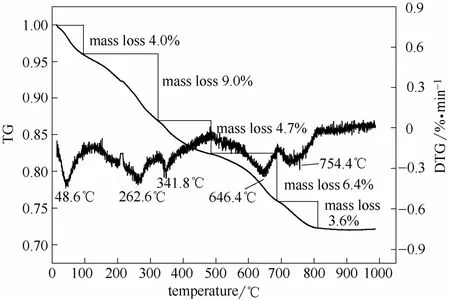
图3 M-CLEAs的热重分析Fig.3 TGA analysis of M-CLEAs
2.2 M-CLEAs的制备条件考察
2.2.1 交联时间对固定化的影响 图4为交联时间对酶负载量和固定化酶活性的影响,M-CLEAs制备条件不变,仅改变交联时间。由图可知,随交联时间延长,固定化糖化酶的载酶量基本不变,说明吸附阶段糖化酶与磁性纳米粒子结合已较稳定,交联阶段对酶和粒子的相互作用影响较小。在6 h以前,酶活缓慢增加,其后,酶活快速下降,因此应保证交联时间小于6 h。随着固定化时间的延长,酶的交联过于充分,使酶的柔性大大降低,因而降低了酶的活性。Liu等[11]研究0.5%的戊二醛交联淀粉酶2 h得到较优结果,本研究采用 0.25%的戊二醛交联糖化酶6 h较优。
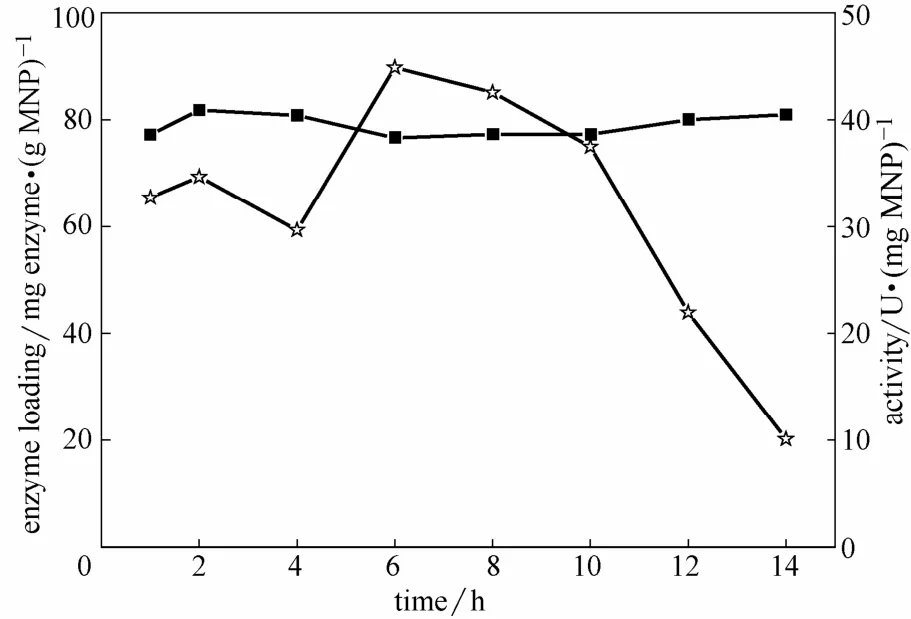
图4 交联时间对载酶量和M-CLEAs活性的影响Fig.4 Effect of crosslinking time on enzyme loading (■) and activity (☆) of M-CLEAs
2.2.2 初始糖化酶浓度对固定化的影响 图5为糖化酶浓度对固定化的影响,M-CLEAs制备条件不变,仅改变初始糖化酶浓度。载酶量随着初始酶浓度增加而增加,在初始酶浓度为2.5 mg·ml-1时达到平衡,而固定化酶酶活在初始酶浓度达到 0.5 mg·ml-1即基本达到平衡。过高的载酶量对酶活增加并无优势,载酶量的增加反而可能导致底物传递限制和酶的柔性变差,进而使其比活下降。因此,控制载酶量对于固定化过程具有重要意义。
2.2.3 戊二醛浓度对固定化的影响 图6反映了戊二醛浓度对固定化的影响,M-CLEAs制备条件不变,仅改变戊二醛浓度。固定化酶随戊二醛浓度的增加,载酶量变化很小,但酶活在戊二醛浓度为0.4%时达最大,之后迅速降低。因为吸附在磁性纳米粒子表面的酶分子是一定的,随交联剂的增加,过多的活性醛基导致酶分子与酶分子之间充分交联,不仅产生空间结构障碍阻碍了底物与酶分子活性中心的接触,而且使酶分子的柔性大大降低。这与前述延长交联时间的作用类似,都导致了酶活性的快速下降。文献[16, 20] 报道,制备α-淀粉酶的M-CLEAs时,戊二醛浓度为50 mmol·L-1最优,其浓度约为0.5%,与本研究较为相近;使用二醛果胶作为交联剂制备糖化酶M-CLEAs,二醛果胶浓度为1.5%时活性最高;可见交联剂的种类与其使用浓度也密切相关。因此宜采取较低浓度戊二醛条件下控制交联时间的策略制备M-CLEAs,但浓度过低的戊二醛会大大增加戊二醛交联时间,对交联效率和M-CLEAs的酶活均有不利影响。
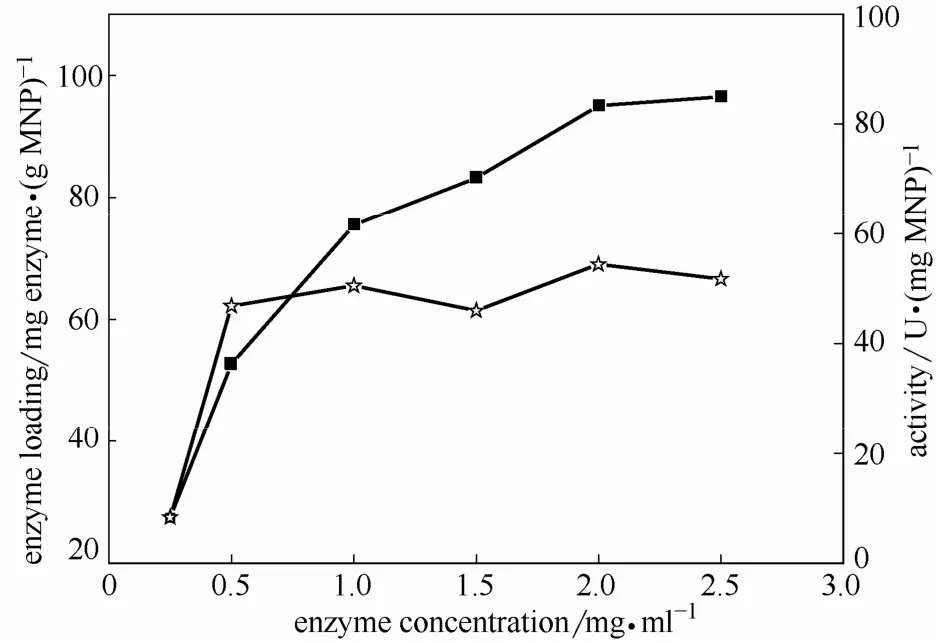
图5 交联过程糖化酶浓度对载酶量和M-CLEAs活性的影响Fig.5 Effect of glucoamylase concentration on enzyme loading (■) and activity (☆) of M-CLEAs during cross-linking

图6 交联过程戊二醛浓度对载酶量和M-CLEAs活性的影响Fig.6 Effect of GA concentration on enzyme loading (■) and activity (☆) of M-CLEAs during cross-linking
2.2.4 pH对固定化的影响 图7为pH对固定化的影响,M-CLEAs制备条件不变,仅改变交联反应pH。由图可知,随pH增加,载酶量逐渐减少,而酶活逐渐增大至pH6.0后稳定。糖化酶的等点电在pH4.5附近[21-22],羧基磁性纳米粒子等电点在pH2.0附近[18,23-24],当pH处于2.0~4.0之间时,两者表面所带的整体电荷相反,有利于磁性纳米粒子与酶的相互作用。在不同的pH环境下,酶分子表面电荷分布有差异,从而改变粒子表面的羧基与酶表面氨基结合的位点,因而对其酶活影响显著[25]。
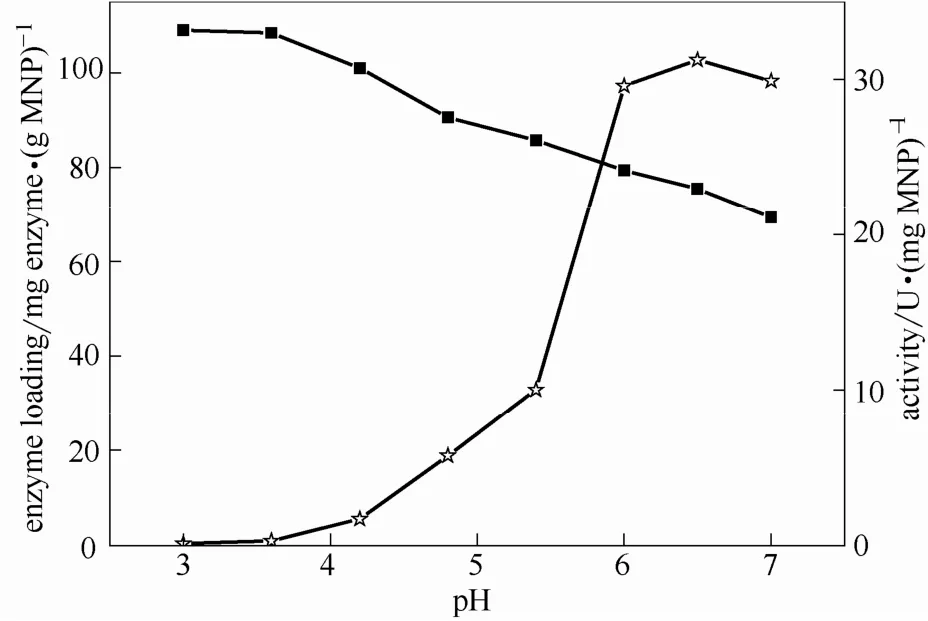
图7 交联过程pH对载酶量和M-CLEAs活性的影响Fig.7 Effect of cross-linking pH on enzyme loading (■) and activity (☆) of M-CLEAs
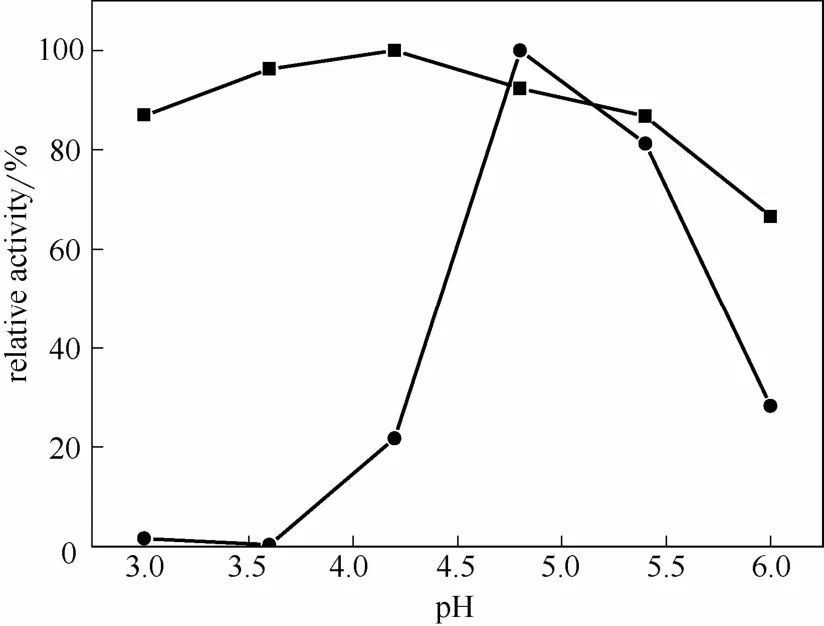
图8 游离糖化酶和M-CLEAs的最适pHFig.8 Optimum pH of free enzyme (●) and M-CLEAs (■)
2.3 M-CLEAs的特性
2.3.1 最适pH和pH稳定性 图8比较了不同pH下游离糖化酶酶活和M-CLEAs的酶活。由图可知,游离酶最适pH为4.8,而固定化酶最适pH为4.2,但固定化酶在pH3.0~5.5酶活变化不大,因此表现出较好的pH适应性,能应用于pH较宽的反应体系。与游离酶相比,M-CLEAs的最适pH有所下降,与Talekar等[20]采用戊二醛交联制得的M-CLEAs趋势相同,但与 Nadar等[16]采用大分子交联剂制得的M-CLEAs趋势相反。图 9比较了游离糖化酶和M-CLEAs的 pH稳定性,可以看出 M-CLEAs在pH3.0~4.8均较稳定,pH稳定性明显优于游离酶。
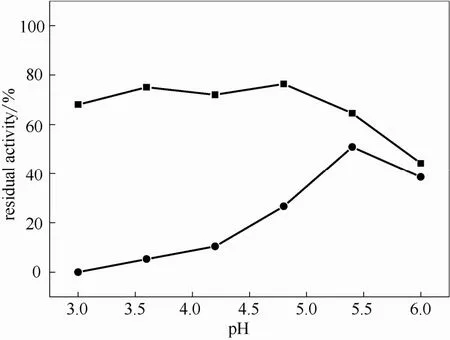
图9 游离糖化酶和M-CLEAs的pH稳定性Fig.9 pH stability of free enzyme (●) and M-CLEAs (■)
2.3.2 最适温度和温度稳定性 图 10比较了温度对游离糖化酶酶活和 M-CLEAs的酶活的影响。M-CLEAs的最适温度为 70℃,而游离糖化酶的最适温度为60℃。但由图11游离糖化酶和M-CLEAs热稳定性的比较可知道,M-CLEAs在 70℃的热稳定性较差,游离糖化酶在60℃的热稳定性较差,均不适合在最适温度下操作。相比游离酶,M-CLEAs在30~60℃的热稳定性均有较大的提高,因为载体和交联剂一定程度增加了酶的刚性,使其不易变性,故提高了其在高温下的稳定性[26-29]。兼顾酶活和热稳定性,50℃应是 M-CLEAs的适宜的操作温度。
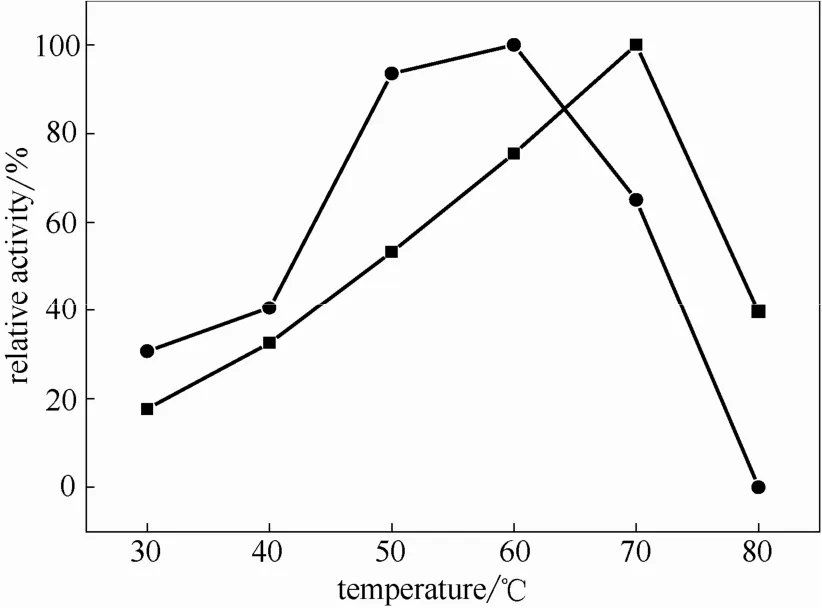
图10 游离糖化酶和M-CLEAs的最适温度Fig.10 Optimum temperature of free enzyme (●) and M-CLEAs (■)

图11 游离糖化酶和M-CLEAs的温度稳定性Fig.11 Thermal stability of free enzyme (●) and M-CLEAs (■)
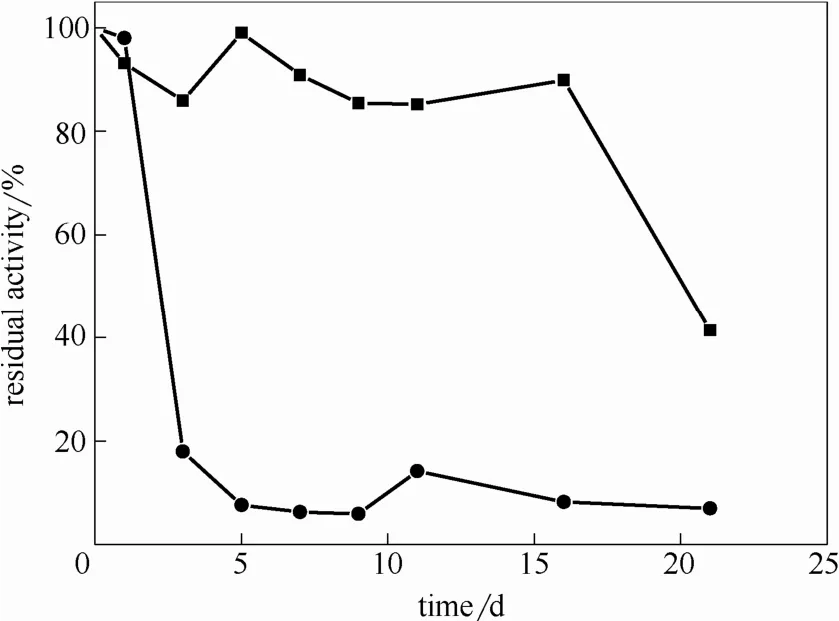
图12 游离糖化酶和M-CLEAs的储存稳定性Fig.12 Storage stability of free enzyme (●) and M-CLEAs (■)

图13 M-CLEAs操作稳定性Fig.13 Operation stability of M-CLEAs
2.3.3 储存稳定性和操作稳定性 图 12为游离糖化酶和M-CLEAs的储存稳定性比较。相同条件下,糖化酶固定化之后的储存稳定性明显提高,30℃下游离酶保存4 d后残余酶活低于20%,而固定化酶在保存15 d后的残余酶活仍高达85%。这是因为糖化酶经戊二醛交联之后,构象发生改变,刚性增加,因而增加了其在室温下的稳定性。此外,4℃储存稳定性的研究表明,固定化糖化酶放置两个月不会有明显的变化,有较好的储存稳定性。图 13为M-CLEC的操作稳定性。由图可知,M-CLEAs连续使用10次后,仍能保持接近60%的酶活,展现了较好的重复使用性能。
2.3.4 动力学参数 通过 Lineweaver-Burk线性拟合,计算酶反应的最大反应速率 Vmax及米氏常数Km,如表 1所示。糖化酶在固定化之后,Km值变大,说明固定化后酶与底物的亲和性降低[30]。最大反应速率Vmax大大降低,因为糖化酶底物为分子量较大的糊化淀粉,M-CLEAs颗粒与底物之间的结合的位阻迅速增加,进而导致表观反应速率的降低[5]。

表1 M-CLEAs与游离酶动力学参数的比较Table 1 Comparison of kinetic parameters of free glucoamylase and M-CLEAs
3 结 论
表面羧基修饰的磁性纳米粒子在合适的pH作用下,可与酶表面的氨基发生较强的静电相互作用,通过戊二醛的交联,可以形成磁响应性交联酶聚集体。以糖化酶为研究对象表明:pH 6.0、1 mg·ml-1的酶浓度,10 mg·ml-1的磁流体浓度,戊二醛浓度0.25%,交联6 h,能够获得载酶量为80 mg·g-1、比活在50 U·mg-1左右的固定化糖化酶。与游离酶相比,形成的纳米酶复合物的最适温度、最适pH均发生了一定变化,稳定性明显提高,而且固定化后的糖化酶可以重复利用,但纳米酶复合物 Km值较大,与底物的亲和性较差。因此,本研究提供的羧基磁性纳米粒子与酶先静电吸附,磁场辅助沉淀,后共交联制备磁响应性交联酶聚集体,是一种有效的酶固定化方法。
[1] 孙建华, 戴荣继, 邓玉林. 酶固定化技术研究进展[J]. 化工进展,2010, 29(4): 715-721.SUN J H, DAI R J, DENG Y L. Progress in enzyme immobilization technique[J]. Chemical Industry and Engineering Progress, 2010,29(4): 715-721.
[2] SCHOEVAART R, WOLBERS M W, GOLUBOVIC M, et al.Preparation, optimization, and structures of cross-linked enzyme aggregates (CLEAs)[J]. Biotechnology and Bioengineering, 2004,87(6): 754-762.
[3] SHELDON R A. Cross-linked enzyme aggregates (CLEA(R)s):stable and recyclable biocatalysts[J]. Biochemical Society Transactions, 2007, 35: 1583-1587.
[4] CUI J D, JIA S R. Optimization protocols and improved strategies of cross-linked enzyme aggregates technology: current development and future challenges[J]. Critical Reviews in Biotechnology, 2015, 35(1):15-28.
[5] TALEKAR S, JOSHI A, JOSHI G, et al. Parameters in preparation and characterization of cross linked enzyme aggregates (CLEAs)[J].RSC Advances, 2013, 3(31): 12485-12511.
[6] SHAARANI S M, JAHIM J M, RAHMAN R A, et al. Silanized maghemite for cross-linked enzyme aggregates of recombinant xylanase from Trichoderma reesei[J]. Journal of Molecular Catalysis B-Enzymatic, 2016, 133: 65-76.
[7] GUPTA K, JANA A K, KUMAR S, et al. Solid state fermentation with recovery of Amyloglucosidase from extract by direct immobilization in cross linked enzyme aggregate for starch hydrolysis[J]. Biocatalysis and Agricultural Biotechnology, 2015,4(4): 486-492.
[8] ZHOU L Y, TANG W, JIANG Y J, et al. Magnetic combined cross-linked enzyme aggregates of horseradish peroxidase and glucose oxidase: an efficient biocatalyst for dye decolourization[J].RSC Advances, 2016, 6(93): 90061-90068.
[9] 吴星涛, 薛原楷, 石贤爱. 磁性交联 β-葡萄糖苷酶聚集体的制备及性质[J]. 生物物理学报, 2013, 29(10): 769-778.WU X T, XUE Y K, SHI X A. The preparation and properties of magnetic cross-linked β-glucosidase aggregates[J]. Acta Biophysica Sinica, 2013, 29(10):769-778.
[10] SOJITRA U V, NADAR S S, RATHOD V K. A magnetic tri-enzyme nanobiocatalyst for fruit juice clarification[J]. Food Chemistry, 2016,213: 296-305.
[11] LIU L L, CEN Y, LIU F, et al. Analysis of alpha-amylase inhibitor from corni fructus by coupling magnetic cross-linked enzyme aggregates of alpha-amylase with HPLC-MS[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2015, 995: 64-69.
[12] KUMAR V V, SIVANESAN S, CABANA H. Magnetic cross-linked laccase aggregates — bioremediation tool for decolorization of distinct classes of recalcitrant dyes[J]. Science of the Total Environment, 2014, 487: 830-839.
[13] CUI J D, CUI L L, JIA S R, et al. Hybrid cross-linked lipase aggregates with magnetic nanoparticles: a robust and recyclable biocatalysis for the epoxidation of oleic acid[J]. Journal of Agricultural and Food Chemistry, 2016, 64(38): 7179-7187.
[14] KOPP W, DA COSTA T P, PEREIRA S C, et al. Easily handling penicillin G acylase magnetic cross-linked enzymes aggregates:catalytic and morphological studies[J]. Process Biochemistry, 2014,49(1): 38-46.
[15] BHATTACHARYA A, PLETSCHKE B I. Magnetic cross-linked enzyme aggregates (CLEAs): a novel concept towards carrier free immobilization of lignocellulolytic enzymes[J]. Enzyme and Microbial Technology, 2014, 61/62: 17-27.
[16] NADAR S S, RATHOD V K. Magnetic macromolecular cross linked enzyme aggregates (CLEAs) of glucoamylase[J]. Enzyme and Microbial Technology, 2016, 83: 78-87.
[17] KUMAR P, SATYANARAYANA T. Microbial glucoamylases:characteristics and applications[J]. Critical Reviews in Biotechnology,2009, 29(3): 225-255.
[18] SU P F, CHEN G, ZHAO J. Convenient preparation and characterization of surface carboxyl-functioned Fe3O4magneticnanoparticles[J]. Chemical Journal of Chinese Universities, 2011,32(7): 1472-1477.
[19] CHEN G, MA Y H, SU P F, et al. Direct binding glucoamylase onto carboxyl-functioned magnetic nanoparticles[J]. Biochemical Engineering Journal, 2012, 67: 120-125.
[20] TALEKAR S, GHODAKE V, GHOTAGE T, et al. Novel magnetic cross-linked enzyme aggregates (magnetic CLEAs) of alpha amylase[J]. Bioresource Technology, 2012, 123: 542-547.
[21] PALDI T, LEVY I, SHOSEYOV O. Glucoamylase starch-binding domain of Aspergillus niger B1: molecular cloning and functional characterization[J]. Biochemical Journal, 2003, 372: 905-910.
[22] CHRISTENSEN U. pH-dependence of the fast step of maltose hydrolysis catalysed by glucoamylase G1 from Aspergillus niger[J].Biochemical Journal, 2000, 349: 623-628.
[23] YU S, CHOW G M. Carboxyl group (—CO2H) functionalized ferrimagnetic iron oxide nanoparticles for potential bio-applications[J]. Journal of Materials Chemistry, 2004, 14(18): 2781-2786.
[24] KRALJ S, DROFENIK M, MAKOVEC D. Controlled surface functionalization of silica-coated magnetic nanoparticles with terminal amino and carboxyl groups[J]. Journal of Nanoparticle Research, 2011, 13(7): 2829-2841.
[25] CUI J D, CUI L L, ZHANG S P, et al. Hybrid magnetic cross-linked enzyme aggregates of phenylalanine ammonia lyase from Rhodotorula glutinis[J]. Plos One, 2014, 9(5): e97221.
[26] HU T G, CHENG J H, ZHANG B B, et al. Immobilization of alkaline protease on amino-functionalized magnetic nanoparticles and its efficient use for preparation of oat polypeptides[J]. Industrial &Engineering Chemistry Research, 2015, 54(17): 4689-4698.
[27] KIM M, PARK J M, UM H J, et al. Immobilization of cross-linked lipase aggregates onto magnetic beads for enzymatic degradation of polycaprolactone[J]. Journal of Basic Microbiology, 2010, 50(3):218-226.
[28] PARK J M, KIM M, PARK J Y, et al. Immobilization of the cross-linked para-nitrobenzyl esterase of Bacillus subtilis aggregates onto magnetic beads[J]. Process Biochemistry, 2010, 45(2): 259-263.
[29] CRUZ-IZQUIERDO A, PICO E A, LOPEZ C, et al. Magnetic cross-linked enzyme aggregates (mCLEAs) of Candida antarctica lipase: an efficient and stable biocatalyst for biodiesel synthesis[J].Plos One, 2014, 9(12): e115202.
[30] ARCA-RAMOS A, KUMAR V V, EIBES G, et al. Recyclable cross-linked laccase aggregates coupled to magnetic silica microbeads for elimination of pharmaceuticals from municipal wastewater[J].Environmental Science and Pollution Research, 2016, 23(9):8929-8939.
Preparation and characterization of magnetic cross-linked glucoamylase aggregates
ZHANG Shuangzheng1, CHEN Guo1,2,3, SU Pengfei1
(1Department of Bioengineering and Biotechnology, College of Chemical Engineering, Huaqiao University, Xiamen 361021, Fujian,China;2Fujian Provincial Key Laboratory of Biochemical Technology (Huaqiao University), Xiamen 361021, Fujian, China;3Instrumental Analysis Center, Huaqiao University, Xiamen 361021, Fujian, China)
The paper presents a method for preparing hybrid magnetic cross-linked enzyme aggregates (M-CLEAs)using carboxyl magnetic nanoparticles (MNP). The magnetic nanoparticle-enzyme complexes induced by electrostatic interaction between carboxyl group of magnetic particle and amino group of enzyme were separated from the solution under magnetic field, and then were cross-linked by glutaraldehyde. The traditional method of M-CLEAs preparation from amino-modified magnetic nanoparticles and the enzyme need the precipitant to prompt the separation of enzyme and magnetic nanoparticle from the solution. The method here proposed does not need the precipitant, thereof the process is greatly simplified. In this paper, the factors of cross-linking time, pH,enzyme concentration and concentration of glutaraldehyde in M-CLEAs preparation process were studied, and then the enzymatic properties of M-CLEAs were also investigated in detail. The results showed that the optimum conditions were as follows: enzyme concentration of 1 mg·ml-1, magnetic fluid concentration of 10 mg·ml-1,glutaraldehyde concentration of 0.25% and crosslinking reaction at pH 6.0 for 6 h. The final enzyme loading reached 80 mg·g-1and the activity of M-CLEAs was 50 U·mg-1. The pH stability, thermostability and storage stability of the immobilized enzyme improved significantly, and M-CLEAs still remained nearly 60% of activity after 10 cycles.
biocatalysis; enzyme; immobilization; magnetic cross-linked enzyme aggregates; preparation method;glucoamylase; characterization of enzyme
date:2016-11-07.
Prof. CHEN Guo, chenguo@hqu.edu.cn
supported by the National Natural Science Foundation of China (21576108), Program for New Century Excellent Talents in Fujian Province University, and Research Innovation Ability Cultivation Program for Graduate Student of Huaqiao University.
Q 814
A
0438—1157(2017)07—2763—08
10.11949/j.issn.0438-1157.20161565
2016-11-07收到初稿,2017-03-31收到修改稿。
联系人:陈国。
张双正(1991—),男,硕士研究生。
国家自然科学基金面上基金项目(21576108);福建省新世纪优秀人才项目;华侨大学研究生科研创新能力培育计划资助项目。

