库尔勒香梨表皮酵母菌的筛选及耐受性的分析
姚晓瑞宁,高飞飞,王斌,肖婧,贾晨坤,史学伟*
(1.石河子大学食品学院,新疆石河子832000;2.石河子大学信息科学与技术学院,新疆石河子832000)
库尔勒香梨表皮酵母菌的筛选及耐受性的分析
姚晓瑞宁1,高飞飞1,王斌1,肖婧2,贾晨坤1,史学伟1*
(1.石河子大学食品学院,新疆石河子832000;2.石河子大学信息科学与技术学院,新疆石河子832000)
以优良的库尔勒香梨为原料,使用YEPD培养基,从中分离获得100株酵母菌,按照菌落特征,形态学分析并结合ITS区基因序列同源性分析确定其种属,确定其为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)和奥默毕赤酵母(Pichia kudriavzevii),并对其进行耐酸、耐糖、耐乙醇和耐二氧化硫的分析。结果表明,菌株D4的最高耐糖含量为18%、菌株13为14%,菌株D4耐受pH值为3.0、菌株13耐受pH值为3.5,菌株D4、13最高耐乙醇体积分数均为9%,菌株D4的最高耐二氧化硫含量为0.20%、菌株13为0.15%。
库尔勒香梨;酵母菌;耐受性分析
新疆维吾尔自治区巴音郭楞蒙古自治州阿克苏地区是最早生产库尔勒香梨的地方,1 400年的栽培历史使得库尔勒香梨成为新疆独特的优良特产,巴音郭楞蒙古自治州地区是库尔勒香梨最主要的种植基地,种植面积达109.49万亩,年产量在104.6万t以上[1]。该产品远销港澳地区、美国、加拿大、欧盟国家以及日本、新西兰等20多个国家,年均创汇3 000万美元。库尔勒香梨在香梨品种中是一个远近闻名的“名、优、特”优良品种,也是该地区甚至全国最优异的地方梨品种之一。库尔勒香梨被誉为“西域圣果”,其外观诱人、皮薄、果肉白色微绿、汁多味甜、肉质细腻酥脆、清脆爽口、其特点享誉国内外,并且富含多种营养成分,因而受到国内外广大消费者的青睐[2]。
现代发酵工业离不开微生物发酵剂[3],目前德、法、荷兰、美国、加拿大均已有优良的活性干酵母商品生产。中国的酵母工业形成了安琪、丹宝利、梅山等14家酵母企业。有关微生物选育的研究也成为热点,近年来国外相关学者在酵母菌对发酵制品风味品质影响方面做了大量的研究工作,相关研究成果充分表征了酵母菌在发酵过程中所起到的关键作用及对香气物质富集与产品整体风味呈现的影响力。库尔勒香梨经加工可制成香梨果酒、香梨白兰地、香梨精汁、香梨浊汁以及香梨发酵饮料等。
人类对于酵母菌的深入研究使得人们的生活水平有了极大的提高[4]。近年来,随着食品技术的发展,果酒果醋的种类越来越多,新疆有着“瓜果之乡”的美誉,但是在果酒方面的发展比较欠缺,其中发酵菌种单一也是制约其发展的主要原因,因此,本试验对于发酵菌种的选育的意义深远,为今后果酒果醋的发展奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
库尔勒香梨:购自新疆库尔勒市及石河子市大型超市。
1.1.2 主要试剂
葡萄糖、酵母浸粉、琼脂粉(生化试剂):北京奥博星生物技术有限责任公司;氢氧化钠、磷酸氢二钾、柠檬酸钠:天津市致远化学试剂有限公司;磷酸二氢钾:天津永晟精细化工厂有限公司;丙三醇:天津市福晨化学试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS):天津市富宇精细化工有限公司;以上试剂均为分析纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基[5]:葡萄糖2%、酵母浸粉1%、蛋白胨2%。
酵母浸出粉胨葡萄糖琼脂(YPD)培养基[5]:葡萄糖2%、酵母浸粉1%、蛋白胨2%、琼脂2%。
耐糖培养基[6]、耐酸培养基[7]、耐酒精培养基[8]、耐NaHSO3培养基[9]均是在YEPD培养基的基础上添加被测物质并调整各项比例。
1.1.4 溶液配制
Tris-HCl缓冲溶液(pH 7.0~8.0):某一特定pH值的0.05 mol/L Tris缓冲液的配制:将50 mL 0.1 mol/L Tris碱溶液与配方表中所示相应体积(单位mL)的0.1 mol/L HCl混合,加水将体积调至100 mL即可(配制0.1 mol/L HCl即为8.58 mL浓盐酸用蒸馏水定容到1 000 mL)。

表1 Tris-HCl缓冲溶液配制方法Table 1 Preparation method of Tris-HCl buffered solution
另配制10%的SDS溶液、1 mol/L Tris-HCl(pH 8.0)、0.5 mol/L EDTA(pH 8.0)、1×TE(10 mmol/L Tris-HCl,pH 8.0;1 mmol/L EDTA,pH 8.0)。
1.2 仪器与设备
5810R高速冷冻离心机:德国Eppendorf仪器公司;BCD-265F冷藏冷冻箱:荣事达集团;LAC-5040S全自动高压灭菌锅:浙江新丰医疗器械有限公司;pHS-3C标准型pH计:上海精密科学仪器有限公司;CX21FS1光学显微镜:Olympus公司;722光栅紫外分光光度计:上海精密科学仪器有限公司;Bnp-9272智能生化培养箱:上海精宏试验设备有限公司;SHZ-B水浴恒温振荡器:上海博讯实业有限公司;TC-512PCR扩增仪:英国Techne公司;Power Pac Universal水平电泳仪、GelDOCXR凝胶成像系统:美国Bio-Rad公司。
1.3 试验方法
1.3.1 样品采集
(1)2015年10月于库尔勒农八师梨园采集的香梨。
(2)2016年3月于石河子好家乡超市购买的香梨。
1.3.2 样品预处理
取适量香梨皮于2%的无菌葡萄糖水溶液中浸泡,置于酵母培养箱中,28℃培养24~48 h。
1.3.3 菌株的分离纯化
将1.3.2中的菌液梯度稀释,用涂布法每一梯度接种三个平面,置于28℃培养箱中培养24~48 h;将不同形态大小的酵母菌接种在YEPD培养基中,获得单菌落后接入液体培养基活化24 h,置于甘油和水的混合物中保藏备用。
1.3.4 酵母菌的形态特征分类
常规鉴定方法主要依据《酵母的特征及鉴定手册》[10]以及张纪忠[11]的《微生物分类学》。
1.3.5 ITS区基因PCR扩增
根据形态学特征选取生长力较好且具有代表性的菌株按以下方法进行DNA提取及PCR扩增产物测序。
(1)DNA的提取
取1mL菌悬液,5000r/min离心3min;离心后的菌体用pH 7.4的磷酸盐缓冲液洗脱三次,再用0.5 mL无菌水洗脱三次,5 000×g离心3 min;细胞悬液用0.5 mL 6 mol/L的尿素和0.1 mL 10%SDS于37℃培养20 min;沸水煮沸后加热5 min;加热后25℃、8 000×g离心10 min;弃上清液,向离心管中加入0.2 mol/L NaOH 0.1 mL,37℃,10 min;25℃、3000×g离心3min,取上清液;用2.5倍体积的无水乙醇加入上清液,-20℃,放置2 h;取出后12 000×g、4℃离心20 min,再用体积分数70%的乙醇洗脱;12 000×g离心5 min;洗脱后烘干,加100 μL 1×TE-20℃保存[12]。
(2)PCR扩增
PCR扩增使用引物ITS1:5′-TCCGTAGGTGAACCT GCGG-3′和引物ITS4:5′-TCCTCCGCTTATTGATATGC-3′,PCR反应体系总体积为25 μL,每管中加入2×EcoTaqSuper Mix(+dye)14 μL;引物各1.25 μL;模板DNA 2 μL;加双蒸水至6.5μL。PCR循环为95℃预变性5min,95℃变性1min,52℃退火2 min,72℃延伸1 min,循环35次,72 μ延伸10 min[13]。取4μLPCR产物于1.0%琼脂糖凝胶(含0.5μg/mL GoldView)电泳后在GelDOCXR凝胶成像仪中观察结果。
(3)基于ITS区序列的酵母菌株系统发育分析
PCR产物交至华大基因有限公司测序,依据测序结果,用Blast搜索程序从GenBank等公共数据库中调出相似性较高的相关菌株的ITS区序列进行同源性比较,用Clustal X进行多序列比对,系统进化矩阵根据Kimura模型估算,用MEGA(molecular evolutionary genetics analysis)5.0软件采用邻接法(neighbor-joining,NJ)聚类分析,并构建出系统发育树[14]。同时,重复取样1 000次进行自展值(bootstrap value)分析来评估系统进化树的拓扑结构的稳定性。
1.3.6 酵母菌耐受性的分析
(1)菌株的活化
将4℃保藏的已鉴定的菌株,接种于YEPD液体培养基,在28℃条件下活化培养48 h。
(2)菌株的扩大培养
将活化的菌株按10%的接种量再次接于YEPD液体培养基中,在28℃恒温培养箱中培养24 h,保证菌体进入稳定的对数期,以便后续试验中保持菌株稳定的活性。
(3)酵母菌的耐糖试验
取活化好的菌液按4%接种量接种于葡萄糖含量分别为2%、5%、10%、14%、18%、22%的YPD培养基中,每组2个平行,恒温水浴振荡箱28℃、180 r/min培养,由于菌悬液浓度与OD600nm值成正比,所以利用比浊法,每隔6 h测定一次样品的OD600nm值[15],获得试验酵母菌的生长曲线。
(4)酵母菌的耐酸试验
将培养好的菌液(OD600nm值约为1.0)按4%接种量接种于pH为5.0、4.5、4.0、3.5、3.0、2.5的YPD培养基,培养条件及计数方法同耐糖试验[16]。
(5)酵母菌的耐酒精试验
将培养好的菌液(OD600nm值约为1.0)按4%接种量接种于无水乙醇体积分数分别为0、3%、6%、9%、12%、15%的YPD培养基,培养条件及计数方法同耐糖试验[17]。
(6)酵母菌的耐NaHSO3试验
按4%的接种量将扩增培养好的菌液接种到含NaHSO3液体培养基(SO2含量分别为0%、0.05%、0.10%、0.15%、0.20%、0.25%)中,培养和观察方法同耐糖菌株的筛选[18]。
2 结果与分析
2.1 酵母菌的分类
2.1.1 形态学鉴定
本试验共分离筛选得到100株酵母菌(根据观察顺序编号),根据菌落的颜色和显微形态将其聚类,共分为5种形态类型,结果见表2。

表2 培养基上酵母的形态特征Table 2 Morphological characteristics of yeast culture
2.1.2 分子生物学鉴定
根据分类结果,选34株菌提取DNA,进行PCR扩增,结果见图1。
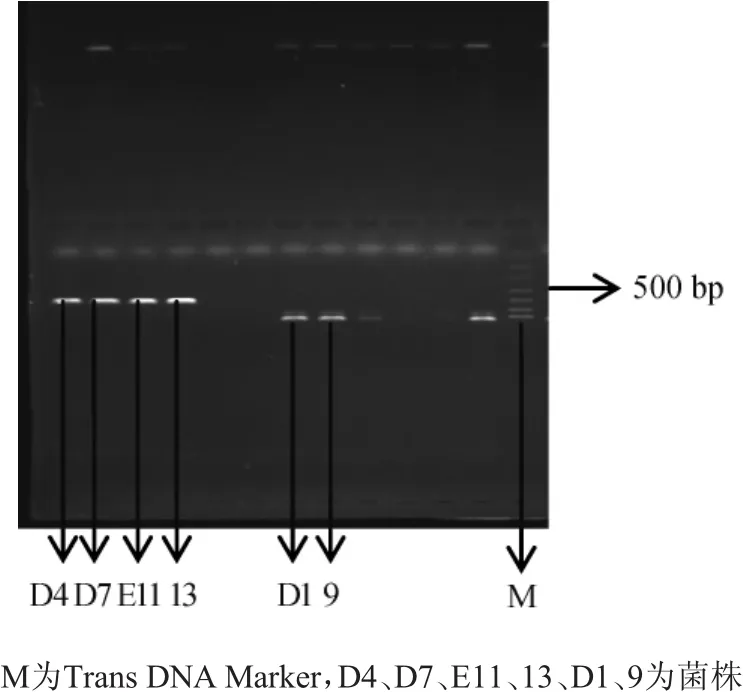
图1 菌株PCR扩增凝胶电泳图Fig.1 Gel electrophoresis of PCR amplification results of strains
由图1可知,条带清晰的有菌株D4(Ⅱ类)、D7(Ⅲ类)、E11(Ⅱ类)、13(Ⅲ类),对这4株菌基因组进行测序。
2.1.3 基于ITS区序列的酵母菌株系统发育分析
参考电泳图选取4株菌的PCR产物交至华大基因有限公司测序,根据测序结果,构建出系统发育树,结果见图2。
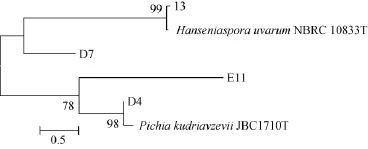
图2 基于ITS区序列分析的酵母菌株的系统发育树Fig.2 Phylogenetic tree of yeast strains based on ITS sequence analysis
由图2可知,菌株13、D7、D4、E11均为酵母菌,菌株13与葡萄汁有孢汉逊酵母的标准菌种相比较置信度为99%,菌株D4与奥默毕赤酵母的标准菌株相比的置信度为98%,D7和E11也分别属于汉逊酵母属和毕赤酵母属,但与标准菌株相比进化距离比较长,所以本实验选用能基本确定种属关系的菌株13和D4两株酵母菌进行后续实验。
2.2 D4、13两株菌的耐受性分析
(1)耐糖生长曲线及耐受性分析
菌株D4和13在不同葡萄糖含量条件下的生长曲线见图3。由图3A可知,随着糖含量增加,菌株D4生长受到不同程度抑制。在糖含量18%条件下,生长量明显下降,延滞期为12 h;在糖含量22%条件下,延滞期为48 h,且未出现明显增长。可得菌株D4的最高耐糖浓度为18%。
由图3B可知,随着糖含量增加,菌株13生长受到不同程度抑制。延滞期为6 h时,生长量明显下降;当糖含量为18%和22%时,菌株13的延滞期延长至48 h未出现明显增长。可得菌株13的最高耐糖浓度为14%。

图3 菌株D4(A)和菌株13(B)在不同葡萄糖含量下的生长曲线Fig.3 Growth curves of strain D4(A)and strain 13(B)in different glucose concentration
(2)耐酸生长曲线及耐受性分析

图4 菌株D4(A)和菌株13(B)在不同pH条件下的生长曲线Fig.4 Growth curves of strain D4(A)and strain 13(B)in different pH
菌株D4和13在不同pH条件下的生长曲线见图4。由图4A可知,菌株D4在pH为3.0时,延滞期为6 h,其生长受到明显抑制;在pH为2.5和3.0时,未出现明显增长;由此得出D4的最高耐酸pH为3.0。
由图4B可知,菌株13在pH为5.6、4.5时其生长未受到抑制;菌株13在pH为3.5时,生长受到抑制,生长量有所下降;在pH为3.0、2.5、2.0时其生长受到明显抑制,延滞期延长至48h后未出现明显增长;得到菌株13的最高耐酸pH为3.5。
(3)耐乙醇生长曲线及耐受性分析
菌株D4和13在不同乙醇体积分数条件下的生长曲线见图5。由图5A可知,在乙醇体积分数为3%、6%时,菌株D4受到抑制不强烈,延滞期稍有延长;乙醇体积分数9%时,延滞期延长18 h,抑制明显;乙醇体积分数12%和15%时,未出现明显增长,所以菌株D4的乙醇最高耐受性体积分数为9%。
由图5B可知,菌株13在乙醇体积分数为3%时未受到明显抑制;乙醇体积分数6%、9%时,延滞期延长至12 h,抑制明显,增长缓慢;乙醇体积分数12%、15%时,菌株13的延滞期延长至48 h未出现明显增长,所以菌株13的乙醇最高耐受性体积分数为9%。
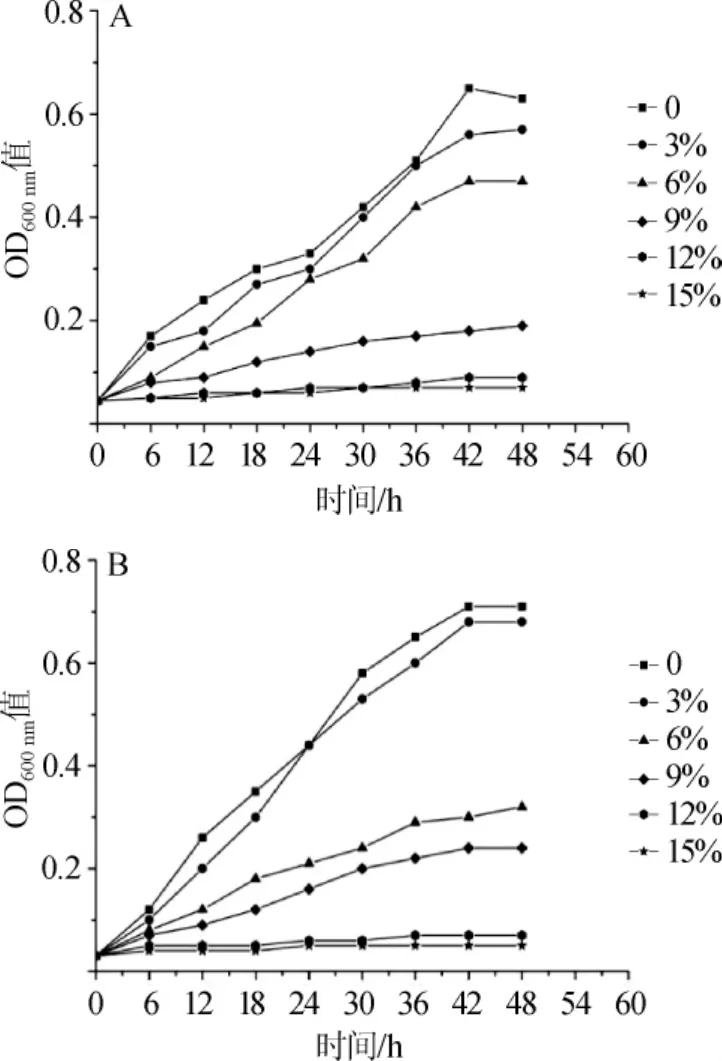
图5 菌株D4(A)和菌株13(B)在不同乙醇体积分数下的生长曲线Fig.5 Growth curves of strain D4(A)and strain 13(B)in different ethanol concentration
(4)耐二氧化硫生长曲线及耐受性分析
菌株D4和13在不同NaHSO3含量下的生长曲线见图6。由图6A可知,NaHSO3含量0.20%条件下,延滞期逐渐延长,生长量明显降低;NaHSO3含量0.25%条件下,延滞期延长至48 h且未有明显增长,所以菌株D4的最高耐二氧化硫含量为0.20%。
由图6B可知,在NaHSO3含量0.15%条件下,延滞期逐渐延长至18 h,生长速率明显降低;在NaHSO3含量0.20%、0.25%条件下,延滞期逐渐延长至48 h未出现明显增长;所以菌株13的最高耐二氧化硫含量为0.15%。

图6 菌株D4(A)和菌株13(B)在不同NaHSO3含量下的生长曲线Fig.6 Growth curves of strain D4(A)and strain 13(B)in different NaHSO3concentration
3 结论
通过对库尔勒香梨表皮酵母菌的筛选、纯化,对其DNA进行PCR扩增,将PCR产物送检测序后得到2种不同的酵母菌,并构建系统发育树。依据绘制的发育树中菌株13和葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)相似性的置信度为99%;菌株D4与奥默毕赤酵母(Pichia kudriavzevii)相似性的置信度为98%。
根据菌株筛选结果,对其进行耐受性分析,并绘制酵母菌的生长曲线;分析曲线得到菌株D4的最高耐糖浓度为18%、菌株13为14%,菌株D4最耐酸pH为3.0、菌株13为3.5,菌株D4、13最高耐酒精体积分数均为9%,菌株D4的最高耐二氧化硫含量为0.20%、菌株13为0.15%。根据以上特点可以提高发酵质量并且对新风味的研究提供理论依据,所以对香梨表面酵母菌的研究是十分有必要的。
[1]刘文玉,欧婷婷,魏长庆,等.响应面优化库尔勒香梨果醋发酵工艺的研究[J].食品工业,2016(5):158-161.
[2]林宁晓.发酵果酒工艺技术的研究进展[J].福建轻纺,2015,8(8):32-35.
[3]傅力,张华,叶红.库尔勒香梨酵母XL1和XL2发酵性能的研究[J].食品科学,2003,24(1):61-64.
[4]王雪莹.优质甜橙果酒酵母分离、筛选及耐受性研究[D].重庆:西南大学,2013.
[5]刘根娣,隋明.冬果梨果酒酵母的筛选及鉴定[J].中国酿造,2016,35(6):85-89.
[6]刘灿灿,岳田利,袁亚宏.浓缩苹果汁中高渗酵母的分离鉴定及耐糖性研究[J].西北农林科技大学学报:自然科学版,2014,42(8):111-118.
[7]刘壮,冮洁,涂茂林,等.1株从冰葡萄汁中分离的德巴利酵母菌的鉴定及耐性研究[J].食品与发酵工业,2015,41(7):51-56.
[8]万海霞.呼和浩特地区葡萄源酵母菌优良株的筛选及耐受性研究[D].呼和浩特:内蒙古农业大学,2013.
[9]刘庆军.新疆野生酵母的耐受性、耐受性及生产适用性研究[D].济南:山东轻工业学院,2009.
[10]JA巴尼特,R.W佩恩.酵母的特征及鉴定手册[M].青岛:青岛海洋大学出版社,1984:35-41.
[11]张纪忠.微生物分类学[M].上海:复旦大学出版社,1990:28-32.
[12]赵红梅,刘景武,张伟.耐高渗酵母的分离、筛选及鉴定[J].食品研究与开发,2006,27(6):34-37.
[13]BAUTISTA-GALLEGO J,R ODRÍGUEZ-GÓMEZ F,BARRIO E,et al. Exploring the yeast biodiversity of green table olive industrial fermentations for technological applications[J].Int J Food Microbiol,2011, 147(2):89-96.
[14]HONG Y A,PARK H D.Role of non-Saccharomycesyeasts in Korean wines produced from Campbell early grapes:Potential use ofHanseniaspora uvarumas a starter culture[J].Food Microbiol,2013,34(1): 207-214.
[15]徐亚男.非酿酒酵母菌的筛选及产酶研究[D].石河子:石河子大学,2016.
[16]张勤.耐酸酵母的选育及初步应用[D].无锡:江南大学,2011.
[17]王晓丽,王聪,王涛,等.HIV感染者口腔白假丝酵母菌生长曲线及代时分析[J].大理学院学报,2014,13(4):14-17.
[18]李勤.三种酵母菌生长曲线的对比研究[J].食品与发酵科技,2014,50(4):39-41,55.
Screening and tolerance analysis of yeast on Kurla pear peel
YAO Xiaoruining1,GAO Feifei1,WANG Bin1,XIAO Jing2,JIA Chenkun1,SHI Xuewei1*
(1.College of Food Science,Shihezi University,Shihezi 832000,China; 2.College of Information Science and Technology,Shihezi University,Shihezi 832000,China)
Using excellent Korla pears as raw material,100 strains of yeasts were isolated from Korla pears by YEPD medium.The strains were identified according to the characteristics of colony and morphological analysis and the homology analysis of ITS gene sequence.Results showed that Hanseniaspora uvarumandPichia kudriavzeviiwere confirmed and then their acid,sugar,ethanol and sulfur dioxide tolerance were tested.The results showed that for strain D4,the highest sugar,pH,ethanol concentration and sulfur dioxide tolerances were 18%,3.0,9%and 0.20%,respectively. For strain 13,the tolerances mentioned above were 14%,3.5,9%and 0.15%,respectively.
Korla pear;yeast;tolerance analysis
Q935
0254-5071(2017)06-0067-05
10.11882/j.issn.0254-5071.2017.06.014
2016-12-20
兵团科技攻关计划(2016AB009);青年科学基金项目(31500092);兵团科技攻关与成果转化计划项目(2016AD024);高层次人才科研启动资金专项(RCZX201526)
姚晓瑞宁(1994-),女,硕士研究生,研究方向为食品安全生物技术。
*通讯作者:史学伟(1980-),男,副教授,博士,研究方向为食品科学生物技术。

