海南三亚豇豆枯萎病病原菌鉴定及室内药剂筛选
李秋洁+符启位+王爽+黄国宋+刘勇+叶其宏+吴乾兴+孔祥义

摘 要 通过形态学观察、致病性测定和 ITS 序列分析对海南三亚地区采集的豇豆枯萎病病原菌进行鉴定,将豇豆枯萎病病原鉴定为尖孢镰刀菌(Fusarium oxysporum)。进行10种常用药剂对病原菌的毒力测定试验,结果表明:乙蒜素、甲基硫菌灵、代森锰锌3种药剂对豇豆枯萎病具有较好抑制作用,其EC50值分别为47.42、33.58、74.26 μg/mL;EC90值分别为196.69、325.26和581.06 μg/mL;a值分别为2.074 4、1.299 6和1.434 4,表明豇豆枯萎病病原菌对该3种药剂较为敏感。
关键词 豇豆 ;枯萎病 ;病原鉴定 ;药剂筛选
中图分类号 S643.4;S436.43 文献标识码 A Doi:10.12008/j.issn.1009-2196.2017.06.009
Pathogenic Identification and Indoor Screening of Cowpea Fusarium
Wilt in Sanya, Hainan Province
LI Qiujie FU Qiwei WANG Shuang HUANG Guosong
LIU Yong YE Qihong WU Qianxing KING Xiangyi
(Sanya Science and Technology Academy for Crop Winter Multiplication, Sanya, Hainan 572000)
Abstract Isolatesstrains of cowpea fusarium wilt collected from cowpea in Sanya were identified by using the morphological description, pathogenicity testing in vivo and ITS sequence analysis. These isolates were identified to be Fusarium oxysporum. The toxicity of 10 fungicides against the isolateswas tested. The results showed that ethylicin, thiophanate methyl and mancozeb had better inhibiting effect on fusarium wilt with their EC50 values being 47.42, 33.58, 74.26 μg/mL, respectively, and their EC90 values being 196.69, 325.26, 581.06 μg/mL, respectively, as well as their a values being 2.074 4, 1.299 6 and 1.434 4, respectively. This indicated that the isolates were sensitive to these three fungicides.
Keywords cowpea ; Fusarium wilt ; pathogenic identification ; screening of fungicides
豇豆营养丰富,口感好,是大众餐桌上常见的蔬菜品种。其种植范围广泛,在中国湖北、福建、广西、海南等地均有大面积种植,尤其在海南三亚地区,豇豆种植面积已达5 340 hm2,出岛产量达 15 万t[1],成为该地冬种北运的主角,对该地的农业经济发展起到积极的促进作用。但随着三亚豇豆产业的发展,病虫害成为阻碍豇豆产业发展的重要因素,尤其是豇豆枯萎病,严重影响了豇豆的产量与品质。近年来,由于多年连作,土壤条件恶化,三亚市豇豆枯萎病大面积流行,造成豇豆大量减产。
枯萎病是一种毁灭性土传病害,植株一旦发病,往往造成整株枯萎死亡。目前,已有多个研究报道香蕉、大豆、黄瓜、甜瓜、西瓜、甘蓝等多种经济作物均可发生枯萎病,枯萎病的病原主要为尖孢镰刀菌,不同作物的枯萎病病原专化型不同,且同种作物下病原菌存在小种分化现象[2]。2012年,吴仁锋对武汉市豇豆枯萎病分离后鉴定为尖孢镰刀菌[3]。2015年肖敏将海南乐东地区的豇豆枯萎病病原鉴定为尖孢镰刀菌菜豆专化型(Fusarium oxysporum f. sp. phaseolus)[4]。本研究对海南三亚豇豆主产区采集到的病原菌分离物进行鉴定,并开展室内药剂筛选试验,以确定病原菌种类,并比较分析这些杀菌剂对该病菌生长的影响,以期为生产中防治豇豆枯萎病提供指导与参考。
1 材料与方法
1.1 材料
1.1.1 供試菌株
供试菌株于2016 年12月从海南省三亚市崖州区豇豆地枯萎病发病样本上采集分离到,经病健交界处组织分离和纯化培养后,纯化菌株于无菌水中常温保存备用。
1.1.2 供试药剂
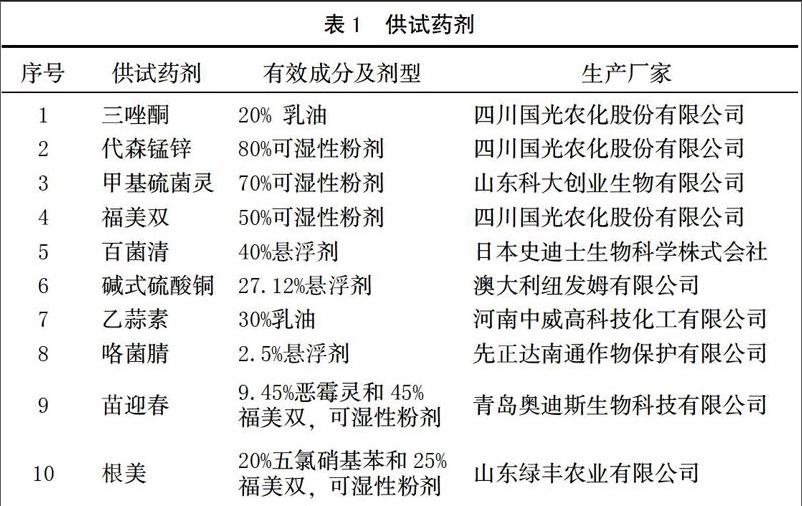
供试药剂详见表1。
1.2 方法
1.2.1 病原菌分离及其形态观察
选取新发病植株的根茎部位,在病健交界处,剪取5 mm大小的组织,参照文献[5]中有关病原真菌的分离方法,进行常规组织分离,经划线分离纯化获得单孢菌株。在PDA培养基上,28℃恒温培养箱培养7 d后,观察菌落形态及分生孢子形态。
1.2.2 病原菌致病性测定
病原菌在PDB培养基震荡培养7 d后,过滤获得孢子悬浮液,将浓度调至108个/mL。采用伤根接种法接种植株。取长势一致,长出3~4片真叶的豇豆幼苗,用无菌水将根部表面冲洗干净,用消毒的剪刀剪掉少许根尖,然后使根完全浸在孢子悬浮液中30 min,最后将植株定植于椰糠基质的花盆中,剩余悬浮液浇灌幼苗根部。每个菌株接种6株苗,设置2次重复,以无菌水为对照。正常栽培管理,10 d后观察发病情况。发病后,从病株再次分离病原菌,确认致病菌。
1.2.3 病原菌ITS序列分析鉴定
(1)菌丝收集 病原菌在PDA平板培养4 d后,用灭菌药匙刮取菌丝,置于4℃保存备用。
(2)DNA提取 CTAB法提取病原菌DNA,将50 mg菌丝体放入已灭菌的2 mL离心管内,每一离心管中加入600 μL 2×CTAB提取缓冲液(0.7 mol/L NaCl,100 mmol/L Tris-HCl,pH 8.0;20 mmol/L EDTA;20 g/L CTAB),用电钻将菌丝磨碎后,涡旋混匀,65℃水浴锅中温浴30 min,期间颠倒混匀3次。每管加入600 μL氯仿/异戊醇(体积比24∶1)抽提液,充分混匀后,于12 000 r/min离心15 min。吸取上清液至干净离心管中,加等体积氯仿/异戊醇再抽提1次。将上清转入干净的离心管中,加2倍体积的无水乙醇沉淀20 min,12 000 r/min离心10 min,去上清,沉淀用70%冰乙醇冲洗2遍。将离心管置于37℃温箱中干燥后用TE溶解沉淀,经1%脂糖凝胶电泳检测后-20℃冰箱保存,备用。
(3)ITS特异序列扩增 用真核生物核糖体DNA通用引物ITS1和ITS4进行PCR扩增。其序列为,ITS1:5′-TCCGTAGGTGAACCTGCCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′。
PCR反应条件 PCR反应体系总体积为50 μL,反应液组分:10×PCR Buffer 5 μL,25 mmol/L MgCl2 24 μL,10 mmol/L d NTP 2 μL,5 U/μL Taq酶0.3 μL,模板DNA 10 ng,引物ITS1和 ITS4 (25 μmol/L)各1 μL,用dd H2O使总体积达到50 μL。扩增条件:95℃预变性3 min;94℃变性1 min;56℃退火1 min;72℃延伸30 s,共30个循环;最后72℃延伸10 min。PCR产物委托深圳华大基因公司纯化和测序。
(4)ITS序列分析 将测序所得ITS序列与GenBank 中核酸数据库中的ITS区相关序列进行同源性比较。
1.2.4 供试药剂对病原菌的毒力测定
在预备试验的基础上,选择各药剂对豇豆枯萎病病菌菌丝体生长具有一定抑制作用的4~5个浓度,作为各药剂的供试浓度。供试药剂用无菌水稀释成不同浓度的药液,将PDA培养基熔化,冷却至50℃左右,按照各药剂所需浓度加入适量的药液,倒入灭菌培养皿制成含药平板。每种药剂每个浓度设置3次重复,以加无菌水PDA培养基作空白对照。用直径为5 mm的打孔器打取生长一致的菌饼,置于含药平板中央,28℃恒温培养,待对照菌丝体直径至少 4 cm 以上但不长满皿时,采用十字交叉法测量每个处理的菌落直径,计算生长抑制率,分析不同杀菌剂对供试病菌菌丝生长的影响。其中,生长抑制率=[(对照菌落直径-0.5)-(处理菌落直径-0.5)]/(对照菌落直径-0.5)×100%。再根据生物统计几率值换算表,将抑制百分率换算成抑制几率值。以试验中设定的浓度对数为横坐标,抑制几率值为纵坐标,计算不同杀菌剂对相应菌株的剂量反应回归方程y=ax+b,并由回归方程计算各药剂对相应菌株的抑制中浓度EC50、EC90及相关系数r值与斜率a值。
2 结果与分析
2.1 病原菌分离与菌落形态
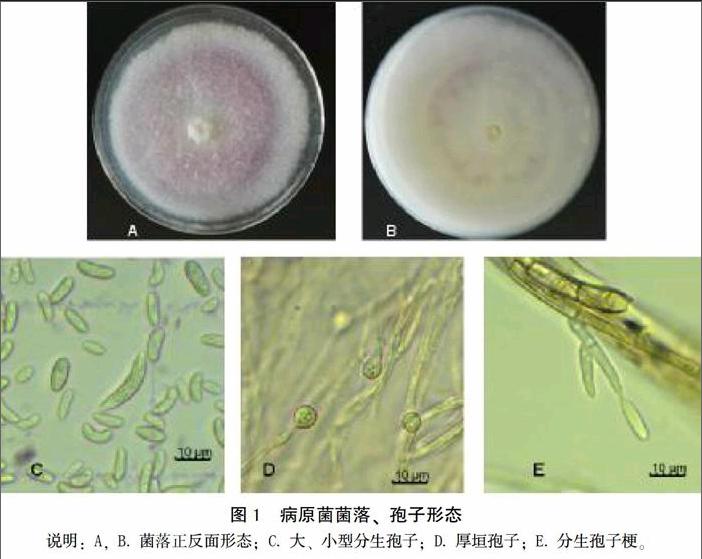
病原菌在PDA培养基上28℃培养6~7 d后,菌落呈规则圆形,边缘白色,中间淡紫色,气生菌丝茂盛,绒毛状,背面浅紫色,可见同心圆环。挑取菌丝在显微镜下观察可见大量分生孢子,存在2种分生孢子:大型分生孢子、小型分生孢子。大型孢子顶细胞渐尖并弯曲成喙状,基细胞足状,多数为3隔,大小为20.25 μm×4.2 μm;小型孢子數量多,单胞,椭圆形或肾型,大小为8.25 μm×3.01 μm,分生孢子梗在菌丝上直接长出,单瓶梗。厚垣孢子在生长后期出现,球形,间生或顶生。通过对菌落形态、孢子形态等观察,初步鉴定病原菌为尖孢镰刀菌,见图1。
2.2 病原菌致病性测定
接种病原菌孢子悬浮液的豇豆幼苗,植株长势瘦弱,接种10 d,叶片开始变黄萎蔫,13 d 后,叶片皱缩陆续掉落,植株萎蔫枯死,茎基部及根部切面变褐。15 d后,残留的发病残株茎基部可见粉色孢子堆。对照无此症状。对发病植株进行镜检和再次组织分离,获得的菌株与接种的菌株形态一致,证明分离物即为豇豆枯萎病病原,见图2。
2.3 病原菌ITS序列分析鉴定
利用真核通用引物ITS1和ITS4引物进行ITS特异序列扩增,扩增条带位于500~750 bp,约600 bp。测得的序列大小为518 bp在 NCBI 网站比对发现:该 序 列 与Genbank中 的Fusarium oxysporum(登录号为:KX009490.1,GQ121287.1)的相应片段同源性最高,同源性为99%。根据比对结果及形态观察,将该菌鉴定为尖孢镰刀菌(Fusarium oxysporum. Schl)
2.4 不同供试药剂对病原菌的室内毒力测定
采用10种常用药剂对海南三亚地区的豇豆枯萎病病原菌进行毒力测定,试验结果表明,10种药剂对病原菌菌丝生长均有一定的抑制作用,其中,甲基硫菌灵、乙蒜素、苗迎春3种药剂对病原菌菌丝生长抑制作用明显,其EC50分别为33.58、47.42、51.90 μg/mL。 根美、代森锰锌、百菌清对病原菌菌丝生长的抑制作用也较明显,EC50值分别为53.53、74.26、83.86 μg/mL。为进一步确定供试药剂对豇豆枯萎病病菌的抑制作用,对10种药剂的EC90进行分析比较。其中,EC90值小于500 μg/mL的有2种药剂,分别为乙蒜素、甲基硫菌灵,其EC90值为196.69、325.26 μg/mL。EC90值大于500 μg/mL小于1 000 μg/mL的有代森锰锌、苗迎春,其EC90值为581.06、669.59 μg/mL。
毒力回归曲线的斜率(a值)越大,病原菌对杀菌剂越敏感[6]。10种药剂的毒力回归方程a值范围在0.461 7~2.074 4,a值最大的供试药剂为乙蒜素,a值为2.074 4;其次是代森锰锌,a值为1.434 4;然后是甲基硫菌灵,a值为1.299 6。
综合比较EC50、EC90、a值发现,乙蒜素、甲基硫菌灵、代森锰锌EC50值、EC90值均较小,对豇豆枯萎病病原菌抑制作用较强。而且,a值相对较大,豇豆枯萎病病原菌对该3种药剂较为敏感,见表2。
3 讨论
豇豆枯萎病是豇豆生产常见的土传病害,在海南三亚市豇豆主产区发生严重,田间发病率一般在 5%~20%,严重时达30%以上,甚至绝收。本研究从病原菌形态、致病力测定、ITS序列分析将海南三亚地区的豇豆枯萎病病原菌鉴定为尖孢镰刀菌菌,与吴仁锋等[3]、肖敏等[4]的研究结果一致。但尚未能确定病原菌的专化型种类,有待下一步研究。
枯萎病作为一种严重的土传病害,曾造成多种经济作物的大量减产,目前多数研究对于枯萎病的防治倾向于抗病育种研究,但由于抗病育种需要时间长,且抗病品种容易丧失抗性,因此,在生产实践上,化学防治仍然处于不可代替的地位,生物药剂协同化学药剂防治病虫害也是另一个新的思路。本研究开展了10种常见药剂对豇豆枯萎病的毒力测定试验,结果表明:乙蒜素、甲基硫菌灵、代森锰锌3种药剂对豇豆枯萎病具有较好抑制作用,其EC50值分别为47.42、33.58、74.26 μg/mL;EC90值分别为196.69、325.26、581.06 μg/mL;a值分别为2.074 4、1.299 6、1.434 4,表明豇豆枯萎病病原菌对该3种药剂较为敏感。乙蒜素是大蒜提取物,作为一种仿生植物农药,既对环境友好,又能壮根壮苗,促进植物生长,光谱高效,对多种植物病原菌具有较强抑制作用。张博等[7]发现,乙蒜素在室内或田间条件下对马铃薯致病疫霉菌均具用抑制效果。本研究中,甲基硫菌灵对豇豆枯萎病表现出较强抑制作用,甲基硫菌灵是一种苯并咪唑类杀菌剂,有研究表明,长期单一使用同一种苯并咪唑类杀菌剂,容易导致病原菌产生抗性[8]。因此,在生产中不宜长期单一使用甲基硫菌灵防治豇豆枯萎病。
根据本研究结果,在生产实践中防治豇豆枯萎病建议使用乙蒜素、甲基硫菌灵、代森锰锌轮换使用,可达到良好的防治效果,同时避免产生抗药性。
参考文献
[1] 黄国宋,李秋洁,刘 勇,等. 三亚市冬种豇豆品种比较试验[J]. 热带农业科学,2017,37(1):53-59.
[2] 徐伟慧,周 岩,吴凤芝. 西瓜枯萎病的研究进展[J]. 中国蔬菜,2013(8):4-11.
[3]吴仁锋,杨绍丽,万 鹏,等. 豇豆枯萎病病原分离鉴定[J]. 湖北大学学报(自然科学版),2012,34(1):100-104.
[4] 肖 敏,曾向萍,严婉荣,等. 海南豇豆枯萎病病原鉴定及生物学特性初步研究[J]. 基因组学与应用生物学,2015,34(2):345-349.
[5] 方中达. 植病研究方法第3版[M]. 北京:中国农业出版社,1998:122-125
[6] 吴伟怀,王彩霞,梁艳琼,等. 11种杀菌剂对甘蔗赤腐病菌的毒力测定[J]. 热带农业科学,2015,35(6):37-42.
[7] 张 博,马立国,张悦丽,等. 几种生物制剂对致病疫霉的毒力测定[J]. 农药,2017,56(2):138-140.
[8] 叶 佳,张传清. 葡萄炭疽病菌对甲基硫菌灵、戊唑醇和醚菌酯的敏感性检测[J].農药学学报,2012,14(1):111-114.

