白菜叶片表皮蜡粉成分及合成相关基因表达分析
孙 红 苏同兵 汪维红 卢桂香于拴仓 张凤兰* 余阳俊 张德双 赵岫云( 北京农学院植物科学技术学院,北京006; 北京市农林科学院蔬菜研究中心,北京00097)
白菜叶片表皮蜡粉成分及合成相关基因表达分析
孙 红1,2苏同兵2汪维红2卢桂香2
于拴仓2张凤兰2*余阳俊2张德双2赵岫云2
(1北京农学院植物科学技术学院,北京102206;2北京市农林科学院蔬菜研究中心,北京100097)
为了解白菜叶片表皮蜡粉晶体结构形态、成分及合成,以有蜡粉的R-o-18和无蜡粉的15E-545-2为试材,利用扫描电镜观察成熟期新鲜叶片表皮的晶体结构;采用气相色谱-质谱联用(GC-MS)分析二者在蜡粉成分上的差别,以峰面积为指标,定量计算蜡粉组分含量。结果表明:5 000×下R-o-18上下表皮的蜡粉晶体均呈致密的面包屑状,大小约为10 μm;15E-545-2则没有观察到类似结构。GC-MS分析结果表明,R-o-18成熟期叶片表皮蜡粉成分中含酮类2种,占表皮蜡粉提取物的1.02%;醇类4种,占8.33%;烷烃10种,占55.09%;酯类2种,占26.34%。15E-545-2中检测到酮类1种,占3.83%;醇类3种,占9.17%;脂肪酸4种,占23.29%;烷烃1种,占9.32%。蜡粉合成途径Bra034583、Bra018412、Bra032670、Bra027907、Bra027906、Bra027904、Bra027902基因在两个材料中都呈先升后降的表达趋势;且蜡粉性状显现期在R-o-18中的表达均高于15E-545-2,初步证明此7个基因是与白菜叶片表皮蜡粉合成相关的基因。
白菜;表皮蜡粉;气相色谱-质谱联用;电镜扫描;RT-PCR
白菜(Brassica rapa L.)是十字花科芸薹属芸薹种作物(AA,2n=20),具有悠久的栽培历史。我国是世界上公认的白菜起源中心,种植面积广,经过长期的驯化和栽培,逐渐形成了丰富的多样性,在我国蔬菜生产和周年供应中占有主导地位。
植物蜡质是对覆盖于裸露在空气中的植物组织表皮脂质成分的一个集体称呼(Cheng & Russell,2004),还包括地下的木栓质基质、愈伤组织、花粉粒以及种皮中的脂类(岑斌和王慧中,2009)。它是由亲脂性化合物构成的疏水层,一般呈绿灰色、灰白色霜状,在十字花科蔬菜作物上称之为蜡粉(张曦,2013)。植物表皮蜡质因其晶体结构可以有效反射紫外线(Cameron et al.,2005),能够防止过量紫外线的伤害从而保护植物免受生物或非生物的不利因素的危害(曾琼 等,2013;杨柳依 等,2016)。但是,对于以叶片为产品的叶菜类蔬菜,植株表面有无蜡粉通常能决定其商品品质(牟向丽等,2013),无蜡粉叶片往往与优质相关联,更受消费者欢迎。鉴于蜡粉在白菜品质育种中扮演重要的角色,有必要对白菜蜡粉进行生理生化方面的研究探索。
有关模式植物拟南芥中的蜡质合成、运输的相关机理研究较多(Broun et al.,2004;连金番 等,2011),特别是在抗旱性方面,水稻(Cervantes et al.,2002)、玉米、小麦(张芸芸 等,2014)上的研究也有许多,但是白菜中并不多见。拟南芥蜡质合成相关基因有20多个,包含蜡质直接合成、转录水平调控和激素水平调控相关等多个层面的基因;其中直接控制拟南芥蜡质合成的基因分别为位于醇合成途径上的At4g33790、At5g37300和位于烷烃合成途径上的At1g02205、At1g57750(图1)。本试验采用扫描电镜观察成熟期白菜叶片表皮晶体结构,并采用气相-质谱联用(GC-MS)分析蜡粉组分及含量;利用荧光定量PCR技术对白菜中与拟南芥2条蜡质合成途径中4个关键基因的同源基因进行表达分析,为进一步了解控制白菜中蜡粉合成的机理奠定基础。

图1 拟南芥中的蜡质合成途径
1 材料与方法
1.1 试验材料
试验于2016年在北京市农林科学院蔬菜研究中心进行。供试材料为欧洲白菜R-o-18,该品种成熟期叶片表面呈现白色霜状;无蜡粉材料15E-545-2是R-o-18通过EMS诱变得到的;均由北京市农林科学院蔬菜研究中心白菜遗传育种课题提供。
1.2 试验方法
1.2.1 表皮蜡粉电镜观察 供试材料生长至成熟期,用锋利的刀片分别在有蜡粉和无蜡粉新鲜植株叶片相同的中心位置取3 mm×4 mm的平面,注意不要触碰到待观察的部位。3次重复。将制好的平面直接粘在样品台上,进行导电处理。使用日本岛津公司的S-3400N扫描电子显微镜进行观察。
1.2.2 表皮蜡粉化学成分检测 以三氯甲烷为有机溶剂提取叶片表皮蜡粉。分别称取成熟期的有蜡粉和无蜡粉材料的新鲜叶片各20 g,依次在分别盛有80 mL室温三氯甲烷和60 ℃的三氯甲烷中浸提1 min,合并提取液到1个烧杯中,将烧杯置于通风橱中,待提取液挥发蒸干后分别收集提取物到青霉素瓶中,加入5 μg正二十四烷作为内参,并加入100 μL BSTFA作为衍生试剂,用橡胶塞盖好并用封口膜密封后放置在70 ℃水浴中衍生1 h,衍生后的样品用氮吹仪吹去衍生试剂,加入1 mL三氯甲烷,进行GC-MS分析。2次重复。
应用岛津GCMS-QP2010气相色谱-质谱联用仪进行检测。色谱柱:DB-5MS,石英毛细管柱(30 m×0.25 mm×0.25 μm)。色谱条件为载气:He(99.999%);进样口温度:270 ℃;柱流速:14.0 mL·min-1,恒定流速;分流比:10∶1;离子源温度:200 ℃;传输杆温度:280 ℃;溶剂延迟时间:4 min。升温程序:总时间43 min,初始温度50 ℃,保持1 min,然后以20 ℃·min-1升温至170 ℃,保持2 min,再以5 ℃·min-1升温至300 ℃,保持8 min。依据各化合物的沸点不同从而把化合物依次分离出来。经过GC-MS检测,解析得到离子峰,依据质谱库鉴定离子。
1.2.3 RNA提取及反转录 同时种植R-o-18和15E-545-2各20株,待植株长到两叶一心(4月5日)时开始取材,每隔8 d取1次,共取4次样。利用天根公司的RNA Prep Pure植物总RNA提取试剂盒(离心柱型)提取植物的总RNA。3次重复。
RNA反转录采用TaKaRa公司的反转录试剂盒,具体操作:在RNase-Free离心管中加入2 μL 5×gDNA Eraser Buffer、1 μL gDNA Eraser、2 μL总RNA、5 μL RNase-Free ddH2O,混匀;在PCR仪上42 ℃加热2 min;向反应物中加入4 μL 5×PrimeScriptⅡ、1 μL Prime Script RT Enzyme MixⅠ、1 μL RT Primer Mix、4 μL RNase-Free dH2O,混匀;放入PCR仪37 ℃ 15 min,85 ℃ 5 s。用RNase-Free ddH2O将反转录得到的cDNA稀释到150 ng·μL-1待用。
Real-time PCR引物序列由Brassica Database查询得到,采用Primer Premier 5.0软件设计引物,由北京博迈德生物公司合成。
Real-time PCR体系:上、下游引物各0.5 μL,cDNA模板1 μL,ddH2O 3 μL,Light Cycler 480 SYBR GreenⅠMaster 5 μL。Real-time PCR扩增程序:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火12 s,72 ℃延伸15 s,40个循环。利用Light Cycler 480SW软件处理数据,软件会自动计算标准曲线和Ct值等,再利用Microsoft Excel 2010软件绘制基因表达差异图。
1.2.4 蜡粉合成相关基因的荧光定量检测 通过TAIR(http://www.arabidopsis.org/)获得模式植物拟南芥中与蜡质合成相关的基因At4g33790、At5g37300、At1g02205、At1g57750,利用Brassica Database(http://brassicadb.org/brad/)获得与蜡粉合成相关的白菜中同源基因及引物序列(表1)。

表1 拟南芥与白菜中蜡质合成相关基因及其RT-PCR引物序列
2 结果与分析
2.1 白菜叶片表皮蜡粉电镜观察结果
在扫描电子显微镜100×下观察,15E-545-2叶片上下表皮较光滑,未观察到蜡粉层(图2-A、B),R-o-18叶片上下表皮均呈现致密的蜡粉层(图2-C、D);1 000×下15E-545-2叶片上下表皮及气孔周围未观察到蜡粉晶体(图3-A、B),R-o-18上下表皮及气孔周围则观察到丰富的蜡粉晶体(图3-C、D);5 000×下15E-545-2上下表皮及气孔周围未发现蜡粉晶体(图4-A、B),R-o-18上下表皮及气孔周围观察到丰富的蜡粉晶体,呈面包屑状,大小约为10 μm(图4-C、D)。
2.2 白菜叶片表皮蜡粉成分
由图5可以看出,本试验采用的程序和方法较好地分离出了R-o-18和15E-545-2叶片表皮蜡粉成分。
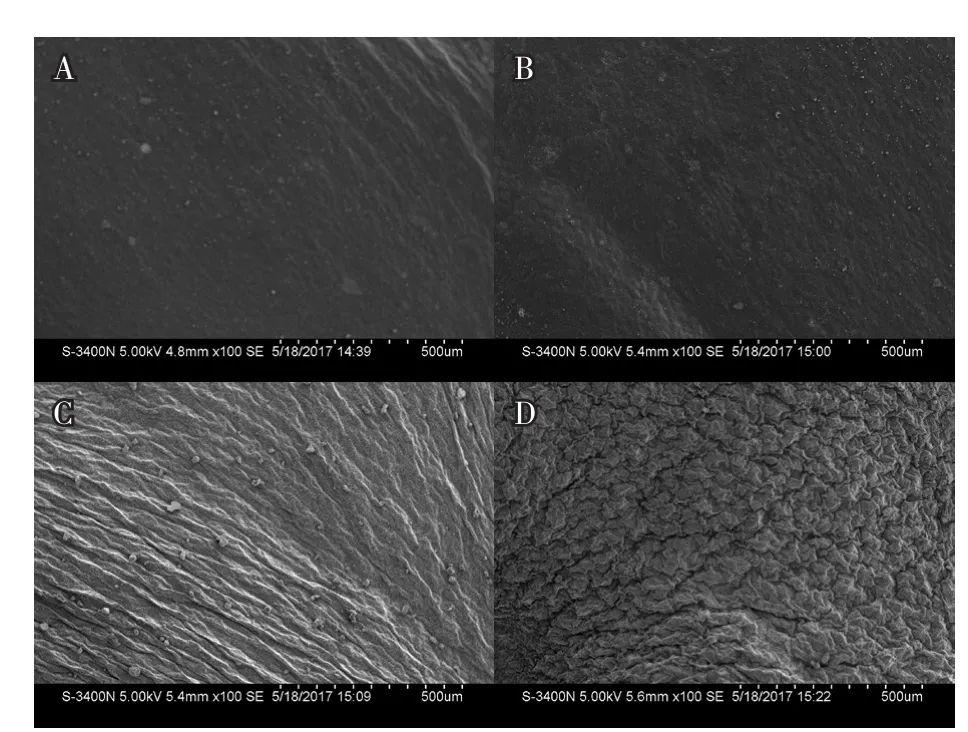
图2 白菜叶片表皮蜡粉100×电镜观察结果A,B分别为15E-545-2上、下表皮;C,D分别为R-o-18上、下表皮;下图同。

图3 白菜叶片表皮蜡粉1 000×电镜观察结果
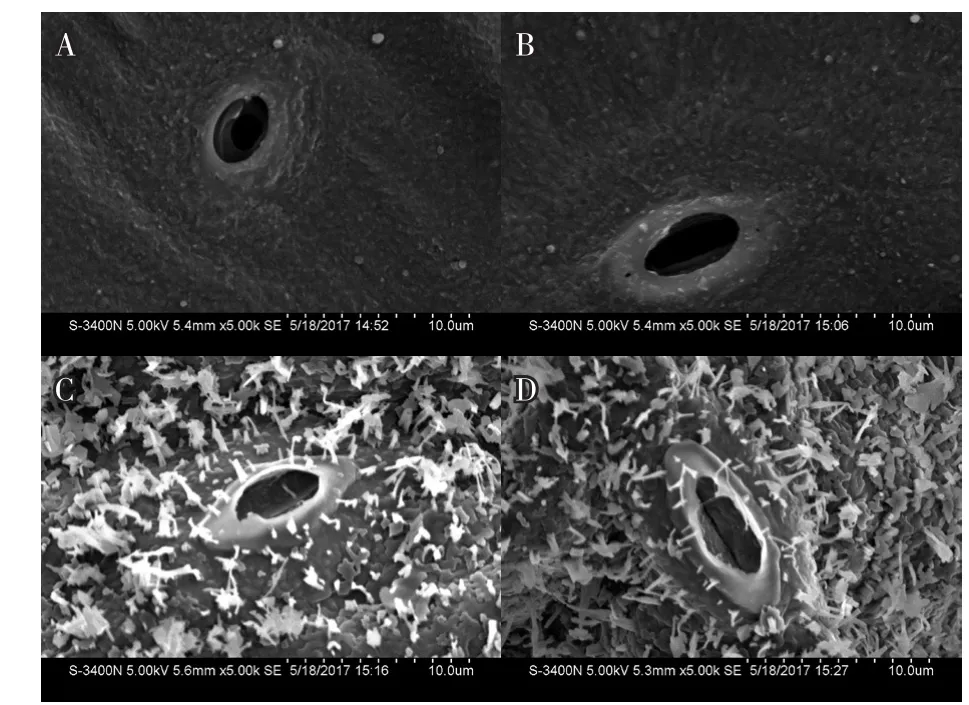
图4 白菜叶片表皮蜡粉5 000×电镜观察结果
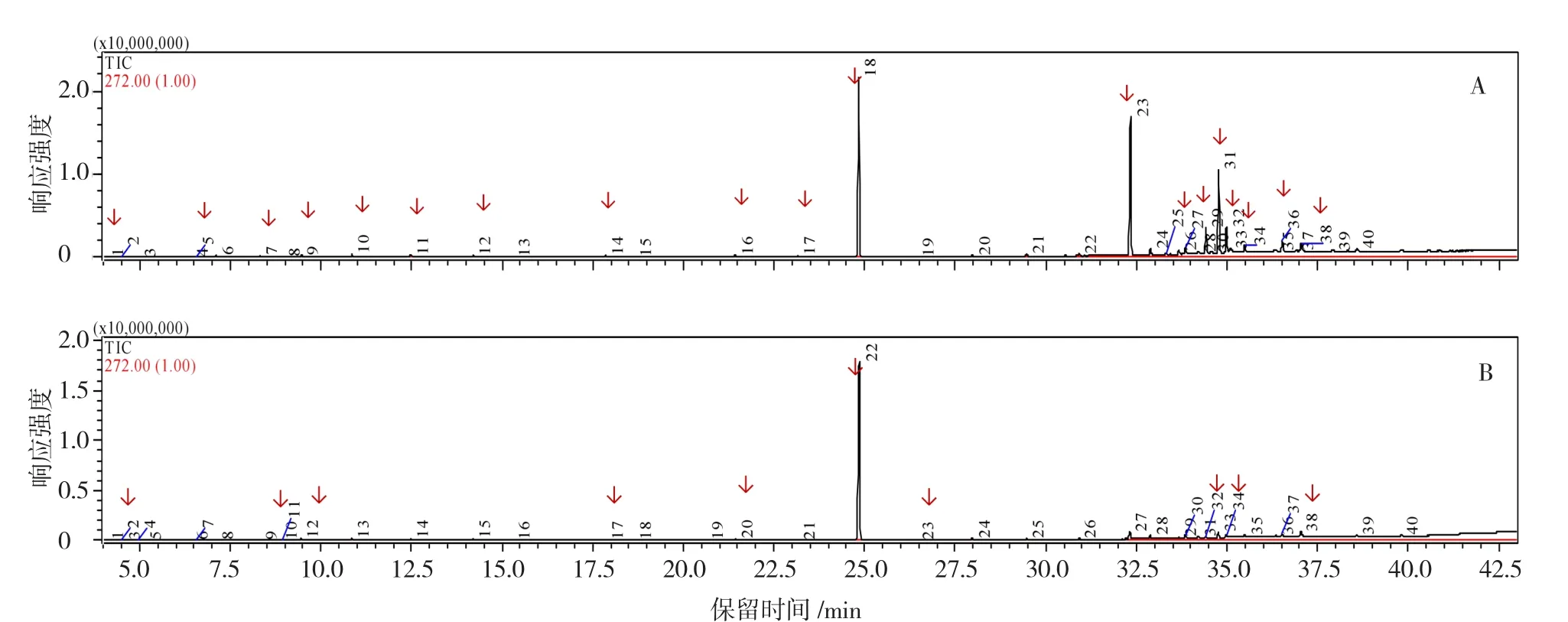
图5 R-o-18和15E-545-2叶片表皮蜡粉成分色谱图A为R-o-18:1,酮类;5,醇类;7,C14烷烃;9,C15烷烃;10,C16烷烃;11,4-叔丁基-2-(1-甲基-2-硝基乙基)环己酮;12,C18烷烃;14,C20烷烃;16,C28烷烃;17,C19烷烃;18,C24烷烃(内参);23,C36烷烃;26,C35烷烃;27,醇类;31,酯类;32,C40烷烃;33,1,2-十六烷二醇;36,酯类;38,1,3-三十烷二醇。B为15E-545-2:1,酮类;9,C15烷烃;12,1-四十烷醇;17,C16脂肪酸;20,C18脂肪酸;22,C24烷烃(内参);23,C20脂肪酸;32,C16脂肪酸;34,C28醇;38,C30醇。箭头所示为剔除溶剂成分后的蜡粉成分色谱峰。
白菜表皮蜡粉的主要成分包括特长链烷烃、酯、脂肪醇和酮。R-o-18叶片表皮蜡粉中检测到烷烃10种,酮2种,酯2种,醇4种;烷烃的碳原子数变化范围为C14~C54,包括C14、C15、C16、C18、C19、C20、C28、C35、C36、C40;4种醇中有2种不能确定名称,另外2个分别为1,2-十六烷二醇、1,3-三十烷二醇;2种酯不能确定名称;2种酮中1种是4-叔丁基-2-(1-甲基-2-硝基乙基)环己酮,另1种不能确定名称。此结果与张曦(2013)的研究结果存在差异,可能是由于不同材料间的蜡粉成分含量存在差异(Chen et al.,2003;Broun et al.,2004),环境因素例如干旱胁迫等亦可能导致表皮蜡粉成分的变化(张芸芸等,2014)。

图6 白菜叶片表皮蜡粉合成相关基因的RT-PCR检测结果
无蜡粉材料15E-545-2与有蜡粉材料R-o-18叶片表皮蜡粉成分差异如表2所示。二者的成分差异主要表现在烷烃和酯类上,这与前人推断烷烃合成途径可能是蜡质合成的主要途径一致(Beattie &Marcell,2002;Chen et al.,2003)。
2.3 白菜叶片表皮蜡粉合成相关基因的RT-PCR检测结果
由图6可以看出,Bra034583、Bra011470、Bra018412、Bra032670、Bra027907、Bra027906、Bra027904、Bra027902这8个基因在有蜡粉材料和无蜡粉材料中的表达量大多呈先升高后下降的趋势,表达量上调大多数出现在4月21日(蜡粉性状明显期);在蜡粉性状出现前相关基因的表达量差异没有明显的规律性。进一步比较4月21日的相对表达量(图7),发现Bra034583、 Bra018412、Bra032670、Bra027907、Bra027906、Bra027904、Bra027902这7个基因在R-o-18中的表达量均高于15E-545-2,说明这7个基因可能与蜡粉的合成有密切关系。其中,Bra027906、Bra027904、Bra027902的表达量相对较高,可能在控制蜡粉合成中功能作用较其他基因更大;此外,这3个基因均是位于烷烃合成通路上的基因,结合GC-MS分析结果进一步验证了烷烃合成途径可能是白菜叶片表皮蜡粉合成的主要途径,有无蜡粉这一性状很可能是位于烷烃合成途径上的某个基因。
Bra034583是拟南芥醇合成途径中与控制成醇酯酰Co-A还原酶合成基因CER4在白菜中的同源基因,所以Bra034583的基因功能很可能也是调控成醇酯酰Co-A的合成。同样,Bra018412基因是拟南芥醇合成途径中蜡质合成酶基因AT5G37300的同源基因;Bra032670是合成醛脱羰基反应酶基因CER1的同源基因;Bra027907、Bra027906、Bra027904、Bra027902是合成中链烷烃羟化酶基因CYP96A15的同源基因。结合RT-PCR检测、电镜观察以及蜡质成分分析结果,当蜡粉性状开始明显(4月21日)时,Bra034583基因的表达量上调致使促进醇合成途径上初级醇的合成增多;Bra018412基因在有蜡粉材料中的表达上调,在无蜡粉材料中可能受蜡质合成途径外基因共同调控作用导致抑制;另一条合成途径上的Bra032670、Bra027907、Bra027906、Bra027904、Bra027902基因表达上调,致使表型结构上有蜡粉材料可以观察到清晰的蜡粉晶体结构,蜡粉主要成分含量也都较无蜡粉材料高。初步证明这7个基因是与白菜叶片表皮蜡粉合成相关的基因。

表2 R-o-18和15E-545-2叶片表皮蜡粉各组分相对含量

图7 7个基因在4月21日的RT-PCR检测结果
3 结论与讨论
本试验在无蜡粉材料中也检测到了蜡粉的一些组分,这与李红莲(2014)在红菜薹无蜡粉材料中也观察到了蜡粉晶体结构的研究结果一致,推断白菜无蜡粉突变体植株可能是控制蜡粉合成调控的基因受到了阻断,导致蜡粉合成通路受阻,但仍有少量肉眼看不到的蜡粉成分。
本试验初步证实基因Bra034583、Bra018412、Bra032670、Bra027907、Bra027906、Bra027904、Bra027902与白菜叶片表皮蜡粉合成有关;基因Bra027899、Bra027898、Bra027897在R-o-18和15E-545-2两份材料上的表达没有呈现出规律性,关于其在有蜡粉材料和无蜡粉材料上的表达仍需进一步研究。另外,尽管从表达趋势上看相关基因大多呈现出先升高后降低的趋势,但是Bra018412、Bra011470、Bra032670在无蜡粉材料中的表达呈现出如上趋势后又骤然高出有蜡粉材料,具体原因尚未可知,需进一步探究。
参考文献
岑斌,王慧中.2009.植物蜡质合成与分泌的研究进展.科技通报,(3):265-270,275.
李红莲.2014.红菜薹蜡粉性状遗传分析与基因初步定位〔硕士论文〕.武汉:华中农业大学.
连金番,常青,孙建丽,石磊,王倩.2011.拟南芥茎表皮蜡缺失突变体cera蜡成分分析.东北农业大学学报,42(10):99-104.
田诗快言快语地插话进来:“好了,好了,悄悄话一会进屋说去吧。来,姐夫,听姐说你还把我的那根发丝拈走了去研究去了。还给我——”田诗调皮地伸出了手。
牟向丽,王超,王帅.2013.甘蓝无蜡粉突变体叶表皮蜡质超微结构观察.中国蔬菜,(4):32-37.
杨柳依,赵荣秋,刘乐承.2016.拟南芥eceriferm突变体对表皮蜡质合成影响的研究进展.长江大学学报:自然科学版,13(9):53-58.
张曦.2013.大白菜蜡粉基因的精细定位及表达分析〔博士论文〕.沈阳:沈阳农业大学.
张芸芸,李婷婷,孙瑜琳,王艳婷,王美玲,汪勇,史雪,权力,李春莲,王中华.2014.小麦叶片表皮蜡质成分及含量分析.麦类作物学报,34(7):963-968.
曾琼,刘德春,刘勇.2013.植物角质层蜡质的化学组成研究综述.生态学报,33(17):5133-5140.
Beattie G A,Marcell L M.2002.Effect of alterations in cuticular wax biosynthesis on the physicochemical properties and topography of maize leaf surfaces.Plant,Cell & Environment,25(1):1-16.
Cameron K D,Teece M A,Smart L B.2005.Increased accumulation of cuticular wax and expression of lipid transfer protein in response to periodic drying events in leaves of tree tobacco.Plant Physiology,140(1):176-183.
Cervantes D E,Eigenbrode S D,Ding H J,Bosque-Pérez N A.2002.Oviposition responses by hessian fly,Mayetiola destructor,to wheats varying in surfaces waxes.J Chem Ecol,28(1):193-210.
Chen X,Goodwin S M,Boroff V L,Liu X,Jenks M A.2003.Cloning and characterization of the WAX2 gene of Arabidopsis involved in cuticle membrane and wax production.Plant Cell,15:1170-1185.
Cheng J B,Russell D W.2004.Mammalian wax biosynthesis.J Biol Chem,279:37789-37797.
Analysis of Leaf Cuticular Wax Composition of Brassica rapa L. and Related Gene Expression
SUN Hong1,2,SU Tong-bing2,YU Shuan-cang2,ZHANG Feng-lan2*,YU Yang-jun2,ZHANG Deshuang2,ZHAO Xiu-yun2,WANG Wei-hong2,LU Gui-xiang2
(1College of Plant Science and Technology,Beijing College of Agriculture,Beijing 102206,China;2Beijing Vegetable Research Center,Beijing Academy of Agriculture and Forestry Sciences,Beijing 100097,China)
In order to understand the cuticular wax structure morphology,components and compound of Brassica rapa L.,this paper took ‘R-o-18’(in waxy)and ‘15E-545-2’(in glossy)as material and observed the crystal texture of fresh leaves cuticule by scanning electron microscope,analyzed the differences between these 2 wax components with GC-MS,and quantitatively calculated wax content taking peak area as target.The results showed that the waxy crystals on both side of ‘R-o-18’ leaf surface showed a dense breadcrumbs-like structure.5 000 times could clearly see the crystal showing breadcrumbs,and the size was about 10 μm. No similar structure was observed on ‘15E-545-2’.The results of GCMS showed that there were 2 ketones in wax powder of ‘R-o-18’,accounting for 1.02% of the extract of epidermal wax powder.And 10 alkanes accounted for 55.09%,4 alcohols accounted for 8.33%,2 esters accounted for 26.34%,respectively.Fatty acid was the major component of ‘15E-545-2’,accounting for 23.29%.And ketone,alcohol,alkane accounted for 3.83%,9.17%,9.32%,respectively.Seven genes(Bra034583,Bra018412,Bra032670,Bra027907,Bra027906,Bra027904,Bra027902)mentioned above in both material showed the tendency of increasing first then declining.And in the waxy traits appearing period,the above mentioned genes expression in ‘R-o-18’ was higher than that in ‘15E-545-2’.These results preliminary proved that these 7 genes did paly roles in synthesis of leaf cuticular wax.
Brassica rapa L. ;Cuticular wax;GC-MS;Scanning electron microscope;RT-PCR
孙红,硕士研究生,专业方向:蔬菜遗传育种,E-mail:xinersunhong@126.com
*通讯作者(Corresponding author):张凤兰,女,研究员,博士生导师,专业方向:蔬菜遗传育种,E-mail:zhangfenglan@nercv.org
2017-02-27;接受日期:2017-06-13
科技部“十三五”重点研发项目(2016YFD0101701,2016YFD0100506),国家自然科学基金项目(31401875,31171970),北京市自然科学基金项目(6172008,6154025)

