双黄连注射剂中黄芩苷致敏家兔后血清中特异性抗体的测定※
邓颖颖 胡宗苗 周园里 陈世忠 刘继平 张恩户
(陕西中医药大学药学院2015级硕士研究生,陕西 咸阳 712046)
双黄连注射剂中黄芩苷致敏家兔后血清中特异性抗体的测定※
邓颖颖 胡宗苗1周园里 陈世忠2刘继平3张恩户△
(陕西中医药大学药学院2015级硕士研究生,陕西 咸阳 712046)
目的 酶联免疫吸附法(ELISA)检测双黄连注射剂中小分子半抗原物质黄芩苷致敏家兔后血清中特异性抗体效价。方法 取新西兰种家兔10只,分为空白组、黄芩苷组,每组各5只。自家兔耳缘动脉采血10 mL,制备致敏前血清。将被液相色谱-质谱-血清白蛋白结合系统检测的黄芩苷与家兔血清体外孵育,制成黄芩苷-血浆蛋白完全抗原。将此完全抗原以皮下注射的方式对家兔进行免疫,免疫次数共5次。最后一次免疫结束后,间隔1周时间,将其麻醉,用采血针自家兔腹主动脉采血制备黄芩苷-血浆蛋白全抗原的抗血清。用ELISA法检测抗血清的抗体效价(OD值);间接竞争ELISA法测定家兔抗血清的特异性抗体;采用兔免疫球蛋白E(IgE)ELISA试剂盒检测各组家兔抗血清中IgE抗体的含量。结果 黄芩苷的抗体效价(OD)与阴性对照组的(OD)比值>2,因此说明黄芩苷具有致敏性。家兔体内产生的抗血清中的抗体具有一定的特异性。家兔体内明显产生了外源性IgE型抗体。结论 黄芩苷对家兔具有致敏性。
黄芩苷;双黄连注射剂;ELISA法;免疫球蛋白个体基因型;抗体
中药注射剂是中医药现代化过程中取得的标志性重大成果,其突破了中药传统的给药方式,并且吸收了西药注射剂起效速度快、生物利用度高、使用方便等优势而在临床中广泛应用。但是,其不良反应的报道也随之显著递增[1]。2010—2013年,在同期4 680例中药注射剂不良反应的调查统计中,高居首位的是双黄连注射剂(药物组成:金银花、黄芩、连翘)引起的变态反应,共计844例,约占其中的18.03%[2]。有关报道指出双黄连注射剂中致敏成分的存在可能是引起其发生变态反应的主要原因之一[3]。黄芩苷是双黄连注射剂中的主要成分之一,有关文献表明其是一种小分子半抗原物质可引发变态反应[4-5]。但当前有关黄芩苷与双黄连注射剂变态反应之间的关联性研究尚有待进一步探讨和完善。因此,我们将运用酶联免疫吸附法(ELISA)原理考证黄芩苷对家兔是否具有致敏性。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 黄芩苷(含有量≥99.8%,由中国科学院成都生物研究所提供,生产批号为MUST-15011413);Tween-20(天津市科密欧化学试剂有限公司,批号:20150424);邻苯二胺(OPD),上海科丰实业有限公司;0.15 mol/L pH 7.4磷酸盐缓冲液(PBS);金黄色葡萄球菌细胞壁蛋白A交联的辣根过氧化酶(HRP-SPA);弗氏佐剂(美国SIGMA公司,10 mL,SLBD0736);兔免疫球蛋白E(IgE)ELISA试剂盒(上海酶联生物科技有限公司);牛血清白蛋白(BSA)等。
1.1.2 实验动物 新西兰白兔,雄性,体质量2.5~3.5 kg,购自第四军医大学实验动物中心,实验动物质量合格证号:NO.61000400000021,生产许可证号:SCXK-(军)2012-0007。
1.1.3 主要仪器设备 酶标仪(美国BioTek公司);漩涡混合器(赛多利斯科学仪器有限公司);HH-S6型水浴锅(北京科伟永兴仪器有限公司);低速离心机(江苏省金坛市正基仪器有限公司)。
1.2 实验方法
1.2.1 分组与黄芩苷特异性抗体的制备 取新西兰种家兔10只,分为空白组、黄芩苷组,每组各5只。分别自每只家兔耳缘动脉采血10 mL,制备家兔致敏前血清。精密称取黄芩苷2 mg,溶于0.6 mL 0.9%氯化钠注射液中,制成3.3 mg/mL的黄芩苷0.9%氯化钠注射液溶液,将0.4 mL的家兔致敏前血清与配制好的黄芩苷0.9%氯化钠注射液溶液搅拌混匀,37 ℃温育2 h后将1 mL弗氏佐剂加入此溶液中乳化混合。
使用弗氏完全佐剂乳化的抗原液进行首次免疫,将家兔背部脊中线距离脊柱3 cm处用剃毛机剃毛后,于脊柱两侧皮下多点注射,每点0.2 mL,共10处注射点,每处注射点间隔2 cm,注射完药物后观察注射点处有皮丘出现即为注射成功,家兔皮内注射给药后第2 d皮肤表面就会出现结痂,随着时间的推后逐渐恢复。10 d后进行加强免疫,使用与首次免疫剂量相同的弗氏不完全佐剂乳化的抗原液,之后每隔7 d对免疫过的家兔再加强免疫1次,同种操作进行5次。最后一次免疫结束后隔1周时间,麻醉家兔,用采血针一头扎入家兔腹主动脉,一头插入5 mL抗凝管中取血,3 000 r/min离心15 min,用移液枪小心吸取上层血清,即得黄芩苷-血浆蛋白全抗原的抗血清[6]。
1.2.1.1 试剂的配制 ①碳酸钠缓冲溶液的制备。称取Na2CO31.465 g,NaHCO30.795 g置于50 mL量瓶中,加双蒸水溶解且定容至刻度。②2%BSA的制备。称取1 g BSA,加50 mL 0.15 mol/L pH 7.4 PBS搅拌使其充分溶解。③磷酸盐吐温缓冲液(PBST)的制备。量取50 μL Tween-20,加0.15 mol/L pH 7.4的PBS至100 mL,充分搅拌使其混合均匀。④HRP-SPA、底物液、终止液的制备参照文献[7]。
1.2.1.2 抗体效价的检测方法[8]①包被。将黄芩苷-血浆蛋白与碳酸钠缓冲溶液按1∶4倍稀释,以此作为包被原,每孔滴加110 μL后将96孔板置于湿盒内,随后将其放入4 ℃冰箱内包被过夜;第2 d将96孔板中的液体倾尽,拍干残留液体,然后用PBST每5 min洗涤1次,共洗涤3次,将2%BSA用移液枪每孔加入130 μL,此操作完成后将96孔板放入4 ℃冰箱中封闭过夜。②加抗血清。将96孔板中的液体倾尽,并甩去残留液体,洗涤方法同上,洗涤后加入用0.15 mol/L pH 7.4 PBS 1∶1~1∶128每隔2倍稀释的8个浓度抗血清各100 μL,37 ℃温育2 h。③加酶标二抗。倒掉液体并拍干残留液体,洗涤方法同上,洗涤后每孔加入100 μL HRP-SPA,37 ℃孵育1 h。④显色、终止、测定方法参照文献[7]。⑤判定阴性对照为加致敏前血清的孔,空白对照为不加血清的孔,每一样品设5个平行孔,阳性的评判标准为:OD值大于或等于阴性对照孔2倍。
1.2.2 间接竞争ELISA测定抗体特异性 以1.00 mg/mL的黄芩苷-血浆蛋白作为包被原,每孔加入110 μL,封闭洗涤(洗涤的目的是:除去未结合的抗原和杂质),将配置好的4.00 mg/mL黄芩苷0.9%氯化钠注射液吸取一半放入2 mL EP管中加入等容积的0.9%氯化钠注射液2倍稀释,按此方法共稀释得到5个不同浓度。然后用移液枪将上述不同浓度的黄芩苷0.9%氯化钠注射液溶液每孔加入50 μL,之后每孔再加入用0.15 mol/L pH 7.4 PBS 1∶1稀释的抗血清100 μL,37 ℃温育2 h;用PBST洗涤3次后每孔加入按工作浓度稀释的酶标抗体HRP-SPA 100 μL,37 ℃温育1 h;洗涤、显色、终止、测定[7]。将加稀释液的孔作为空白对照,不加黄芩苷的孔看作0标准孔,为了减少误差同时设置5个平行重复孔。计算黄芩苷的抑制率I(%),应用的公式是I=OD0-OD/(OD0-ODmin)×100%[9],其中OD是指测定样品的吸光值,OD0是指0标准孔的吸光值,ODmin是指空白对照孔的吸光值。绘制抑制曲线的依据为:黄芩苷浓度的对数值为横坐标,抑制率为纵坐标。通过回归分析,建立回归方程并计算相关数据。
1.2.3 IgE型抗体浓度的测定 用兔免疫球蛋白E(IgE)ELISA试剂盒测定本实验中家兔IgE的水平。具体操作步骤按说明书进行。

2 结 果
2.1 不同稀释倍数抗血清的OD值(效价)比较 见表1。

表1 不同稀释倍数抗血清的OD值(效价)比较
与致敏前血清OD值比较,*P<0.01
由表1可见,家兔经过黄芩苷-血浆蛋白全抗原多次免疫后的抗血清按1∶1到1∶128的倍数稀释后结果仍为阳性,说明家兔血清中已经产生了外源性抗体。黄芩苷的各稀释抗血清组抗体效价与致敏前血清OD值(效价)之间的差异有统计学意义(P<0.01),提示黄芩苷具有致敏性。
2.2 黄芩苷对抗血清的特异性研究 见表2、图1。

表2 黄芩苷对抗血清的特异性研究
通过回归分析,建立回归方程I=0.106lgC+0.769,R2=0.9 948,半数抑制浓度IC50=0.0 029 mg/mL,检测限IC10为0.49 ng/mL。
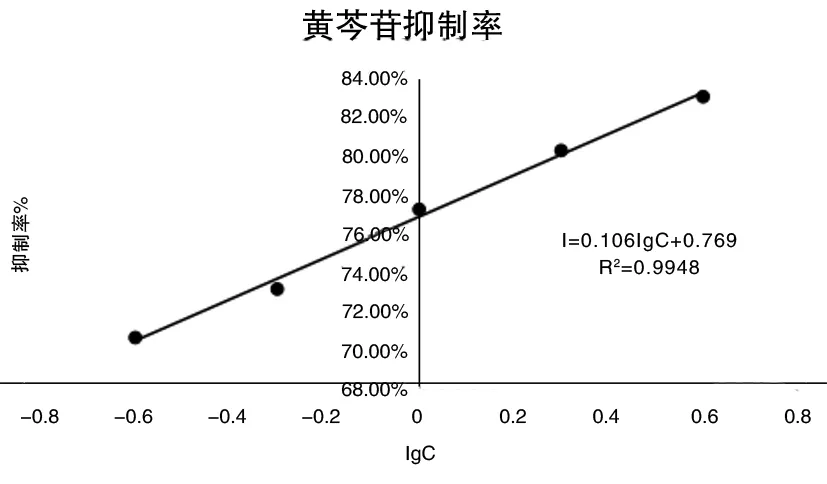
图1 黄芩苷抑制曲线
由表2、图1可见,黄芩苷对抗血清的抑制率随其浓度的增大而升高,表明抗血清中的抗体是针对其产生的,具有一定特异性。
2.3 黄芩苷抗血清中IgE型抗体浓度测定 见表3。

表3 黄芩苷抗血清中IgE型抗体浓度测定
与空白组比较,*P<0.01
通过回归分析,建立曲线方程:Y=1.849X2+13.344X-0.30 878,r2=0.99 991,其中X为吸光度,Y为对应IgE型抗体浓度。根据曲线方程可计算出各样本的对应IgE型抗体浓度及浓度提高率,提高率的计算公式=(OD-OD空白)/OD空白,OD空白是指未经过免疫的正常家兔血清检测出的OD值。由表3可知,黄芩苷抗血清中的IgE型抗体浓度提高率高于空白组的IgE型抗体浓度提高率,黄芩苷组IgE型抗体浓度与空白组之间的差异有统计学意义(P<0.01),表明经过多次免疫后家兔体内产生了外源性IgE型抗体。
3 讨 论
ELISA法是以免疫学反应为基础的一种敏感性很高的试验技术,使抗原、抗体的特异性反应在一种固相载体中进行,然后将其与酶对底物的高效催化作用充分相结合,最后定性、定量分析的依据是产物颜色的深浅。该方法以特异性强、灵敏度高、操作简便等优点而得到迅速发展和广泛应用[10]。
双黄连注射剂是治疗风热感冒的常用药物之一,因此在临床使用相当广泛。但伴随着广泛使用,其不良反应也随之增多,变态反应所占比例最高。据有关《药品不良反应信息通报》统计分别在2011-11-19、2009-05-18、2009-09-16双黄连注射剂引起的不良反应(变态反应)病例报告和文献报道频繁,并有死亡病例[11]。其中致敏物质存在引发的速发型变态反应的发生率高、危害大,严重危害患者的生命健康,使多个已上市中药注射剂在临床中的安全使用受到人们的广泛质疑。因此,为了保障患者临床用药的安全性,分析、研究并阐明致敏性成分是解决中药注射剂变态反应问题的根本途径。中药注射剂的变态反应主要是由IgE抗体介导的Ⅰ型超敏反应和无需IgE抗体介导的类变态反应,两者在临床上的病理症状表现十分相似[12-13]。Ⅰ型超敏反应由完全抗原或半抗原引发,其中半抗原分子量小,不具备抗原性,当其进入血液后与血清白蛋白结合形成完全抗原时而获得免疫原性,进而诱导机体产生变态反应。血清白蛋白是血液中含量最高的蛋白质,是药物在体内的主要转运蛋白,也是研究具有半抗原特性药物的常用蛋白[14]。
本实验模拟双黄连注射剂进入体内以后的致敏过程,将双黄连注射剂中小分子半抗原物质黄芩苷与家兔血清体外孵育,制成药物-血浆蛋白完全抗原免疫家兔。经过对ELISA法所测定的一系列数值进行分析得到黄芩苷具有致敏性。本实验运用的ELISA法具有一定的通用性,为研究双黄连注射剂乃至其他中药注射剂中的致敏成分提供了理论依据和指导方法。如若日后能将筛选出的中药注射剂中的具体某一致敏成分制成过敏诊断试剂,通过用药前对患者进行皮下注射判断患者是否对该成分过敏而准确用药,就可很大程度上减少变态反应的发生,从而为患者的生命安全保驾护航。
[1] 肖贵南,程朝辉,陈浩桉.中药注射剂引起的过敏反应及其检测技术[J].广东药学院学报,2009,25(6):636-638.
[2] 程芳.注射用双黄连类变态反应及其机制研究[D].济南:山东大学,2009.
[3] 赵玉斌,肖颖,谢雁鸣,等.双黄连注射液过敏原研究进展及其重要致敏原的易感基因研究策略[J].中国中药杂志,2011,36(8):1106-1108.
[4] 屈会化,赵琰,王雪茜,等.黄芩苷人工抗原的合成与鉴定[J].北京中医药大学学报,2010,33(9):606-609.
[5] 尹婕,尹利辉,胡昌勤,等.双黄连注射液中半抗原成分酶联免疫检测方法的建立[J].中成药,2013,35(12):2678-2683.
[6] 赖宇红,陈浩桉,杨卫荣.中药注射剂变态反应研究亟待加强[J].中药新药与临床药理,2002,13(5):324-326.
[7] 胡宗苗,张恩户,刘继平,等.双黄连注射剂中连翘酯苷A致敏家兔后血清中特异性抗体的测定[J].中成药,2016,38(9):2045-2048.
[8] 曾姣丽,贺福元,唐昱,等.双黄连注射剂中黄芩苷致敏原性的研究[J].中国实验方剂学杂志,2012,18(1):102-106.
[9] 于洪侠,杨曙明,朱宇.莱克多巴胺多克隆抗体的制备[J].中国兽医科学,2006,36(1):62-65.
[10] 张启云,张卓辉,张增珠,等.双黄连注射剂中半抗原物质ELISA检测方法的研究[J].江西中医学院学报,2009,21(1):39-41.
[11] 苗明三,李艳,祝侠丽,等.中药注射剂临床应用中存在的问题及安全应用策略[J].中国药师,2015,18(10):1739-1743,1746.
[12] 易艳,李春英,张宇实,等.3种中药注射剂类变态反应评价及其机制探讨[J].中国中药杂志,2015,40(14):2711-2716.
[13] 高建波.类过敏反应的研究进展[J].中国药物警戒,2014,11(6):344-346.
[14] 廖国平,汪艳,陈莉婧,等.中药有效成分半抗原抗体制备技术的研究进展[J].中成药,2011,33(6):1025-1029.
(本文编辑:董军杰)
Determination of specific antibodies in serum of rabbits sensitized by baicalin in shuanghuanglian injection
DENG Yingying, HU Zongmiao, ZHOU Yuanli, et al.
2015-Grade Master of Pharmaceutical College in Shaanxi University of Traditional Chinese Medicine, Shaanxi, Xianyang 712046
Objective To detect the specific antibody titers by ELISA in the small molecular semi- antigenic baicalin components of shuanghuanglian injection in the rabbits sensitized by baicalin. Methods Total 10 New Zealand rabbits were randomized into the the blank group and baicalin group, 5 rabbits in each group. Blood (10 mL) was collected from auricular artery for serum preparation befroe sensitization. The serum was incubated in vitro with baicalin which detected by lc-ms-serume albumin binding system, preparing baicalin-serum protein complete antigen. Rabbits were immunized by subcutaneous injuection of complete antigen 5 times. The antiserum of baicalin-serum protein complete antigen was collected from abdominal aorta at a one week interval after the last immunizations. ELISA was used to determine the specific antibody titers (OD value) of antiserum. The indirect competitive ELISA was used to determine the antiserum specificity. ELISA kit was used to detect the level of rabbit immunoglobulin (IgE) antibody in serum. Results The antibody titers ratio of baicalin and nagative control group was more than 2, so that the baicalin had sensitization. The antibody from antiserum in rabbits had somewhat specificity. The exogenous IgE antibody was produced in rabbits clearly. Conculsion Baicalin has sensitization to rabbits.
Baicalin; Shuanghuanglian injection; ELISA;Immunoglobulin Antibody idiotypes
10.3969/j.issn.1002-2619.2017.06.019
北京市自然科学基金资助项目(编号:7142088)
邓颖颖(1991—),女,学士,硕士研究生在读。研究方向:中药药理。
R-332;R284.1;R287;R392.11
A
1002-2619(2017)06-0880-04
2017-03-17)
△ 通讯作者:陕西中医药大学中药药理教研室,陕西 咸阳 712046
1 陕西中医药大学药学院2014级硕士研究生,陕西 咸阳 712046
2 北京大学药学院天然药物学系,北京 100083
3 陕西中医药大学中药药理教研室,陕西 咸阳 712046

