高产β-葡萄糖苷酶的乳酸菌在葡萄汁酸面团面包中的应用
钱 超
杨文丹1
张宾乐1
庄 靓1
徐 岩2
黄卫宁1
李 宁3
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 江南大学生物工程学院工业生物技术教育部重点实验室,江苏 无锡 214122;3. 广州焙乐道食品有限公司,广东 广州 511400;4. 焙乐道食品集团,比利时 布鲁塞尔 1201)
高产β-葡萄糖苷酶的乳酸菌在葡萄汁酸面团面包中的应用
钱 超1
杨文丹1
张宾乐1
庄 靓1
徐 岩2
黄卫宁1
李 宁3
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 江南大学生物工程学院工业生物技术教育部重点实验室,江苏 无锡 214122;3. 广州焙乐道食品有限公司,广东 广州 511400;4. 焙乐道食品集团,比利时 布鲁塞尔 1201)
从4种酒曲中分离筛选乳酸菌,并通过七叶苷平板显色法结合酶活测定筛选出3株高产β-葡萄糖苷酶的菌株。通过16S rDNA基因鉴定其种属,研究了3株菌粗酶液的最适温度、pH,并对酶进行定位。应用高产β-葡萄糖苷酶的乳酸菌发酵葡萄汁酸面团制作面包,通过固相微萃取气相色谱质谱联用技术(GC—MS)分析了面包香气成分,并进行了感官评定。结果表明:酒曲中一共筛得124株乳酸菌,其中产β-葡萄糖苷酶的乳酸菌有28株,产酶能力最高的3株乳酸菌经鉴定为哈尔滨乳杆菌(Lactobacillusharbinensis,M12和M24)和戊糖片球菌(Pediococcuspentosaceus,J28)。用M12发酵葡萄汁酸面团制作面包(RSB),RSB中一共检测出52种风味物质,较普通酵母面包(CYB)的风味物质种类增加了52.9%,而风味物质总峰面积也提高了65.5%。经过感官评定,RSB的整体接受度优于普通酵母面包(CYB)及含未发酵葡萄汁的酵母面包(RYB)。
β-葡萄糖苷酶;酸面团;面包;风味;乳酸菌
面包风味包括香气、滋味和质地等,与原料、发酵、酶反应和热反应多种因素有关,其中挥发性风味物质是影响消费者购买意图的重要依据。目前主要通过添加合成香精、天然香料和具有浓厚香气的原料来提高面包风味[1]。但普遍存在安全隐患、留香差、成本高以及不够健康等缺陷。寻求更加安全、有效和健康的方法改善面包风味成为了研究者们的研究热点。
将水果或果干通过发酵得到的发酵液添加到面包中去,制得具有水果风味和发酵香气的发酵水果面包,可以很明显地改善面包风味[2]38[3]47。
葡萄含有丰富的营养物质,已有研究[2]38[3]47通过将葡萄接种产香酵母发酵的发酵液制作面包获得天然发酵风味面包,但是其并没有充分发挥葡萄本身的风味。葡萄本身含有种类丰富的品种香,主要是萜烯类物质[4],而这些萜烯类物质大部分以不挥发的糖苷形式存在。β-葡萄糖苷酶是一类水解葡萄糖苷键的酶,它可以水解葡萄中的糖苷类物质,使与之结合的萜烯等风味物质成为可挥发性的游离态。所以在葡萄酒研究中,研究者[5-6]们通过筛选产β-葡萄糖苷酶的菌株来提高葡萄酒的风味。
目前中国对β-葡萄糖苷酶的研究主要集中在高产黑曲霉菌等菌种的筛选,酶的固定化应用,及其在葡萄酒发酵过程中的增香作用[7-8],对将其应用在发酵葡萄汁酸面团的报道还没有。故本研究旨在分离筛选出产β-葡萄糖苷酶的乳酸菌发酵葡萄汁酸面团制作面包,以期充分发挥葡萄本身的果香,提高面包的风味,将为β-葡萄糖苷酶的应用提供一条新的思路。
1 材料与方法
1.1 材料与试剂
酒曲:多地酒厂收集;
对硝基苯基-β-D吡喃葡萄糖(p-NPG)、对硝基苯酚(pNP)、七叶苷:杭州百思生物科技公司;
细菌提取试剂盒:天根生化科技有限公司;
引物1492R(5’- GGTTACCTTGTTACGACTT-3’)和27F(5’-AGAGTTTGATCCTGGCTCA-3’):上海桑尼生物科技有限公司;
面包粉:中粮面业(秦皇岛)鹏泰面粉有限公司;
干酵母:安琪酵母股份有限公司;
黄油:中粮食品营销有限公司;
白砂糖、食盐、玫瑰香葡萄干:市售。
1.2 仪器与设备
超净台:SW-CJ-2F型,苏州安泰空气技术有限公司;
恒温水浴锅:HH.S2I-4型,上海博讯实业有限公司医疗设备厂;
离心机:H1650-W型,湖南湘仪实验室仪器开发有限公司;
恒温恒湿培养箱:BSC-250型,上海博讯实业有限公司医疗设备厂;
电子显微镜:XSP-10C型,上海彼爱姆光学仪器制造有限公司;
电子天平:JE2002型,上海浦春计量仪器有限公司;
紫外可见分光光度计:TU-1810型,北京普析通用仪器有限责任公司;
PCR仪:PC300型,艾本德(中国)有限司;
pH计:FE20型,梅特勒仪器(上海)有限公司;
搅拌机:SM-25型,新麦机械(无锡)有限公司;
醒发箱:SPC-40SP型,新麦机械(无锡)有限公司;
烤箱:SM-523型,新麦机械(无锡)有限公司;
气相色谱-质谱联用仪: TSQ Quantum XLS型,赛默飞世尔科技(中国)有限公司;
固相微萃取装置(萃取头):CAR/PDMS型,美国 Supelco公司。
1.3 方法
1.3.1 产β-葡萄糖苷酶的乳酸菌的分离
(1) MRS筛选培养基的配制:称取蛋白胨 10.0 g,牛肉膏 10.0 g,酵母提取物 5.0 g,葡萄糖 20.0 g,柠檬酸三铵 2.0 g,磷酸氢二钾 2.0 g,乙酸钠 5.0 g,吐温-80 1.0 mL,七水硫酸镁 0.5 g,四水硫酸锰 0.25 g,加入去离子水至1 L,调pH至6.2~6.4;再称取20 g 碳酸钙加入到100 mL蒸馏水中,制成碳酸钙乳浊液;将MRS培养基和碳酸钙乳浊液分开于121 ℃灭菌15 min;倒平板前,待培养基融化冷却后,平板上加入一定量的碳酸钙乳浊液,晾干了以后再接种。
(2) 酒曲中乳酸菌的分离:称取10 g酒曲,溶于90 mL生理盐水中,置于磁力搅拌器上混匀30 min后,取1 mL梯度稀释;吸取10-5,10-6,10-7梯度的稀释液各100 μL在MRS筛选平板上进行涂布,于37 ℃恒温培养箱中培养48 h[9-10]。挑取菌落旁出现透明溶解圈的菌落接到MRS液体培养基中,再经过数次划线分离和镜检,得到纯化的乳酸菌。传代并加30%甘油保护剂,保存于-80 ℃超低温冰箱中,做后续试验。
1.3.2 产β-葡萄糖苷酶的乳酸菌的筛选
(1) 初筛:根据赵林果等[11-12]的方法,采用96孔板法进行筛选。在MRS液体培养基中添加质量分数0.3%的七叶苷和0.05%的柠檬酸铁,加上1.8%的琼脂。121 ℃下灭菌15 min。之后在96孔板中每个孔中加入250 μL的培养基。将保存于-80 ℃超低温冰箱中的乳酸菌在室温下解冻,以2 mL/100 mL接种于MRS液体培养基中,37 ℃下培养24 h,传代2次,恢复菌株活力。然后取活化后的乳酸菌15 μL接种到96孔板上,每株菌做2个平行。
(2) 复筛:取5 mL在液体培养基中活化24 h后的乳酸菌,在4 ℃下5 000 r/min离心10 min,取离心沉淀用生理盐水溶液洗涤2次后,加入1 mL生理盐水,混匀稀释作为粗酶液。取100 μL粗酶液加入1.8 mL乙酸-乙酸钠缓冲液在37 ℃下水浴5 min,然后加入100 μL底物p-NPG(20 mmol/L),空白组改用100 μL缓冲液替代粗酶液。反应10 min之后加入1 mol/L的Na2CO3溶液1 mL终止反应。400 nm下测量其紫外吸收[13]。酶单位(U)[14]则定义为以上条件下,每分钟催化生成1 μmol对硝基苯酚所需的酶量即为1个酶活力单位。菌干重测定:取15 mL生长24 h的菌液在4 ℃下5 000 r/min离心10 min得菌体,放入110 ℃干燥箱中烘干至恒重,称重。
(3) pNP标准曲线的绘制:称取pNP 139.0 mg,加蒸馏水定容至1 000 mL,分别吸取 1.0,2.0,3.0,4.0,5.0,6.0 mL于100 mL容量瓶中,用 1 mol/L Na2CO3溶液定容后混匀。稀释后的pNP终浓度分别为0.01,0.02,0.03,0.04,0.05,0.06 mmol/mL,以蒸馏水作为空白,用分光光度计于400 nm处测其紫外吸收。以pNP浓度为横坐标,吸光值为纵坐标,绘制标准曲线。
1.3.3 产β-葡萄糖苷酶的乳酸菌的鉴定 根据细菌基因组DNA提取试剂盒操作说明,提取待鉴定菌株的DNA,并将其作为PCR扩增模板,进行目标片段扩增。待鉴定菌株的16S rDNA基因扩增体系见表1[15]。
表1 产β-葡萄糖苷酶的乳酸菌16S rDNA 的PCR扩增体系
Table 1 PCR amplification system for 16S rDNA of high producingβ-glucosidase lactic acid bacteria

试剂种类添加量/μLdNTPsMIX(2.5mmol/L)4.010×Buffer(+Mg2+)5.0EasyTaqDNA酶(5U/μL)2.027F(10pmol/μL)1.51495R(10pmol/μL)1.5DNA模板(100ng/μL)2.0加ddH2O至反应体系总体积50.0
根据表1列出的PCR扩增体系,进行扩增,程序为:94 ℃下预变性5 min后进入30个循环:94 ℃变性1 min,55 ℃复性45 s,72 ℃延伸1 min。最后72 ℃终延伸 7 min。
扩增产物分别经过琼脂糖凝胶电泳检测、凝胶成像仪拍照确认条带后,将产物送往上海桑尼公司进行测序,再将测序结果所得扩增序列在NCBI数据库中进行BLAST同源序列比对,以确定菌株的种属[16]。下载相应的模式菌株,通过MEGA软件和Neighbor-Joinning方法构建系统发育树。
1.3.4 乳酸菌中β-葡萄糖苷酶的定位 对数生长中期菌液各取1 mL,在4 ℃下5 000 r/min离心10 min得到菌体和菌液上清,菌液上清直接进行酶活测定,菌体用生理盐水洗涤2遍,添加1 mL生理盐水悬浮后再进行酶活性测定。
再取10 mL菌液,同样处理后得菌体,菌体洗涤2次后加入10 mL PBS(NaCl 140 mmol/L;KCl 2.7 mmol/L;KH2PO41.8 mmol/L;Na2HPO410 mmol/L;pH 7.4)悬浮。再在冰浴条件下,将菌体悬浮液用超声细胞破碎机破碎20 min(450 W,间隔5 s)。其中1 mL破碎液直接进行酶活测定,再取1 mL破碎液在4 ℃下10 000 r/min离心10 min得到菌体破碎液上清和细胞碎片。细胞碎片用生理盐水洗涤2次,再添加0.5 mL生理盐水,进行悬浮后测定酶活,菌体破碎液上清同样直接进行酶活性测定[17]。
1.3.5 粗酶液的酶学性质 分别取100 μL粗酶液,加入不同pH的1.8 mL的缓冲液按照1.3.2(2)的方法测酶活。
再分别取100 μL粗酶液,加入1.8 mL的乙酸-乙酸钠缓冲液(pH=4.5)后置于不同温度下水浴5 min后,再加入100 μL底物p-NPG,在相应温度下反应10 min,其余步骤同1.3.2(2)。
1.3.6 含有葡萄汁的发酵酸面团面包的制作与风味
(1) 含有葡萄汁的发酵酸面团面包的制作:将高产β-葡萄糖苷酶的乳酸菌接种于MRS液体培养基中活化,培养24 h后,取5 mL菌液以5 000 r/min离心10 min,沉淀用生理盐水洗涤2次。然后接种至小麦粉∶水质量比为1∶1的面团中(用葡萄汁替代20%的水),使接入菌的初始量为106CFU/g,然后置于37 ℃恒温恒湿培养箱中培养12 h后,即为含有葡萄汁的发酵酸面团。对照组为普通酵母面包和含有葡萄汁酵母面包。3种面包的配方见表2。参照张思佳等[18]的制作方法并略作修改:将含有葡萄汁的发酵酸面团和面粉以及其他配料混合加入搅面缸中搅打成形后,取出用保鲜膜覆盖5 min,然后分割为每个面团90 g,再次用保鲜膜覆盖10 min后,成型,之后置于37 ℃的醒发箱中醒发90 min,最后置于烤箱中以上火170 ℃下火210 ℃焙烤23 min。取出后脱模,室温冷却2 h后做后续试验。
(2) 面包风味分析:取5 g面包芯碎片加入样品瓶中, 60 ℃下恒温水浴,再将老化后的CAR/PDMS萃取头插入顶空瓶中萃取40 min。之后将萃取头插入气相色谱的高温汽化室中进样并进行GC—MS分析。
色谱条件:DB-5MS毛细管色谱柱,载气为He,保持1.2 mL/min速度恒流2 min后分流,速度为10 mL/min,分流比为12∶1。升温程序为40 ℃下,恒温2 min后,以6 ℃/min 速度升至160 ℃,再以10 ℃/min升至240 ℃,之后保持10 min。
质谱条件:进样孔温度250 ℃,电子电离,电子能量为70 eV,发射电流为200 μA,离子源温度200 ℃,采集方式为全扫描,质量范围m/z为33~495。结果利用GC—MS数据分析软件进行处理,化合物经计算机检索,并与NSIT谱库和RTLPEST谱库相匹配,仅报道匹配度大于800的结果并采用峰面积归一化法定量计算出各挥发性香气成分在面包中的相对含量[19]。

表2 普通酵母面包(CYB)、含有葡萄汁的酵母面包(RYB)和含有葡萄汁的发酵酸面团面包(RSB)配方Table 2 Formulations of wheat yeast bread, raisin yeast bread and raisin sourdough bread g
(3) 感官评价:20位经过培训的人员(男女比例1∶1)组成感官评定小组,评定方法采用9分嗜好法,数字越大代表喜好程度越高,分别对面包的色泽、外观等方面进行评分。
1.3 数据分析
运用SPSS、Microsoft office和Origin等软件进行数据的分析。利用方差分析法(ANOVA)对数据进行显著性分析,显著差异水平取P<0.05。
2 结果与讨论
2.1 酒曲中乳酸菌的分离
经过乳酸菌筛选培养基的筛选,平板涂布,划线分离和染色镜检,部分乳酸菌菌落形态见图1,从4种酒曲中共分离出124株乳酸菌,其中承德酒曲(C)33株,梅兰春酒曲(M)33株,酒鬼酒曲(J)28株,汤沟酒曲(T)30株。

图1 部分乳酸菌的菌落形态Figure 1 Colony morphology of lactic acid bacteria
2.2 产β-葡萄糖苷酶的乳酸菌的分离筛选
2.2.1 产β-葡萄糖苷酶的乳酸菌的初筛β-葡萄糖苷酶可以将七叶苷(6,7-2-羟基-香豆素-β-D-葡萄糖苷)分解为葡萄糖和七叶苷原(6,7-2-羟基-香豆素),七叶苷原可以与Fe3+作用显现出棕黑色。从96孔平板结果中,一共有28株乳酸菌显棕黑色(见图2)。除汤沟酒曲(T)外,其余酒曲中均有产酶的菌株,但数量差异较大,其中梅兰春酒曲(M)中50%以上的乳酸菌都具有不同程度的酶活,而酒鬼酒曲(J)中则只有3株。这可能与酒曲制作原料中的微生物以及当地的环境微生物有关。将这28株菌传代并加30%甘油保护剂,保存于-80 ℃超低温冰箱中,做后续试验。
2.2.2 产β-葡萄糖苷酶的乳酸菌的复筛 对硝基苯酚与碳酸钠试剂在碱性条件下显色,通过测定其吸光值,制得标准曲线见图3。
由图3可知,回归方程为y=19.369x-0.077 1,线性相关系数为0.999 7,在pNP含量为0.010~0.060 mmol/L时,吸光度值与对硝基苯酚含量呈线性相关。

图2 七叶苷平板的显色反应Figure 2 Eseulin plate colored method
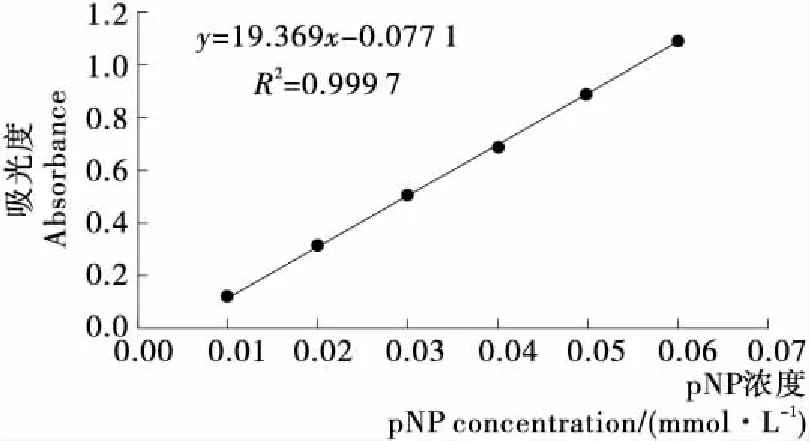
图3 对硝基苯酚的标准曲线Figure 3 The standard curve of p-nitrophenol
由图4可知,各个菌株间酶活差异较大,从2.2 U/g 到10.1 U/g,其中M12的酶活最高为10.1 U/g,M24、J28次之,酶活分别为7.3,6.8 U/g。最终将这3株作为高产β-葡萄糖苷酶的乳酸菌。

图4 复筛菌株的酶活Figure 4 The enzyme activity of Secondary screening lactic acid bacteria
2.2.3 高产β-葡萄糖苷酶的乳酸菌的鉴定 3株乳酸菌的16S rDNA的测序结果见表3,其中,M12、M24与LactobacillusharbinensisFQ003的同源性都达到了99%。J28与PediococcuspentosaceusKID7的同源性达到了100%。根据比对结果,构建系统发育树,见图5。
由图5可知,M12和M24是同一种属的哈尔滨乳杆菌,但在菌液中的形态有比较大的差异。酒曲中分离戊糖片球菌已有报道[10],但鲜有从酒曲分离出哈尔滨乳杆菌的报道。
2.2.4 乳酸菌中β-葡萄糖苷酶的定位研究 由图6可知,这3种菌均是完整细胞的酶活最高,除J28的上清有微弱酶活之外,其余两株菌上清菌没有酶活。超声破碎之后,破碎液酶活都很高,推测这3株菌产的β-葡萄糖苷酶均是胞内酶;而细胞碎片主要是细胞壁碎片和细胞膜碎片以及部分可能未被破碎的菌体,推测该酶可能是结合在细胞壁上[20],也有可能结合在原生质体的细胞膜上,为膜结合酶[21]。
表3 高产β-葡萄糖苷酶的乳酸菌的16s rDNA 序列比对
Table 3 Blast result of 16S rDNA sequence of high produc-ingβ- glucosidase lactic acid bacteria

菌株编号序列比对结果序列号同源性/%M12哈尔滨乳杆菌(LactobacillusharbinensisFQ003)KF418816.199M24哈尔滨乳杆菌(LactobacillusharbinensisFQ003)KF418816.199J28戊糖片球菌(Pediococcuspen-tosaceusKID7)KJ810576.1100

图5 高产β-葡萄糖苷酶的乳酸菌的 16S rDNA 序列系统发育树
Figure 5 Phylogenetic tree based on 16S rDNA gene sequ-ence of high producingβ-glucosidase

图6 β-葡萄糖苷酶的定位Figure 6 β-glucosidase activity of different fractions in strains
2.2.5 粗酶液的酶学性质 3种菌的粗酶液最适pH略有不同,M12的最适pH为4.5,而M24与J28在pH为4.0时酶活最高,见图7。这与相关报道一致,即β-葡萄糖苷酶的最适pH在4~6[22-23]。
最适温度方面M12与M24的最适温度均为37 ℃,而J28的最适温度在44 ℃,见图8。文献中不同菌株的最适温度差异较大,李晓东等[22]发现的一株黑曲霉的β-葡萄糖苷酶最适温度为70 ℃,万振堂等[24]筛选出的一株乳酸菌的β-葡萄糖苷酶最适温度为37 ℃,张敏等[25]筛选出的一株酵母菌的最适温度为30 ℃。故选取最适合温度和pH均适合发酵酸面团的M12做后续酸面团发酵试验。

图7 粗酶液的最适pHFigure 7 The activity of crude enzyme in different pH
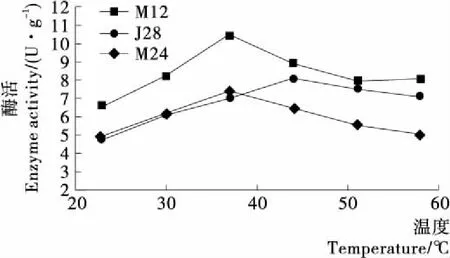
图8 粗酶液的最适温度Figure 8 The activity of crude enzyme in different temperatures
2.3 含有葡萄汁的发酵酸面团面包的风味研究
由表4、5可知,3种面包的风味物质种类和含量各有不同。普通酵母面包共检测出34种风味化合物,含有葡萄汁的酵母面包中检测出了35种风味物质,虽然种类相差不大,但总峰面积提高了34.4%;含有葡萄汁的发酵酸面团面包中一共检测出52种风味物质,较普通酵母面包风味物质种类提高了52.9%,而风味物质总峰面积提高了65.5%。由此可见,添加葡萄汁和含有葡萄汁发酵酸面团均会提高面包的风味。
3种面包的风味物质主要包括醇类、酸类、烷烃类、芳香类和脂类等,萜烯类物质则是葡萄汁的引入带来的特殊风味物质。
醇类物质在3种面包中含量都是最高的,虽然醇类物质阈值相对较高,但因其在风味中所占的比例也是最大,所以是影响面包风味的一类重要的物质[26]。由表5可知,3种面包的醇类物质的种类并没有显著差异,而含量差异显著,其中含有葡萄汁的酵母面包的醇类含量提高了35.7%,发酵葡萄酸面团面包的醇类含量提高了30.2%。乙醇和异戊醇含量最高,乙醇和异戊醇是酵母发酵产生,含量提高可能是由酵母的活力提高引起的。
酸类物质是酸面团发酵面包产生独特风味的重要原因。与CYB相比,RYB的酸类物质种类不但没有增加,反而减少了。但是在含量上增加了26.2%。而RSB的酸类物质种类上增加了5种,而总体含量也提高了169.5%。这与张庆等[27]的结论相似。
芳香类化合物在面包中所占的比重也较大,其中含量比较高的苯乙醇具有清甜的玫瑰样花香,苯乙醛具有水果的香气。与CYB相比,RYB的芳香类物质含量提高51.2%,而RSB则比CYB和RYB分别提高了196.9%和96.4%。由此可见,葡萄汁和酸面团的引入都提高了面包中芳香类化合物的含量。
萜烯类化合物在面包中的含量虽然不高,但是其阈值较低,是RSB风味组成的重要部分。葡萄汁的添加使PYB中出现了萜烯类的物质,但是含量很低,添加了M12发酵的酸面团之后,萜烯含量提升明显。由此可以推断出,高产β-葡萄糖苷酶的乳酸菌对面包的萜烯类风味物质有明显的提升作用。其中含量最高的8-羟基芳樟醇带有浓青带甜的木青气息,脱氢橙花醇具有令人愉快的玫瑰和橙花的香气,β-石竹烯醇具有辛香、木香和柑橘香。
2.4 面包感官分析
由图9可知,含有葡萄汁的酸面团制作的面包在外观、风味和口感等方面均优于普通酵母面包和含有葡萄汁的酵母面包。外观方面,CYB的得分较低,可能是比容较小引起的。RSB和RYB没有显著性差异。色泽方面,RYB要比RSB和CYB低,表现为RYB要更加偏褐色,推测原因是添加了葡萄汁,而葡萄汁中有较多的葡萄糖和果糖,导致面包在烘焙过程中,美拉德反应和焦糖化反应加剧引起的。而RSB中经过酸面团发酵之后,葡萄糖等已经被乳酸菌消耗,所以色泽与CYB组相差不大。口感方面,根据测试者描述,RYB和RSB在口感上还能吃出一些CYB中没有的口味,RSB中有略微的酸味影响了其评分但也在可接受范围内。风味方面,优劣程度排序为RSB>RYB>CYB。根据测试者描述,CYB风味较为一般, RYB和RSB风味上要更加丰富一点,其中RSB中能闻出一些淡清香与果香,整体风味更加浓郁。整体可接受度方面,优劣排列顺序为RSB>RYB>CYB。表明只添加葡萄汁的面包与普通酵母面包相比,外观、口感和风味等方面均有优势,色泽评分较普通酵母面包低,而添加含有乳酸菌发酵的酸面团除色泽与空白酵母面包评分相同外,其余各项评分均有较大提高,与只添加葡萄汁的酵母面包相比,口感因为略有酸味导致评分有所降低外,其他方面都有明显的提高。整体接受度上,含有葡萄汁的酸面团面包要高于其他两组面包。

表4 普通酵母面包、含有葡萄汁的酵母面包和含有葡萄汁的发酵酸面团面包的GC—MS结果Table 4 The GC—MS analysis of wheat yeast bread, raisin yeast bread and raisin sourdough bread

表5 普通酵母面包、含有葡萄汁的酵母面包和含有葡萄汁的发酵酸面团面包的风味物质统计Table 5 The statistics of aroma compounds in wheat yeast bread, raisin yeast bread and raisin sourdough bread

图9 3种面包的感官评价Figure 9 Sensory characteristics of three kinds of bread
3 结论
本研究从酒曲中筛选高产β-葡萄糖苷酶的乳酸菌,探究了该乳酸菌产酶活位置和最适条件,并将其运用至含有葡萄汁基质的酸面团中,制作水果酸面团面包。结果表明,添加高产β-葡萄糖苷酶的乳酸菌发酵的葡萄汁酸面团能够明显改善面包风味,制得的面包较普通酵母面包有更多的萜烯类风味物质,能够带给消费者更愉悦的感官体验,整体可接受度更高。若能够将工艺条件进一步优化,将有望实现工业化生产。
[1] 汤晨, 张蕾, 仇智宁. 试论食用香精香料安全性[J]. 粮食与油脂, 2012, 25(7): 50-51.
[2] 张薇. 葡果自然发酵酸面团菌群结构及发酵面包烘焙品质研究[D]. 无锡: 江南大学, 2015.
[3] 涂雅俊. 葡萄干发酵汁的性质及其对面包烘焙特性的影响[D]. 无锡: 江南大学, 2013.
[4] 李庆华. 高产β-葡萄糖苷酶酿酒酵母的筛选及其发酵特性的研究[D]. 杨凌: 西北农林科技大学, 2009: 1-2.
[5] 彭帅, 樊明涛, 张庭静, 等. 熊果苷诱导植物乳杆菌β-D-葡萄糖苷酶对葡萄酒香气的影响[J]. 食品工业科技, 2016, 37(19): 12-15.
[6] BAFFI M A, TOBAL T, LAGO J H G, et al. A Novel beta-Glucosidase from Sporidiobolus pararoseus: Characterization and Application in Winemaking[J]. J Food Sci, 2011, 76(7): C997-C1 002.
[7] 桑苇, 唐柯, 徐岩, 等. 黑曲霉β-葡萄糖苷酶对葡萄酒酶解增香调控及香气物质的影响[J]. 食品与发酵工业, 2015, 41(5): 8-13.
[8] 韦策, 陆青山, 勇强, 等. 固定化β-葡萄糖苷酶填充床反应器的研究[J]. 林产化学与工业, 2013, 33(3): 64-68.
[9] 侯小歌, 杜小波, 李学思, 等. 中温大曲中乳酸菌的分离鉴定及产酸特性[J]. 酿酒科技, 2010(9): 17-20.
[10] 王兴洁, 魏超, 廖光敏, 等. 产γ-氨基丁酸乳酸菌的分离鉴定及发酵条件优化[J]. 食品与机械, 2016, 32(7): 40-44.
[11] 赵林果, 孟鹏, 李丽娟, 等. 利用七叶灵显色技术检验和判断β-葡萄糖苷酶的研究[J]. 食品与发酵工业, 2008, 34(12): 163-166.
[12] 蔡万华, 丁少鹏, 叶蕊芳, 等. 利用96孔板和酿酒酵母生长圈复合筛选高产管囊酵母[J]. 酿酒科技, 2011(4): 36-38.
[13] 李少远. 最新数据: 全球葡萄园面积、葡萄酒产量和消费情况[EB/OL].[2016-04-26]. http://www.jianiang.cn/shuju/042B61342016.html.
[14] 白瑞, 苏东民, 苏东海, 等. 小麦麸皮内源性β-木糖苷酶酶活测定及酶学性质[J]. 食品与机械, 2014, 30(4): 30-33.
[15] 程晓燕. 酸面团乳酸菌优势菌群及发酵馒头品质与风味特性研究[D]. 无锡: 江南大学, 2015: 11.
[16] 滕志利, 钱方, 姜淑娟, 等. 产广谱细菌素乳酸菌的筛选及分类鉴定[J]. 食品与机械, 2013, 29(6): 45-48.
[17] BARBAGALLO R N, SPAGNA G, PALMERI R, et al. Assessment of beta-glucosidase activity in selected wild strains of Oenococcus oeni for malolactic fermentation[J]. Enzyme and Microbial Technology, 2004, 34(3/4): 292-296.
[18] 张思佳, 张薇, 苏晓琴, 等. 乳杆菌发酵对荞麦面包抗氧化及烘焙特性影响[J]. 食品工业科技, 2015(19): 49-53.
[19] 王益姝, 钱超, 黄卫宁, 等. 梅兰春酒醅中生香酵母的分离鉴定及其发酵面包香气成分分析[J]. 食品与发酵工业, 2016, 42(9): 45-51.
[20] P REZ-MART N F, SESE A S, IZQUIERDO P M, et al. Screening for glycosidase activities of lactic acid bacteria as a biotechnological tool in oenology[J]. World Journal of Microbiology and Biotechnology, 2012, 28(4): 1 423-1 432.
[21] 张哲. 植物乳杆菌β-D-葡萄糖苷酶的胞内定位及性质研究[D]. 杨凌: 西北农林科技大学, 2014: 17.
[22] 李晓东, 周明, 杨丽娜, 等. 黑曲霉β-葡萄糖苷酶的酶学特性研究[J]. 微生物学杂志, 2014, 34(3): 14-18.
[23] MESAS J M, RODRIGUEZ M C, ALEGRE M T. Basic characterization and partial purification of beta-glucosidase from cell-free extracts of Oenococcus oeni ST81[J]. Letters In Applied Microbiology, 2012, 55(3): 247-255.
[24] 万振堂, 杨丽杰. 产胞外β-葡萄糖苷酶乳酸菌的筛选及其酶学性质的初步研究[J]. 食品与发酵工业, 2009, 35(4): 28-32.
[25] 张敏, 李佳益, 史学伟, 等. 产β-葡萄糖苷酶非酿酒酵母的筛选及酶学特性研究[J]. 中国酿造, 2016, 35(5): 97-101.
[26] POZO-BAY N M A, GUICHARD E, CAYOT N. Flavor Control in Baked Cereal Products[J]. Food Reviews International, 2006, 22(4): 335-379.
[27] 张庆, 钟京, 王凤, 等. 植物乳杆菌燕麦酸面团发酵面包风味化合物的特征[J]. 食品科学技术学报, 2011, 29(4): 12-18.
Application of high producingβ-glucosidase lactic acid bacteria in raisin sourdough bread
QIANChao1
YANGWen-dan1
ZHANGBin-le1
ZHUANGJin1
XUYan2
HUANGWei-ning1
LINing3FilipArnaut4FILIPArnaut4
(1.StateKeyLaboratoryofFoodScienceandTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China;2.KeyLaboratoryofIndustrialBiotechnologyofMinistryofEducation,SchoolofBiotechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China; 3.GuangzhouPuratosFoodCo.Ltd.,Guangzhou,Guangdong511400,China; 4.PuratosGroupNV/SA,Brussels, 1201,Belgium)
Three high producingβ-glucosidase lactic acid bacteria strains were isolated and screened from Qu by eseulin plate colored method combining enzyme activity test, then identified by 16S rDNA. The screened bacteria with highest enzyme activity was used in raisin sourdough fermentation and bread making. After that, the aroma of the bread was analyzed by GC-MS as well as sensory evaluation. The results showed that among the 125 isolated lactic acid bacteria, there were 28 strains which produceβ-glucosidase. Three strains showed high enzyme-producing ability, they were identified asLactobacillusharbinensis(M12, M24) andPediococcuspentosaceus(J28). M12, which appeared the highest activity was used in raisin sourdough fermentation and bread making. Compared with the common yeast bread, the number and the peak area of the aroma compounds in raisin sourdough bread increased by 52.9% and 65.5%. Besides, raisin sourdough bread is more acceptable than common yeast bread and raisin yeast bread in sensory evaluation.
β-glucosidase; sourdough; bread; flavor; lactic acid bacteria
国家自然科学基金面上项目(编号:31071595,31571877);国家高技术研究发展计划(863计划)项目(编号:2012AA022207C);比利时国际合作项目(编号:BE110021000)
钱超,男,江南大学在读硕士研究生。
黄卫宁(1963—),男,江南大学教授,博士。 E-mail:wnhuang@jiangnan.edu.cn
2017—03—27
10.13652/j.issn.1003-5788.2017.05.003

