金黄色葡萄球菌菌膜形成过程中过氧化氢酶变化的研究
杨存迪 - 李忠海,2 -,2 任佳丽,2 -,2
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 稻谷及副产品深加工国家工程实验室,湖南 长沙 410004)
金黄色葡萄球菌菌膜形成过程中过氧化氢酶变化的研究
杨存迪1YANGCun-di1李忠海1,2LIZhong-hai1,2任佳丽1,2RENJia-li1,2
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 稻谷及副产品深加工国家工程实验室,湖南 长沙 410004)
选择食品工业中出现的典型细菌菌膜(金黄色葡萄球菌菌膜),探讨单一细菌菌膜形成中细菌自身产生的具有氧化还原活性的生物酶在菌膜形成与生长过程中的变化,并将其与菌膜的实时变化相对照,探索菌膜形成过程中的氧化还原活动的变化,以寻求食品工业中可有效地控制菌膜污染的方法。对金黄色葡萄球菌菌膜中过氧化氢酶量的变化进行实时监测,并对不同培养时间段的菌膜所得到的检测峰电流进行作图分析,结果显示:细菌中过氧化氢酶的量随着菌膜形成量的上升而上升,随着菌膜的自溶分解现象而减小。可为金黄色葡萄球菌菌膜中的氧化代谢活动研究提供理论依据与研究基础。
金黄色葡萄球菌;菌膜;过氧化氢酶;SECM
根据细菌通过提升自身的抗氧化代谢途径来提升自身耐药性这一理论,抗生素等杀菌型药物会刺激细菌细胞的呼吸作用,从而导致超氧化物的产生以及游离铁的释放[1]。游离铁会激活芬顿反应以羟自由基(OH·)产生有毒活性氧(ROS),这些自由基能破坏蛋白质、脂类、DNA而引起细胞死亡[2]。
细菌细胞通过上调自身的抗氧化酶来抗衡ROS,包括超氧化物歧化酶(SOD)和过氧化氢酶。由Nguyen的研究[2]可知,当细菌受到外部环境的影响,自身营养吸收被限制时,由饥饿信号而引起的应激反应也会提升细菌的耐药性。细菌黏附在实体表面并分泌多糖、糖蛋白等形成菌膜,菌膜的产生会导致细菌的整体活性下降,菌膜也会对细菌与环境外部的营养物质交换起到一定程度的阻碍作用[3-5]。菌膜的产生会降低细菌的营养吸收导致应激反应产生,从而提升耐药性,这也是形成菌膜后细菌难以彻底清除的重要原因之一。由此可见,对细菌菌膜形成中抗氧化酶变化过程的研究是抑制细菌耐药性提升的关键。
中国对菌膜的研究起源于医学方面,近年来才逐渐关注其在食品工业中的危害性。中国的菌膜研究主要集中在被膜形成条件、吸附界面影响、消毒剂作用、菌膜形成的分子机制等方面[6]。国外大部分菌膜研究主要集中在菌膜形成中菌体的表面性质、胞外多糖、群体感应信号分子的信号传递方面,其中菌膜中信号分子之间的作用又是研究的热点[6-7]。综合国内外对菌膜的研究进展可知,对于菌膜形成过程中细菌内各类氧化还原代谢酶的研究与检测十分缺乏。
本研究拟以扫描电化学显微镜(SECM)这一新型扫描探针显微技术为研究工具,HQ与H2O2为氧化还原介质,介导酶与电极间的电子传递,对食源性病原菌金黄色葡萄球菌菌膜形成中过氧化氢酶的具体变化过程进行初步研究与探索[6],以期为解决食品行业中菌膜污染问题提供一定的理论依据与研究基础。
1 材料与方法
1.1 试剂与仪器
数控超声波清洗器:KQ-100DB型,昆山市超声仪器有限公司;
SECM扫描电化学显微镜、10 μm微电极探针、Ag/AgCl参比电极、铂对电极:CHI900D/920D型,上海辰华仪器有限公司;
单人单面垂直净化工作台:SW-CJ-1D型,苏州净化有限公司;
生化培养箱:LRH-250-A型,韶关市泰宏医疗器械有限公司;
紫外分光光度仪:UV-1800型,岛津分析仪器;
电子分析天平:ZA120R4型,上海赞维衡器有限公司;
金黄色葡萄球菌:CICC 21600,购于ACTT;
过氧化氢酶:2 KU/mg,上海源叶生物科技有限公司;
冰醋酸:分析纯,上海源叶生物有限公司;
二茂铁甲醇:分析纯,湖北巨胜科技有限公司;
TSB(胰蛋白胨大豆肉汤):MCA014型,郑州亚世生物技术有限公司;
对苯二酚(HQ):分析纯,国药集团化学试剂有限公司;
过氧化氢:浓度为30%,湖北信康医药化工有限公司。
1.2 研究方法
1.2.1 溶液配制
(1) PBS(0.01 mol/L磷酸盐缓冲液):8 g NaCl、0.2 g KCl、1.44 g Na2HPO4和0.24 g KH2PO4,溶于800 mL蒸馏水中,用盐酸调节溶液的pH至7.4,再定容至1 L。
(2) 4.00 mmol/L H2O2溶液:移取4.12 mL 30% H2O2,用缓冲液稀释至100 mL,再稀释100倍。低浓度H2O2溶液现配现用。
(3) 1 mmol/L HQ溶液:取0.11 g HQ,用缓冲液溶解定容至10 mL,再稀释100倍,HQ有氧化还原活性,容易被氧气氧化,所以现配现用(2,3,4,5 mmol/L HQ溶液同理配制)。
(4) TSB培养基:取30 g 胰蛋白胨大豆肉汤粉,加入到800 mL无菌水中,加热搅拌至完全溶解,用0.1 mol/L盐酸与0.1 mol/L氢氧化钠将pH调整到7.2左右,再加入无菌水定容至1 000 mL。
1.2.2 金黄色葡萄球菌母液制备 将冷冻保藏(冷冻保藏温度为-18 ℃)的金黄色葡萄球菌菌种取出,放入4 ℃的冰箱中约24 h,以便金黄色葡萄球菌菌种的活力恢复,达到活化目的。取1 μL活化好的菌种原液,在无菌环境中将其接种到制备好的TSB培养基中(TSB培养基的量为20 mL),将TSB培养基放入恒温振荡培养箱(恒温振荡培养箱温度为37 ℃,转速为120 r/min)中培养约18 h后,用紫外分光光度仪在600 nm波长处检测其OD值,并加入新鲜的无菌TSB培养基调节OD值到0.5,轻微振荡将其混合均匀后放入4 ℃冰箱备用[7]。
1.2.3 金黄色葡萄球菌菌膜培养 将玻片与6孔细胞板放入75%的乙醇溶液浸泡5 min,取出后用无菌水反复冲洗干净,自然风干后放在紫外灯下灭菌30 min。在6孔细胞板中每孔加入3 mL培养基及100 μL菌悬液,将玻片竖直插在孔中,将6孔细胞板转移至37 ℃恒温培养箱中培养[8]。
因为金黄色葡萄球菌为兼性厌氧型细菌,所以随着培养时间的增长,在培养基的表面以及玻片与液面交界处形成一层菌膜,菌膜有较强的黏附性,在玻片上的菌膜不容易脱落,并且大小面积相对统一,方便后续的检测工作[9]。
1.2.4 结晶紫染色检测菌膜基本生长情况 在菌膜培养了12,24,36,48,60,72 h后分别取出6孔细胞板并做结晶紫染色检测。
结晶紫染色检测步骤:将培养好的玻片取出,用蒸馏水冲洗3次,除去多余的培养基与悬浮细菌,放入事先准备好的干净离心管中,在离心管中加入5 mL甲醇溶液固定菌膜15 min,吸出甲醇溶液,让玻片自然风干;在离心管中加入6 mL 0.01%的结晶紫溶液,室温下染色15 min,取出玻片并用蒸馏水冲洗除去多余的染料,在37 ℃下烘干,然后放置至室温,将玻片放入5 mL 33%冰醋酸中,在37 ℃下脱色30 min;以33%冰醋酸溶液为空白对照,用紫外分光光度计测溶液在600 nm处的OD值。以OD值的大小来反应菌膜的大小,从而反映菌膜的基本生长情况[10]。
1.2.5 SECM确定HQ的最佳试验浓度 以pH为7.2的磷酸缓冲液配制浓度分别为1,2,3,4,5 mmol/L的HQ溶液,用SECM做其方波伏安曲线(扫描电压为0~1 V),以方波伏安曲线判断各浓度HQ溶液检测时电信号的强弱,由此确定出HQ的最佳检测浓度[11]。
1.2.6 SECM检测菌膜生长过程中过氧化氢酶的变化 在菌膜培养到4,8,12,16,20,24,28,32,36,40,44,48 h后,分别取出黏附有金黄色葡萄球菌菌膜的盖玻片,放入准备好的PBS缓冲液中,轻轻振荡盖玻片,清洗掉多余的悬浮细菌与培养基,将清洗后的盖玻片在通风工作台中干燥15 min,以便于菌膜的固定[12]。
将干燥好的盖玻片转移至SECM检测池中,分别加入4 mmol/L的HQ溶液与4 mmol/L的H2O2溶液各0.8 mL,保持检测探针与玻片的距离为30 μm,并将检测探针移动到菌膜的正上方,每隔40 s做一个方波伏安曲线(扫描电压为0~-0.8 V),共做20个时间点,将20条方波伏安曲线中的峰值与检测时间作图,可得菌膜中过氧化氢酶的基本变化曲线[13]。
2 结果与分析
2.1 菌膜的结晶紫染色试验
将培养了12,24,36,48,60,72 h后的菌膜进行结晶紫染色,脱色后在600 nm波长处测OD值(A、B、C组互为平行组,空白对照为33%冰醋酸)。由表1可知,菌膜在6孔板培养了12 h左右时,有少量菌膜开始出现并黏附在盖玻片上,此时的OD值约为0.170;在培养了24 h后,菌膜在盖玻片上的黏附量出现了明显的增长OD值约为0.25;当培养时间达到36 h左右时,菌膜在盖玻片上的黏附量达到了最大值OD值约为0.33;在培养了48 h后,菌膜量出现下滑,测得OD值约为0.27;培养时间超过48 h后,菌膜量出现持续下滑,在60~72 h时,下滑趋势趋于平缓。菌膜的整个生长是一个先上升再下降,最后趋于平缓的一个过程[14]。随着培养的开始,悬浮的细菌会开始在实体表面黏附,慢慢聚集并分泌多糖与糖蛋白等,形成菌膜,当菌膜量达到最大值后,菌膜会发生降解与自溶现象导致菌膜量持续下降,最后趋于稳定(图1)。菌膜的形成量与细菌的种类、培养基的选择、培养温度、细菌黏附材料条件等都有着密切的联系。根据此次结晶紫染色试验结果,选择将金黄色葡萄球菌菌膜的最佳培养时间定为36 h。
2.2 HQ最佳检测浓度的确定
在检测池中分别加入1 mL的1,2,3,4,5 mmol/L的HQ溶液,扫描电压为0~1 V,并分别做方波伏安曲线。由图2可知,电压在0.4 V左右时,所有浓度的HQ溶液在此处出现了氧化峰(HQ本身具有还原性,在此处被氧化)。随着HQ浓度的上升,电流随之上升,5组浓度相比于空白组都有非常明显的电流变化,1~3 mmol/L HQ溶液的检测电流随着浓度的上升稳步上升,在3 mmol/L HQ浓度时达到最大,约为-1.30E-009 A(正负仅对应电流方向,与大小无关),当HQ溶液浓度为4,5 mmol/L时,电流相比于3 mmol/L HQ溶液出现了大幅上升,说明当HQ浓度为4,5 mmol/L时SECM的检测信号明显优于1~3 mmol/L的HQ溶液。5 mmol/L HQ溶液的电流强度相比于4 mmol/L HQ溶液增幅有限,变化并不明显,而且过高的HQ溶液浓度可能对后续试验中的菌膜造成破坏,检测电流过大也会对SECM仪器本身造成损耗,为减少仪器使用寿命[15],所以本试验将HQ的最佳检测浓度选为4 mmol/L,后续试验中所使用的HQ溶液浓度也是基于此次试验而统一选取为4 mmol/L。
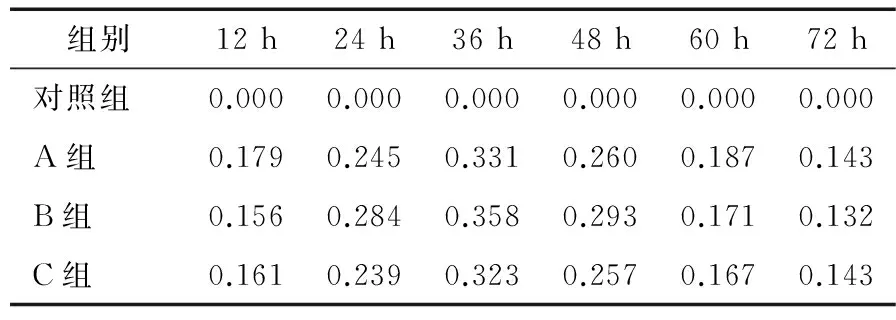
表1 菌膜形成过程中OD值变化表Table 1 The change of OD value in the process of bacterial membrance formation

图1 使用紫外分光光度仪在600 nm波长所得的菌膜 培养时间与吸光度曲线
Figure 1 Using the ultraviolet spectrophotometer at 600 nm wavelength obtained by the film culture time and absorbance curve
2.3 菌膜生长过程中过氧化氢酶的变化
将培养时间各异的金黄色葡萄球菌菌膜经过通风干燥处理后放入检测池中,加入0.8 mL的4 mmol/L的HQ溶液与0.8 mL的4 mmol/L的H2O2溶液,将扫描电压设为0~-0.8 V,做方波伏安曲线,每隔40 s做一次,记录20次方波伏安曲线,并取其峰值,制作峰值电流与时间的关系曲线[16]。
HQ与H2O2本身为小分子物质,而过氧化氢酶为胞内酶。菌膜经过干燥,不仅将菌膜固定在盖玻片实体表面上,使其在检测时会不随意移动甚至脱落,而且菌膜干燥后,菌膜与细菌本身细胞膜的通透性会发生变化,使得HQ与H2O2等小分子物质易于通过,过氧化氢酶本身分子较大不能通过细胞膜。HQ与H2O2进入金黄色葡萄球菌细胞后,在过氧化氢酶的催化下发生氧化还原反应,生成BQ,BQ经细菌细胞向胞外扩散,检测探针离菌膜很近,当BQ扩散出细胞后会很快进入检测探针前端的扩散层,BQ在外部提供电势的情况下,会被还原生成HQ,从而形成还原电流被SECM检测到[17]。反应公式:
HQ+H2O2→BQ+H2O,
(1)
BQ+2H++2e-→HQ。
(2)
所有时间段检测出的方波伏安曲线峰电流与时间的曲线见图3。

图3 菌膜不同培养时间段方波伏安曲线峰 电流与检测时间曲线Figure 3 Peak Current and Time Curve of Square Wave Voltammetry Curve of Different Culture Time
所有曲线的趋势都是开始上升较快,后基本维持稳定或稍有变化,其原因是HQ与H2O2经过扩散进入细菌中需要穿过菌膜与细胞膜,这本身就需要一定时间,生成的BQ从细胞中进入检测探针扩散层也需要一定时间,随着HQ等反应物的进入,生成BQ的速率也越来越快,检测电流成较快上升趋势,当反应物在细菌细胞中达到饱和时,反应速率基本恒定,检测电流增长速度也变慢,最终达到动态稳定。图3中曲线出现的不规律起伏与抖动主要是由外界的噪声所应起的,或检测池与溶液中存在少量杂质在检测过程中黏附在检测探针上[18]。
为了进一部对分析菌膜中过氧化氢酶与菌膜培养时间的关系,将所有培养时间段的菌膜方波伏安曲线峰电流取平均值,作出其与菌膜培养时间的关系曲线,见图4。
根据图4,当金黄色葡萄球菌培养4 h后,有少量的细菌黏附在了盖玻片的表面并开始形成菌膜,此时所检测到的电流为3.561,随着培养时间的上升,菌膜形成量也开始上升,检测电流出现缓慢上升,菌膜培养时间到16 h时,检测电流达到3.721E-009 A。但培养16~24 h时,菌膜的形成量上升,检测电流却大幅下降,在培养20 h时检测电流达到最低,为3.309E-009 A。培养24~36 h时,检测电流出现大幅上升,在36 h时达到最大为4.602E-009 A。培养36~48 h时,根据2.1(结晶紫染色法检测菌膜的生长情况)的试验可知,菌膜因为自身的分解与自溶现象,其形成量已经出现下降,此时检测电流由4.602E-009 A降至3.8E-009 A左右。

图4 菌膜方波伏安曲线峰电流平均值 与菌膜培养时间曲线Figure 4 The Mean Value of Peak Current and the Culture Time Curve of Vesicular Curve
对于培养16~24 h时,菌膜形成量上升,检测电流却下降的现象可以解释为:随着菌膜量的上升,菌膜细菌中过氧化氢酶的形成量也出现了上升,但是生物酶的活性与生物本身的状态以及生长时期有关,菌膜的形成本身也会减慢细菌的生长,使细菌的新陈代谢降低,细菌进入“冬眠”状态[19],其过氧化氢酶的活性也出现了下降,所以催化HQ与H2O2的反应速率不升反而下降,检测电流也就出现了下滑。
综上所述,结合2.1(结晶紫染色法检测菌膜的生长情况)试验,整个培养过程中过氧化氢酶的变化可以大致总结如下:在培养0~4 h时,金黄色葡萄球菌开始从浮游菌状态黏附在盖玻片表面;培养4~16 h时,黏附在盖玻片上的金黄色葡萄球菌开始形成菌膜,此时细菌中过氧化氢酶的也开始上升;培养16~24 h时,菌膜形成量继续上升,过氧化氢酶的量也继续上升,但因为细菌本身活性出现下降,过氧化氢酶活性也随即下降,此时过氧化氢酶活性下降对检测电流的影响大于过氧化氢酶量上升的影响;培养24~36 h时,菌膜的形成量上升,并在36 h左右时达到最大,过氧化氢酶的量也随之上升,在这个时间段中过氧化氢酶量上升对检测电流的影响大于过氧化氢酶活性下降的影响;培养时间大于36 h后,菌膜开始产生自溶与分解,菌膜的形成量开始下降,过氧化氢酶的量也开始下降,细菌本身随着培养时间的延长活性也同样出现了下降。
3 结论
本试验通过对金黄色葡萄球菌菌膜中过氧化氢酶的实时监测,并对不同培养时间段的菌膜所得到的检测峰电流作图分析,结果显示:菌膜形成过程中细菌中过氧化氢酶的量是随着菌膜量的上升而上升的,但过氧化氢酶的活性却受细菌本身的影响而下降。此次试验研究使用最新电化学手段SECM对金黄色葡萄球菌菌膜中过氧化氢酶的变化过程进行探索,为细菌菌膜中的氧化代谢活动研究提供了一定的理论依据与研究基础。但要使用SECM研究清楚金黄色葡萄球菌菌膜形成过程中的整个氧化代谢活动还需要做大量的工作:在金黄色葡萄球菌菌膜形成过程中,其过氧化氢酶也是随之上升的,但菌膜的形成本身会对细菌中酶的活性产生一定的影响,所以在整个变化过程中过氧化氢酶精确的数量变化还需要进一步的探索与研究;菌膜中细菌之间的氧化代谢信号分子传递对细菌的氧化代谢活动有着重要的意义,其信号分子具体对单个细菌中抗氧化酶有着怎样的影响也还有待进一步探究。
[1] ANNE A, CAMBRIL E, CHOVIN A, et al. Electrochemical Atomic Force Microscopy Using a Tip-Attached Redox Mediator for Topographic and Functional Imaging of Nanosystems[J]. ACS Nano, 2009, 3(10): 2 927-2 940.
[2] SERRAPEDE M, DENUAULT G, SOSNA M, et al. Scanning Electrochemical Microscopy: Using the Potentiometric Mode of SECM To Study the Mixed Potential Arising from Two Independent Redox Processes[J]. Analytical Chemistry, 2013, 85(17): 8 341-8 346.
[3] TSIONSKY M, ZHOU Jun-feng, AMEMIYA S, et al. Scanning Electrochemical Microscopy. 38. Application of SECM to the Study of Charge Transfer through Bilayer Lipid Membranes[J]. Analytical Chemistry, 1999, 71(19): 4 300-4 305.
[4] TSUCHIKAMA K, SHIMAMOTO Y, ANAMI Y. Truncated Autoinducing Peptide Conjugates Selectively Recognize and Kill Staphylococcus aureus[J]. ACS Infectious Diseases, 2017, DOI:10.1021/ACSINFECDIS.7b00013.
[5] VALOTTEAU C, PRYSTOPIUK V, PIETROCOLA G, et al. Single-Cell and Single-Molecule Analysis Unravels the Multifunctionality of the Staphylococcus aureus Collagen-Binding Protein Cna[J]. ACS Nano, 2008, 11(2): 2 160-2 170.
[6] 贾红岩, 崔婧, 王轶. 金黄色葡萄球菌感染的分布特征及耐药性分析[J]. 中华医院感染学杂志, 2013(1): 190-192.
[7] 李丽民, 吴先华, 徐礼锋. 金黄色葡萄球菌的临床分布及耐药性分析[J]. 中华医院感染学杂志, 2014(4): 787-789.
[8] 林沛茹, 梁志科, 陈惠玲, 等. 2007-2012年金黄色葡萄球菌的耐药性研究[J]. 中华医院感染学杂志, 2015(5): 975-977.
[9] 王俊瑞, 杜小莉, 塔拉, 等. 甲氧西林耐药/敏感金黄色葡萄球菌基因分型和毒力基因检测[J]. 中国感染与化疗杂志, 2015(1): 70-75.
[10] ASLAM R, LAVENTIE B-J, MARBAN C, et al. Activation of Neutrophils by the Two-Component Leukotoxin LukE/D from Staphylococcus aureus: Proteomic Analysis of the Secretions[J]. Journal of Proteome Research, 2013, 12(8): 3 667-3 678.
[11] BARA R, ZERFASS I, ALY A H, et al. Atropisomeric Dihydroanthracenones as Inhibitors of Multiresistant Staphylococcus aureus[J]. Journal of Medicinal Chemistry, 2013, 56(8): 3 257-3 272.
[12] JENNINGS M C, BUTTARO B A, MINBIOLE K P C, et al. Bioorganic Investigation of Multicationic Antimicrobials to Combat QAC-Resistant Staphylococcus aureus[J]. ACS Infectious Diseases, 2008, 1(7): 304-309.
[13] KIM S J, SINGH M, PREOBRAZHENSKAYA M, et al. Staphylococcus aureus Peptidoglycan Stem Packing by Rotational-Echo Double Resonance NMR Spectroscopy[J]. Biochemistry, 2013, 52(21): 3 651-3 659.
[14] LIANG Zhen-xing, AHN H S, BARD A J. A Study of the Mechanism of the Hydrogen Evolution Reaction on Nickel by Surface Interrogation Scanning Electrochemical Microscopy[J]. Journal of the American Chemical Society, 2017, DOI:10.1021/JACS.7b0027.
[15] LIN Ying-chi, ANDERSON M J, KOHLER P L, et al. Proinflammatory Exoprotein Characterization of Toxic Shock Syndrome Staphylococcus aureus[J]. Biochemistry, 2011, 50(33): 7 157-7 167.
[16] SOLIS N, PARKER B L, KWONG S M, et al. Staphylococcus aureus Surface Proteins Involved in Adaptation to Oxacillin Identified Using a Novel Cell Shaving Approach[J]. Journal of Proteome Research, 2014, 13(6): 2 954-2 972.
[17] ZOSKI C G, LUMAN C R, FERNNDEZ J L, et al. Scanning Electrochemical Microscopy. 57. SECM Tip Voltammetry at Different Substrate Potentials under Quasi-Steady-State and Steady-State Conditions[J]. Analytical Chemistry, 2007, 79(13): 4 957-4 966.
[18] VIMBERG V, KUZMA M, STODULKOVE, et al. Hydnocarpin-Type Flavonolignans: Semisynthesis and Inhibitory Effects on Staphylococcus aureus Biofilm Formation[J]. Journal of Natural Products, 2015, 78(8): 2 095-2 103.
[19] ZIGAH D, NOЁL J-M, LAGROST C, et al. Charge Transfer between Electroactive Species Immobilized on Carbon Surfaces by Aryl Diazonium Reduction. SECM Investigations[J]. The Journal of Physical Chemistry C, 2010, 114(7): 3 075-3 081.
Real-time Analysis of Hydrogen Peroxide in Staphylococcus aureus by SECM
(1.CollegeofFoodScienceandEngineering,CentralSouthUniversityofForestryandTechnology,Changsha,Hunan410004,China; 2.NationalEngineeringLaboratoryforRiceandBy-productDeepProcessing,Changsha,Hunan410004,China)
The typical bacterial membrane in the food industry (Staphylococcus aureus film) was chose to explore the single bacterial membrane in the formation of bacteria, and the production of their own activities with redox activity during the membrane formation and growth process was investigated. Comparing with the real-time changes of the bacterial membrane, the change of the redox activity was also studied to find the mechanism of controlling the bacterial pollution in the food industry. The real-time monitoring of catalase in Staphylococcus aureus membrane was carried out by analyzing the peak current obtained from the bacterial membrane of different culture periods. The results showed that the peroxidation of Staphylococcus aureus changes in the amount of catalase. The amount of catalase in the bacteria increases with the increase of the amount of bacterial membrane, and decreases with the autolysis of the membrane. This study would provide a theoretical and research basis for the study of oxidative metabolism in Staphylococcus aureus.
Staphylococcus aureus; bacterial membrane; catalase; SECM
10.13652/j.issn.1003-5788.2017.04.008

