四种不同接触表面蜡样芽孢杆菌菌膜形成的影响
夏俊芳,卢 岩,古丽娜孜,马 瑶,木丽登,禹 凯,刘 霞,李晓燕,王 威,张亚南,武 运
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
蜡样芽孢杆菌(Bacilluscereus,简称B.cereus)为革兰氏阳性杆菌,产芽孢,在多种食品(乳制品、蔬菜、大米和肉类)中极易检出[1],该菌可引起恶心、呕吐、腹痛和腹泻等胃肠道疾病[2],严重时还会造成其他病原的机会性感染从而引发败血症、肺炎和脑膜炎等疾病[3]。B.cereus引起的食物腐败是食品行业的主要威胁,例如其在巴氏消毒和制冷过程中能够存活的孢子易使牛奶和牛奶制品造成污染[4]。在食品加工环境中,B.cereus在多种接触表面(输送带、不锈钢管和储罐)形成菌膜[5]严重危害食品安全,成为潜在的污染产品和再污染源[6]。菌膜(biofilm)是附着于细菌群落表面的胞外多聚物(Extracellular polymeric substance,EPS)[7]。菌膜的形成是一种非常复杂的动态过程,主要包括五个阶段:初始可逆附着期,浮游细菌附着于材料表面;不可逆粘附期,菌体分泌EPS形成微团聚集物;菌膜初步形成期,具有一定空间结构的细菌聚集体;菌膜成熟期,空间结构成熟稳定;主动分散期,细菌或小部分菌膜分离并重新附着到新的表面[8]。初始可逆附着期和不可逆粘附期对菌膜形成是至关重要的阶段,因为这两个阶段主要完成浮游菌附着在载体表面以启动菌膜的循环生成任务,所以菌膜的形成与菌体及附着材料的表面特性密切相关,且食品加工环境中丰富的营养成分和有机成分非常有利于菌膜形成,因此研究不同温度、时间、糖、盐、pH、防腐剂等诸多因素对于食品工业不同加工设备表面类型菌膜形成的影响及建立菌膜定点清洁(CIP)提供参考。
目前,关于B.cereus菌膜形成影响因素的研究多集中与不锈钢[9-10]、玻璃[11]等单一接触材料对B.cereus菌膜形成的影响分析,缺乏食品加工环境因子影响的相关研究。因此,本文以B.cereus为受试菌,以食品工业常用的四种接触面材料为载体,采用超声波平板菌落计数法测定各种环境条件下(不同的温度、pH、氯化钠、葡萄糖、苯甲酸钠、山梨酸钾等)不同材料表面B.cereus菌膜形成变化趋势,为食品工业B.cereus菌膜的预防和控制奠定基础,B.cereus风险评估提供基础数据,改进B.cereus的清洗控制措施提供参考。
1 材料与方法
1.1 材料与仪器
蜡样芽孢杆菌(CMCC63303) 上海理工大学医疗器械与食品学院微生物实验室;营养琼脂培养基、LB肉汤培养基 北京陆桥生物技术有限公司;山梨酸钾、苯甲酸钠、氯化钠、葡萄糖、硫酸、氢氧化钠等 分析纯,天津市盛淼精细化工有限公司;不锈钢(SS)(食品级304,10 mm×10 mm) 深圳市华昌五金模具有限公司;聚氯乙烯(PVC)(10 mm×10 mm)、聚丙烯(PPR)(10 mm×10 mm) 深圳海诺塑胶有限公司;玻璃片(Glass)(10 mm×10 mm) 盐城市飞舟玻塑有限公司。
SK2200H超声波清洗器 上海科导超声仪器有限公司;FE20 PLUS pH计 上海梅特勒托利多仪器有限公司;LDZX-40SCI 型高压灭菌锅 上海早安医疗器械厂;LHS-150SC恒温培养箱 上海森信实验仪器有限公司;FA2104N 电子天平 上海民桥精密科学仪器有限公司仪器有限公司。
1.2 实验方法
1.2.1 菌悬液的制备 将B.cereus标准菌株用LB肉汤30 ℃培养18 h后取1 mL纯菌液,用无菌蒸馏水依次按10-1~10-7倍比稀释,共7个浓度梯度(依次标记为1~7号)。取1~7号梯度菌液1 mL加入15 mL的融化并冷却到45 ℃左右无菌营养琼脂培养基,冷凝后于30 ℃恒温培养箱内培养24 h后进行平板计数(各梯度纯菌悬液分别设3个重复,并计算三个重复的计数平均值),1~7号梯度菌液计数结果分别为2.3×108~2.3×102CFU/mL,于4 ℃冰箱中贮存备用。
1.2.2 载体的清洗 将载体材料不锈钢片(SS)、聚氯乙烯片(PVC)、聚丙烯片(PPR)、玻璃片(Glass)用洗涤剂清洗,置于丙酮中超声15 min,除去表面油脂,再用蒸馏水冲洗干净后置于75%的乙醇浸泡30 min,蒸馏水冲净,烘干后灭菌备用。然后放入装有10 mL LB肉汤的15 mm×150 mm试管中,灭菌备用。
1.2.3 菌膜的培养 将10 mL LB肉汤培养基和载体片(均已灭菌)放入灭菌培养皿中,接入0.1% 的1.0×108CFU/mLB.cereus菌悬液,混合均匀,30 ℃培养,连续培养,隔天换液。
1.2.4B.cereus菌膜活菌计数 前处理及超声:去除培养24 h菌膜的培养液,用无菌磷酸缓冲溶液反复冲洗,洗去浮游菌,再取10 mL无菌磷酸缓冲液加入到试管中,并用超声波清洗仪(振荡频率为45 Hz)处理15 min。稀释及培养:从经过超声波清洗仪处理后的试管中吸取1 mL菌液,沿管壁慢慢注入含有9 mL无菌水的试管内,摇匀,梯度稀释后制成10-3、10-4、10-5稀释度的菌悬液,各取1 mL,分别加入培养皿内(每个稀释度做3个培养皿),再向培养皿中倾注约15 mL融化并冷却到45 ℃左右无菌营养琼脂培养基,冷凝后,于30 ℃恒温培养箱内培养24 h后取出,进行活菌计数。
总菌落数(lgCFU/cm2)=(同一稀释度3个平皿上的菌落平均数×稀释倍数×10)/载体片的面积
1.2.5B.cereus菌膜生长曲线的绘制 将11个载体片分别放入装有10 mL LB肉汤培养基的试管中,灭菌后,冷却至室温,分别接入0.1% 的1.0×108CFU/mL的B.cereus菌悬液,将试管放在30 ℃的培养箱中培养2、4、6、8、10、12、16、20、24、48、72 h后,对菌膜进行活菌计数。
1.2.6 不同因素对B.cereus菌膜形成的影响分析 四种材质片为载体材料,以B.cereus菌膜的活菌数Lg(CFU/cm2)为指标,考察各因素(温度、pH、葡萄糖、氯化钠、防腐剂)对B.cereus菌膜形成的影响。
1.2.6.1 不同温度对B.cereus菌膜形成的影响 把载体片分别放入装有10 mL LB培养基(pH7.0)的试管中,加入0.1 mL初始菌悬液浓度1.0×108CFU/mL的B.cereus菌悬液分别在4、25、30、50、60、70 ℃条件下培养24 h,进行B.cereus菌膜活菌数的测定。
1.2.6.2 不同酸碱对B.cereus菌膜形成的影响 把载体片分别放入pH为3.0、5.0、7.0、9.0、11.0的10 mL LB培养基试管中灭菌,然后加入0.1 mL初始菌悬液浓度1.0×108CFU/mL的B.cereus菌悬液,在30 ℃条件下培养24 h,进行B.cereus菌膜活菌数的测定。
1.2.6.3 不同葡萄糖浓度对B.cereus菌膜形成的影响 把载体片分别放入不同质量分数为0%、2.0%、4.0%、6.0%、8.0%、10.0%葡萄糖的10 mL LB培养基(pH7.0)试管中灭菌,然后加入0.1 mL初始菌悬液浓度1.0×108CFU/mL的B.cereus菌悬液,在30 ℃条件下培养24 h,进行B.cereus菌膜活菌数的测定。
1.2.6.4 不同氯化钠浓度对B.cereus菌膜形成的影响 把载体片分别放入NaCl浓度分别为0%、0.5%、4.0%、6.0%、8.0%、10.0%、12.0%的10 mL LB培养基(pH7.0)试管中灭菌,然后加入0.1 mL初始菌悬液浓度1.0×108CFU/mL的B.cereus菌悬液,在30 ℃条件下培养24 h,进行B.cereus菌膜活菌数的测定。
1.2.6.5 不同防腐剂浓度对B.cereus菌膜形成的影响 把载体片分别放入不同质量分数为0%、0.02%、0.05%、0.10%、0.15%的食品防腐剂(苯甲酸钠、山梨酸钾)的10 mL LB培养基(pH7.0)试管中灭菌,然后加入0.1 mL初始菌悬液浓度1.0×108CFU/mL的B.cereus菌悬液,在30 ℃条件下培养24 h,进行B.cereus菌膜活菌数的测定。
1.3 数据处理
每个实验重复3次,数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序,差异显著性(p<0.05)分析使用Tukey HSD程序,采用Excel 2007整理实验数据,作图。
2 结果与分析
2.1 B.cereus菌膜生长曲线
如图1所示,相同时间内,四种材质表面形成B.cereus菌膜能力的大小顺序为:玻璃(Glass)>不锈钢(SS)>聚氯乙烯(PVC)>聚丙烯(PPR),四种不同材质菌膜粘附数量差异显著(p<0.05),表明亲水性介质更有利于B.cereus菌膜的生成。而通常认为菌体在亲水性表面的粘附能力弱于其在疏水表面[12],但Na等[13]发现B.cereus具有高水平疏水性却是低水平的菌膜形成量,Auger等[14]发现B.cereus菌膜形成量与菌株疏水性没有相关性,Esther等[15]发现B.cereus菌体是疏水的且不易结合于疏水材料上。在本研究中玻璃和不锈钢表面菌膜形成量较大,可能是因为表面较粗糙,较多无机物更容易粘附细菌形成菌膜,且B.cereus菌膜胞外分泌物中亲水性物质较多,易在亲水玻璃表面形成菌膜。
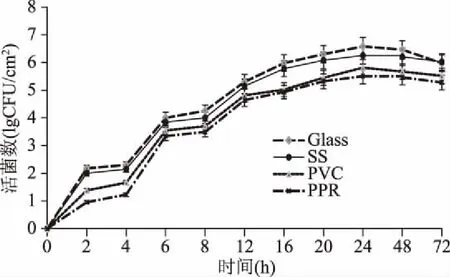
图1 B.cereus菌膜形成数随时间的变化
四种材料表面B.cereus菌膜的生长趋势大致一致,随着培养时间的增加,菌膜的生物量不断增加,培养初期(0~2 h)时,菌体开始粘附于接触表面,数量逐渐增长,此阶段为B.cereus在载体的初始可逆附着期;6~8 h,菌体与接触面相互作用菌膜不断生成,为菌膜的不可逆粘附期;12~24 h时,菌膜基本形成并趋向成熟,24 h时达最高值:玻璃材质活菌数为6.30 lg(CFU/cm2)、不锈钢材质活菌数为6.07 lg(CFU/cm2)、聚氯乙烯材质活菌数为5.45 lg(CFU/cm2)、聚丙烯材质活菌数为5.32 Lg(CFU/cm2);24~48 h,随着培养时间的增加,菌膜生物量增长平稳,为菌膜成熟阶段;48~72 h,随着培养时间的延长,菌膜形成量反而减少,为菌膜主动分散阶段。表明24 h为B.cereus菌膜的形成阶段,这与Wijman等[16]对B.cereus菌膜形成的研究结果一致(24 hB.cereus表现出显著菌膜形成而48 h后逐渐产生菌膜分散体),故后续实验选择24 h作为菌膜培养时间。
2.2 不同因素对B.cereus菌膜形成的影响分析
2.2.1 不同温度对B.cereus菌膜形成的影响 由图2可知,接触面材料对B.cereus菌膜的形成具有显著影响(p<0.05),在相同温度下,四种材质表面形成B.cereus菌膜能力的大小顺序为:玻璃(Glass)>不锈钢(SS)>聚氯乙烯(PVC)>聚丙烯(PPR)。B.cereus菌膜的形成量显著依赖于培养温度(p<0.05),30 ℃生长状况明显优于其他温度(4、25、50、60及70 ℃),30 ℃时,四种材质表面菌膜的活菌数均达到最高,玻璃材质表面为6.58 lg(CFU/cm2),不锈钢材质表面为6.17 lg(CFU/cm2),聚氯乙烯材质表面为5.88 lg(CFU/cm2),聚丙烯材质表面为5.44 lg(CFU/cm2),30 ℃也是浮游态B.cereus的最适生长温度。60及70 ℃时,四种接触面菌膜形成量为0 lg(CFU/cm2)。塑料材质(PVC、PPR)在4 ℃菌膜形成量高于50 ℃(p<0.05),而玻璃(Glass)、不锈钢(SS)材质在50 ℃菌膜形成量高于4 ℃(p<0.05),表明不同接触面对低温(4 ℃)、高温(50 ℃)的菌膜形成量有差异,所以对于不同材质要制定不同的定点清除措施。

图2 不同培养温度对B.cereus形成数的影响
2.2.2 不同pH对B.cereus菌膜形成的影响 由图3可知,不同pH对四种材质表面的菌膜形成量的影响有显著差异(p<0.05),pH7.0>pH5.0>pH9.0>pH11.0>pH3.0,在pH为7.0时,不同材质的菌膜形成量亦有显著性差异(p<0.05),大小顺序为:玻璃(Glass)>不锈钢(SS)>聚氯乙烯(PVC)>聚丙烯(PPR),这与Esther[15]实验结果类似,pH为6.8 的LB培养液B.cereus菌膜形成量是LB培养液菌膜形成量的2.5倍。在本实验中pH在3.0~7.0时,菌膜形成数随 pH增加呈不断上升趋势,当pH在7.0~11.0 时,菌膜形成数明显下降(p<0.05),说明在B.cereus菌膜形成中pH起到决定性作用。
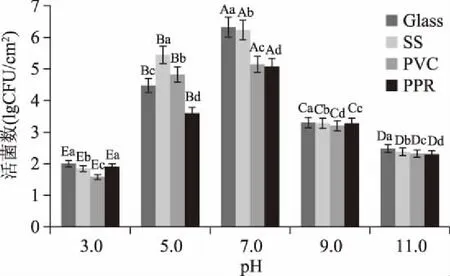
图3 不同pH对B.cereus菌膜形成数的影响
2.2.3 不同葡萄糖浓度对B.cereus菌膜形成的影响 如图4所示,添加一定浓度(<10.0%)葡萄糖的四种材质表面菌膜形成量均大于不添加葡萄糖的菌膜形成量(p<0.05),大小顺序为:玻璃(Glass)>不锈钢(SS)>聚氯乙烯(PVC)>聚丙烯(PPR)。整体来看,添加葡萄糖有利于B.cereus菌膜形成,即营养丰富的生长培养基可以增强菌膜形成[17],当添加量为4.0%时B.cereus菌膜形成量最大,玻璃材质表面为7.48 lg(CFU/cm2),不锈钢材质表面为7.33 lg(CFU/cm2),聚氯乙烯材质表面为6.50 lg(CFU/cm2),聚丙烯材质表面为6.38 lg(CFU/cm2),显著高于0.0%葡萄糖浓度的各材质表面B.cereus菌膜形成量(p<0.05)。这可能是由于加入一定浓度的葡萄糖,不仅提高培养液的营养浓度,而且适当降低了体系pH,使得B.cereus菌膜形成量增大[18]。但当浓度超过4.0%时,菌膜形成量反而降低,即高浓度的葡萄糖产生高渗透压,抑制B.cereus菌膜的形成。这与Minyeong K等[1]报道的葡萄糖对B.cereus菌膜研究结果一致。
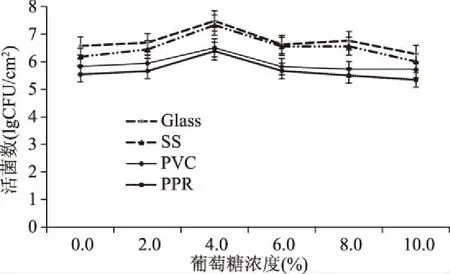
图4 B.cereus菌膜形成数随葡萄糖浓度的变化
2.2.4 不同NaCl浓度对B.cereus菌膜形成的影响 由图5可知,NaCl对B.cereus菌膜形成量的影响,添加0.5% NaCl显著促进了四种材质表面菌膜的形成(p<0.05),但随着NaCl添加量的增加,B.cereus菌膜形成量逐渐降低,超过4.0% NaCl浓度的B.cereus菌膜形成量均显著小于未添加NaCl的菌膜形成量(p<0.05),且随着NaCl浓度的增大,菌膜形成量逐渐降低,这与Rode等[19]研究结果一致。表明高浓度的NaCl对菌膜形成有抑制作用,这可能是由于高浓度NaCl造成水分活度的下降,破坏了正常细胞功能,造成菌膜形成量的减少,而低浓度NaCl对水分活度无明显影响,低渗环境对菌膜形成有利。
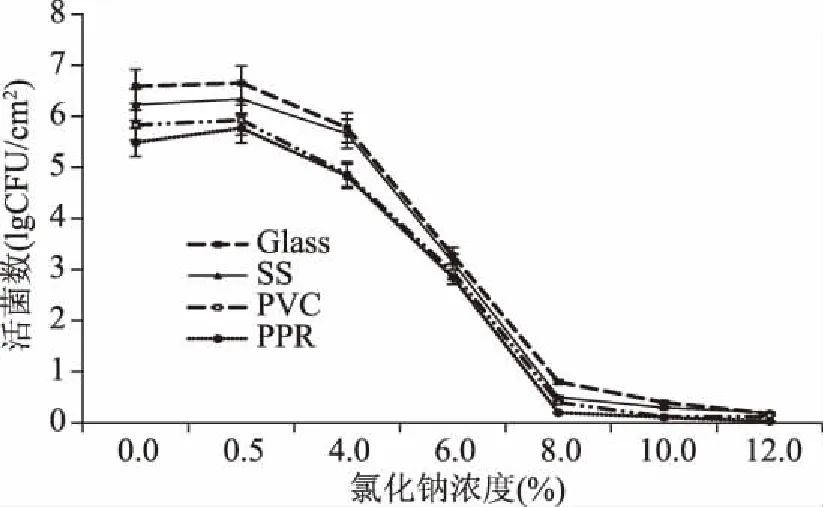
图5 B.cereus菌膜形成数随氯化钠浓度的变化
2.2.5 不同防腐剂浓度对B.cereus菌膜形成的影响 苯甲酸钠(pH2.5~4.0)在食品中的限量值为0.2~1.0 g/kg,山梨酸钾(pH5.0~6.0)在食品中的限量值0.2~2.0 g/kg,由图6~图7可知,不同防腐剂对四种材质表面形成B.cereus菌膜能力的影响有显著差异(p<0.05),大小顺序为:玻璃(Glass)>不锈钢(SS)>聚氯乙烯(PVC)>聚丙烯(PPR)。由图6可知,不同浓度的苯甲酸钠的四种材质表面菌膜形成量均是0%>0.02%>0.15%>0.05%>0.10%。由图7可得,对于玻璃、不锈钢材质,不同浓度的山梨酸钾的B.cereus菌膜形成量0%>0.02%>0.05%>0.15%>0.10%,对于塑料材质(PVC、PPR),不同浓度的山梨酸钾的B.cereus菌膜形成量0%>0.02%>0.15%>0.05%>0.10%,可见,较高浓度(0.15%)山梨酸钾、苯甲酸钠菌膜形成量显著高于较低浓度(0.10%)苯甲酸钠、山梨酸钾菌膜形成量(p<0.05)。这可能是因为防腐剂对浮游细胞有防腐杀菌效果但却对菌膜细胞无根除作用,而当高浓度的非致死浓度的防腐剂更容易增强菌膜对防腐剂的耐受性(据Belessi等[20],Bonez等[21]研究发现菌膜对消毒产品的抵抗力是浮游细胞的1000倍),由此会形成更多的菌膜从而导致防腐失败,对食品工业带来更为严重的安全问题。因此,定期清洁和消毒是目前预防菌膜污染的主要策略[22]。

图6 苯甲酸钠对B.cereus菌膜形成数的影响

图7 山梨酸钾对B.cereus菌膜形成数的影响
3 结论与讨论
B.cereus可在多种材质(玻璃、不锈钢、聚氯乙烯、聚丙烯)表面形成菌膜,四种材质表面形成B.cereus菌膜能力的大小顺序为:玻璃(Glass)>不锈钢(SS)>聚氯乙烯(PVC)>聚丙烯(PPR)(p<0.05)。本研究中玻璃和不锈钢表面菌膜形成量较大,亲水表面比疏水表面更易形成B.cereus菌膜。同时在多种食品加工环境因素的影响下也能形成B.cereus菌膜,温度因素:低温4 ℃,中温25、30 ℃,高温50 ℃均能形成菌膜,其中30 ℃时菌膜形成量最大,此温度也是浮游菌生长的最佳温度;酸碱因素:四种接触材料在pH(3.0、5.0、7.0、9.0、11.0)都可形成B.cereus菌膜,其中pH为7.0时四种材料表面菌膜形成量最大,pH对B.cereus菌膜的形成具有显著影响作用;葡萄糖因素:添加葡萄糖有利于B.cereus菌膜形成,4.0%葡萄糖浓度四种接触材料表面菌膜形成量显著增加(p<0.05),当浓度超过4.0%时,菌膜形成量降低,即高浓度的葡萄糖产生高渗透压,抑制B.cereus菌膜的形成;NaCl因素:添加低浓度的NaCl(0.5%)对B.cereus形成有促进作用而高浓度的NaCl(大于4.0%)对菌膜形成抑制作用明显;防腐剂因素:在食品可添加的最高限量防腐剂浓度下,B.cereus在四种材质表面均能形成菌膜,使用0.15%防腐剂B.cereus菌膜形成量高于0.10%防腐剂的菌膜形成量(p<0.05)。
因此,为避免菌膜对食品工业的污染要制定菌膜控制策略。主要从以下几个方面着手:防止菌体与任一表面之间的粘附形成菌膜,食品企业应多选择疏水材料或通过材料改性例如超疏水表面材料,已经发现在预防细菌附着和菌膜形成方面有效,如铜绿假单胞菌和金黄色葡萄球菌[23-24];材料表面加入抗菌剂涂层,例如抗菌肽、精油、酶剂等涂覆表面杀灭抑制菌体以预防菌膜形成[25-26]。目前,定期清洁和消毒是防止菌膜形成的主要策略,食品工业中,在细菌初始粘附接触面就进行迅速全面清洁,在菌膜成熟前及时清除,会大大降低食品安全的隐患。
[1]Minyeong Kwon,Mohammad Shakhawat Hussain,Deog Hwan Oh. Biofilm formation ofBacilluscereusunder food-processing-related conditions[J]. Food Science and Biotechnology,2017,26(4):1103-1111.
[2]Kotiranta A,Lounatmaa K,Haapasalo M. Epidemiology and pathogenesis ofBacilluscereusinfections[J]. Microbes and Infection,2000,2(2):189-198.
[3]Hoffmaster AR,Hill KK,Gee JE,et al. Characterization ofBacilluscereusisolates associated with fatal pneumonias:Strains are closely related toBacillusanthracisandHarborB.anthracisvirulence genes[J]. Journal of Clinical Microbiology,2006,44(9):3352-3360.
[4]Meer RR.,Baker J,Bodyfelt FW,et al. PsychrotrophicBacillus591spp. in fluid milk products:A review[J]. Journal of Food Protection,1991,54(12):969-979.
[5]Hussain MS,Oh DH. Substratum attachment location and biofilm formation byBacilluscereusstrains isolated from different sources:Effect on total biomass production and sporulation in different growth conditions[J]. Food Control,2017,77:270-280.
[6]Srey S,Jahid IK,Ha S Do. Biofilm formation in food industries:A food safety concern[J]. Food Control,2013,31:572-585.
[7]Costerton JW,Stewart PS,Greenberg EP. Bacterial biofilms:Acommon cause of persistent infections[J]. Science,1999,284:1318-1322.
[8]Costerton JW,Davies DG,Stoodley P. Biofilms as complex differentiated communities[J]. Annual Review Microbiology,2002,56:187-209.
[9]李南薇,何佩倩,杜冰,等. 培养条件对蜡样芽孢杆菌生物被膜生长的影响[J]. 食品工业,2012,33(7):108-110.
[10]马悦,吴谦,吴希阳,等. 培养条件及接触材料对大米中蜡样芽孢杆菌生物被膜形成的影响[J]. 食品与发酵工业,2015,41(12):64-68.
[11]夏俊芳,刘霞,李晓燕,等. 胁迫因素对玻璃表面蜡样芽孢杆菌菌膜形成的影响分析[J]. 食品工业科技,2017,38(7):105-110.
[12]Donlan RM.Biofilms:microbial life on surfaces[J]. Emerging Infectious Diseases,2002,8(9):881-890.
[13]Na-Young Choi,Young-Min Bae,Sun-Yong Lee. Cell surface properties and biofilm bormation of pathogenic bacteria[J]. Food Science and Biotechnology,2015,24(6):2257-2264.
[14]Auger S,Ramarao N,Faille C,et al. Biofilm formation and cell surface properties among pathogenic and nonpathogenicstrains of theBacilluscereusgroup[J]. Applied and Environmental. Microbiology,2009,75(20):6616-6618.
[15]Esther Karunakaran CA Biggs. Mechanisms ofBacilluscereusbiofilm formation:an investigation of the physicochemical characteristics of cell surfaces and extracellular proteins[J]. Applied Microbiol Biotechnology,2011,89(4):1161-1175.
[16]Wijman JGE,De Leeuw PPLA,Moezelaar R,et al. Air-liquid interface biofilms ofBacilluscereus:Formation,sporulation,and dispersion[J]. Applied and environmental microbiology,2007,73(5):1481.
[17]Marwan Abdallah,Corinne Benoliel,Djamel Drider,et al. Biofilm formation and persistence on abiotic surfaces in the context of food and medical environments[J]. Archives of Microbiology,2014,196(7):453-472.
[18]Gao T,Foulston L,Chai Y,et al. Alternative modes of biofilm formation by plant-associatedBacilluscereus[J]. Microbiology Open,2015,4(3):452-464.
[19]Rode T M,Langsrud S,Holck A,et al.Different patterns of biofilm formation inStaphylococcusaureusunder food-related stress conditions[J]. International Journal of food Microbiology,2007,116(3):372-383.
[20]Belessi CEA,Gounadaki AS. Efficiency of different sanitation methods on Listeria monocytogenes biofilms formed under various environmental conditions[J]. International Journal of Food Microbiology,2011,145 Suppl 1(1):S46.
[21]Bonez PC,Santos CF,Dalmolin TV,et al. Chlorhexidine activity against bacterial biofilms[J]. Amerian Journal of Infection Control,2013,41(12):119-22.
[22]Simões M,Simões LC,Vieira MJ.A review of current andemergent biofilm control strategies[J]. LwT-Food Science Technology,2010,43:573-583.
[23]Peifu Tang,Wei Zhang,Yan Wang,et al. Effect of superhydrophobic surface of titanium on Staphylococcus aureus adhesion[J]. Journal of Nanomaterials,2011(20):3385-3385.
[24]Loo CY,Young PM,Lee WH,et al. Superhydrophobic,nanotextured polyvinylchloride films for delayingPseudomonasaeruginosaattachment to intubation tubes and medical plastics[J].Acta Biomaterialia,2012,8(5):1881-1890.
[25]Glinel K,Thebault P,Humblot v,et al. Antibacterial surfaces developed from bioinspired approaches[J]. Acta Biomaterialia,2012,8(5):1670-1684.
[26]Karam L,Jama C,Dhulster P,et al. Study of surface interactions between peptides,materials and bacteria for setting up antimicrobial surfaces and active food packaging[J]. Journal of Materials and Environmental Science,2013,4(5):798-821.

