血液滤过联合动脉灌流对重症急性胰腺炎患者生化指标和T淋巴细胞亚群表达水平的影响
王 健, 李荣军, 徐春霞, 赵 平, 李 炎, 付 丽, 罗 彦
(四川省泸州市中医院, 1. 脾胃病科; 2. 重症医学科, 四川 泸州, 646000)
血液滤过联合动脉灌流对重症急性胰腺炎患者生化指标和T淋巴细胞亚群表达水平的影响
王 健1, 李荣军1, 徐春霞1, 赵 平1, 李 炎1, 付 丽1, 罗 彦2
(四川省泸州市中医院, 1. 脾胃病科; 2. 重症医学科, 四川 泸州, 646000)
血液滤过联合动脉灌流; 重症急性胰腺炎; 生化指标; T淋巴细胞亚群
急性胰腺炎为一种消化系统急腹症,主要临床症状有胰腺水肿、胰腺出血、胰腺坏死及其他功能器官功能不全[1-2]。研究[3]统计,目前临床上约有20%的急性胰腺炎患者可发展为重症急性胰腺炎(SAP), 而SAP治疗不及时则会导致多器官功能障碍,严重时造成患者死亡[4]。研究[5-7]认为体内细胞因子变化水平与急性胰腺炎的诊断、发展以及预后情况有一定相关性。本研究采用血液滤过联合动脉灌流法对本院SAP患者进行治疗,同时检测SAP患者生化指标及T淋巴细胞亚群表达水平,探讨血液滤过联合动脉灌流疗法有效性,现报告如下。
1 资料与方法
选取2014年11月—2015年11月在本院就诊的SAP患者92例,其中男 42例,女 50例,平均年龄为(40.33±10.29)岁。入选标准: ① 所有患者均进行影像学检查、血清淀粉酶检测以及临床体征与临床症状观察,检查结果均符合2003年中华医学会消化病学分会胰腺疾病学组制定的“急性胰腺炎诊治指南”的诊断标准[8]。② 所有患者除符合“急性胰腺炎诊治标准”外,其急性生理学与慢性健康状况(APACHEII)评分不小于8分。以上入选者均对本研究知情,并自愿签署知情同意书。实验前对患者一般生命体征等进行检查,排除严重血液系统疾病者、有恶性肿瘤者、感染性疾病者以及近期服用过可影响血清生化指标及T淋巴细胞亚群表达水平检测的药物者。采取数字随机分组法将患者分为对照组与观察组各46例。对照组采用传统方法进行治疗,观察组采用血液滤过联合动脉灌流进行治疗。2组患者性别、年龄、入院当天APACHEII评分、发病到入院时间、病因、体内生化指标水平、体温、呼吸以及心率等基础资料比较,差异均无统计学意义(P>0.05), 具有可比性。见表1。

表1 2组患者基线资料比较
患者入院后1~2 d内放置鼻肠管,同时根据病情对患者进行肠内营养治疗及通便。在治疗期间对患者均进行常规禁食,给予抑酸治疗,维持水、电解质平衡,胃肠减压以及营养支持等; 出现呼吸衰竭的患者则采用机械通气; 出现胰腺的坏死组织发生感染者,则立即采取手术治疗。
对照组则在上述治疗基础上采用常规静脉输注治疗,输注药物包括:奥硝唑(中国药科大学制药有限公司生产,批号: 211987) 500 mg, 1次/d; 丹参酮(昆明科翔生物科技有限公司生产,批号: 200754) 20 mL, 1次/d; 地塞米松(郑州卓峰制药有限公司生产,批号: 039816) 5 mg, 2次/d; 乌司他丁(广东天普生化医药股份有限公司,批号: 720034) 20 万 U, 2次/d; 生长抑素[上海华源药业(宁夏)沙赛制药有限公司,批号:200497] 3 mg, 2次/d; 头孢他啶(哈药集团制药总厂,批号: 201163) 2 g, 3次/d。
观察组在一般治疗的基础上,于患者确诊后4 h内进行区域动脉灌注。在放射可介入条件下,采用Seldinger 法经患者股动脉进行穿刺,以患者胰腺炎症及坏死发生的部位和大小为指导,选择置入Cobra导管还是5F 的单弯导管。将所选导管置于胃十二指肠动脉及末梢或者腹腔动脉、脾动脉的动脉管中,并在置管成功后将导管固定在穿刺位,用输液泵将药物从导管末端输入患者体内,所输药物种类及剂量与对照组完全一致。此外,为进行床旁血液的净化治疗,在连续整天给予观察组患者连续性静脉-静脉血液的滤过。以上灌注治疗时长为7 d, 在治疗期间时刻关注患者灌注导管的通畅情况,且在拔管7 d后对导管的尖端进行细菌的培养,验证是否存在细菌。
1.4 观察指标
① 检测血清中相关炎性指标TNF-α、CRP以及IL-6: 各组患者在入院时及治疗后第60天,清晨采集静脉血 4~5 mL, 血清中TNF-α及IL-6水平采用ELISA法进行检测, CRP则采用免疫比浊法检测。② T淋巴细胞亚群表达水平指标检测:各组患者在入院时及治疗后第1、7、14天清晨采集静脉血 2~3 mL, 采用免疫荧光法检测血清中CD8+、CD4+以及CD3+。
2 结 果
2组患者TNF-α、CRP、IL-6等炎症因子水平随着治疗时间的延长有逐渐下降的趋势,与对照组相比,观察组治疗后第7、14天TNF-α、CRP、IL-6水平均显著偏低(P<0.05), 见表2。2组患者体T淋巴细胞亚群(CD4+、CD4+/CD8+、CD3+)表达水平随着治疗时间的延长有逐渐上升的趋势,与对照组相比,观察组治疗后第7、14天T淋巴细胞亚群(CD4+、CD4+/CD8+、CD3+)表达水平均显著偏高(P<0.05), 见表3。
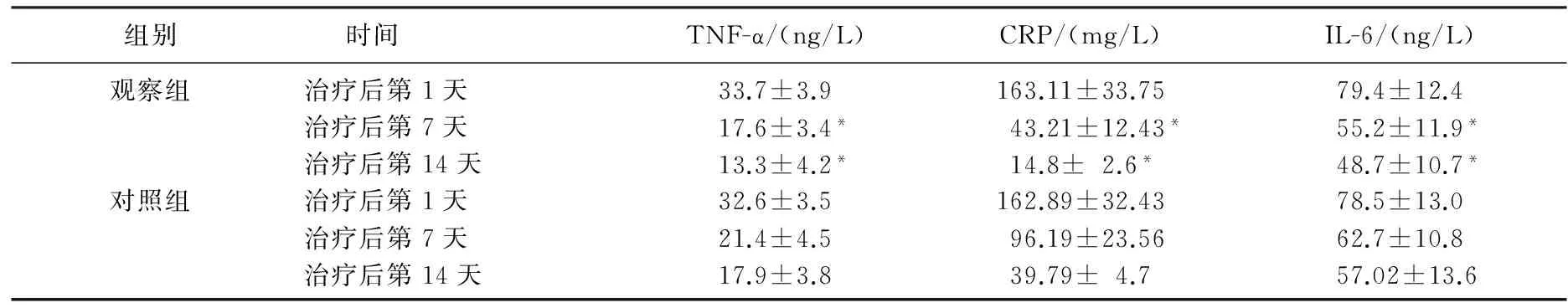
表2 2组患者治疗前后生化指标差异比较
与对照组比较, *P< 0.05。

表3 2组患者治疗后T淋巴细胞亚群表达水平比较
与对照组比较, *P< 0.05。
3 讨 论
根据有关报道[9-10], 酒精、胆道结石、高脂血症等原因可导致人体胰腺内胰酶的激活,进而引发胰腺组织出现自身消化、胰腺出血、胰腺水肿及胰腺坏死等一系列炎症反应。该类疾病又根据病情轻重分为轻症急性胰腺炎以及SAP。其中SAP患者多出现胰腺大面积坏死,大量炎症介质的释放导致的炎症反应,同时导致瀑布样级联反应的发生,并且伴有全身多处器官功能的障碍。因此, SAP的发生发展又与炎症反应密不可分。研究[11]发现, SAP 早期患者肺器官中TNF-α 水平较健康志愿者明显偏高,且TNF-α 水平的高低与患者体内炎症反应情况及疾病的预后关系密切; 此外, IL-6水平在急性胰腺炎早期也出现上调,能够与TNF-α协同诱导免疫损伤,加重患者全身炎症反应[12]。
急性胰腺炎状态下,巨噬细胞被激活并释放炎症介质,导致细胞因子系统。因此,使用阻断过量炎性因子释放逐渐成为治疗 SAP的研究热点和新切入点。血液滤过联合动脉灌流疗法不仅可以清除过多的炎性因子与炎性细胞介质,同时能够,调节促/抗炎反应的平衡,防止因SAP引发的多器官功能不全综合征的发生[13]。本研究结果显示,观察组治疗7、14 d 后,体内TNF-α、CRP、IL-6等炎症因子水平明显降低,且随着治疗时间的延长,炎性因子降低水平越明显。与同时间段对照组相比,观察组患者体内TNF-α、CRP、IL-6等炎性因子水平显著偏低(P<0.05), 证实了血液滤过联合动脉灌流法能够有效调节体内炎症水平。
本研究发现,观察组患者治疗7、14 d后,体内CD4+、CD4+/CD8+以及CD3+等T淋巴细胞亚群表达水平显著升高,与对照组相比,差异有统计学意义(P<0.05)。
[1] Razavi D, Lindblad M, Bexelius T, et al. Polypharmacy and risk of acute pancreatitis[J]. Pharmacoepidemiol Drug Saf, 2016, 25(11): 1337-1341.
[2] Maheshwari R, Subramanian R M. Severe acute pancreatitis and necrotizing pancreatitis[J]. Crit Care Clin, 2016, 32(2): 279-290.
[3] Kirchner J, Lorenz F, Vlahovic J, et al. Spontaneously reversible portal vein thrombosis complicating acute pancreatits--computed tomographic findings[J]. Rontgenpraxis, 2008, 56(5): 191-194.
[4] Dick JF 3rd, Gardner TB, Merrens EJ. Acute pancreatitis: New developments and strategies for the hospitalist[J]. J Hosp Med, 2016, 11(10): 724-729.
[5] 丁凯宏, 班副植, 黄承乐, 等. 急性胰腺炎患者血清降钙素原、超敏C反应蛋白、白细胞介素6水平变化及临床意义[J]. 国际检验医学杂志, 2013, 34(17): 2241-2242.
[6] Jakkampudi A, Jangala R, Reddy B R, et al. NF-κB in acute pancreatitis: Mechanisms and therapeutic potential[J]. Pancreatology, 2016, 16(4): 477-488.
[7] Huan C, Kim D, Ou P, et al. Mechanisms of interleukin-22′s beneficial effects in acute pancreatitis[J]. World J Gastrointest Pathophysiol, 2016, 7(1): 108-116.
[8] 中华医学会消化病学分会胰腺疾病学组. 中国急性胰腺炎诊治指南(草案)[J]. 中华消化杂志, 2004, 24(3): 190-193.
[9] Singh P, Garg P K. Pathophysiological mechanisms in acute pancreatitis: Current understanding[J]. Indian J Gastroenterol, 2016, 35(3): 153-166.
[10] Lee J K. Recent advances in management of acute pancreatitis[J]. Korean J Gastroenterol, 2015, 66(3): 135-143.
[11] Wang L Z, Luo M Y, Zhang J S, et al. Effect of ulinastatin on serum inflammatory factors in Asian patients with acute pancreatitis before and after treatment: a meta-analysis[J]. Int J Clin Pharmacol Ther, 2016, 54(11): 890-898.
[12] Gillies N, Pendharkar S A, Asrani V M, et al. Interleukin-6 is associated with chronic hyperglycemia and insulin resistance in patients after acute pancreatitis[J]. Pancreatology, 2016, 16(5): 748-755.
[13] Li M Q, Shi Z X, Xu J Y, et al. Hemodiafiltration combined with resin-mediated absorption as a therapy for hyperlipidemic acute pancreatitis[J]. Cell Biochem Biophys, 2014, 69(3): 699-702.
2017-01-22
R 657.5
A
1672-2353(2017)13-206-03
10.7619/jcmp.201713073

