诱导物对猴头菇子实体生长发育及产量的影响
VI MINH THUAN, ,2,,2,,,2,,*,
(1.华南农业大学食品生物技术研究所,华南农业大学食品学院生物工程系,广东广州 510640; 2.广东省微生态制剂工程技术研究中心,广东广州 510640; 3.广州市澳键丰泽生物科技有限公司,广东广州 510760)
诱导物对猴头菇子实体生长发育及产量的影响
VI MINH THUAN1,李雄1,2,郭丽琼1,2,3,林俊芳1,2,3,*,云帆3
(1.华南农业大学食品生物技术研究所,华南农业大学食品学院生物工程系,广东广州 510640; 2.广东省微生态制剂工程技术研究中心,广东广州 510640; 3.广州市澳键丰泽生物科技有限公司,广东广州 510760)
本文选用了7种诱导物(壳聚糖、茉莉酸甲酯、赤霉素、萘乙酸、三十烷醇、吲哚乙酸和2,4-二氯苯氧乙酸(2,4-D))设定不同浓度,采用喷湿方法对猴头菇生长发育影响进行研究,结果表明0.5、1.0 mg/kg的茉莉酸甲酯和0.05、0.5 mg/kg的吲哚乙酸能显著缩短猴头菇的生长周期(p<0.05);1.5、2.0 mg/kg的赤霉素、1.0 mg/kg的萘乙酸及0.5、1.5、2.0 mg/kg的吲哚乙酸能显著提高猴头菇的产量(p<0.05)。其中,0.5 mg/kg吲哚乙酸既能缩短猴头菇生长周期(缩短4 d)又能提高产量(比对照组提高22.18%),有望进一步应用到生产中。
猴头菇,诱导物,生长发育
猴头菇(Lion’s Mane),属于多孔菌目猴头属,是一种具有食药用价值的蘑菇[1],是我国著名的食用兼药用菌。猴头菇营养物质含量十分丰富,烘干后其子实体中含蛋白质20.8%,游离氨基酸14.3 mg/g干重[2]。此外,猴头菇还富含多糖及其它次级代谢产物,如猴头素、hericerins、猴头菇酮、甾醇、类固醇、Erinaceolactones以及萜类化合物等[3]。众多研究表明,猴头菇在预防、减轻或治疗疾病如癌症、抑郁症、糖尿病、高血压、高血脂和神经变性疾病等有潜在的帮助,同时还具有抗疲劳、抗衰老,保护心脏、肝脏、肾脏和神经组织的功能[3]。由于野生猴头菇资源较少,研究和探索高产、高效的人工猴头栽培方法是进一步满足社会需要的重要途径。目前,猴头有段木栽培和代料栽培两种栽培方法。
植物的生长调节剂也称化学诱导物,是一类能够调节细胞分裂、生长、分化和其他生物过程的低剂量信号分子,此类物质经常被用于提高农作物的产率[4-5]。目前,生长调节剂用于改善菌丝的生长和子实体的得率。Atri NS[6]等使用生长调节剂赤霉酸、吲哚乙酸、吲哚丁酸、激动素和萘基乙酸调节香菇的生长。结果表明,生长调节剂可有效改善香菇的菌丝生长。Uddin M R[7]等报道吲哚乙酸和萘乙酸对佛罗里达侧耳、Calocybeindica、双孢蘑菇菌丝增殖有促进作用。
目前,诱导物已经广泛应用于食用菌增产中。顾学峰等[8]的研究表明,在不同时期使用不同浓度的吲哚乙酸可促进黑木耳菌丝生长,提高产量,使用0.03 mg/L吲哚乙酸进行拌料处理,菌丝生长加速,可使制菌周期缩短7~8 d。而在出菇期喷洒0.02 mg/L吲哚乙酸,可有效促进原基形成和子实体分化,产量较对照增加20%以上。Kadiri M[9]将经过组织培养得到的香菇子实体接种到经0.1%吲哚乙酸浸泡过的原料上繁殖,可明显提高香菇菌丝的生长量,提高香菇产量。丁凤珍[10]研究发现用0.5 mg/kg的三十烷醇在金针菇幼蕾时期喷洒,能提早现蕾出菇,改善金针菇色泽与整齐度,可使优质菇产量提高至20%。邹向英[11]等采用配合喷湿的方法来研究生长促进剂对金针菇产量的影响,结果表明不同生长促进剂配合喷湿能显著提高金针菇产量。樊忠良等[12]采用0.5~1.0 mg/kg的三十烷醇的拌料培养平菇时,能够明显促进平菇菌丝生长,缩短平菇生育期和提高平菇的产量。然而,植物的生长调节剂在猴头菇栽培方面还未见报道。因此,选择合适的诱导物种类和浓度对猴头菇高产和优质子实体具有重要作用。
本文研究了7种植物生长调节剂——壳聚糖、赤霉酸、茉莉酸甲酯、萘基乙酸、三十烷醇、吲哚乙酸和2,4-二氯苯氧乙酸(2,4-D)对猴头菇生育期和子实体产量的影响,将其添加到猴头菇培养基中,探究其对猴头菇活性物质产量的影响,为进一步发展猴头菇的人工栽培产业和猴头菇的生物学特性研究奠定基础。
1 材料与方法
1.1材料与仪器
猴头菇菌种Hereciumerinaceus(简称:T3) 购自于北京吉蕈园科技有限公司,由本实验室-70 ℃保存;土豆、棉籽壳、玉米芯、麸皮、石膏粉 市售;葡萄糖、琼脂、硫酸镁、磷酸二氢钾、可溶性淀粉、酵母膏、壳聚糖、赤霉素、茉莉酸甲酯、三十烷醇、吲哚乙酸、2,4-D、萘乙酸、过磷酸钙等 分析纯,广州化学试剂厂。
自动灭菌锅 山东新华医疗器械股份有限公司;HH-2型数显恒温水溶锅 江苏常州国华电器有限公司;HZQ-F160型金属振荡培养箱 哈尔滨联电子技术开发有限公司;美的多功能电磁炉 广东广州美的生活电器有限公司;LRH-70型生化培养箱 海一恒科学仪器有限公司;SW-CJ-1F型超净工作台 江苏苏州安泰空气技术有限公司;101A-3S型电热鼓风干燥箱 广东广州富民测控科技有限公司;格兰仕WD800B型微波炉 广东顺德格兰仕电器实业有限公司;JJ1000Y型电子天平 常熟市双杰测试仪器厂。
1.2实验方法
1.2.1 菌种的活化 将猴头菇菌种接种于PDA固体培养基中,待菌丝长满平板后,再将活化后的菌种接种于栽培培养基中。
1.2.2 栽培培养基的制作 栽培培养基配方:棉籽壳60%,玉米芯23%,麸皮15%,石膏粉1%,过磷酸钙1%。称取300 g栽培培养基干料置于17 cm×33 cm的聚丙烯塑料袋中,按1∶1.6的料水比加入自来水,混均,使培养料高达13 cm,pH自然。将料袋装入灭菌锅中121 ℃湿热灭菌3 h。
1.2.3 接种方法 栽培培养基降温至25 ℃后,在无菌条件下接种约1 cm2的菌块,每袋3块,之后搬到22~25 ℃养菌室、在相对湿度65%~70%下进行菌丝培养。
1.2.4 出菇管理 经过菌丝生长阶段后用消过毒的刀片进行搔菌。把接种块上表层老化衰退、干湿死亡的菌丝除去,以促进原基的形成,通过控制温度16~20 ℃,相对湿度85%~95%,促进子实体生产,待子实体菌刺长到1.0 cm后采收。
1.2.5 诱导物对猴头菇产量的影响 将壳聚糖、赤霉素(GA)、茉莉酸甲酯(MeJA)、萘乙酸(NAA)、三十烷醇(TA)、吲哚乙酸(IAA)和2,4-D七种诱导物配制成0.05、0.5、1.0、1.5、2 mg/kg的溶液,在搔菌后的实验组猴头菇培养料的表面分别喷洒6 mL,对照组喷洒等量蒸馏水,测定猴头菇子实体生长所需时间及其产量。
1.2.6 培养所需时间的测定 当菌刺长1.0 cm视为子实体成熟,记录从搔菌后到子实体菌刺长为1.0 cm所需要的培养天数。
1.2.7 猴头菇产量的测定 在菌刺长1.0 cm进行采收。为了保证采收质量,采收前3 d,将相对湿度降至80%~85%,使菇体表面干燥。采收时,一手握好袋料颈,一手抓住子实体基轻轻拔下,再用小刀切除粘有培养基的黑褐色根部。称重采收后的子实体。
1.3数据处理
采用SPSS 16和Microsoft Excel的软件进行统计分析。
2 结果与分析
2.1不同浓度的壳聚糖对猴头菇生长周期以及产量的影响
采用不同质量浓度的壳聚糖对猴头菇菌丝进行处理后,猴头菇的生长周期与产量受到不同程度的影响,结果见表1。结果显示,从搔菌到采收结束,在五个不同浓度的壳聚糖处理,除CH3组(浓度为1.0 mg/kg)与对照组相同外,其它处理组均可缩短猴头菇的生长周期,但差异不显著;五个不同浓度的壳聚糖处理的猴头菇产量与对照组相比分别提高13.54%、6.07%、6.81%、4.83%、14.42%,其中最高产量可达268.50 g。在不同浓度的壳聚糖处理的产量及生物效率由高到低的顺序为CH5>CH1>CH3>CH2>CH4>CK。

表1 不同浓度的壳聚糖对猴头菇生长周期及产量的影响Table 1 Effect of different concentrations of chitosan on H.erinaceus growth period and yield
注:结果=平均数±标准差(n=5),同列不同字母表示差异显著(p<0.05)。表2~表7同。
2.2不同浓度的茉莉酸甲酯对猴头菇生长周期和产量的影响
不同质量浓度的茉莉酸甲酯对猴头菇菌的生长周期与产量的影响结果见表2。由表2中可以看出,从搔菌到采收结束,除了处理组MJ5(浓度为2.0 mg/kg)与对照组相同外,其它处理组均可缩短猴头菇的生长周期。浓度为0.5 和1.0 mg/kg的茉莉花甲酯可将猴头菇生长周期由68 d缩短至63 d,且差异显著;猴头菇的周期顺序由长到短为MJ5=CK>MJ1=MJ4>MJ2=MJ3;五个不同浓度的茉莉酸甲酯处理后对猴头菇产量与对照组无显著性差异,除了处理组MJ5(浓度为2.0 mg/kg)产量最高为238.28 g,其他处理组产量均比对照组低,其中0.05 mg/kg时产量最低,为200.65 g。

表2 不同浓度的茉莉酸甲酯对猴头菇生长周期以及产量的影响Table 2 Effect of different concentrations of methyl jasmonate on H.erinaceus growth period and yield
通过实验结果分析表明,茉莉酸甲酯对猴头菇生长有较大影响,茉莉酸甲酯的浓度为0.05、1.00 mg/kg时可显著缩短对猴头菇生长周期,但其对猴头菇子实体的产量无显著影响。
2.3不同浓度的赤霉素对猴头菇生长周期以及产量的影响
赤霉素对猴头菇的生长周期与产量的影响见表3。由表3可以看出,从搔菌到采收结束,五个不同浓度的赤霉素处理相对于对照组均可缩短猴头菇的生长周期但差异不显著;不同浓度的赤霉素均能提高猴头菇的产量,其中1.5、2.0 mg/kg的浓度增产效果显著,其产量最高可达289.20 g。

表3 不同浓度的赤霉素对猴头菇生长周期和产量的影响Table 3 Effect of different concentrations of gibberellins on H. erinaceus growth period and yield
2.4不同浓度的萘乙酸对猴头菇生长周期以及产量的影响
不同浓度的萘乙酸对猴头菇的生长周期与产量的影响见表4。由表4可以看出,从搔菌到采收结束,不同浓度的萘乙酸处理对猴头菇的生长周期并无显著影响,但均能提高猴头菇的产量,其中1.0 mg/kg的增产效果最高且效果显著,产量可达283.16 g。五个浓度的萘乙酸与对照组(CK)相比产量分别增加14.68%、15.75%、20.66%、2.96%、10.20%。以上结果说明适宜浓度的萘乙酸可以提高猴头菇的产量,尤以1.0 mg/kg最佳。

表4 不同浓度的萘乙酸对猴头菇生长周期以及产量的影响Table 4 Effect of different concentrations of NAA on H. erinaceus growth period and yield
2.5不同浓度的三十烷醇对猴头菇生长周期以及产量的影响
不同质量浓度的三十烷醇处理猴头菇菌丝,对其生长周期及产量的影响结果见表5。由表5可以看出,从搔菌到采收结束,五个不同浓度的三十烷醇均可缩短猴头菇的生长周期,但差异不显著;浓度为0.05 mg/kg的三十烷醇可将猴头菇生长周期由68 d缩短至62 d,缩短时间最长。五个浓度的三十烷醇喷湿于猴头菇表面,都能促进子实体生长,但差异不显著,比对照组分别增产:0.87%、7.37%、6.80%、17.40%、25.21%,其中TR5处理组(2.0 mg/kg)产量产最高,产量为293.84 g。

表5 不同浓度的三十烷醇对猴头菇生长周期以及产量的影响Table 5 Effect of different concentrations of triacontanol on H. erinaceus growth period and yield
总之,处理组的产量和生物效率约高于对照组,明确证明三十烷醇对猴头菇产生长及产量有影响。
2.6不同浓度的吲哚乙酸对猴头菇生长周期以及产量的影响
不同质量浓度的吲哚乙酸对猴猴头菇生长周期与产量的影响结果见表6。由表6可以看出,从搔菌到采收结束,0.05、0.50 mg/kg的吲哚乙酸可显著降低生长周期,其余3个组别差异不显著。除0.05 mg/kg的吲哚乙酸外,其余组别均对产量均有促进作用,0.5、1.5、2.0 mg/kg的吲哚乙酸均可显著(p<0.05)增加猴头菇的产量,其中浓度为0.5 mg/kg 产量最高,为286.69 g。

表6 不同浓度的吲哚乙酸对猴头菇生长周期和产量的影响Table 6 Effect of different concentrations of indole acetic acid on H. erinaceus growth period and yield
2.7不同浓度的2,4-D对猴头菇生长周期以及产量的影响
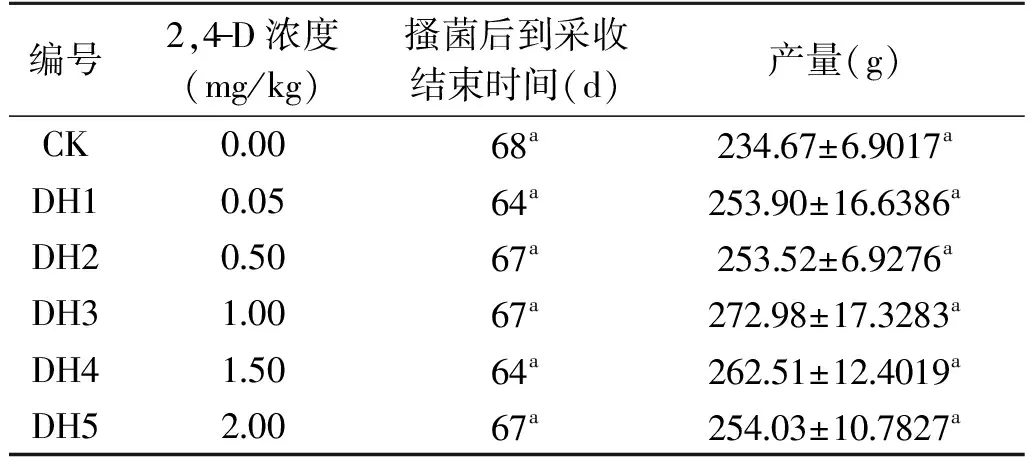
表7 不同浓度的2,4-D对猴头菇生长周期以及产量的影响Table 7 Effect of different concentrations of 2,4-D on H. erinaceus growth period and yield
不同质量浓度的2,4-D对猴头菇生长周期以及产量的影响结果见表7。由表7可以看出,从搔菌到采收结束,浓度为0.05、1.5 mg/kg的2,4-D可将猴头菇生长周期由68 d缩短至64 d,且其余浓度的2,4-D处理均可缩短猴头菇的生长周期,但差异不显著。不同浓度的2,4-D均能提高猴头菇的产量,比对照组分别增产为:8.19%、8.03%、16.33%、11.86%、8.25%,其中处理组DH3(1.0 mg/kg)增产效果最高,产量为272.98 g。
3 结论
添加一定浓度的诱导物可促进猴头菇的子实体分化形成,缩短生长周期。在本文选取的诱导物中,0.5、1.0 mg/kg的茉莉酸甲酯和0.05、0.5 mg/kg的吲哚乙酸能显著(p<0.05)缩短猴头菇的生长周期;其他诱导物在适宜的浓度也能缩短猴头菇的生长周期,但差异不显著。同时,添加一定浓度的诱导物能提高猴头菇产量(茉莉酸甲酯除外),其中1.5、2.0 mg/kg的赤霉素、1.0 mg/kg的萘乙酸以及0.5、1.5、2.0 mg/kg的吲哚乙酸能显著(p<0.05)提高猴头菇的产量。相对于其它诱导物,0.5 mg/kg的吲哚乙酸能在显著(p<0.05)降低猴头菇生长周期4 d的同时显著(p<0.05)提高其产量,使猴头菇相对于对照组增产22.18%,这对猴头菇的人工栽培生产意义重大,有望进一步应用到生产中。
[1]Wu D,Li W,Chen J,et al. An evaluation system for characterization of polysaccharides from the fruiting body of Hericium erinaceus and identification of its commercial product[J]. Carbohydrate Polymers,2015,124:201-207.
[2]Cohen N,Cohen J,Asatiani M D,et al. Chemical Composition and Nutritional and Medicinal Value of Fruit Bodies and Submerged Cultured Mycelia of Culinary-Medicinal Higher Basidiomycetes Mushrooms[J]. International Journal of Medicinal Mushrooms,2014,16(3):273-291.
[3]Friedman M. Chemistry,Nutrition,and Health-Promoting Properties of Hericium erinaceus(Lion’s Mane)Mushroom Fruiting Bodies and Mycelia and Their Bioactive Compounds[J]. Journal of Agricultural and Food Chemistry,2015,63(32):7108-7123.
[4]杨吉安,张艳,罗小华. 化学调控技术在我国葡萄生产上的应用及研究进展[J]. 西北林学院学报,2009(5):92-95.
[5]Davida Bull,张国平,陈锦新. 氮肥施用时间和植物生长调节剂对小麦氮吸收和利用的影响(英文)[J]. 浙江大学学报:农业与生命科学版,2000(2):44-49.
[6]Atri N S,Kumari B,Singh R,et al. Effect of Vitamins and growth regulators on the vegetative growth of Lentinus squarrosulus[J]. Mycosphere,2013,4(6):1080-1090.
[7]Uddin M R,Park W T,Kim Y K,et al. Effects of Auxins on Sorgoleone Accumulation and Genes for Sorgoleone Biosynthesis in Sorghum Roots[J]. Journal of Agricultural and Food Chemistry,2011,59(24):12948-12953.
[8]顾学峰,陈志新,张新春,等. 生长调节剂在黑木耳生产中的应用[J]. 林业勘查设计,2005(2):71-73.
[9]Kadiri M,Arzai A H. Cultivation of Lentinus subnudus berk(Polyporales-polyporaceae)on woodlogs[J]. Bioresource Technology,2004,94(1):65-67.
[10]丁凤珍,蒋宁,张云桥,等. 植物生长调节剂在金针菇栽培上的应用[J]. 中国食用菌,1990(5):18-19.
[11]邹向英,赵洪斌,乔德生. 生长促进剂配合喷湿对金针菇产量的影响[J]. 北方园艺,2006(6):176-177.
[12]樊忠良. 三十烷醇在平菇生料栽培中抗污染作用的研究[J]. 中国食用菌,2000(3):22-23.
EffectsofinducersongrowthandyieldofHericiumerinaceus
VIMINHTHUAN1,LIXiong1,2,GUOLi-qiong1,2,3,LINJun-fang1,2,3,*,YUNFan3
(1.Institute of Food Biotechnology & Department of Bioengineering, College of Food Science,South China Agricultural University,Guangzhou 510640,China; 2.Research Center for Micro-Ecological Agent Engineering and Technology of Guangdong Province,Guangzhou 510640,China; 3.Guangzhou Ao Jiang Feng Ze Biotechnology Co.,Ltd.,Guangzhou 510760,China)
In this paper,7 kinds of inducers(chitosan,methyl jasmonate,gibberellin,NAA,triacontanol,indole acetic acid and 2,4-dichlorophenoxy acetic acid(2,4-D))of different concentration were used by spraying method to study its influence ofH.erinaceusgrowth. The results showed that treated with 0.5 and 1.0 mg/kg of methyl jasmonate could significantly shorten the growth period ofH.erinaceus,while the same results could be achieved when 0.05 and 0.5 mg/kg of indole acetic acid was applied(p<0.05). As for the result ofH.erinaceusprodution,1.5 and 2.0 mg/kg of gibberellin,1.0 mg/kg of naphthalene acetic acid,as well as 0.5,1.5 and 2.0 mg/kg of indole acetic acid could significantly increase the yield ofH.erinaceus(p<0.05). Among these results,0.5 mg/kg of indole acetic acid could shorten the growth period ofH.erinaceusby 4 days and increase the yield by 22.18% simultaneously,which made it a potential inducer for further application.
Hericiumerinaceus;inducer;growth and development
2016-11-01
VI MINH THUAN(1982-),男,博士研究生,研究方向:食品微生物,E-mail:viminhthuan@gmail.com。
*通讯作者:林俊芳(1962-),男,博士,研究员,研究方向:天然产物的生物制造,E-mail:linjf@scau.edu.cn。
国家自然科学基金项目(31372116,31572178);广东省科技项目(2012A020100010,2014B020205003,2016A030313404);广东省现代农业产业技术体系创新团队项目(2016LM1125,2016LM1126)。
TS255.1
:A
:1002-0306(2017)12-0077-05
10.13386/j.issn1002-0306.2017.12.014

