乳酸菌破壁方法的比较研究
,, , ,,,,,,,*
(1.扬州大学兽医学院,江苏扬州 225009;2.军事医学科学院,军事兽医研究所,省部共建吉林省人兽共患病预防与控制重点实验室,吉林长春 130122; 3.温州大学病毒病研究所,浙江温州 325035)
乳酸菌破壁方法的比较研究
潘荣荣1,2,王茂鹏2,+,李昌2,3,邸洋2,荣凤君2,杜寿文2,朱羿龙2,刘立明3,朱国强1,*,金宁一2,3,*
(1.扬州大学兽医学院,江苏扬州 225009;2.军事医学科学院,军事兽医研究所,省部共建吉林省人兽共患病预防与控制重点实验室,吉林长春 130122; 3.温州大学病毒病研究所,浙江温州 325035)
本实验旨在探索一种快速、高效、经济的乳酸菌破壁方法。通过甘氨酸破壁法、反复冻融破壁法、溶菌酶破壁法、氧化锆珠破壁法、超声波破壁法以及3种复合破壁法对植物乳杆菌Lactobacillus.plantarum1.557进行破壁处理,并以革兰氏染色和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)为评价方法,比较破壁效果和破壁时间的差异。此外,通过β-葡萄糖醛酸酶(GUS)活力的测定对氧化锆珠破壁法所提蛋白进行活性检测,通过琼脂糖凝胶电泳对氧化锆珠破壁法所提RNA的质量进行了检测。结果表明:氧化锆珠破壁法优胜于其他几种处理方法,该法所提取的 GUS蛋白具有蛋白活性,提取的RNA的OD260/OD280的比值在1.8~2.1 之间,符合标准的比值,纯度较高,降解程度低。因此,氧化锆珠破壁法适用于快速提取乳酸菌菌体蛋白和总RNA,它是一种快速、高效、经济的乳酸菌破壁方法。
乳酸菌,破壁方法,氧化锆珠,蛋白提取,RNA提取
乳酸菌是一类重要的工业菌株,被广泛应用于食品发酵,有着重要的经济价值。其合成代谢产物具有降胆固醇、降血压、抗肿瘤和提高机体免疫等作用[1]。近年来,利用乳酸菌系统表达外源蛋白也已引起广泛关注,但由于乳酸菌属于革兰氏阳性菌,具有厚而致密的刚性细胞壁,致使乳酸菌内源蛋白、表达的非分泌性外源蛋白以及其他非分泌性代谢产物的提取效率极低[1-2]。因此,研究乳酸菌破壁方法以提高乳酸菌蛋白以及各种代谢产物的获得率具有重要的意义和应用价值。
细胞破壁方法很多,如:化学法,如酸热法、化学渗透法;物理法,如反复冻融法、超声破壁法、机械法和微波法等;生物法,如酶溶法等,各有优缺点[3]。我们需要根据细胞的结构和化学组成选择合适的破壁方法[4]。目前,国内外系统地研究乳酸菌破壁方法的报道较少,而利用不同的破壁方法相互叠加对乳酸菌进行复合处理的研究尚未发现相关报道,该研究以期为乳酸菌内源蛋白、表达的外源蛋白以及多种代谢产物的提取提供参考。
1 材料与方法
1.1材料与仪器
菌株Lactobacillus.plantarum1.557 本实验室保存;质粒pSIP411 山东大学祁庆生教授惠赠;MRS培养基 青岛高科园海博生物技术有限公司;甘氨酸 Promega公司;溶菌酶 购自北京索莱宝科技有限公司;革兰氏染色液 购自天津市光复精细化工研究所;Trizol 购自Invitrogen公司;RIPA裂解液(强)P0013 购自碧云天公司;4-硝基苯基-D-吡喃葡糖苷(4-NPG) 购自上海宝曼生物科技有限公司。
超声波破碎仪 宁波新芝科器研究所;MCO-18M型CO2恒温培养箱 日本 SANYO公司;5417R小型台式高速离心机 德国Eppendorf公司;Tissue Lyser II组织研磨仪 QIAGEN公司;0.1 μm氧化锆珠 河源帝诺新材料有限公司。
1.2实验方法
1.2.1 菌株的培养与收集 将L.plantarum1.557 MRS平板培养基上新鲜活化的单菌落挑至5 mL MRS液体培养基,37 ℃静置培养过夜。12000 r/min,离心1 min,收集菌体。用1 mL预冷的洗涤液(100 mmol/L磷酸缓冲液,10 mmol/L EDTA)洗涤菌体,洗涤3次,再用PBS洗涤3次,离心,收集菌体。
1.2.2 氧化锆珠的前处理 用5.8 mol/L HCl覆盖氧化锆磨介,室温振荡处理过夜。弃上清,加入灭菌水清洗(每次清洗都要反复振荡),共洗10次。最后,放入平皿中铺散开,75 ℃烘干备用[5]。
1.2.3 乳酸菌的破壁处理
1.2.3.1 氧化锆珠破壁法 用1.5 mL离心管称取0.013 g左右的菌体,加入300 μL预冷的RIPA裂解液并重悬菌体,再加入1 g左右预冷的氧化锆珠。放入组织研磨仪中振荡研磨(振荡频率为每秒30次)研磨15 min。研磨结束后,用1 mL注射器在研磨后的离心管底部扎一个小孔,并将扎孔的离心管立即放入另一新的预冷的1.5 mL离心管,4 ℃,5000 r/min,离心5 min,收集研磨后的蛋白上清和菌体[5]。
1.2.3.2 低功率(400 W)超声波破壁法 用1.5 mL离心管称取2管相同重量(0.01 g左右)的菌体,加入300 μL预冷的RIPA裂解液并重悬菌体。在冰浴条件下分别超声破碎30 min和1 h(功率400 W,工作30 s,间隔30 s)。超声结束后,4 ℃,12000 r/min,离心5 min,收集超声后的蛋白上清和菌体[3-4]。
1.2.3.3 大功率(1500 W)超声波破壁法 用1.5 mL离心管称取2管相同重量(0.01 g左右)的菌体,加入300 μL预冷的RIPA裂解液并重悬菌体。在冰浴条件下进行超声破碎20 min(功率1500 W,工作5 s,间隔9 s)。超声结束后,4 ℃,12000 r/min,离心5 min,收集超声后的蛋白上清和菌体[3-4]。
1.2.3.4 反复冻融破壁法 用1.5 mL离心管称取重量为0.013 g左右的菌体,加入300 μL预冷的RIPA裂解液并重悬菌体。于液氮中反复冻融3次,每次冷冻时间20 min,37 ℃水浴中解冻20 min[6-7]。
1.2.3.5 溶菌酶破壁法 用1.5 mL离心管称取重量为0.013 g左右的菌体,将菌体重悬于300 μL含溶菌酶(10 mg/mL)的PBS(pH8.0)。在37 ℃水浴中处理30 min,处理结束后,12000 r/min,离心5 min,收集溶菌酶处理后的蛋白上清和菌体[8-9]。
1.2.3.6 甘氨酸破壁法 将L.plantarum1.557 MRS平板培养基上新鲜活化的单菌落挑至5 mL含2%甘氨酸的MRS培养基中,37 ℃静置培养过夜。然后,按照方法1.2.1收集菌体。
1.2.3.7 冻融-研磨复合破壁法 用1.5 mL离心管称取2管相同重量(0.013 g左右)的菌体。然后,按照方法1.2.3.4反复冻融菌体3次,解冻后,直接加入1 g左右预冷的氧化锆珠,放入组织研磨仪中振荡研磨(振荡频率为每秒30次),分别在研磨5 min后,10 min后取出一管,置于冰上。然后,用1 mL注射器在研磨后的离心管底部扎一个小孔,并将扎孔的离心管立即放入另一新的预冷的1.5 mL离心管,4 ℃,5000 r/min,离心5 min,收集研磨后的蛋白上清。
1.2.3.8 溶菌酶-研磨复合破壁法 用1.5 mL离心管称取2管相同重量(0.013 g左右)的菌体。然后,按照方法1.2.3.5 用溶菌酶处理菌体30 min,处理结束后,分别直接加入1 g左右预冷的氧化锆珠,接下来按照方法1.2.3.7进行氧化锆珠研磨和收集研磨后的蛋白上清。
1.2.3.9 甘氨酸-研磨复合破壁法 按照方法1.2.3.6用2%甘氨酸处理菌株并收集处理后的菌体。用1.5 mL离心管称取2管相同重量(0.013 g左右)的菌体,分别加入300 μL预冷的RIPA裂解液并重悬菌体,再分别加入1 g预冷的氧化锆珠。接下来按照方法1.2.3.7进行氧化锆珠研磨和收集研磨后上清。
1.2.4 革兰氏染色 对分别经氧化锆珠破碎、超声破碎、反复冻融、溶菌酶处理、甘氨酸处理的菌体进行革兰氏染色,按照革兰氏染色液试剂盒说明书来进行操作。
1.2.5 SDS-PAGE分析 从收集的蛋白上清中各取50 μL,直接加入12.5 μL 5×SDS 样品缓冲液,充分混匀,煮沸5 min,各取15 μL煮沸后样品进行12% SDS-PAGE分析。
1.2.6 GUS酶活力的测定 将菌株L.plantarum1.557(已电转入了质粒pSIP411)在MRS平板培养基上活化后的单菌落挑至5 mL MRS 液体培养基,37 ℃静置过夜培养。以1%(V/V)的接种量转接到6 mL MRS 液体培养基(红霉素15 μg/mL)中,37 ℃静置培养4 h(OD=0.3左右)。培养4 h后,取出3 mL菌液加入诱导剂 SppIP(100 ng/mL),剩余3 mL菌液不加诱导剂作为对照。然后,继续培养6 h。按照方法1.2.1和1.2.3.1进行菌体和蛋白上清的收集。取诱导和未诱导的研磨上清各50 μL,分别加入500 μL含1.25 μmol/L 4-硝基苯基-D-吡喃葡糖苷(4-NPG)的GUS Buffer(pH=7 50 mmol/L磷酸缓冲液10 mmol/Lβ-巯基乙醇1 mmol/L EDTA 0.1% TritonX-100,37 ℃温育,观察颜色变化[10]。
1.2.7 乳酸菌RNA的提取 用1.5 mL离心管称取6管相同重量(0.01 g左右)的菌体,分别加入300 μL预冷的Trizol并重悬菌体,再分别加入1 g左右预冷的氧化锆珠。然后,将其中的5管放入组织研磨仪中振荡研磨(振荡频率为每秒30次),另外1管不研磨作为对照。然后,分别在研磨5、10、15、20 min后取出一管,置于冰上。接下来按照方法1.2.3.1收集菌体碎片和上清,用上清重悬菌体碎片后,接下来按照Trizol总RNA提取法进行RNA的提取并用NanoDrop 2000紫外分光光度仪测定RNA浓度。
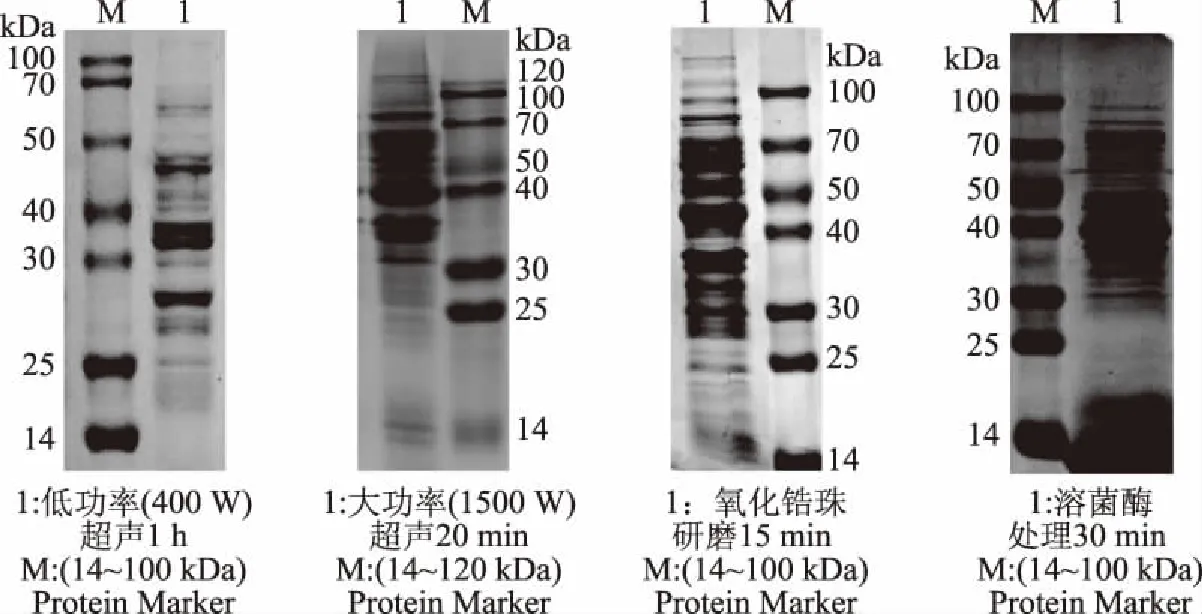
图2 L.plantarum 1.557不同破壁方法SDS-PAGE效果图Fig.2 SDS-PAGE renderings of different wall-breaking method
2 结果与分析
2.1几种单纯破壁方法的分析比较
2.1.1 几种单纯破壁方法革兰氏染色效果的分析比较 由图1可知,甘氨酸破壁法(A、B)、反复冻融破壁法(E、F)仅可使菌壁受到一定程度破坏(破壁处理后,革兰氏染色菌体变红),但无法破坏整个细胞结构,菌体蛋白无法释放。低功率(400 W)超声波破壁法(I、K)在超声30 min后,细胞结构仍比较完整,菌体破碎不完全,需要较长时间(1 h左右)才可破坏整个细胞结构。而氧化锆珠破壁法(G、H)、大功率(1500 W)超声波破壁法(L、M)、溶菌酶破壁法(C、D)这三种方法都可在较短时间内(15~30 min)破坏完整细胞结构,使菌体蛋白得到释放。
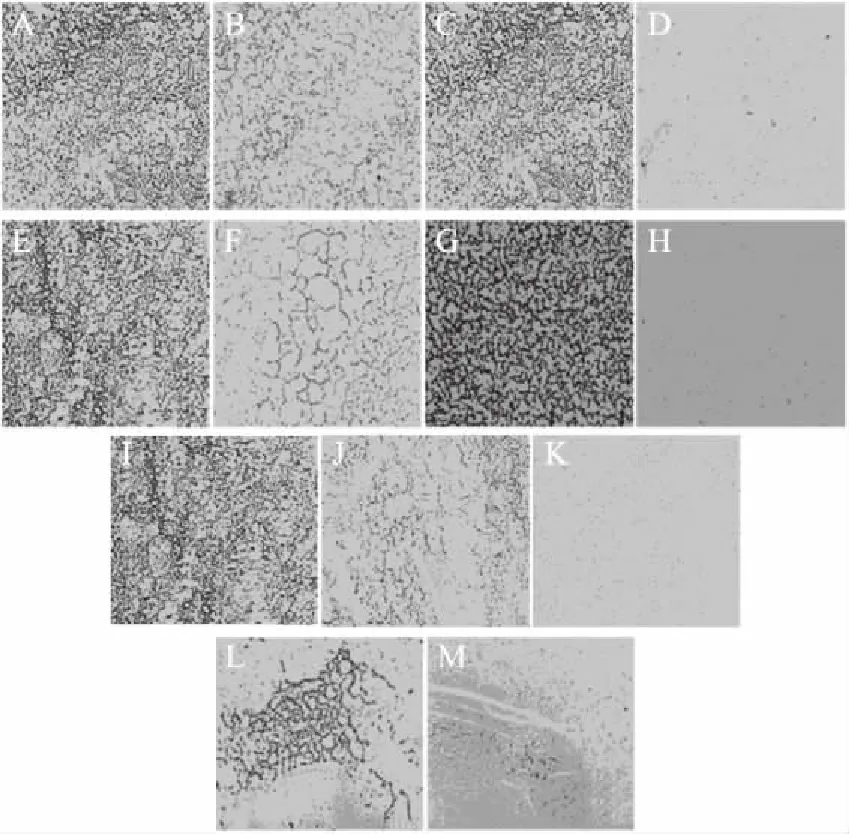
图1 不同破壁方法革兰氏染色效果图(100×)Fig.1 gram renderings of differentwall-breaking method(100×)注:A、B为甘氨酸处理结果,A未处理,B处理后;C、D为溶菌酶处理结果,C未处理,D处理30 min后;E、F为反复冻融结果,E未处理,F反复冻融后;G、H为锆珠研磨结果,G未处理,H锆珠研磨15 min后;I~K为低功率(400 W)超声处理结果,I未处理,J超声30 min后,K超声1 h后;L~M为大功率(1500 W)超声处理结果,L未处理,M超声20 min后。
2.1.2 几种单纯破壁方法 SDS-PAGE效果的分析比较 由图1可知,甘氨酸破壁法和反复冻融破壁法无法有效破坏细胞结构,菌体蛋白释放不完全。因此,我们只对溶菌酶破壁法、氧化锆珠破壁法、超声波破壁法进行了SDS-PAGE分析。由图2可知,溶菌酶虽然可以破坏菌体完整细胞结构,但PAGE条带的数目却缺少许多,说明仍有许多菌体蛋白没有释放到上清中。大功率(1500 W)超声波破壁法和低功率(400 W)超声波破壁法的PAGE图片条带数目少且清晰度差,说明菌体蛋白收获不完全。氧化锆珠破壁法的PAGE图片条带数目多且清晰度高,说明菌体蛋白收获较完全。
2.2几种复合破壁方法的分析比较
由图1、图2可知,上述几种破壁方法对乳酸菌的菌壁均有一定程度的破坏作用,为了进一步提高其破壁效率,又将不同的破壁方法相叠加对乳酸菌进行复合处理。由图3可知,菌体不经任何处理,加入RIPA后直接锆珠研磨(单纯氧化锆珠破壁法),在研磨5 min后,PAGE条带数少很多(尤其30 kD以下),研磨不充分,但在研磨10 min后,PAGE条带数多且清晰度高,说明菌体蛋白收获较完全。对于几种复合处理方法,只有甘氨酸-研磨复合破壁法,在研磨5 min后,就达到了单纯氧化锆珠破壁法研磨10 min的效果,在破壁时间上略有缩短。而溶菌酶-研磨复合破壁法,在研磨5 min和10 min后,在30 kD以下的PAGE条带数少很多且清晰度差,研磨效果不如单纯氧化锆珠破壁法。对于反复冻融-研磨复合破壁法,在破壁效果及破壁时间上也没有明显的优势。

图3 复合破壁法 SDS-PAGE效果图Fig.3 SDS-PAGE rendering of compound wall-breaking method注:1、2:经溶菌酶处理后,氧化锆珠分别研磨5、10 min;3、4:经反复冻融三次后,氧化锆珠分别研磨5、10 min;5、6:经2%甘氨酸处理后,氧化锆珠分别研磨5、10 min;7、8:未经任何处理,加入RIPA后,直接研磨5,10、min;9:溶菌酶处理30 min后,离心取上清,直接跑SDS-PAGE;M:(14~100 kDa)Protein Marker。
因此,综合考虑成本问题、操作的简捷性以及工艺放大的可行性,单纯氧化锆珠破壁法是一种适用于乳酸菌破壁的快速、高效、经济的破壁方法。
2.3氧化锆珠破壁法提取蛋白的活性检测
从上述革兰氏染色以及SDS-PAGE结果可知,对于乳酸菌的破壁,锆珠破壁法要优于其他几种处理方法,但考虑到此法所提蛋白的活性问题,接下来又通过GUS酶活力的测定对所提蛋白的活性进行了定性检测。若以pSIP411为载体表达外源蛋白并通过锆珠破壁法提取,则GUS酶活力检测实验可在检测所提蛋白活性的同时检测外源蛋白在乳酸菌中是否表达。如图4所示,加入底物4-NPG后,诱导表达产生 GUS酶的那一管(左)溶液变黄,而未诱导(右)的则不变黄,说明质粒pSIP411在菌株L.plantarum1.557中正常表达了 GUS酶,且经氧化锆珠研磨提取后仍具有酶活性。说明此方法在蛋白提取过程中未破坏蛋白活性。

图4 蛋白活性检测Fig.4 The detection of protein activity注:1:提取的蛋白上清(诱导6 h); 2:提取的蛋白上清(未诱导)。
2.4氧化锆珠破壁法在RNA提取方面的应用
菌壁破碎后,不仅可以释放出内源性蛋白,同样也可以释放出核酸以及其他代谢产物。以RNA的提取为例,RNA容易降解,所以提取要迅速。图5中可看出,菌株经锆珠研磨5 min后,即可提出较高浓度的RNA,且该法所提取的RNA的OD260/OD280的比值在1.8~2.1之间,符合标准的比值,纯度较高,降解程度低,能够继续应用于后续的RT-PCR等实验。因此,氧化锆珠破壁法也是一种快速、高效提取乳酸菌RNA的方法。
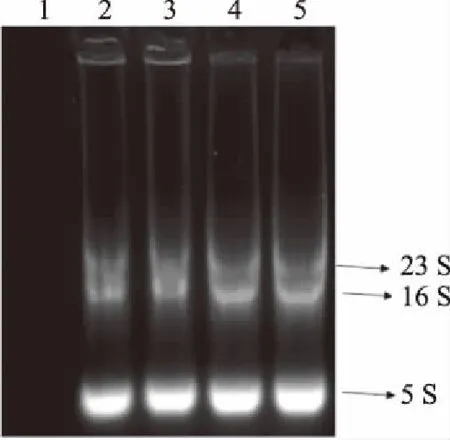
图5 RNA琼脂糖凝胶电泳图Fig.5 RNA agarose gel electrophoresis注:研磨时间(RNA浓度,OD260 nm/OD280 nm);1~5:0 min(49 ng/μL,1.75)、5 min(1904.3 ng/μL,2.06)、10 min(3459 ng/μL,2.01)、15 min(3636.8 ng/μL,2.07)、20 min(3741.4 ng/μL,2.08)。
3 讨论与结论
细胞破壁的方法很多,需要根据细胞的结构和化学组成选择合适的破壁方法。乳酸菌属于革兰氏阳性菌,细胞壁具有很厚的肽聚糖成分,破壁较为困难。溶菌酶可以通过分解肽聚糖中的β-1,4-葡萄糖苷键来破坏菌壁,甘氨酸可以通过取代肽聚糖中N-乙酰胞壁酸短肽上的L-丙氨酸和D-丙氨酸来破坏菌壁[2,4]。超声波可以通过空化效应引起的冲击波和剪切力使细胞破碎,反复冻融法是利用冻融过程中内部形成的冰晶体对细胞壁的机械作用使细胞破碎[3,6]。氧化锆珠法是借助研磨中锆珠与细胞的切力及碰撞作用来破碎细胞。因此,本实验选择上述5种方法对乳酸菌进行破壁处理。
实验过程中发现上述5种方法对于乳酸菌的破壁均具有一定程度的破坏作用,但一些具有明显的局限性。甘氨酸破壁法不能达到充分破除菌壁的目的,仅能在菌体复制时才起到破坏作用。反复冻融法需要反复操作,耗时较大,且不能充分破除乳酸菌菌壁[6-7]。酶法破壁相对成本较高,且常常存在产物抑制[8,11],菌体蛋白释放不完全。低功率超声波短时间内不能达到充分破除乳酸菌菌壁的目的,而大功率超声波容易产生局部高温,散热困难,噪音也比较大[4,11]。目前,只有氧化锆珠破壁法能有效避免上述问题。
因此,为了获得更好的效果,我们将氧化锆珠破壁法与其他破壁方法相叠加对乳酸菌进行复合处理,从研究结果来看,与单纯氧化锆珠破壁法相比,在破壁效果及破壁时间上没有明显的优势。而氧化锆珠破壁法可以在短时间内破碎裂解样品且研磨过程中产生的热量少,可以最大限度的避免核酸的降解和蛋白的变性。
综上,氧化锆珠破壁法具有以下优势:氧化锆珠低磨耗,高硬度,可重复利用的特点降低了研磨成本[12-13]。可快速同时处理多个样品,具有高通量的特性。研磨时间短,只需要10~15 min,有效保护蛋白活性。破壁效果充分,操作简便。所以,氧化锆珠破壁法是一种适用于乳酸菌破壁的快速、高效、经济、高通量的破壁方法。
[1]康素花.乳酸菌菌体蛋白的开发与应用[J].中国酿造,2015,34(1):18-20.
[2]杨子萱.质粒pMG36e电转化保加利亚乳杆菌、鼠李糖乳杆菌和干酪乳杆菌的研究[D]. 保定:河北农业大学,2014.
[3]孟国庆,王传宝,朱陶,等.啤酒废酵母细胞破壁方法的研究[J].中国果菜2014,34(12):30-34.
[4]汪家政,范明.蛋白技术手册[M].北京:科学出版社,2000.
[5]Sasidharan K,Amariei C,Tomita M,et al. Rapid DNA,RNA and protein extraction protocols optimized for slow continuously growing yeast cultures[J]. Yeast,2012,29(8):311-322.
[6]李琦,张兰威,韩雪,等.破壁方法对嗜热链球菌SP1.1 胞内乳糖代谢关键酶活性的影响及其条件优化[J].食品科学,2011,32(9):183-187.
[7]郭卫芸,杜冰,袁根良,等.反复冻融法破壁啤酒废酵母的研究[J].酿酒科技,2009(3):103-105.
[8]赵春燕.酶法破碎乳酸菌细胞壁提取菌体蛋白的研究[J]. 食品工业科技,2014,35(9):235-238.
[9]崔丁维,胡学超,包珊珊,等.酶法破碎微生物细胞的研究进展[J].微生物学通报,2010,3(11):1672-1678.
[10]Christ Plaitbeuw,Guus Simons,And Willem M. Use of the Escherichia coli 13-Glucuronidase(gusA)gene as a Reportergene for Analyzing Promoters in Lactic Acid Bacteria[J]. Applied and Environmental Microbiology,1994,60(2):587-593.
[11]杨翠竹,李艳,阮南,等.酵母细胞破壁技术研究与应用进展[J].食品科技,2006,49(7):138-139.
[12]周新木,赵光好,谈宏宇,等.纳米氧化锆的固相合成及机理研究[J].有色金属(冶炼部分),2006,1:50-52.
[13]夏宇正,朱也莉,石淑先,等.纳米二氧化锆的制备及其光学性能研究[J].涂料工业,2006,36(8):13-15.
Comparisionresearchonthecellwall-breakingmethodsoflacticacidbacteria
PANRong-rong1,2,WANGMao-peng2,+,LIChang2,3,DIYang2,RONGFeng-jun2,DUShou-wen2,ZHUYi-long2,LIULi-ming3,ZHUGuo-qiang1,*,JINNing-yi2,3,*
(1.College of Veterinary Medicine,Yangzhou University,Yangzhou 225009,China; 2.Key Laboratory of Zoonosis Prevention and Control of Jilin Province,Institute of Military Veterinary,Academy of Military Medical Sciences,Changchun 130122,China; 3. Institute of Viral Diseases,Wenzhou University,Wenzhou 325035,China)
This study aims to explore a rapid,efficient and economical method for breaking lactic acid bacteria cell wall. Five different methods including glycine treatment,repeated freezing and thawing,lysozyme digestion,zirconia beads disruption,ultrasonic treatment and three composite wall-breaking methods were used to treatLactobacillus.plantarum1.557 cells,respectively. And gram staining and sodium dodecyl sulfate polyacrylamide gel electrophoresis(SDS-PAGE)were used as evaluation method to analyze the difference of cell wall-breaking effects and time costs. In addition,the activity of protein extracted by zirconia beads method was tested by theβ-glucuronidase(GUS)assays. The quality of RNA extracted by zirconia beads method was tested by agarose gel electrophoresis. Results showed that zirconia beads method was better than other methods,the GUS protein extracted by this method had the activity of protein. The OD260/OD280ratio of RNA extracted by this method was between 1.8 and 2.1,which was in accordance with the standard ratio,and the purity was high and the degradation degree was low. Therefore,the zirconia beads method was a fast,efficient and economical method for rapid extraction of lactic acid bacteria bacterial protein and total RNA.
lactic acid bacteria;cell wall-breaking method;zirconia beads;protein extraction;RNA extraction
2016-11-04 +并列第一作者
潘荣荣(1989-),女,硕士研究生,研究方向:兽医免疫学,E-mail:2281078335@qq.com。 王茂鹏(1987-),男,博士,研究方向:分子免疫学,E-mail:wangmaopeng@126.com。
*通讯作者:朱国强(1964-),男,博士,研究方向:(病原)微生物和(动物)机体的相互作用的分子机理,E-mail :yzgqzhu@yzu.edu.cn。 金宁一(1956-),男,博士,研究方向:分子病毒学与免疫学,E-mail :ningyik@126.com。
国家自然科学基金(31472197);病原微生物生物安全国家重点实验室开放课题(SKLPBS1435)。
TS201.3
:A
:1002-0306(2017)12-0034-05
10.13386/j.issn1002-0306.2017.12.007

