SH3GL1与p⁃ERK在原发性肝癌中的表达与其对索拉非尼治疗效果的影响
吴祥曾 柏强 冉义洪 张红卫*
·论著与临床研究·
SH3GL1与p⁃ERK在原发性肝癌中的表达与其对索拉非尼治疗效果的影响
吴祥曾 柏强 冉义洪 张红卫*
目的研究SH3GL1和p⁃ERK在原发性肝癌组织中的表达以及二者对服用索拉非尼患者预后的影响。方法收集我院自2008年1月至2016年12月期间因原发性肝癌进行手术治疗,并且术后坚持口服索拉非尼的患者组织标本共73例,免疫组化分析患者组织中SH3GL1和p⁃ERK的表达情况,统计所有患者性别、年龄、术前HBsAg表达情况、术前AFP值、术前肝功能分级、体力状况评分、肿瘤分化程度、是否有脉管侵犯、是否有肝外转移病灶、肿瘤数量、肿瘤分期在内的多项临床指标,分析SH3GL1和p⁃ERK在HCC中的表达情况与这些指标的联系及其对患者预后的影响。结果SH3GL1和p⁃ERK在原发性肝癌患者组织中阳性表达率高,并且二者的表达水平呈正相关关系(P<0.001);SH3GL1的高表达与肿瘤有肝外转移、肿瘤多发和肿瘤分期相关,p⁃ERK的高表达则与患者肿瘤分期相关;影响肝癌术后服用索拉非尼患者总生存期的危险因素包括年龄低于50岁、SH3GL1高表达,p⁃ERK高表达、有肝外转移灶、肿瘤多发,其中SH3GL1高表达、有肝外转移和肿瘤多发为影响总预后的独立危险因素。结论SH3GL1和p⁃ERK在原发性肝癌中的表达对于肝癌多项临床指标相关,并且二者的高表达是影响服用索拉非尼患者总生存期的危险因素。
原发性肝癌;索拉非尼;SH3GL1;p⁃ERK;耐药
索拉非尼(sorafenib,多吉美)是一种口服多激酶抑制剂,是目前FDA唯一批准的可用于治疗原发性肝癌的系统性治疗药物。但索拉非尼治疗目前存在原发及获得性耐药的情况[1],并且具体机制仍未完全阐明。SH3GL1(Src homology 3⁃domain GRB2⁃like protein 1)蛋白是由SH3GL1基因编码的SH3域包含蛋白中吞蛋白家族中的一员[2],近年来许多研究表明SH3GL1的异常表达与包括白血病、骨髓瘤、黑色素瘤、乳腺癌在内的多种肿瘤的发生、发展、转移及耐药等多种肿瘤特性相关[3-6]。PI3K/MAPK信号传导通路是影响原发性肝癌发生、发展的重要细胞信号通路之一,在多数原发性肝癌肿瘤细胞中可发现此通路的异常高表达,并且有研究发现索拉非尼耐药细胞株中ERK1/2磷酸化水平明显上调,耐药基因MDR1基因表达显著增加,提示肝癌细胞耐药与ERK1/2磷酸化水平上调导致耐药基因MDR1表达增加相关[7]。
本研究旨在通过免疫组织化学法(IHC)检测服用索拉非尼的原发性肝癌患者肿瘤组织中SH3GL1及p⁃ERK的表达情况,并进一步分析其与临床各项指标之间的关系及对于索拉非尼治疗预后的影响,现报告如下。
1 材料与方法
1.1 一般资料
本研究由中山大学孙逸仙纪念医院医学伦理委员会审查批准。收集2008年1月至2016年12月期间在我院因原发性肝癌进行手术治疗的患者组织标本,术后病理诊断明确为原发性肝癌,同时患者术后坚持400mg bid口服索拉非尼治疗,并且定期返回我院复查。
最终本研究共纳入73例患者,73例入选的患者中男性患者63例,女性患者10例,中位年龄为48岁(24~75岁),其中年龄小于50岁者39例,大于或等于50岁者34例。手术前患者HBsAg阳性者69例,阴性者4例。术前中位AFP值1 835μg/L(范围1~391 009μg/L),其中≤25μg/L者19例,>25μg/L者54例。根据Child⁃Pugh标准对所有患者进行术前肝功能评估,其中肝功能A级者64人,B级者9人(此部分患者术前经护肝治疗可将肝功能转为A级)。术前患者体力状况根据ECOG评分标准评估,其中1分者65人,2分者8人。所有患者术后标本均送病理诊断,术后病理结果示肿瘤分化程度高分化者7例,中分化者23例,低分化者43例;有脉管侵犯者64例,无脉管侵犯者9例;有肝外转移者10例(包括淋巴结转移),无肝外转移者63例。肿瘤单发者为49例,多发者为24例。术后分期包括Ⅰ期6例,Ⅱ期19例,Ⅲ期36例,Ⅳ期12例。
1.2 生存期评估
所有纳入的73例患者均定期返回我院复查随访。随访起点为手术日期,终点事件为患者因原发性肝癌或其相关疾病死亡,总生存期(OS)为从观察起点到终点事件的时间或与最后随访时间的时间差。随访截止日期为2016年12月31日。所有73例患者中,最长随访时间81个月,最短随访时间3个月,中位生存时间为22个月。
1.3 免疫组织化学检测
收集纳入研究的患者术后经石蜡包埋的病理组织标本(由中山大学孙逸仙纪念医院病理科提供),组织切片厚度5μm,用于免疫组织化学检测。实验试剂:鼠抗人SH3GL1单克隆抗体(英国Abcam公司);兔抗人p⁃ERK单克隆抗体(英国Abcam公司);二抗试剂盒-鼠兔通用型Streptavidin⁃HRP试剂盒(北京康为世纪公司);DAB显色液(碧云天生物技术所)。检测方法:组织经常规二甲苯脱蜡、梯度酒精水化后,微波炉高温抗原修复;自然冷却至室温后3%过氧化氢溶液灭活内源性过氧化物酶;一抗4℃孵育过夜(SH3GL1浓度1∶150,p⁃ERK浓度1∶400);复温经二抗孵育后,新鲜配置DAB溶液显色;苏木素复染。用PBS代替一抗作阴性对照。
IHC评分标准:高倍镜观察,根据范围计分(1~4分),1=20%以下染色,2=21%~50%染色,3=51%~80%染色,4=80%以上染色;根据染色深浅计分(0~3分),0=未染色,1=淡黄色,2=棕黄色,3=棕褐色。染色范围及染色深浅乘积作为评价总体染色强弱的依据。0为阴性,≤4为弱阳性,>4为强阳性。
1.4 统计学方法
所有数据通过SPSS 20.0分析。正态分布计量资料以均数±标准差表示,非正态分布计量资料以中位数(全距)表示。不同分组之间IHC表达强度差异比较通过卡方检验;预后的单因素分析采用Kaplan⁃Meier曲线分析,其中不同分组之间的比较采用log⁃rank检验;预后的多因素分析采用Cox比例风险模型;IHC评分之间相关性分析采用Spearman等级相关分析方法。以P<0.05为具有统计学差异。
2 结果
2.1 SH3GL1在原发性肝癌组织中的表达情况
SH3GL1蛋白在原发性肝癌组织中的IHC阳性表达产物表现为棕黄色染色的颗粒,将组织玻片评分后得出,本研究中73例原发性肝癌患者的组织中SH3GL1蛋白阴性表达5(6.8%)例,阳性表达68(93.2%)例,而在此68例阳性表达组织中,弱阳性表达38(52.1%)例,强阳性表达30(41.1%)例。其中代表性IHC图片如图1所示。
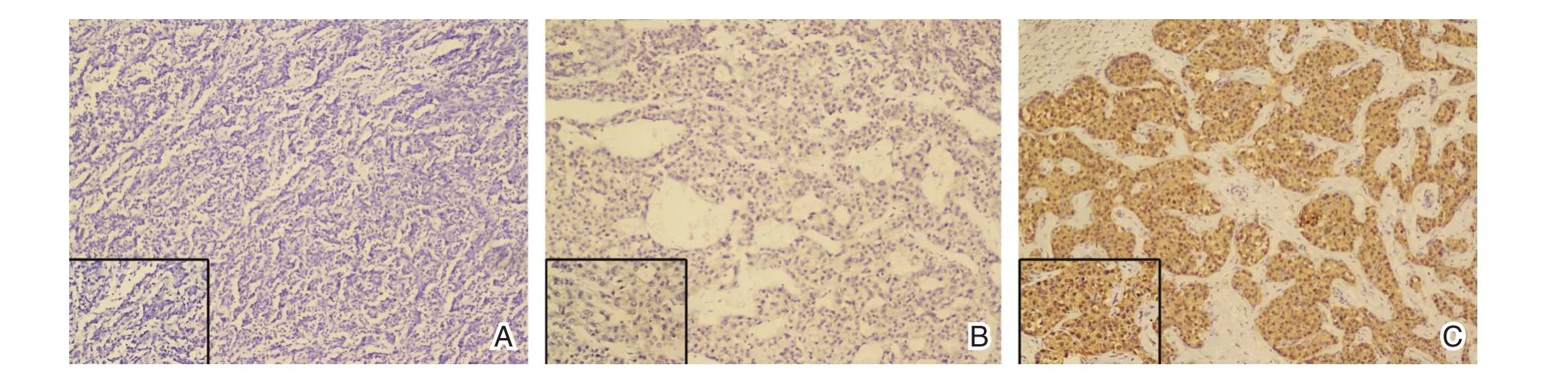
图1 原发性肝癌组织中SH3GL1的表达情况代表性免疫组化图片
2.2 p⁃ERK在原发性肝癌组织中的表达情况
p⁃ERK蛋白在原发性肝癌组织中的IHC阳性表达产物表现为棕黄色染色的颗粒,将组织玻片评分后得出,本研究中73例原发性肝癌患者的组织中p⁃ERK蛋白阴性表达10(13.7%)例,阳性表达63(86.3%)例,而在此63例阳性表达组织中,弱阳性表达44(60.3%)例,强阳性表达19(26.0%)例。其中代表性IHC图片如图2所示。

图2 原发性肝癌组织中p⁃ERK的表达情况代表性免疫组化图片
2.3 SH3GL1与p⁃ERK在原发性肝癌中表达的相关性
由于SH3GL1和p⁃erk免疫组化评分均为等级资料,比较二者相关性时用Spearman等级相关性检验。对本研究中73例原发性肝癌患者组织中的SH3GL1和p⁃ERK免疫组化评分进行相关性分析后结果显示在原发性肝癌组织中,SH3GL1的表达水平和p⁃ERK的表达水平呈正相关关系,二者相关系数r=0.723,P<0.001,表明在肝癌组织中二者的表达可能存在内在联系。
2.4 SH3GL1与p⁃ERK在原发性肝癌患者中的表达和肿瘤病理特点的相关性分析
将SH3GL1蛋白和p⁃ERK的表达量高低分为阴性(-)、弱阳性(+)、强阳性组(++),分别与各临床资料及病理特点进行统计学分析,结果显示SH3GL1的表达与原发性肝癌肝外转移和肿瘤分期相关,而p⁃ERK的表达量则与原发性肝癌的肿瘤分化程度相关。进一步将SH3GL1和p⁃ERK的阴性表达与弱阳性表达合并为弱表达,再将弱表达与强阳性组之间进行对比,可得出SH3GL1的强阳性表达与原发性肝癌肝外转移、肿瘤数量和肿瘤分期相关,而p⁃ERK的强阳性表达则与肿瘤分期相关。结果如表1所示。
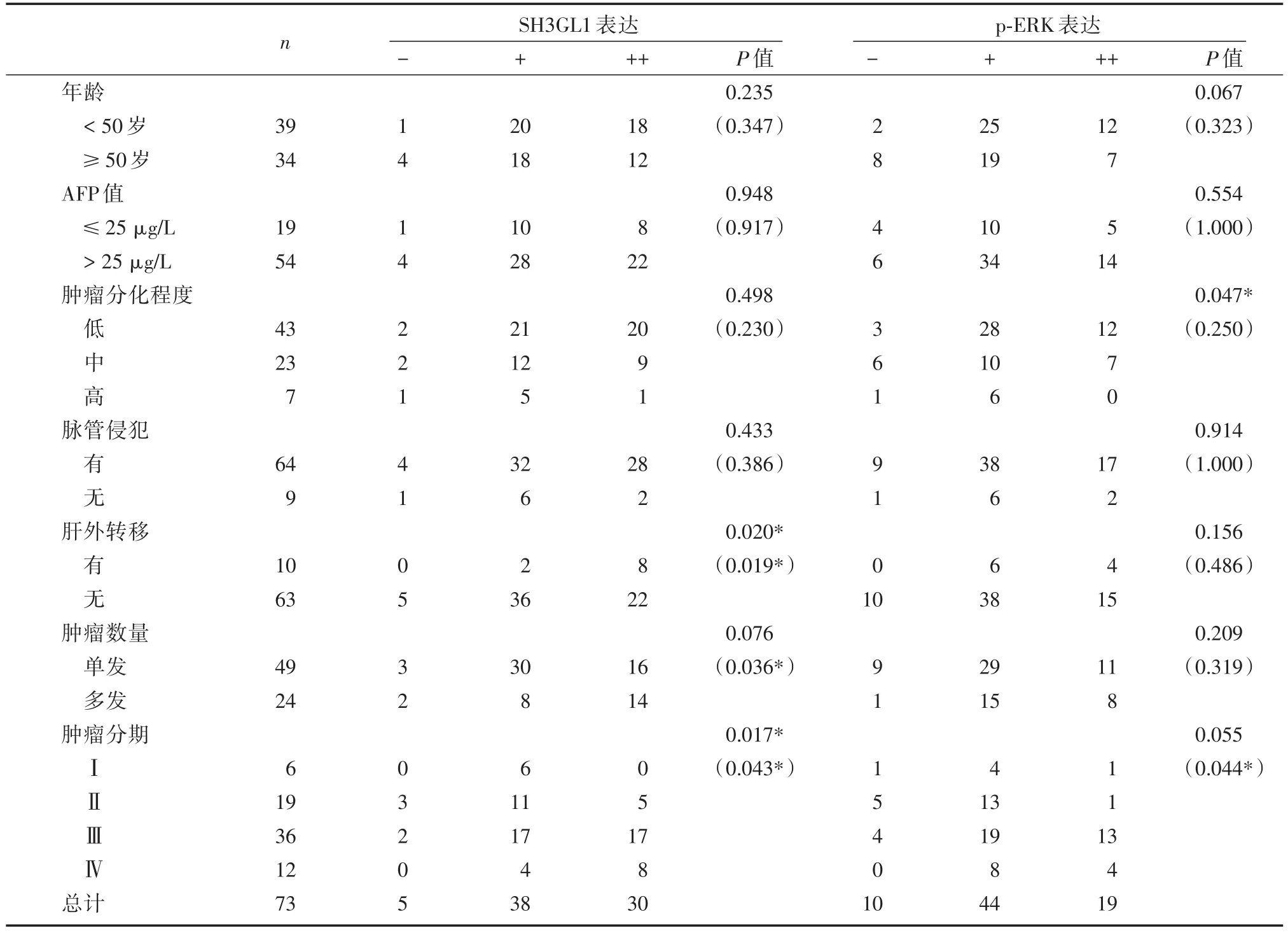
表1 SH 3GL1和p⁃erk表达情况与临床资料及病理资料的关系(n)
2.5 影响原发性肝癌患者预后的各项相关因素分析
将73例患者的各项临床指标和病理特点与患者预后进行分析,首先使用单变量Kaplan⁃Meier曲线逐个筛选分析得出年龄低于50岁、SH3GL1强表达、p⁃ERK强表达、有肝外转移、肿瘤多发为影响原发性肝癌患者术后总体生存的危险因素。而性别、HBsAg表达情况、AFP值、术前肝功能分级、肿瘤分化程度、肿瘤分期、肿瘤是否有脉管侵犯、术前ECOG评分等指标则对患者总体生存率无明显影响。将筛选出来的指标进一步进行Cox比例风险模型多因素分析结果显示,SH3GL1高表达、肿瘤有肝外转移和肿瘤多发为影响预后的独立危险因素。结果如表2所示。
2.6 SH3GL1与p⁃ERK的IHC阳性表达与患者生存预后的关系
绘制Kaplan⁃Meier生存曲线,分别描述SH3GL1蛋白和p⁃erk在原发性肝癌组织中的表达情况与患者总生存时间的关系,结果得出在原发性肝癌患者组织中SH3GL1和p⁃ERK表达强阳性组生存率明显低于其弱阳性组和阴性组。生存曲线结果如图3、图4所示。
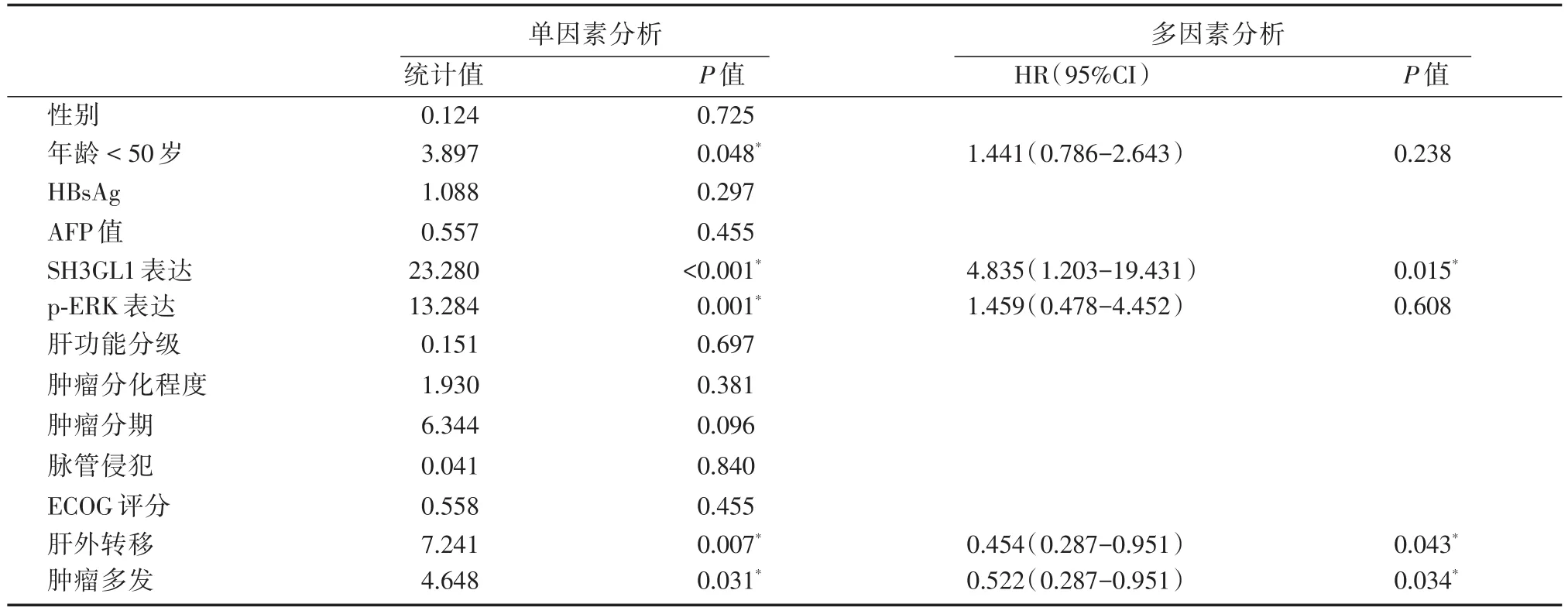
表2 单因素分析和多因素分析各项临床资料和病理资料对于患者预后影响的关系
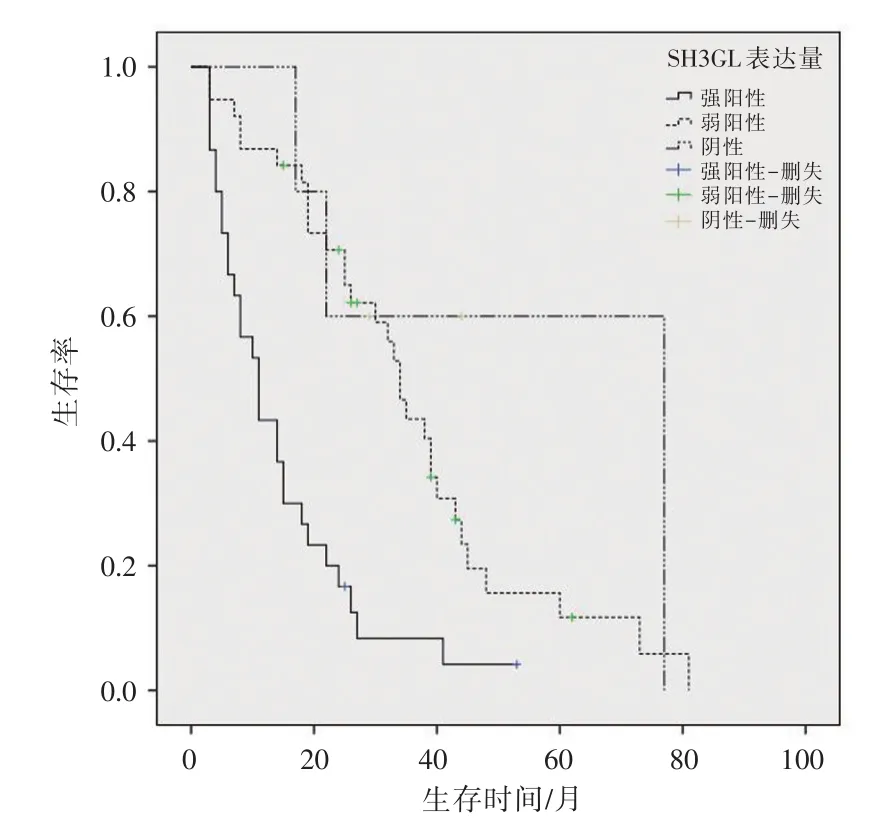
图3 原发性肝癌患者组织中SH 3GL1表达情况与预后的生存分析函数
3 讨论
根据巴塞罗那肝癌临床分期,对于B期、C期的HCC患者,已无肝切除、肝移植、局部消融等根治性治疗指征,仅能对其进行姑息性治疗,包括经皮动脉化疗栓塞术(TACE)、靶向药物治疗、对症治疗等。索拉非尼是目前唯一被批准使用于HCC的靶向药物,然而HCC患者对索拉非尼原发及获得性耐药的现象,大大影响了其治疗效果。
SH3结构域包含SH3GL家族多种蛋白,包括SH3GL1、SH3GL2、SH3GL3等,涉及到细胞极化、运动、酶激活和转录翻译调节等多种功能。SH3GL家族三种蛋白在人体内分布各不相同:SH3GL2主要表达于人体中枢神经系统,SH3GL3则主要表达于中枢神经系统和睾丸组织,而SH3GL1的表达无明显组织特异性[8]。SH3GL1主要的生物学功能是通过调节细胞膜蛋白的分布,进而影响细胞的内吞和外排作用而达成,并通过此途径来影响下游多条细胞信号传导同路[4]。近年来已有不同研究发现SH3GL1对于多种恶性肿瘤生长、增殖、凋亡、转移、耐药等多种功能有着不同程度的影响,SH3GL1在一些肿瘤中可能是潜在的诊断标志物或治疗靶点[9,10]。SH3GL1在正常肝脏组织中通常有低量表达,然而在原发性肝癌组织中SH3GL1的表达情况如何至今仍未见报道,而且SH3GL1对于原发性肝癌的肿瘤特性、临床指标及索拉非尼治疗敏感性的影响也尚不明确,因此本研究旨在通过免疫组织化学实验初步探讨SH3GL1和p⁃ERK在HCC中的表达和其临床意义。
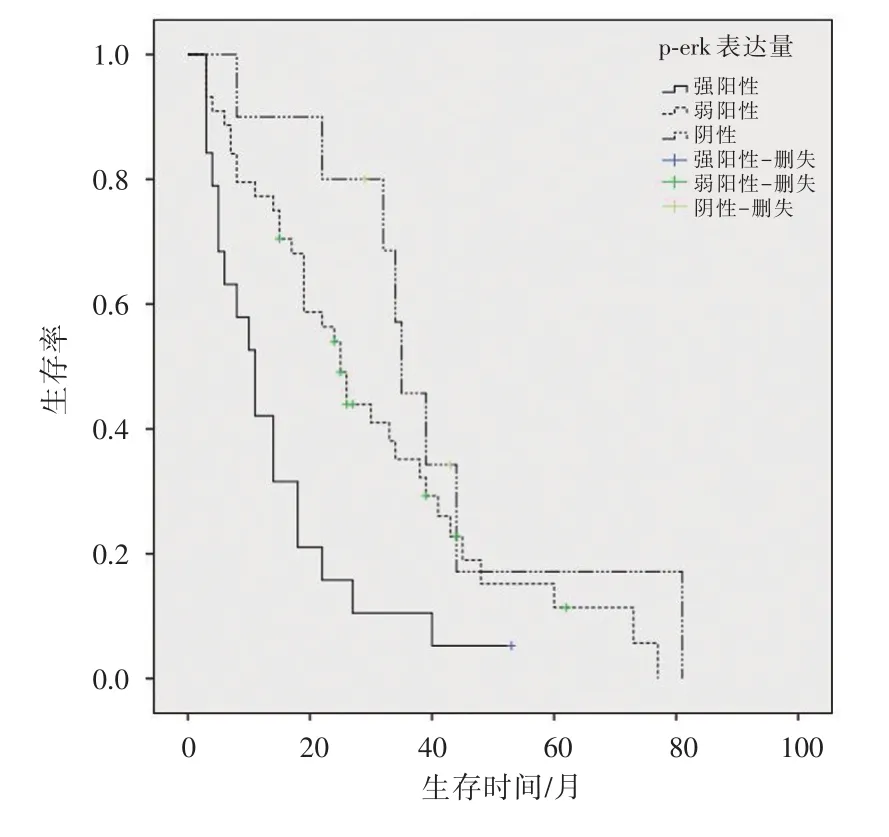
图4 原发性肝癌患者组织中p⁃erk表达情况与预后的生存分析函数
通过收集术后服用索拉非尼患者的病理标本进行免疫组化分析,我们发现,在HCC患者肿瘤组织中,SH3GL1的阴性表达率仅6.8%(5/73),阳性表达率达到93.2%(68/73),而p⁃ERK的阴性表达率也仅有13.7%(10/73),阳性表达率达86.3%(63/73),进一步对二者的表达评分进行相关性分析得出,二者的表达量评分存在正相关关系,表明在原发性肝癌组织中SH3GL1和p⁃ERK的表达可能存在内在联系或互相影响。
在分析SH3GL1和p⁃ERK的表达强度与患者临床特征及病理资料之间的关系时发现,SH3GL1的高表达与患者有肝外转移、肿瘤多发与肿瘤分期相关,而p⁃ERK的高表达则与肿瘤分期相关。本研究中,在有肝外转移的患者中SH3GL1强阳性表达高达80%(8/10),而在无肝外转移的患者中此比例仅为35.0%(22/63);多发肿瘤患者中,SH3GL1的高表达比例(58.3%,14/24)也较单发肿瘤中(32.7%,16/49)更高;在临床分期方面,SH3GL1和p⁃ERK的高表达同样与肿瘤处于中晚期相关。由于对于HCC患者,肿瘤多发、有肝外转移和更晚的分期往往预示着相对更差的预后[11],因此SH3GL1和p⁃ERK的在肝癌组织中的异常高表达可能在一定程度上影响了肿瘤的发生、发展和转移的过程。
对于肝癌术后服用索拉非尼的患者,年龄低于50岁、SH3GL1高表达、p⁃ERK高表达、有肝外转移和肿瘤多发是影响HCC患者生存的危险因素,将这些因素进一步通过Cox比例风险模型分析得出SH3GL1的高表达、肝外转移和肿瘤多发为影响肝癌术后服用索拉非尼的患者总生存期的独立危险因素。由图3可以看出,SH3GL1强阳性的患者总生存率明显低于其弱阳性表达和阴性表达的患者。因此,一方面SH3GL1的高表达可以影响肿瘤的肝外转移和肿瘤发生数量,另外一方面其高表达又是影响原发性肝癌术后服用索拉非尼的患者总生存期的独立危险因素。我们推测SH3GL1的表达量可能通过影响肿瘤的发生发展、转移及分期进而影响原发性肝癌患者索拉非尼治疗的总体预后,SH3GL1可以作为预测HCC患者术后服用索拉非尼预后的一个有效指标,肿瘤组织中高表达SH3GL1的患者对于索拉非尼治疗的敏感性较低表达和阴性表达者更差,总体预后情况也相对更差。
综上所述,本研究发现SH3GL1在原发性肝癌组织中的高表达与肿瘤肝外转移、肿瘤多发及肿瘤分期相关,而p⁃ERK的高表达则与肿瘤分期相关,SH3GL1和p⁃ERK二者在肿瘤组织中的表达呈正相关关系;另外SH3GL1的强阳性表达、有肝外转移灶、肿瘤多发为影响术后服用索拉非尼肝癌患者总生存期的独立危险因素,SH3GL1和p⁃ERK高表达患者服用索拉非尼总生存期低于其弱表达和阴性表达患者。
[1]Raoul JL,Bruix J,Greten TF,et al.Relationship between baseline hepatic status and outcome,and effect of sorafenib on liver function:SHARP trial subanalyses[J].JHepatol,2012,56(5):1080-1088.
[2]Wang MQ,Kim W,Gao G,et al.Endophilins interact with Moloney murine leukemia virus Gag and modulate virion production[J].JBiol,2003,3(1):4.
[3]Ma L H,Liu H,Xiong H,et al.Aberrant transcriptional regulation of the MLL fusion partner EEN by AML1⁃ETO and its implication in leukemogenesis[J].Blood,2007,109(2):769-777.
[4]Huang EW,Xue SJ,Li XY,et al.EEN regulates the proliferation and survival of multiple myeloma cells by potentiating IGF⁃1 secretion[J].Biochem Biophys Res Commun,2014,447(2):271-277.
[5]Liu H,He Z,Simon HU.Targeting autophagy as a potential therapeutic approach formelanoma therapy[J].Semin Cancer Biol,2013,23(5):352-360.
[6]Baldassarre T,Watt K,Truesdell P,et al.Endophilin A2 promotes TNBC cell invasion and tumor Metastasis[J].Mol Cancer Res,2015,13(6):1044-1055.
[7]Wu CH,Wu X,Zhang HW.Inhibition of acquired⁃resistance hepatocellular carcinoma cell growth by combining sorafenib with phosphoinositide 3⁃kinase and rat sarcoma inhibitor[J].J Surg Res,2016,206(2):371-379.
[8]So CW,Sham MH,Chew SL,et al.Expression and protein⁃binding studies of the EEN gene family,new interacting partners for dynamin,synaptojanin and huntingtin proteins[J].Biochem J,2000,348 Pt2:447-458.
[9]Zhao L,Wang H,Liu C,et al.Promotion of colorectal cancer growth and metastasis by the LIM and SH3 domain protein 1[J].Gut,2010,59(9):1226-1235.
[10]Matsutani T,Hiwasa T,Takiguchi M,et al.Autologous antibody to src⁃homology 3⁃domain GRB2⁃like 1 specifically increases in the sera of patients with low⁃grade gliomas[J].J Exp Clin Cancer Res,2012,31:85.
[11]Llovet JM,Burroughs A,Bruix J.Hepatocellular carcinoma[J].Lancet,2003,362(9399):1907-1917.
Expression of SH3GL1 and p ⁃ ERK in hepatocellular carcinoma and their impact on efficacy of sorafenib therapy
WU Xiang,ZENG Baiqiang,RAN Yihong,ZHANG Hongwei.Department of Hepatobiliary Surgery,Sun Yat⁃sen Memorial Hospital,Guangzhou 510289,China.Corresponding author:ZHANGHongwei,hongweizhang88@126.com
Objective To evaluate the expression ofSH3GL1 and p⁃ERK in hepatocellularcarci⁃mona(HCC)and their correlation with the clinical characteristics and their impact on the efficacy of sorafenib therapy.M ethods The specimens of the patientswho underwent surgical resection due to HCC in Sun Yat⁃sen Memorial Hospitaland then
sorafenib therapy after the surgerywere collected from January 2008 to December 2016.Immunohistochemical staining(IHC)was used to analyze the expression of SH3GL1 and p⁃ERK in these tissues.The information of the patients included the gender,age,status of HBsAg,AFP value,Child⁃Pugh stage of liver function,ECOG performance status before surgery,tumor differentiation degree,vascular invasion,extrahepatic metastasis,tumor number and tumor staging was divided into differentgroups.Further,the correlations between the IHC scores and the clinical factorsand the prognosis of patients were analyzed.Results The positive rate of SH3GL1 and p⁃ERK in HCC sampleswere high,and there was positive correlation between these two proteins(P<0.001).The strong expression of SH3GL1 was correlated with extrahepatic metastasis,multiple tumor and tumor staging,while the strong expression of p⁃ERK was correlated with tumor staging.The risk factors thatworsened the prognosis of HCC patientswho received sorafenib treatmentafter surgical resection included age less than50 years old,strong expression of SH3GL1,strong expression of p⁃ERK,existence of extrahepatic metastasis and multiple tumor.Further,strong expression of SH3GL1,existence of extrahepatic metastasis and multiple tumor were the independent risk factor.Conclusion The expression of SH3GL1 and p⁃ERK were correlated with several tumor characteristics of HCC and the prognosis of patients,and high expression of these two proteinsare risk factor for patients overall survival.
hepatocellular carcinoma;sorafenib;SH3GL1;p⁃ERK;drug resistance
R735.7
A
10.3969/j.issn.1009⁃976X.2017.03.001
2017-05-10)
广东省科技计划项目(2012B031800073)
510289广州中山大学孙逸仙纪念医院肝胆外科
*通讯作者:张红卫,Email:hongweizhang88@126.com

