载阿霉素的γ-PGA-co-PLA-DPPE纳米载药系统对C6细胞的毒性研究①
王公钊,刘君星,辛 华,王振玉,刘春辉,乔 峰,王 琳
(1.佳木斯大学附属第一医院,黑龙江 佳木斯 154003;2.佳木斯大学基础医学院,黑龙江 佳木斯 154007)
载阿霉素的γ-PGA-co-PLA-DPPE纳米载药系统对C6细胞的毒性研究①
王公钊1,刘君星2,辛 华1,王振玉1,刘春辉1,乔 峰1,王 琳1
(1.佳木斯大学附属第一医院,黑龙江 佳木斯 154003;2.佳木斯大学基础医学院,黑龙江 佳木斯 154007)
目的:研究载DOX(阿霉素)的γ-PGA-co-PLA-DPPE纳米载药系统(NPS)对C6细胞(大鼠胶质瘤细胞)的毒性作用。方法:通过乳化/溶剂蒸发法制备NPS-DOX和Tf-NPS-DOX,用MTT法检测NPS-DOX和Tf-NPS-DOX对体外培养的C6细胞的毒性作用,并以NPS、Tf-NPS、DOX作为对照组。结果:24h时,药物浓度为0.1μg/mL时,Tf-DOX-NPS的作用比较明显,存活率为78.90%,而NPS-DOX组为93.77%,DOX组为95.54%;随着药物浓度的增高及时间的延长,48hNPS-DOX体现了更好的杀伤作用,4μg/mL作用48h时存活率仅为19.34%,而DOX的存活率为34.98%,Tf-DOX-NPS存活率为26.36%。结论:载DOX(阿霉素)的γ-PGA-co-PLA-DPPE纳米载药系统比单纯抗癌药对C6细胞的毒性作用更强。
纳米载药系统;阿霉素;靶向;C6细胞
阿霉素(Doxorubicin)是一种应用广泛的化疗药物,已经被美国食品药品管理局认证为最有效的癌症化疗药物之一,但其较低水溶性及低选择性限制了它的临床应用,患者用药后骨髓抑制和心脏毒性呈现剂量依赖[1]。在过去的十几年中,对共聚物纳米粒做为运载化疗药物工具的研究日益增加,纳米载药系统凭借其独特的药物靶向策略和药物释放机制改善了药物递送过程中稳定性低、溶解度小、选择性差等问题,显著增强了药物的抗肿瘤作用[2,3]。在本实验中,我们选择了具有良好生物相容性的两亲性纳米聚合物γ-PGA-co-PLA-DPPE(γ-多聚谷氨酸-聚乳酸-二棕榈酰磷酯酰乙醇胺)作为载体,通过乳化/溶剂蒸发法包载阿霉素,并在载体上引入转铁蛋白(Tf)靶向基,最后以C6细胞为模型,比较纳米药物和游离药物在相同剂量时对肿瘤细胞生长的抑制作用。
1 材料与方法
1.1 主要仪器与试剂
酶标仪(RS-232-C,美国BIO-RAD公司),倒置式生物显微镜(CKX41,Olympus),二氧化碳培养箱(E191IR/W200IR,美国西蒙公司)。C6细胞购买于ATCC细胞库,MTS试剂(CellTiter96AQueousOneSolutionCellProliferationAssay)购买于Promega公司。所有其他试剂和溶剂均为分析级。
1.2 方法
1.2.1 载药纳米粒子的制备
纳米载体由国家纳米中心提供,载有阿霉素的纳米粒子是通过乳化/溶剂蒸发法制备[4]。以Tf-NPS-DOX为例,将20mg纳米共聚物溶于2mL二氯甲烷(DCM)构成共聚物溶液,1mg的DOX溶解在1mLDCM中。取400μLDOX溶液滴加到2mL共聚物溶液中,并加入1%的PVA。磁力搅拌10min后,在40w功率下超声5min,所得乳状液减压蒸馏除去溶液中的二氯甲烷。旋蒸后的乳状液在13000rpm下离心20min得靶向载药纳米粒子,去离子水洗涤三次除去残留的PVA。将载药纳米粒子溶解在PBS(pH=7.4)溶液中,备用。
1.2.2MTT法检测药物对细胞的毒性作用
用MTT法测定NPS、Tf-NPS、NPS-DOX、Tf-NPS-DOX、DOX对体外培养的C6细胞的细胞毒性。体外培养C6细胞(培养基为DMEM,含10%胎牛血清,1.2%双抗,培养温度为37℃,二氧化碳浓度5%),当细胞处于对数生长期时,用PBS冲洗细胞2遍,胰酶消化,细胞计数板计数,调节浓度至 1×105/mL;将细胞接种于96孔细胞培养板,每孔接种100μL(约1×104个细胞),培养24h;弃去培养基,每孔加入100μL含4μg/mL,2μg/mL,1μg/mL,0.1μg/mL,0.01μg/mL的NPS、Tf-NPS、NPS-DOX、Tf-NPS-DOX、DOXDMEM培养基,另设空白组(不加药),每个浓度4个平行样品,继续培养至预定时间24h和48h;每孔加入20μLMTS试剂,37℃静置1h。全自动酶标仪于490nm波长检测溶液吸光值,实验重复3次。绘制不同药物浓度下不同作用时间的细胞生长曲线。
2 结果
图A、B显示,从0.01~4μg/mL不同浓度的药物诱导培养后,细胞存活率的变化。可以发现,NPS组在0.1μg/mL以下时没有产生明显的毒性,证明了共聚物纳米粒子在0.1μg/mL以下具有良好的生物安全性。
NPS-DOX组、Tf-NPS-DOX组、DOX组,随着药物作用时间的增加以及阿霉素浓度的升高,细胞活力明显降低。药物作用24h时,Tf-NPS-DOX组在较低浓度(0.1μg/mL)时,率先显示出比较好的抑制作用,细胞存活率为78.90%,这是由癌细胞表面高表达的转铁蛋白受体高效的介导Tf-NPS-DOX入胞产生作用[5];高浓度时,24h三组的毒性作用相差不大,而培养48h后,NPS-DOX组、Tf-NPS-DOX组毒性作用明显优于DOX组,可以归因于阿霉素由NPS-DOX、Tf-NPS-DOX释放缓慢。这是因为纳米粒子进入细胞是采取主动转运,但游离的DOX进入细胞是通过扩散,扩散通路的激活可以使游离DOX快速进入细胞,而装载DOX的纳米颗粒的药物释放需要酸性环境触发,如酸性细胞器[4]。
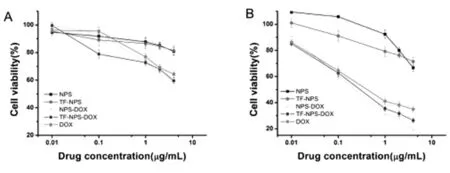
图A,图B 分别为NPS、Tf-NPS、NPS-DOX、Tf-NPS-DOX、DOX作用于C6细胞24h、48h的细胞存活率-药物浓度曲线
3 讨论
化疗药物是治疗肿瘤的主要方法之一,但化疗药会随着血液循环到达全身绝大部分器官与组织,选择性差;而且具有明显的阈值,增加到一定量时具有明显的毒副作用,呈现剂量依赖性[6]。纳米载药系统可以通过被动靶向(主要为EPR效应)和主动靶向(载药纳米颗粒表面肿瘤靶向配体修饰)克服这一缺陷,比如:RGD修饰的纳米载药系统,EricA.Murphy等人用RGD修饰载有阿霉素的纳米粒子,并观察到载药纳米粒子在整合素过量表达的肿瘤血管处富集并引起细胞的凋亡,相对于游离阿霉素,抑制肿瘤转移的能力增强了15倍[7]。
在本实验中,我们利用γ-PGA的亲水性及PLA的疏水性片段,组成新型的两亲性纳米粒子γ-PGA-co-PLA-DPPE,并在载体上结合了Tf以提高药物的靶向性。实验结果显示,具有转铁蛋白修饰的药物在较低浓度时率先显示出较好的抑制作用,此与TfR的高效介导药物入胞相关。在正常细胞中,TfR(转铁蛋白受体)表达水平较低,而快速生长的肿瘤细胞因为需铁量增加,TfR表达显著增加,可达正常细胞的10~100倍[8],相比非靶向载药纳米粒子,肿瘤靶向修饰的载药纳米胶束能够更有效地抑制肿瘤细胞的生长,更迅速地穿透细胞膜并更多的在细胞内积累。此外通过对24h与48h结果对比,得出载药纳米颗粒具有缓释特性,可以增加药物在体内的作用时间,降低用药量。
综上所述,我们评价了载DOX的γ-PGA-co-PLA-DPPE纳米载药系统对C6细胞的毒性作用,可为临床用药提供一定的实验基础和理论依据,希望能够早日将更多的纳米载药系统推向临床试验。
[1]MohanP,RapoportN.Doxorubicinasamolecularnanotheranosticagent:effectofdoxorubicinencapsulationinmicellesornanoemulsionsontheultrasound-mediatedintracellulardeliveryandnucleartrafficking[J].MolecularPharmaceutics, 2010, 7(6):1959-1973
[2]李晶晶, 郭曼曼, 韩顺平,等. 共修饰冰片和叶酸的阿霉素聚酰胺-胺纳米给药系统的制备及体外评价[J]. 药学学报, 2015,(7):59
[3]陈熙, 张馨欣, 李菲菲,等. 载盐酸伊立替康的半乳糖修饰脂质-介孔硅核壳纳米粒对肝癌细胞的抑制效果[J]. 药学学报, 2014,(5):1156
[4]LiuX,SuS,WeiF,etal.ConstructionofnanoparticleSbasedonamphiphiliccopolymersofpoly(gamma-glutamicacidco-L-lactide)-1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamineasapotentialdrugdeliverycarrier[J].JournalofColloid&InterfaceScience, 2014, 413:54-64
[5]李华, 胡世林, 王海龙,等. 转铁蛋白修饰共载阿霉素和Rg3脂质体靶向抑制胃癌细胞增殖[J]. 中国生化药物杂志, 2014, 34(1):1
[6]李明军, 李英夫, 吴雁,等. 氰基丙烯酸正丁酯纳米载体促进紫杉醇粒抗脑胶质瘤作用的实验研究[J]. 黑龙江医药科学, 2015, 38(2):29-30
[7]MurphyEA,MajetiBK,BarnesLA,etal.Nanoparticle-mediateddrugdeliverytotumorvasculaturesuppressesmetastasis[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2008, 105(27):9343-9348
[8]QianZM,LiH,SunH,etal.Targeteddrugdeliveryviathetransferrinreceptor-mediatedendocytosispathway[J]. 中国药学(英文版), 2009, 54(4):561-587
佳木斯大学研究生创新项目,编号:LZR2015-013。
王公钊(1990~)男,山东泰安人,在读硕士研究生。
王琳(1974~)女,黑龙江佳木斯人,硕士,副教授,硕士研究生导师。E-mail:wanglin4477@163.com。
R
A
1008-0104(2017)03-0078-02
2017-03-16)

