GST-CBX2-1融合蛋白表达载体的构建及其在原核细胞中的表达①
刘婷隽,洪泽辉,胡安康
(1.徐州医科大学实验动物中心,江苏 徐州 221004;2.东南大学基础医学院,江苏 徐州 221004)
GST-CBX2-1融合蛋白表达载体的构建及其在原核细胞中的表达①
刘婷隽1,洪泽辉2,胡安康1
(1.徐州医科大学实验动物中心,江苏 徐州 221004;2.东南大学基础医学院,江苏 徐州 221004)
目的:构建GST标签的CBX2-1融合蛋白表达载体,并在大肠杆菌中诱导表达,纯化出表达蛋白。方法:以CBX2-1全长为模板,构建3对引物,将CBX2-1PCR扩增成3段,通过XhoⅠ和NotⅠ酶切位点将其定向插入pGEX-4T-3载体中,并转化E.coliDH5ɑ,通过限制性内切酶酶切电泳和DNA测序坚定正确后,转入E.coliBL21中,经IPTG大量诱导表达,SDS-PAGE电泳和Westernblot鉴定,运用GSTpulldown方法纯化3段蛋白。结果:酶切电泳及测序结果证明,原核表达质粒GST-CBX2-1 3个载体构建成功,用Westernblot方法证实了GST-CBX2-1-1(1-288),GST-CBX2-1-2(259-600),GST-CBX2-1-3(601-1596)融合蛋白的表达,并成功纯化出3段蛋白。结论:成功构建了GST-CBX2-1-1,GST-CBX2-1-2,GST-CBX2-1-3原核表达载体,证实了其在原核细胞大肠埃希菌中的表达与纯化,为进一步研究CBX2-1各结构域的功能提供了前提基础。
CBX2-1蛋白;原核表达;载体构建;蛋白纯化
多梳家族(PcG)蛋白可以作为组蛋白修饰激酶,通过调节染色质高级结构参与基因表达的调控[1]。研究表明,PcG成员参与不同的细胞过程,例如干细胞分化、细胞命运决定、衰老、哺乳动物或肿瘤形成过程中调节X染色体的失活[2~4]。CBX2,是Pc家族同系物,N端含有染色质结构域,C端含有高度保守的Pc盒[5,6]。在人类CBX2基因座上,含有两个转录体,一个转录体是由5个外显子组成含有532个基因的亚体CBX2-1,其包含保守的染色质结构域和Pc盒。另一个转录体CBX2-2由4个外显子组成包含211个基因,其只存在染色质结构域,没有Pc盒[7]。前人的研究发现,CBX2-1比CBX2-2表达量更高,对CBX2-1的探究更深入,于是本实验选取CBX2-1作为研究对象。为深入研究CBX2-1各结构域的功能及分子机制,我们利用分子克隆技术成功构建了CBX2-1-1、CBX2-1-2、CBX2-1-3基因原核表达载体,并在大肠埃希菌中诱导表达其融合蛋白,GSTpulldown成功纯化3段蛋白,为CBX2-1各结构域功能的研究提供了基础。
1 材料与方法
1.1 实验材料
1.1.1 供试材料
CBX2-1模版由东南大学洪泽辉老师实验室提供;引物合成由南京金斯瑞生物科技有限公司合成;RedTaqDNA聚合酶、10mmol/LdNTPs、10×PCRBuffer(Mg2+free) 、25mmol/LMgCl2、无菌双蒸水ddH2O、琼脂糖、溴化乙锭(EB)、TAE电泳缓冲液、SDS凝胶上样缓冲液、半干转转移缓冲液、Tris-Glycine电泳缓冲液。
1.1.2 引物设计
设计3对引物送南京金斯瑞公司合成,见表1。

表1 扩增目的基因的引物序列
F-1、F-259、F-601的5’端添加XhoⅠ酶切位点,R-288、R-600、R-1596的3’端添加NotⅠ酶切位点。
1.1.3 主要试剂盒
TaKaRaDNABluntingKit(DNA平滑化连接试剂盒)、TaKaRaTaqTM酶、TaKaRaMiniBESTPlasmidPurificationKitVer.2.0(质粒提取试剂盒)和TaKaRaAgaroseGelDNAPurificationKitVer.2.0(琼脂糖胶回收提纯DNA试剂盒)购自宝生物工程(大连)有限公司;RestrictionEndonuclease(限制性内切酶)与T4DNALigase(T4DNA连接酶)购自NEB(北京)生物科技有限公司、GSTResin购于南京金斯瑞公司、兔抗鼠二抗(HRP标记)购于上海Genetech公司、ECLplus购于美国GE公司。
1.1.4 主要仪器设备
MJPCR扩增仪、Eppendorf移液枪、Eeppendorf超速冷冻离心机、DYY-8C型电泳仪、凝胶成像系统、恒温摇床、恒温培养箱、恒温干燥箱、低温冰箱、超低温冰箱、超净工作台、高压灭菌锅、SP-2102UV型微量紫外分光光度计、LQP-B-4颗粒测定仪(制冰机),超声机等。
1.2 实验方法
1.2.1GST-CBX2-1-1(1-288),GST-CBX2-1-2(259-600),GST-CBX2-1-3(601-1596)融合蛋白表达载体的构建
PCR扩增CBX2-13段基因,将pGEX-4T-3载体和CBX2-1 3段PCR产物分别用NotⅠ和XhoⅠ两个限制性内切酶双酶切,并进一步纯化,T4DNA连接酶16℃连接4h,然后涂到含有氨苄抗性的培养板上,37℃过夜,挑取白色克隆,转化到DH5α感受态细胞中,37℃、250rpm过夜培养。提取质粒后酶切及测序验证。
1.2.2 重组蛋白在原核细胞中的大量表达
将鉴定正确的重组质粒pGEX-4T-CBX2-1及pGEX-4T-3空载体转化大肠杆菌BL21,37℃、250rpm振荡培养过夜。过夜的培养液以1:50转接于含100mL新鲜培养基的锥形瓶中,37℃、250rpm振荡培养1.5~2h,使OD值达0.4~0.6。加入IPTG(终浓度为0.5mM,37℃、250rpm条件下培养8h。
1.2.3GST-CBX2-1-1(1-288),GST-CBX2-1-2(259-600),GST-CBX2-1-3(601-1596)融合蛋白的纯化
诱导后的细菌在4℃、5000rpm条件下离心15min,用冰PBS洗一次,离心去上清。取沉淀菌体,向沉淀中加入8mLPBS和终浓度为1mM的PMSF,超声破碎大肠杆菌细胞,超声条件为:超10s,停10s,40%功率,15min。整个超声过程需在冰上进行,以防超声过程中蛋白质预热变性。
超声后,12000rpm,离心15min取上清,分别与GlutathioneResinbeads孵育,4℃旋转过夜,次日,3000rpm,5min,离心收集珠子。用含有500mMNacl,1%TritonX-100的PBS洗涤珠子,4℃旋转5min,共5次。离心收集珠子,SDS-PAGE电泳后考马斯亮蓝染色检测纯化结果。
1.2.4 Western Blot
将纯化好的珠子,加入适量SDS loading buffer裂解,100℃、煮沸5min。12000rpm、离心15min,取上清。等量的蛋白通过12%的SDS-PAGE凝胶进行跑胶分离,并转移至PVDF膜上,用2%脱脂奶粉封闭1h,并分别用GST(1:2000)、p53(1:1000)、抗体孵育,4℃孵育过夜,TBST洗膜;加入HRP标记的羊抗鼠(1:2000)二抗,室温孵育2h,TBST洗膜;ECL显色、发光。
2 结果
2.1 PCR反应扩增3段CBX2-1基因
在本实验中,我们将其分为1-288,259-600,601-1596三段,分别对CBX2-1所分的3段基因进行PCR扩增,可见约288bp、342bp、997bp的特异性片段与预期相符,见图1。
2.2 GST-CBX2-1-1(1-288),GST-CBX2-1-2(259-600),GST-CBX2-1-3(601-1596)原核表达载体的构建及鉴定
重组质粒GST-CBX2-1-1、GST-CBX2-1-2、GST-CBX2-1-3经XhoⅠ和NotⅠ双酶切后得到相应大小的条带,见图2,与预期一致,进一步测序鉴定正确。

图1 CBX2-1的3段目的基因PCR产物电泳图
M DNA标志物;1、2、3分别为CBX2-1 3段目的基因的PCR产物

图2 GST-CBX2-1-1,GST-CBX2-1-2,GST-CBX2-1-3经XhoⅠ和NotⅠ双酶切结果电泳图
2.3 GST-CBX2-1-1(1-288),GST-CBX2-1-2(259-600),GST-CBX2-1-3(601-1596) 重组质粒在大肠杆菌BL21中的诱导表达
将3个重组质粒转化至E.coli BL21中,在0.5mmol/L IPTG、30℃下,诱导表达3h,考马斯亮蓝染色后在40kDa、42kDa、68kDa附近出现明显的特异性条带,其分子量与预期相符,见图3。
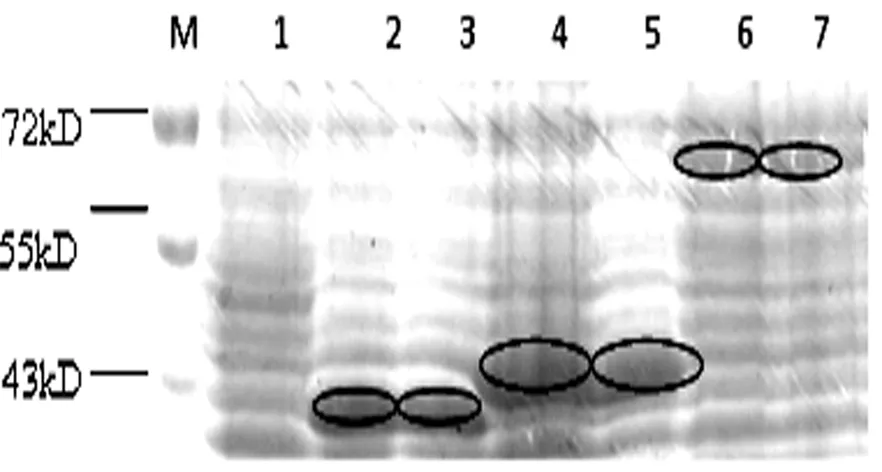
图3 考马斯亮蓝染色鉴定GST-CBX2-13段蛋白在原核细胞中的表达
2.4 GST-CBX2-1-1、GST-CBX2-1-2、GST-CBX2-1-3 融合蛋白的纯化及鉴定
运用GST pull down实验原理,对CBX2-1的3段基因表达的蛋白质进行纯化,SDS-PAGE电泳分离,考马斯亮蓝染色后在40 kDa、42 kDa、68 kDa附近出现明显的特异性条带,其分子量与预期相符,见图4。
2.5 Western Blot检测CBX2-1的3段蛋白的纯化结果
Western Blot进一步鉴定GST-CBX2-1-1、GST-CBX2-1-2、GST-CBX2-1-3的表达,结果可见在40 kDa、42 kDa、68 kDa附近出现明显的特异性条带,见图5,说明成功表达出3段重组融合蛋白。

图4 考马斯亮蓝检测GST pull down纯化CBX2-1 3段蛋白

图5 Western Blot检测CBX2-1的3段蛋白的纯化
3 讨论
CBX2参与人类性成熟过程,它和鼠中同源蛋白M33都是PcG家族成员。研究发现[8],与其他的前列腺癌相比,在神经性前列腺癌中CBX2作为作重要的表观遗传学上调因子。CBX2的高表达与患者的预后结果差及更严重的肿瘤表型密切相关,并符合神经性前列腺癌的临床特征。人类CBX2存在两个转录本,CBX2-1含有532个基因,CBX2-2含有211个基因。为了深入研究CBX2-1各结构域的生物学功能,构建CBX2-1的原核表达载体是关键之一。在本研究中,我们根据CBX2-1的空间结构将CBX2-1分成3段,成功构建GBX2-1-1
(1-288),CBX2-1-2(259-600),CBX2-1-3(601-1596)的原核表达载体,并利用IPTG进行大量诱导表达,获得GST-GBX2-1-1,GST-CBX2-1-2,GST-CBX2-1-3纯化蛋白。在载体选择上,我们采用了pGEX-4T-3载体,此类载体带有GST标签,能够增加目的蛋白的溶解度,融合蛋白可以很方便地从细菌细胞裂解液中用Glutathione Sepharose等柱料吸附纯化。pGEX载体带有一个tac启动子,可作诱导表达用,适用于任何大肠杆菌,并且可以用温和的洗脱条件从亲和介质上洗脱下来,最大限度地减少对抗原性的活性损伤。
本研究为进一步了解CBX2-1蛋白各结构域的功能提供了分子生物学的基础,并为进一步探索CBX2-1相互作用的蛋白及其与肿瘤发生发展的关系提供了新思路。
[1]Simon JA and RE Kingston. Occupying chromatin: Polycomb mechanisms for getting to genomic targets, stopping transcriptional traffic, and staying put[J]. Mol Cell,2013,49(5):808-824
[2]Kennison JA.The Polycomb and trithorax group proteins of Drosophila: trans-regulators of homeotic gene function[J]. Annu Rev Genet,1995,29:289-303
[3]Ringrose L and R Paro. Epigenetic regulation of cellular memory by the Polycomb and Trithorax group proteins[J]. Annu Rev Genet, 2004,38:413-443
[4]Sparmann A and M van Lohuizen.Polycomb silencers control cell fate, development and cancer[J].Nat Rev Cancer, 2006,6(11):846-856
[5]Schuettengruber B.Genome regulation by polycomb and trithorax proteins[J]. Cell, 2007,128(4):735-745
[6]Bracken AP and K Helin.Polycomb group proteins: navigators of lineage pathways led astray in cancer[J]. Nat Rev Cancer, 2009,9(11):773-784
[7]Katoh-Fukui Y. Male-to-female sex reversal in M33 mutant mice[J]. Nature, 1998,393(6686):688-692
[8]Clermont PL.Polycomb-mediated silencing in neuroendocrine prostate cancer[J]. Clin Epigenetics, 2015,7:40
江苏省高校自然科学基金资助项目,编号:13KJD180003。
刘婷隽(1990~)女,江苏徐州人,硕士,助理实验师。
胡安康(1981~)男,江苏徐州人,博士,高级实验师。E-mail:5501908@qq.com。
Q
A
1008-0104(2017)03-0118-03
2017-03-16)

