大鼠在不同力度打击造成弥漫性轴索损伤后脑脊液NGF的表达①
韩骏飞,李明军,孙凌峰,王崇禧
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
大鼠在不同力度打击造成弥漫性轴索损伤后脑脊液NGF的表达①
韩骏飞,李明军,孙凌峰,王崇禧
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
目的:探究大鼠脑脊液中神经生长因子(Nervegrowthfactor,NGF)在不同力度打击造成弥漫性轴索损伤(Diffuseaxonalinjury,DAI)后的表达及其与损伤严重水平的相关性。方法:选取48只SD大鼠(雌雄不限),随机分为A、B、C、D、E和假手术组F。在Marmarou等研究的基础上,制作不同力度DAI模型致伤装置,分别采用A组(砝码悬挂高度及质量:70cm×400g)(下同),B组(80cm×400g),C组(90cm×400g),D组(100cm×400g),E组(110cm×400g)冲击力击打大鼠头部,以造出DAI模型以及F假手术组(无冲击力损伤),共6组。于造模成功后第24h,取脑脊液采用酶联免疫吸附试验检测,后处死大鼠制作脑组织标本,观察选取符合DAI模型的大鼠脑脊液标本进行统计。结果:在正常大鼠脑脊液中存在NGF,且DAI后脑脊液NGF含量较正常增多,与假手术组有差别(P<0.05);损伤后各组间也有差别(P<0.05),随损伤程度加重,大鼠脑脊液中NGF含量增加。结论:NGF水平与大鼠弥漫性轴索损伤的严重程度密切相关,NGF的水平可以作为评估DAI严重程度的一种方法。
弥漫性轴索损伤;神经生长因子;酶联免疫吸附试验;大鼠
NGF是研究较为广泛的神经生长因子,通过整体实验模型发现NGF作用巨大,可以保护和修复变性以及坏死的脑缺血神经细胞[1]。NGF结合受体trkA进而产生作用。成熟神经细胞的存活需要其维持,其对损伤细胞的修复有促进作用并且参与细胞凋亡。颅内NGF的量在个体生长、衰老历程中有着复杂的变化,可能与神经细胞分化、功能联系的建立和维持及衰老有密切关系。探求脑脊液及脑组织中NGF在不同力度DAI后表达的变化,目的为临床上判断DAI后患者损伤程度水平提供新思路。
1 材料与方法
1.1 实验对象
选取48只SD大鼠(雌雄不限),体重(310±10)g,不同性别大鼠随机分成A组(砝码悬挂高度及质量:70cm×400g)(下同),B组(80cm×400g),C组(90cm×400g),D组(100cm×400g),E组(110cm×400g)DAI模型以及假手术组F组(无冲击力损伤),各组数目一致。
1.2 制作模型和相关检测
DAI模型制作参照Marmarou等的基础上,制作不同力度DAI模型。质量分数为10%的水合氯醛(400mg/kg)腹腔注射麻醉后,头顶部去毛,分离组织至骨膜暴露颅骨冠状缝与人字缝之间的颅骨穹隆。术区安放不锈钢垫片,移至自制致伤设备有机玻璃管正下端,使砝码处于玻璃管中心位置。待大鼠出现角膜反射及刺痛反应确证苏醒后,分别按规定的打击高度使砝码自由落体,打击不锈钢垫片后即时移走大鼠,避免再次损伤。A组(70cm×400g)、B组(80cm×400g)、C组(90cm×400g)、D组(100cm×400g)、E组(110cm×400g)以及假手术组F组(无冲击力损伤)。大鼠打击后,将各组大鼠分笼饲养,意识障碍恢复后自行进食水。于造模成功后第24h,取脑脊液采用酶联免疫法检测,记录各数据后处死大鼠制作脑组织标本,观察指标:(1)生命体征及神经系统表现;(2)应用光学显微镜和透射电镜观察脑组织标本形态及病理学变化。选取符合DAI模型SD大鼠脑脊液标本进行统计。
1.3 统计学方法
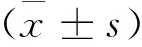
2 结果
NGF在正常大鼠脑脊液中会有少量的存在,SD大鼠DAI后脑脊液中NGF含量均较正常增多,与假手术组有显著差异(P<0.05);损伤后各组间也有显著差异(P>0.05),随实验损伤程度水平加重,大鼠脑脊液中NGF含量呈增多变化,见表1。
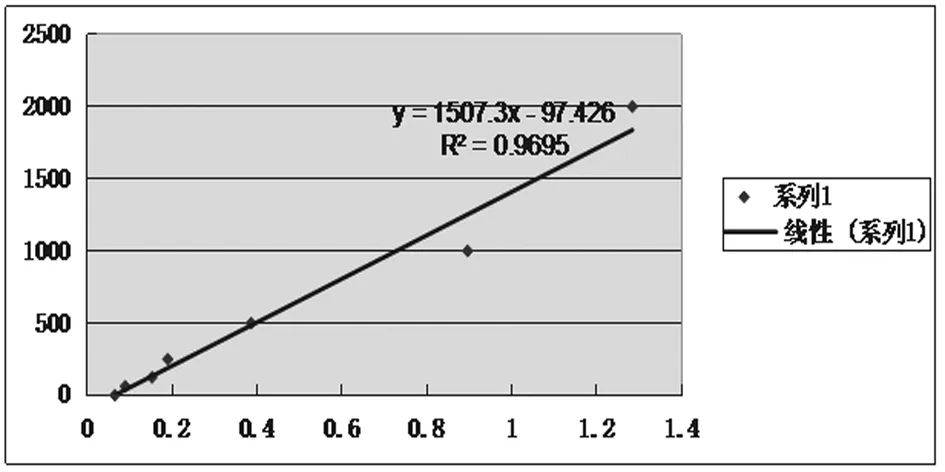
图1 脑脊液酶联免疫法检测标准曲线图
脑脊液酶联免疫法检测标准曲线图:标准品2000、1000、500、250、125、62.5、31.2、0pg/mL为横坐标,OD值为纵坐标,在坐标纸上作图,画出标准曲线,见图1。
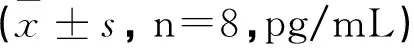
表1 各组造模合格大鼠脑脊液NGF含量测量数据统计
*:与假手术组比较,P<0.05,各实验组之间比较,P<0.05。
3 讨论
弥漫性轴索损伤(diffuseaxonalinjury,DAI),是由于外伤导致,造成颅内神经轴索肿胀或断裂,轴浆外溢出现轴索球为特征的脑实质损伤。在外力作用下,由于脑白质及灰质的密度不同而产生的剪应力使颅脑产生旋转和/或角加速度,从而造成神经轴索和颅内小血管的损伤。目前临床上判断脑外伤造成的DAI时,多依靠影像学检查。CT和MRI应用方便,却不能直接客观地辨别受损轴索的严重程度,且HRCT也很难分辨非出血性的病灶以及细小的出血点,现尚无统一的诊断标准[2]。这给DAI的诊断及治疗方案的选择上加大了难度。
神经损伤修复需要两个前提:一是内源性神经纤维的再生基础;二是神经再生的微环境。即有生长潜能的神经元和营养因素及导向因素。营养因素包括促进因子和抑制因子。前者即为神经营养因子(Neurotrophicfactors,NTFs),包含神经生长因子、脑源性神经营养因素(Brain-derivedneurotrophicfactor,BDNF)、神经营养因子—3、4、5、6、7(NT3、4、5、6、7)等。已确证NGF对外周以及中枢神经元的存活和生长有重要意义,许多文章指出在神经细胞的存活、分化、增殖及受损神经元的退行性病变方面,NGF意义巨大[3],近来探究表明,NGF可以保障脊髓神经元的存活,增进中枢神经细胞的修复[4,5]。
不仅神经细胞可以产生NGF,神经胶质细胞也可以产生NGF。实验表明,正常状态时NGF全部是由神经细胞产生,但颅脑损伤后NGF含量会随之增多,其主要来源是星形胶质细胞(astrocyte,Ast),Guanhua等认为颅脑损伤后由4种转录因子参与调控NGF的合成,这些因子主要存在于Ast中,神经细胞则几乎无表达,所以Ast是伤后NGF的主要来源。学者蔺铁认为推进营养因子的分泌,可能比神经替代方式改善神经功能要越发重要[6]。左右等研究制造大鼠DAI模型,发现采用砝码(高度及质量:90cm×400g)(下同)的冲击力可建立稳定的大鼠中度DAI模型,病理学特征明显并且稳定性好[7]。110cm×400g的冲击力对大鼠损伤则相对较重,导致大鼠意识障碍的时间长,符合重度DAI的特征。本实验选取5种力度对大鼠进行DAI造模,制作脑组织标本选取符合DAI模型的SD大鼠脑脊液标本进行研究。 周政等在实验动物脑损伤后从基因以及蛋白表达这两个方面上对NGF含量随时间改变进行记录并研究,发现NGFmRNA及NGF表达均增高,与对照组差别明显[8]。NGF可以促进神经纤维断端的再生、保护其周围尚未死亡的神经细胞,对神经纤维轴突再生有促进作用,并能促进神经细胞的新陈代谢。根据实验结果,推断NGFmRNA表达的增高可能与神经细胞的保护和修复密切相关[9]。学者刘程伟进行深入探索并发现NGF有协助血管修复、促进血供重新建立等作用,使脏器缺血得到缓解[10]。
在实验选取的时间,NGF的表达与损伤程度情况具有相关性。本实验发现:1、在正常大鼠脑脊液中存在NGF。2、大鼠DAI后脑脊液中NGF含量较正常增多,与假手术组有差别(P<0.05);损伤后各组间也有差别(P<0.05)。大鼠DAI后脑损伤程度越重,NGF含量表达越多。准确认识DAI的病理变化及规律,能够解释部分患者的病程进展,提高诊治水平。本实验进一步证实弥漫性轴索损伤后会出现NGF的表达变化,并且认为NGF可能是有效协助判断弥漫性轴索损伤严重程度的因素之一,今后有望对弥漫性轴索损伤复杂病理变化过程的进一步研究提供指导意义,为临床上研究弥漫性轴索损伤的机制及诊疗等方面提供新的思路和方向。
[1]李义召, 李大年. 神经生长因子与神经系统疾病[J]. 国际神经病学神经外科学杂志, 1993(6):297-300
[2]AndriessenTM,JacobsB,VosPE.Clinicalcharacteristicsandpathophysiologicalmechanismsoffocalanddiffusetraumaticbraininjury[J].JournalofCellular&MolecularMedicine, 2010, 14(10):2381-2392
[3]JelsmaTN,AguayoAJ.Trophicfactors[J].CurrentOpinioninNeurobiology, 1994, 4(5):717
[4]VaronS,ConnerJM.NervegrowthfactorinCNSrepair[J].JournalofNeurotrauma, 1994, 11(5):473-486
[5]GarridoJJ,AlonsoMT,LimF,etal.DefiningResponsivenessofAvianCochlearNeuronstoBrain-DerivedNeurotrophicFactorandNerveGrowthFactorbyHSV-1-MediatedGeneTransfer[J].1998, 70(6):2336-2346
[6]蔺铁, 张相彤. 骨髓基质细胞对脑创伤大鼠神经营养因子表达水平的影响[J]. 黑龙江医药科学, 2008, 31(3):3-4
[7]左右, 李雪松, 赵庆锁,等. 大鼠中度弥漫性轴索损伤模型的制作[J]. 新乡医学院学报, 2013, 30(7):521-523
[8]周政, 陈惠孙, 张可成,等. 大鼠创伤性脑损伤后NGFmRNA表达变化及外源性IL-1β对其影响[J]. 第三军医大学学报, 2003, 25(18):1636-1639
[9]LázármolnárE,HegyesiH,TóthS,etal.Autocrineandparacrineregulationbycytokinesandgrowthfactorsinmelanoma[J].Cytokine, 2000, 12(6):547-554
[10]刘程伟, 田浩, 么荣荣,等. 神经生长因子促大鼠缺血后肢血管再生的实验研究[J]. 黑龙江医药科学, 2012, 35(1):1-2
2016年佳木斯大学研究生科技创新项目,编号:YM2016_037。
韩骏飞(1990~)男, 黑龙江齐齐哈尔人,在读硕士研究生。
李明军(1965~)男,黑龙江佳木斯人,学士,主任医师,硕士研究生导师。E-mail: 382279194@qq.com。
R
B
1008-0104(2017)03-0096-02
2017-03-15)

