猪皮中胶原蛋白的提取与结构鉴定
纪倩,宿丹丹,应慧妍,陈敬华
(江南大学药剂学与药剂材料学研究室,江苏无锡214122)
猪皮中胶原蛋白的提取与结构鉴定
纪倩,宿丹丹,应慧妍,陈敬华*
(江南大学药剂学与药剂材料学研究室,江苏无锡214122)
以猪皮为原料,使用酶法提取胶原蛋白,对提取条件和过程进行筛选和优化,并对胶原产物的结构性质进行表征。结果表明,胶原蛋白产物的提取率为65.33%;纯度为87.38%;热变性温度在118.79℃;紫外最大吸收波长为203 nm;相对分子质量为3.63×105g/mol;红外光谱和圆二色谱结果显示,产物具有典型的胶原蛋白吸收峰,说明提取出的胶原蛋白三螺旋结构保存完整;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)结果显示所得胶原产物主要由3种亚基组分组成。
猪皮;胶原蛋白;提取;纯化;结构鉴定
胶原蛋白是细胞外基质的主要成分,主要分布于哺乳动物的结缔组织中。三条α链缠绕成的螺旋结构是胶原蛋白的最普遍结构特征,其独特的三重螺旋结构使其分子结构非常稳定,而且免疫原性低,生物相容性良好。胶原蛋白在猪皮蛋白质中的含量可达87.8%[1],但我国的猪皮多应用于皮革生产,因此,提取猪皮中的胶原蛋白可以提高猪皮的利用价值。
本文使用酶法提取猪皮中的胶原蛋白,通过筛选脱脂条件,盐析方法与纯化方法,确定胶原蛋白提取的条件,并对猪皮提取物的分子量、提取率、纯度、热稳定温度、三股螺旋结构完整性、亚基组成进行测定,旨在提高胶原蛋白品质,为猪皮中胶原蛋白的提取及结构表征提供试验参考。
1 试验材料、仪器
1.1 材料与试剂
猪皮:无锡市周新农贸市场;过硫酸铵(APS)、四甲基乙二胺(TEMED)、考马斯亮蓝、质量分数为30%丙烯酰胺(丙烯酰胺与甲叉双丙烯酰胺质量比为29∶1)、Tris、溴酚蓝(BPB):上海碧云天生物技术有限公司;标准蛋白(分子量 10 kDa~200 kDa):美国 Thermo scientific公司;胃蛋白酶(3 000 U/mg):上海拓旸生物科技有限公司;羟脯氨酸:Biosharp公司;氯化钠、冰醋酸、氢氧化钠、碳酸钠、乙醚、石油醚、甘氨酸(Glycine)、一水合柠檬酸、醋酸钠、正丙醇、氯胺 T、对二甲氨基苯甲醛、异丙醇、高氯酸、盐酸、二水合氯化亚锡、甲醇、叠氮化钠、十二烷基硫酸钠(SDS):国药集团化学试剂有限公司。
1.2 仪器设备
5804R离心机:艾本德中国有限公司;Multifuge X3R离心机:赛默飞世尔科技(中国)有限公司;BSA 124S分析天平:赛多利斯科学仪器(北京)有限公司;AL104电子天平、FE30/EL30实验室电导率仪:梅特勒-托利多仪器(上海)有限公司;BL-2200H电子天平、UV-2550分光光度计:日本岛津公司;GZX-9140MBE数显鼓风干燥箱:上海博讯实业有限公司医疗设备厂;MS-H280-Pro恒温磁力搅拌器:美国赛洛捷克公司;Gel Doc XR伯乐凝胶成像仪:美国伯乐BIO-RAD公司;FreeZONE冷冻干燥机:美国Labconco公司;JYLC03V九阳切菜料理机:九阳股份有限公司。
2 试验方法
2.1 猪皮中胶原蛋白的提取
猪皮块→去脂→漂洗至中性→酸溶液中酶解→盐析→纯化→冷冻干燥→胶原蛋白产物
2.1.1 前处理
将新鲜猪皮去毛,刮除表皮脂肪,水漂洗3次,将猪皮切成5 mm×5 mm方形小块,用料理机搅碎猪皮20 g,按照 1 ∶10(g/mL)的比例加入脱脂溶液,于磁力搅拌器上搅拌脱脂数小时。脱脂结束后,除去碱溶液,用清水洗涤猪皮至中性。
2.1.2 酶解
按照1∶10(g/mL)的比例配制pH为2.5的醋酸溶液,将脱脂的猪皮浸泡于酸溶液中,再按照酶:猪皮1∶50(质量比)的比例加入胃蛋白酶(3 000 U/mg),于4℃酶解24 h,每隔3 h搅拌5 min,酶解过程中用醋酸精密调节pH在2。
2.1.3 盐析
对酶解液抽滤,取滤液。配制2.5 mol/L的NaOH溶液,逐滴加入滤液中,使滤液pH值升至7~8,记录滤液总体积。再加入一定量的NaCl,使NaCl的终浓度为4 mol/L,置于4℃盐析1 h,盐析结束后于4℃,8 000 r/min离心15 min。收集离心沉淀,即为胶原粗产物。
2.1.4 纯化
配制pH 2.5的醋酸溶液,将上步得到的胶原蛋白粗产物溶于少量醋酸溶液,6000r/min,4℃、离心10min,取上清液,装入分子截留量为8 000 kDa~14 000 kDa的透析袋中,于pH 3.0的醋酸溶液中透析两天,去离子水透析一天,冻干后即得纯化的胶原蛋白样品。
2.2 猪皮中胶原蛋白含量及胶原蛋白提取率测定
羟脯氨酸存在于胶原蛋白、伸展蛋白和弹性蛋白中,其他蛋白质中不含有羟脯氨酸,其占胶原蛋白总质量的10%[2],因此可通过测定样品中羟脯氨酸的相对含量来确定所提取的胶原蛋白的纯度。
2.2.1 羟脯氨酸标准曲线的测定
称取2.5 mg羟脯氨酸,溶于500 mL去离子水中。使用去离子水分别将羟脯氨酸浓度稀释为0、0.5、1.0、1.5、2.0、2.5、5.0 μg/mL。参照张燕婉[3]的试验方法,分别取4 mL上述溶液于20 mL具塞试管中,先加入2 mL、14.1 mg/mL的氯胺T溶液,摇匀并静置20 min,使含有吡咯环的氧化物生成,再加入2 mL对二甲氨基苯甲醛溶液,与羟脯氨酸氧化物反应生成红色化合物,用紫外分光光度计于561 nm波长处测定吸光度,绘制羟脯氨酸标准曲线。
2.2.2 猪皮中胶原蛋白含量的测定
称取约4 g猪皮,与0.5 g二水合氯化亚锡同时溶于100 mL、6 mol/L的盐酸溶液中,100℃冷凝回流20 h。提取液过0.45 μm的水膜后,定容至250 mL容量瓶中,取20 mL精密调节pH值至8,离心取上清液,定容至250 mL,稀释10倍后按照2.2.1的显色方法处理猪皮提取液,测定羟脯氨酸的质量分数,并以10.0的换算系数,按照下式计算胶原蛋白的含量:

式中:c为待测样的浓度,μg/mL;M为猪皮干重,g;V为调节pH值前的体积,mL。
2.2.3 提取物中胶原蛋白含量的测定
称取5 mg的胶原蛋白样品,与0.5 g二水合氯化亚锡同时溶于100 mL、6 mol/L的盐酸溶液中,100℃冷凝回流20 h。提取液过0.45 μm的水膜后,定容至250 mL容量瓶中,取60 mL精密调节pH值至8左右,离心取上清液,定容至100 mL,稀释10倍后按照2.2.1的显色方法处理样品提取液,按照下式计算胶原蛋白的含量:

式中:c为待测样的浓度,μg/mL;M为胶原蛋白样品重量,mg;V为调节pH前的体积,mL。
2.2.4 提取率的计算
根据下式计算胶原蛋白的提取率:

2.3 胶原蛋白的结构表征
2.3.1 凝胶渗透色谱分析
凝胶渗透色谱(Gel Permeation Chromatography,GPC)是根据聚合物分子渗透进入和洗脱流出色谱柱中多孔材料的不同程度来分离的一种液相色谱。以50 mmol/L、pH 5.4的醋酸钠作为流动相和溶剂,使胶原蛋白浓度处于千分之一至千分之五之间。使用GPC专用砂芯漏斗过滤醋酸钠溶液。接柱后设置流速为0.1 mL/min,扫描样品并计算样品中胶原蛋白的相对分子质量。
2.3.2 差示量热扫描分析
称取3 mg~5 mg样品,放置于40 μL专用坩埚内,压盖,空白坩埚作为参比池。设置DSC分析仪升温速率为10℃/min,温度扫描范围为20℃~200℃,记录吸热曲线。
2.3.3 紫外光谱分析
以0.5 mol/L的醋酸溶液溶解胶原蛋白样品,醋酸溶液作为空白对照,扫描波长设置为190 nm~300 nm。
2.3.4 红外光谱分析
由于胶原蛋白不易与溴化钾共同研磨成细粉状,因此取少量胶原蛋白样品,使用全反射法对样品进行检测。在25℃,450 cm-1~4 000 cm-1的范围进行扫描。
2.3.5 圆二色谱分析
以0.5 mol/L的醋酸溶液为溶剂,配制浓度为0.1 mg/mL的胶原蛋白样品溶液10 mL,充分溶解,平衡12h,离心取上清液[4]。设置波长范围190 nm~240 nm,比色皿光程1 mm,扫描速度0.5 nm/s;检测环境25℃,氮气。以0.5 mol/L的醋酸溶液作为空白对照。
2.3.6 SDS-PAGE凝胶电泳
溶解胶原蛋白样品,与上样缓冲液混合,于沸水中水浴5 min,冷却。配制8%的分离胶,5%的浓缩胶。将胶板放入电泳仪,上样量20 μL。设置电压80 V,观察样品跑至分离胶上边缘,再调节电压到120 V。电泳结束后,考马斯亮蓝染色,洗脱液洗净后进行电泳图谱拍摄及分析。
3 试验结果分析
3.1 脱脂处理对胶原蛋白提取的影响
3.1.1 脱脂溶剂的选择
猪皮前处理,经过预试验,分别选用浓度为0.1mol/L 的氢氧化钠溶液[5]、8%(g/mL)的碳酸钠溶液[6]、乙醚与石油醚(体积比1∶1)[7]混合液脱脂4 h,猪皮重量:溶剂体积为1∶10(g/mL),未经脱脂的猪皮作为空白对照,烘干称重,用索氏提取法提取脂肪,分析不同脱脂溶剂的去脂效果。0.1 mol/L的氢氧化钠溶液浸泡4 h,猪皮上的脂肪多半从真皮上脱落,并漂浮在溶液中,少部分脂肪通过外力也易被刮除,溶剂对脱脂效果的影响见图1。

图1 溶剂对脱脂效果的影响Fig.1 Effects of different degreasing solvents
如图1所示,0.1 mol/L的氢氧化钠溶液的脱脂效果最好,因此选用氢氧化钠溶液对猪皮进行脱脂。
3.1.2 脱脂时间的选择
选取脱脂效果最好的0.1 mol/L的氢氧化钠溶液作时间的单因素试验,浸泡时间分别为:2、4、6、8 h,烘干称重,用索氏提取法提取脂肪,分析时间对脱脂效果的影响。时间对脱脂效果的影响见图2。

图2 时间对脱脂效果的影响Fig.2 Effects of different degreasing time
如图2所示,随着脱脂时间的增长,脱脂效果也随之增加,但脱脂时间超过6 h后,脱脂率没有明显的提高,而脱脂时间过长,会增加猪皮变性的程度。因此,采用脱脂时间为6 h,每间隔2 h搅拌5 min。
3.2 盐析方式对盐析效果的影响
盐析步骤中氯化钠的加入方式对盐析效果有明显影响,通过两种方式:一种是逐渐加入氯化钠固体达到盐析浓度,另一种是使用所需盐浓度的氯化钠溶液。试验结果表明,直接加入氯化钠固体会导致盐的局部浓度过大,从而使得胶原蛋白局部大量析出,影响胶原蛋白品质(图3b);可以通过透析的方法避免这种现象,但是透析所需要的盐质量和透析体积非常大,而且必须考虑氯化钠的溶解度问题,所以此方法可行性不高;采用滴管逐滴加入溶解完全的氯化钠溶液[8],既能避免局部浓度过大的问题,也能控制溶液体积,冻干后得到的胶原蛋白疏松均匀,外观良好(图3a)。因此,氯化钠的加入方式对胶原蛋白的提取有重要影响。

图3 冻干后的胶原蛋白形态Fig.3 The form of collagen after freeze drying
3.3 胶原蛋白提取率的测定
3.3.1 羟脯氨酸标准曲线
在561 nm波长处测定羟脯氨酸标准溶液吸光度,绘制标准曲线,得到公式y=0.175 9x+0.059 6,y为吸光度,x为浓度 μg/mL,方差 R2为 0.999 9,准确度高,可用于计算样品中羟脯氨酸含量,再转换为胶原蛋白含量。
3.3.2 猪皮中胶原蛋白的提取率
有报道指出蛋白质在猪皮中的含量约有33%,其中大部分为胶原蛋白,含量在87.8%[9]。本试验测出胶原蛋白在猪皮中含量为42.80%,可能是由于选取了胶原含量较高的猪背脊皮肤作为原料的原因。提取的胶原蛋白纯度达到87.38%,提取率为65.33%。
3.4 胶原蛋白结构鉴定
3.4.1 GPC
胶原蛋白的三股螺旋结构是由三条肽链组成的,分子量约为300 kDa[10]。本试验中产物的分子量分布在300 kDa~400 kDa之间,胶原蛋白的GPC图谱见图4。
如图4所示,符合胶原蛋白最普遍的结构特征,通过计算得到胶原产物的相对分子质量为3.63×105g/mol。
3.4.2 胶原蛋白的热稳定分析
通常胶原蛋白的热收缩温度(Ts)反映胶原蛋白的热稳定性,指的是胶原纤维收缩到原来长度三分之一时的温度[11]。差示量热扫描(DSC)不仅可以确定试样的熔点,也能测定样品的纯度,样品用量少而且操作简便。当物质含有杂质时,DSC峰会变宽,熔点降低[12]。胶原蛋白的DSC图谱见图5。

图4 胶原蛋白的GPC图谱Fig.4 GPC chromatogram of collagen

图5 胶原蛋白的DSC图谱Fig.5 DSC thermogram of collagen
如图5所示,本试验中产物的热变性温度为118.79℃,比之前报道中的胶原蛋白热变性温度(77.27℃)有所提高[4],说明胶原蛋白热稳定性良好,三股螺旋结构保持较为完整。
3.4.3 紫外光谱分析结果
胶原蛋白的紫外图谱见图6。
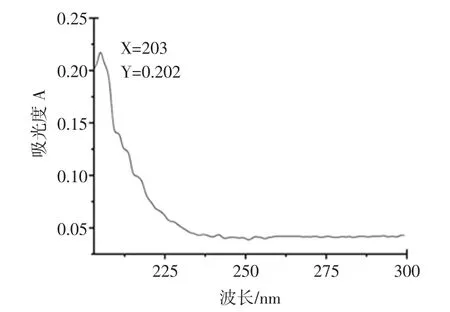
图6 胶原蛋白的紫外图谱Fig.6 UV spectrum of collagen
如图6所示,胃蛋白酶法提取猪皮中胶原蛋白样品在200 nm~300 nm波长处的紫外吸收(A),样品中胶原蛋白的最大吸收峰在203 nm处,与文献报道胶原蛋白最大紫外吸收在225 nm有差异[5],但也符合胶原特征。
3.4.4 红外光谱分析
胶原蛋白的红外图谱见图7。

图7 胶原蛋白的红外图谱Fig.7 Infrared spectrogram of collagen
如图7所示,3 200 cm-1~3 600 cm-1代表酰胺A带的N-H伸缩振动(氢键)峰[13];2 929 cm-1代表酰胺B带N-H和C-H伸缩振动吸收峰,二者都表明肽键间氢键的存在[14];1 630 cm-1代表酰胺Ⅰ带,是形成三股螺旋内氢链的C=O基团的伸缩振动强峰,表征胶原三螺旋结构的存在;1 549 cm-1代表酰胺Ⅱ带的υ N-H弯曲振动、υ C-N伸缩振动吸收峰;1 463 cm-1处的吸收峰表征了肽键的顺式构型,说明胶原蛋白分子中含有大量脯氨酸和羟脯氨酸。因为脯氨酸残基的肽单位之外,绝大多数多肽链中肽单位的N-H和C=O都是反式排列;1 338 cm-1代表酰胺Ⅳ带C-H伸缩,N-H变形或NH2摇摆峰;1 238 cm-1代表酰胺Ⅲ带的N-H变形峰;1 081 cm-1是C-O或C-H-C伸缩振动峰。其中,1 450 cm-1~1 230 cm-1附近存在吸收峰,表明样品中胶原蛋白的三股螺旋结构保存完整[15]。
3.4.5 圆二色谱
在蛋白质中,氨基酸的α-碳原子是不对称碳原子,具有光学活性,蛋白质的肽链走向也是不对称的结构,也具有光学活性,当平面圆偏振光通过这些光活性的生色基团时,光活性中心对平面圆偏振光中的左右圆偏振光的吸收不相同,产生了吸收差值,由于这种吸收差的存在,造成了偏振光矢量的振幅差,圆偏振光变成了椭圆偏振光,这就是蛋白质的圆二色性。一般蛋白质的圆二色光谱分成两段,波长范围在185 nm~245 nm称为远紫外区,245 nm~320 nm称为近紫外区。远紫外区是蛋白质肽链的吸收峰,反映了主链的构象。
猪皮中提取的胶原蛋白在远紫外区的圆二色谱图见图8。

图8 胶原蛋白的圆二色光谱图Fig.8 Circular dichroism spectrum of collagen
如图8所示,193 nm处存在一个负峰,220 nm处存在一个正峰,正负峰强度比值为0.142,说明胶原蛋白三股螺旋结构保持得较好,符合胶原蛋白三股螺旋结构的典型特征圆二色谱峰型[16]。
3.4.6 胶原蛋白的亚基组成
Ⅰ型胶原蛋白有两条α1链,一条α2链;Ⅲ型胶原蛋白有三条α1链;α2链是Ⅰ型胶原蛋白的特征链,所以α2链的存在说明Ⅰ型胶原蛋白的存在[8]。胶原蛋白SDS-PAGE图见图9。
如图9所示,明显的α2链表明Ⅰ型胶原蛋白的存在;位于120 kDa附近的是Ⅰ型胶原蛋白的α1、α2链;位于200 kDa附近的是α链的一种二聚体-β链;位于200 kDa上方的是α链的三聚体-γ链。120 kDa以下并没有其他条带,说明胶原蛋白的结构保存较好,没有被分解成多肽,也没有小分子水解胶原的生成[17]。

图9 胶原蛋白SDS-PAGE图Fig.9 SDS-PAGE electrophoresis of collagen
4 结论
确定猪皮中胶原蛋白提取的工艺:按照1∶10(g/mL)的比例加入0.1 mol/L NaOH溶液浸泡除脂6 h,酶解24 h后,逐滴加入溶解完全的氯化钠溶液盐析,采用醋酸溶液透析的方法纯化胶原蛋白粗品,去离子水透析后冻干即得胶原蛋白样品。结构鉴定表明,本试验提取的样品符合胶原蛋白的紫外、红外、圆二色谱吸收特征,三股螺旋结构保持完整;其由α,β和γ三种亚基组分组成;热变性温度高达118.79℃,热稳定性好;分子量在300 kDa~400 kDa之间;样品纯度高,提取率好。因此,本研究提取的猪皮胶原蛋白具有高质量高纯度,适用于生物医用材料。
[1] 蒋挺大,张春萍.胶原与胶原蛋白[M].北京:化学工业出版社,2006:17-19
[2] 金勇,徐社阳,刘宗惠,等.猪皮提取胶原的研究[J].精细化工,2001,18(5):302-304
[3]张燕婉.肉和肉制品中羟脯氨酸含量的测定[J].食品科学,1990(11):49-51
[4] 于玮,王雪蒙,马良,等.猪皮胶原蛋白提取过程中酶解条件优化及其结构鉴定[J].2015,37(4):106-113
[5] 张玲,芮汉明,张立彦.酶法提取猪皮胶原及产物性质分析[J].食品科学,2013,34(19):123-127
[6] 胡二坤,郭兴凤,谭凤艳,等.猪皮中胶原蛋白的提取[J].河南工业大学学报,2006,27(1):50-53
[7] 刁雪洋.猪皮胶原蛋白提取及理化特性的研究[D].重庆:西南大学,2010
[8] Miller E J,Gay S.Collagen:An overview[J].Methods in enzymology,1982,82:3-7
[9] 李开雄,赵志远,刘霞.猪皮中胶原蛋白的提取及其应用[J].肉类研究,1996(4):43-46,48
[10]王丽娜,黄素珍.胶原蛋白的研究进展[J].肉类研究,2010(1):16-22
[11]杨霞,王珊珊,赵芙钗,等.驴皮中胶原蛋白的提取及其特性[J].精细化工,2011,28(9):883-886
[12]孙凤霞.仪器分析(第二版)[M].北京:化学工业出版社,2011:305
[13]Li D F,Mu C D,Cai S M,et al.Ultrasonic irradiation in the enzymatic extraction of collagen[J].Ultrasonics sonochemistry,2009,16(5):605-609
[14]Muyonga J H,Cole C G B,Duodu K G.Fourier transform infrared(FTIR)spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch (Lates niloticus)[J].Food Chemistry,2004,86(3):325-332
[15]荆煦瑛,陈式隶.红外光谱使用指南[M].天津:天津科学技术出版社,1992
[16]唐兰兰,陈书霖,郝更新,等.三种淡水鱼皮胶原蛋白膜机械性能和α1链一级结构的相关性研究[J].现代食品科技,2015,31(6):59-66,163
[17]刘苏锐,王坤余,琚海燕.猪皮Ⅰ型胶原蛋白的提取及其结构表征[J].中国皮革,2007,36(7):43-46,49
Extraction of Pigskin Collagen and Its Structural Identification
JI Qian,SU Dan-dan,YING Hui-yan,CHEN Jing-hua*
(Laboratory of Pharmaceutics and Pharmaceutical Materials Science,Jiangnan University,Wuxi 214122,Jiangsu,China)
The research used pigskin as raw material,which was treated by enzymes,to extract collagen.To confirm and optimize the best extraction condition and process,the structural properties of collagen product were characterized.The experiment results showed that the extraction yield of collagen product was 65.33%and the purity was 87.38%.The thermal denaturation temperature was 118.79℃.The maximum UV absorption wavelength was 203 nm.The relative molecular mass was 3.63×105g/mol.Infrared spectrum and round two chromatographic experiments showed that the product had a typical collagen absorption peak,indicating the three helical structure of collagen extracted was intact;SDS-PAGE gel electrophoresis test showed that the product was mainly composed of three sub components.
pigskin;collagen;extraction;purification;structural characterization
2017-03-31
江苏省产学研联合创新资金项目(BY2014023-17)
纪倩(1989—),女(汉),实验师,硕士,主要从事药剂学及生物医用材料研究。
*通信作者:陈敬华(1971—),男(汉),教授,博士生导师,主要从事药剂学与药物材料研究。
10.3969/j.issn.1005-6521.2017.13.010

