恶性胸腔积液去血细胞块临床应用价值研究
徐 健,韩 雪,刘春芳,赵俊军,李 平,任丽娜,江 玲,王妮妮
(1.大连医科大学附属大连市中心医院 呼吸科,辽宁 大连 116033;2.大连医科大学附属大连市中心医院 病理科,辽宁 大连 116033)
恶性胸腔积液去血细胞块临床应用价值研究
徐 健1,韩 雪1,刘春芳1,赵俊军2,李 平2,任丽娜1,江 玲1,王妮妮1
(1.大连医科大学附属大连市中心医院 呼吸科,辽宁 大连 116033;2.大连医科大学附属大连市中心医院 病理科,辽宁 大连 116033)
目的 通过与胸膜配对比较观察去血细胞块的临床应用价值。方法 收集2015年1月至2016年6月在大连市中心医院呼吸科就诊的可疑恶性胸腔积液患者36例,血性积液占47.22%。使用50%酒精作为去血剂制成细胞块,随后行内科胸腔镜获得胸膜病理结果。通过与胸膜病理对比观察去血细胞块的检出率、制片质量、免疫组化染色的差异。结果 血性、非血性积液的细胞块及胸膜病理的检出率分别为64.71%、78.95%、88.89%,血性与非血性细胞块比较及两组与胸膜病理比较差异均无统计学意义。细胞块联合胸膜病理检出率在非血性、淡血色及深血色胸腔积液中可达94.74%、100%及100%。非血性、淡血色与深血色积液细胞块切片中不能用于诊断切片的检出率分别为10.53%(9/51),9.52%(2/21),20.00%(6/30),两两比较差异均无统计学意义。红细胞背景干扰诊断的切片在上述3组中检出率分别为0、0、7.84%(4/30),深血色积液组与其他两组的差异有统计学意义。去血细胞块与配对胸膜的免疫组化染色结果对比差异无统计学意义。结论 细胞块病理作为一种创伤更小的检查方法,能够成为胸膜病理的补充。
胸腔积液;胸膜疾病;恶性胸腔积液;细胞块;胸膜病理
随着肺癌等恶性肿瘤发病率的逐年上升,恶性胸腔积液的患者数量也逐年增加。依据积液中细胞的数量、分类及百分比、肿瘤标记物及细胞学涂片等诊断的方法已经不能满足临床的需要。而且部分恶性积液为血性的,积液中红细胞数量过多掩盖了肿瘤细胞,干扰诊断结果。一些文献使用氯化铵、乙醇、甲醇、冰醋酸等化学剂作为去血剂处理血性积液,并证明经去血处理的细胞涂片红细胞溶解破坏,背景干净,肿瘤细胞核膜保存完好[1-2]。由于细胞涂片阳性率只有60%左右,一些胸膜疾病如恶性胸膜间皮瘤也不能依据细胞涂片确诊[3],本文中使用50%酒精作为去血剂处理血性胸腔积液再制成细胞块,通过与胸膜病理的配对对比,观察去血细胞块在检出率、切片质量、免疫组化染色等方面的差异,明确去血细胞块的临床应用价值。
1 资料与方法
1.1 病例选择
收集2015年1月至2016年6月在大连市中心医院呼吸科就诊的、新发现的、临床怀疑恶性的胸腔积液。所有病例先行单腔静脉留置针胸腔闭式引流术引流积液行胸水常规、LDH、蛋白定量、细胞涂片等检测,排除漏出性、未确诊、确诊炎性及细胞涂片确诊恶性的胸腔积液。将肉眼非血性和血性胸腔积液按照不同的方法制成细胞块用于评估。血性积液再按照积液中红细胞数量分为淡血色组(红细胞数量8000~40000个/mm3)和深血色组(红细胞数量≥40000个/mm3)。
最终入选符合标准患者36例,男24例,女12例,平均年龄(68.44±12.98)岁。其中肉眼非血性胸腔积液19例,包括肺腺癌转移16例,恶性胸膜间皮瘤1例,B细胞及T细胞淋巴瘤各1例;血性胸腔积液17例,包括肺腺癌转移8例,恶性胸膜间皮瘤3例,B细胞淋巴瘤2例,乳腺癌胸膜转移2例,肺鳞状细胞癌胸膜转移1例,恶性胸膜间皮瘤伴前列腺癌1例。血性积液占47.22%,深血色积液占27.78%。
1.2 细胞块制作方法
去血细胞块的制作方法:(1)血性胸腔积液200 mL,以2000 r/min离心10 min;(2)弃上清,保留沉淀细胞;(3)等体积50%酒精作为去血剂加入细胞沉淀中旋涡震荡15 s;(4)加入等体积生理盐水,以2000 r/min离心10 min,弃上清液,保留沉淀细胞;(5)深血色积液可重复(3)、(4)步骤一次;(6)生理盐水洗涤沉淀细胞并离心1次;(7)滤纸包裹细胞沉淀,10%甲醛固定30 min;(8)石蜡包埋制成细胞蜡块。
非血性胸腔积液细胞块的制作方法:按以上制作步骤的(1)、(2)、(6)、(7)、(8)。
1.3 胸膜病理检查
入选病例均行内科胸腔镜获得胸膜组织病理证实。所用内科胸腔镜为日本Olympus LTF240。
检查前半小时经留置的引流管缓慢注入约300~500 mL空气制成人工气胸,行胸片或肺CT检查人工气胸的部位及效果。一些粘连较重无法进行人工气胸的,可使用尿激酶1万U溶于20 mL生理盐水经留置的引流管注入,约10 h(一夜)后放开引流管引出积液及药物,再行人工气胸。胸腔镜检查时对患者行心电、血压、脉搏、血氧饱和度监测,予2 L/min氧气吸入。患者取健侧卧位,常规选腋前线至腋后线间第5~7 肋间为进镜部位,胸膜粘连的可根据胸片或肺CT显示的包裹性气胸所在部位适当调整。常规消毒敷单,2 %利多卡因局部浸润麻醉达胸膜,切开皮肤约1.5~2.0 cm,钝性分离皮下组织到胸膜腔,插入Trocar拔出内芯后送入胸腔镜检查。按顺序观察肋、膈、纵膈、脏层胸膜及肺表面等。直视下多次、多部位取材可疑病变8~12块送病理检查。检查结束退出胸腔镜,拔除Trocar,缝合手术切口。经预置的引流管抽尽胸腔积气再夹闭导管。次日若无气体引出,则复查胸片观察肺复张情况[4]。
1.4 诊断标准
以细胞块或/和胸膜病理阳性结果为诊断标准,如两者结果不一致以胸膜病理为准,如两者均阴性而积液仍考虑为恶性的,以近期其他组织病理(如肺活检等)获得阳性结果为准。
1.5 切片质量评估
细胞退变评估:每个细胞块切3张切片行HE染色。每张切片由2名病理科医师分别观察切片中非红细胞形态及内部结构是否完整,可否用于病理诊断,记录每个细胞块中不能用于诊断的切片个数,观察组间的差异。
去红细胞效果评估:观察上述HE染色的切片中红细胞及细胞碎片背景是否干扰诊断,记录每个病例不可用于诊断的切片个数,观察各组的差异。
1.6 免疫组化一致性评估
入选病例中选择细胞块和胸膜病理均阳性的,将细胞块和胸膜组织块重新切片进行免疫组化染色。为避免染色条件导致的误差将同一病例的细胞块和胸膜切片配对置于一个玻片上进行固定、脱蜡、免疫组化染色。染色超过10%的切片为阳性。将浅棕、棕色、深棕色定义为+(1分)、++(2分)、+++(3分);将染色细胞的百分比分为10%~25%(1分)、25%~50%(2分)、50%~75%(3分)、超过75%(4分);将两者分数的乘积作为免疫组化染色的最终分数,1~3分为+,4~6分为++,7~9分为+++,10~12分为++++。对比去血细胞块与配对胸膜、细胞块与配对胸膜切片免疫组化染色阳性的一致性。
1.7 统计学方法
使用SPSS13.0统计软件的McNemar检验方法检测对细胞块与胸膜病理检出率差异作显著性检验,Chi-square检验检测试验组和对照组检查率差异的显著性,两配对样本的Wilcoxon检验检测细胞块和胸膜免疫组化染色的吻合程度。
2 结 果
2.1 细胞块病理的检出率
血性、非血性积液细胞块及胸膜病理的检出率分别为64.71%(11/17)、78.95%(15/19)和88.89%(32/36),细胞块与胸膜病理的检出率比较差异无统计学意义(表1)。血性与非血性积液细胞块比较,检出率差异无统计学意义(P=0.074);深血色积液(使用两次去血剂)细胞块与非血性比较,检出率差异也无统计学意义(P=0.063)。细胞块联合胸膜病理检出率在非血性、淡血色及深血色胸腔积液中可达94.74%、100%及100%。

表1 细胞块与胸膜病理的检出率比较
非血性积液组阴性病例包括2例细胞块病理阴性但胸膜病理阳性的肺腺癌;1例细胞块病理为腺癌但胸膜病理为间皮细胞增生,又经肺活检证实为肺腺癌;1例细胞块病理为腺癌,胸膜病理为恶性胸膜间皮瘤最终诊断为恶性胸膜间皮瘤;1例胸腔积液CEA升高,但细胞块及胸膜病理均阴性,支气管镜病理证实为肺腺癌。
淡血色胸腔积液阴性病例包括1例细胞块病理为间皮细胞增生,胸膜病理为恶性胸膜间皮瘤;1例细胞块病理阴性,胸膜病理为肺腺癌。
深血色胸腔积液阴性病例包括2例细胞块病理为炎性,胸膜病理为肺腺癌;2例细胞块病理为间皮细胞增生,胸膜病理为恶性胸膜间皮瘤,其中1例并发前列腺癌;1例细胞块病理为腺癌,胸膜病理阴性,最终经肺活检证实为肺腺癌;1例细胞块病理为小B细胞淋巴瘤,胸膜病理为炎症,最终诊断为B细胞淋巴瘤。
2.2 细胞退变评估
比较非血性、淡血色与深血色积液细胞块切片中不能用于诊断切片的检出率分别为10.53%(9/51),9.52%(2/21),20.00%(6/30),两两比较差异均无统计学意义,P>0.05。
2.3 去红细胞效果评估
因红细胞背景干扰影响诊断的切片检出率在非血性、淡血色与深血色积液细胞块中分别为0、0、7.84%(4/30),深血色积液组与非血性、淡血色积液组比较,差异均有统计学意义(P<0.05),即切片中大量红细胞背景可干扰诊断的阳性结果(图1)。

图1 深血色胸腔积液未去血制成细胞块与去血制成的细胞块病理切片比较(HE染色×10)Fig 1 Comparison of the cell blocks with or without RBC removal in the dark bloody effusion (HE stained×10)
2.4 细胞块病理与胸膜病理免疫组化一致性评估
选择细胞块及胸膜病理均阳性病例20例,包括肺腺癌胸膜转移15例,乳腺癌胸膜转移2例,淋巴瘤3例。所有病例均进行TTF-1、CK染色,2例乳腺癌再行GATA3、ER、PR染色,3例淋巴瘤行CD3、CD20染色。两组免疫组化结果对比差异无统计学意义(P=0.315)。
其中去血细胞块6例,包括肺腺癌胸膜转移3例,乳腺癌胸膜转移2例,淋巴瘤1例。去血细胞块与胸膜免疫组化染色配对比较,差异无统计学意义(P=0.531),即50%酒精作为去血剂不能显著干扰细胞表面抗原的表达,去血细胞块与胸膜免疫组化结果一致(图2)。
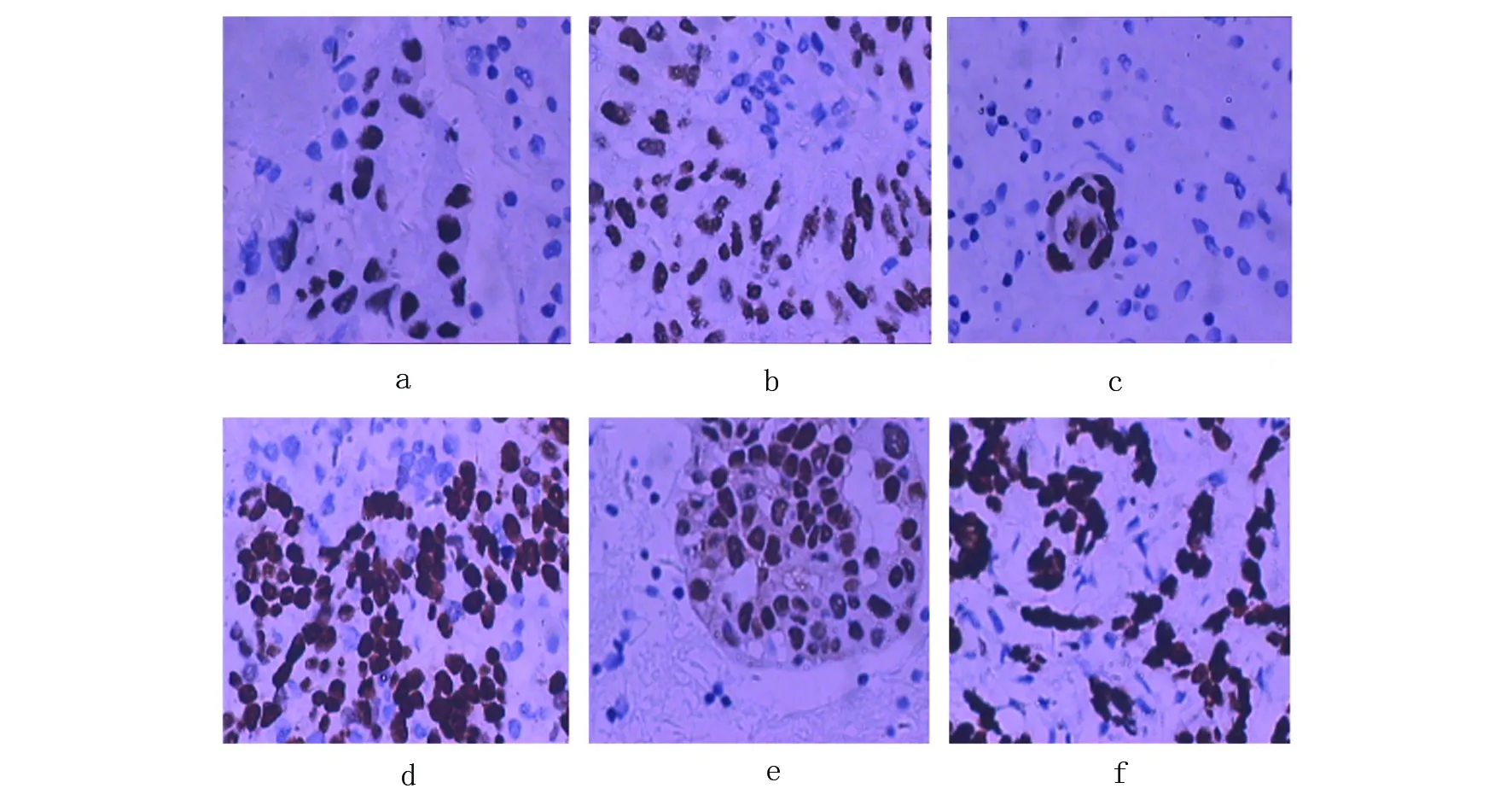
a与b为肺腺癌胸膜转移的细胞块、胸膜病理TTF-1染色结果(×20),c-f为乳腺癌胸膜转移的细胞块、胸膜病理ER(c、d)和GATA3(e、f)染色结果(×20)图2 细胞块与胸膜病理免疫组化染色对照Fig 2 Comparison of immunohistochemical stains between cell blocks and pleural biopsy
3 讨 论
全身的恶性疾病晚期均可发生胸膜转移,成为恶性胸腔积液的病因。细胞涂片虽然是诊断的重要技术,但阳性率不高,诊断也常出现误差。文献报道细胞涂片考虑为良性的病例有0.2%经细胞块证实为恶性,考虑为恶性的有0.6%经细胞块证实为良性,可疑为恶性的有42%经细胞块证实为良性[5]。因此,细胞涂片的敏感性为50%,特异性为90%,而细胞块的敏感性、特异性均为100%。细胞块的制作方法有许多。Jing等[6]比较了血凝酶、组织胶、CTC等方法制作的细胞块,显示3种方法均可以保持细胞的完整性,血凝酶方法更好地保留了细胞内结构。Kruger等[7]比较了CellientTM自动系统与凝胶法制作的细胞块,提出CellientTM虽然提高了细胞内结构的显示但在细胞分类、PASD染色、免疫组织化学染色的强度和清晰度方面无差异。Köksal等[8]也报道细胞块病理能够显著提高检出率。本文收集36例胸腔积液均为细胞涂片阴性病例,细胞块病理检出率分别为64.71%(血性)、78.95%(非血性),提高了检出率,与文献报道一致。本文中细胞块联合胸膜病理诊断的阳性率在非血性、淡血色及深血色胸腔积液中可达94.74%、100%及100%。但是,5例恶性胸膜间皮瘤患者中细胞块病理只有1例阳性,1例诊为腺癌与胸膜病理诊断不一致,3例为阴性,显示了细胞块病理在诊断胸膜间皮瘤方面的局限性,证实胸膜病理仍是诊断胸膜间皮瘤的金标准[3]。
恶性胸腔积液常为血性的,本文中血性积液占47.22%,深血色的占27.78%。细胞块切片中过多的红细胞会掩盖肿瘤细胞,给癌细胞查找造成一定的困难。多篇文献报道在制作细胞涂片时去除红细胞能够显著提高阳性检出率[1-2]。赵俊军等[9]使用50%酒精作为去血剂处理深血色积液再制成细胞块,使异常的肿瘤细胞聚集、更易于被发现,而且细胞块中没有血性成分的干扰使异常细胞显示的比传统细胞涂片更清楚。深血色积液使用了2次去血剂,切片中因细胞退变而无法诊断的数量无明显增加,但部分切片仍有红细胞残留。但残留的红细胞背景对诊断结果无显著干扰,深血色细胞块病理检出率为60%,与胸膜病理和非血性细胞块病理的差异无统计学意义。
医学的发展使临床对肿瘤病理的要求不再局限于组织类型的诊断,分子生物学信息为精准治疗提供了有效的靶点。细胞块不但可以用于免疫组织化学染色,也可以用于原位杂交(FISH)、细胞芯片等分子信息的检测[10-11]。文献报道红细胞及血浆蛋白在免疫组化染色时极易非特异着色,不利于阳性结果的观察[2]。本文观察了去血细胞块与配对的胸膜病理免疫组化染色结果的一致性,显示差异无统计学显著性,提示去血剂不会改变肿瘤细胞表面抗原的性质,也避免了红细胞对诊断结果的干扰。
总之,红细胞背景显著干扰诊断阳性结果的检出,去血剂能够去除部分红细胞,保留切片中非红细胞形态完整,结构清晰,满足病理诊断需要。去血剂不会干扰细胞表面抗原表达,改变免疫组化染色结果。因此,细胞块病理作为一种创伤比内科胸腔镜、胸膜活检更小的检查方法,能够成为胸膜病理的补充。
[1] 潘献柱,潘献晓,陈命家.氯化铵去红细胞法在血性胸腹水脱落细胞学诊断中应用[J].临床与实验病理学杂志,2013,29(6):694-695.
[2] 颜亚晖,郑晖,张革进.血性胸腹水涂片中红细胞的去除方法[J].临床与实验病理学杂志,2004,20(6):750.
[3] Rahman NM, Ali NJ, Brown G, et al. Local anaesthetic thoracoscopy: British Thoracic Society Pleural Disease Guideline 2010[J]. Thorax,2010,65(Suppl 2):ii54-ii60.
[4] 徐健,刘春芳,韩雪,等.内科胸腔镜对未明原因胸腔积液的诊断价值及随诊的临床意义[J].中华结核和呼吸杂志,2014,37(1):64-66.
[5] Ugurluoglu C, Kurtipek E, Unlu Y,et al. Importance of the cell block technique in diagnosing patients with non-small cell carcinoma accompanied by pleural effusion[J]. Asian Pac J Cancer Prev,2015,16(7):3057-3060.
[6] Jing X, Li QK, Bedrossian U, et al. Morphologic and immunocytochemical performances of effusion cell blocks prepared using 3 different methods[J].Am J Clin Pathol, 2013,139(2):177-182.
[7] Kruger AM, Stevens MW, Kerley KJ, et al. Comparison of the Cellient((tm)) automated cell block system and agar cell block method[J].Cytopathology, 2014,25(6):381-388.
[8] Köksal D, DemF, Bayz H, et al. The cell block method increases the diagnostic yield in exudative pleural effusions accompanying lung cancer[J].Turk Patoloji Derg,2013,29(3):165-170.
[9] 赵俊军,徐健,刘春芳,等.以胸腔积液为首发症状的四例非HIV相关原发性渗出性淋巴瘤患者临床特征分析[J].中华血液学杂志,2016,37(7):626-629.
[10] Pu RT, Giordano TJ, Michael CW. Utility of cytology microarray constructed from effusion cell blocks for immunomarker validation[J].Cancer, 2008,114(5):300-306.
[11] 程方圆,王倩.胸腔积液沉淀物在恶性胸腔积液诊断中的价值[J].中国肺癌杂志,2015,18(10):652-654.
Clinical diagnostic value of cell block post RBC removal in malignant pleural effusion
XU Jian1,HAN Xue1,LIU Chunfang1,ZHAO Junjun2,LI Ping2,REN Lina1,JIANG Ling1,WANG Nini1
(1.DepartmentofRespiratory,DalianMunicipalCentralHospitalAffiliatedDalianMedicalUniversity,Dalian116033,China; 2.DepartmentofPathology,DalianMunicipalCentralHospitalAffiliatedDalianMedicalUniversity,Dalian116033,China)
Objective To investigate the diagnostic value of cell block through comparison with paired pleural biopsy. Methods Pleural effusions were collected from patients with suspected malignancy in Dalian Municipal Central Hospital from 2015 Jan to 2016 June. Cell blocks were prepared and red blood cells (RBCs) were removed using 50% ethyl alcohol if the effusion was bloody. Thoracoscopy was then performed to obtain pleural biopsy. The detection rate and the quality of pathological slices and immunohistochemical stains were compared between cell block and pleural biopsy. Results Malignant pleural effusions were finally collected from 36 patients, including 47.22% bloody effusion and 27.78% dark bloody effusion. The detection rates were 64.71%, 78.95% and 88.89%, respectively in bloody cell block post RBC removal, non-bloody cell block and pleural biopsy. There weren't statistical differences among groups. The detective rates reached 94.74%, 100% and 100%, respectively in the cell block post RBC removal, non-bloody cell block and pleural biopsy if the cell block came with pleural biopsy. The slices that couldn' t be use for diagnosis were 10.53%,9.52% and 20.00%, respectively in non-bloody, light bloody and dark bloody group. There weren't statistical differences among groups. The slices that couldn' t be use for diagnosis due to too much erythrocyte in background were 0, 0 and 7.84%, respectively in the above-mentioned group. There were statistical significant in dark bloody group compared with the other two groups. Thus, too many RBCs in background would disturb diagnosis. The immunohistochemical stains were consistent in the cell block post RBC removal compared to the paired pleural biopsy. Conclusion Pathological diagnosis using cell block has smaller wound and is a supplemental to pleural biopsy.
pleural effusion; pleural diseases; malignant pleural effusion; cell block; pleural pathology
徐 健(1967-),女,主任医师,教授。E-mail:karlinee@163.com
10.11724/jdmu.2017.03.10
R561.3;R734.2
A
1671-7295(2017)03-0252-05
徐健,韩雪,刘春芳,等.恶性胸腔积液去血细胞块临床应用价值研究[J].大连医科大学学报,2017,39(3):252-256.
2016-12-30;
2017-05-17)

