儿童急性淋巴细胞白血病E2A/PBX1融合基因检测的临床意义
朱莹莹 宋丽丽 史利欢 李彦格 刘炜
(郑州儿童医院 河南 郑州 450000)
儿童急性淋巴细胞白血病E2A/PBX1融合基因检测的临床意义
朱莹莹 宋丽丽 史利欢 李彦格 刘炜
(郑州儿童医院 河南 郑州 450000)
目的 探讨E2A/PBX1融合基因检测在儿童急性淋巴细胞白血病(ALL)中的临床意义。方法 采用巢式逆转录-聚合酶链反应(RT-PCR)法对郑州儿童医院2010年1月至2014年6月初诊的523例B系的ALL患儿进行E2A/PBX1融合基因检测。共26例表达E2A/PBX1(4.97%,26/523例),中危21例。选取同期收治的B系ALL且不携带E2A/PBX1融合基因的中危组患儿共43例为对照组,比较相同危险度的中危组患儿临床特征、5年无事件生存(EFS)率以及总生存(OS)率。结果E2A/PBX1阳性与阴性中危组患儿在性别以及初诊时的年龄、外周血白细胞、血红蛋白、血小板计数方面比较,差异均无统计学意义(P>0.05)。两组患儿诱导治疗第33天骨髓微小残留病(MRD)差异无统计学意义(P>0.05);5年EFS率分别为81.0%和78.6%,OS率分别为85.7%和83.3%,差异均无统计学意义(P>0.05)。结论E2A/PBX1融合基因阳性ALL患儿接受强烈化疗可改善预后,E2A/PBX1融合基因阳性与阴性中危组ALL患儿临床特征、早期治疗反应及预后未见明显差异,该融合基因是儿童ALL临床危险度分级的中危因素。
急性淋巴细胞白血病;儿童;E2A/PBX1融合基因;预后
急性淋巴细胞白血病(ALL)是儿童时期最常见的恶性肿瘤。近年来,依据白血病细胞的生物学特征、宿主遗传的异质性和微量残留等因素实施的个体化化疗大大提高了ALL的治愈率。目前国内儿童ALL 5年无事件生存(EFS)率可达70%~80%[1],接近国际先进水平[2]。染色体/融合基因作为特异性分子标志物之一,对白血病的诊断、疗效评估及预后提供了重要参考价值。巢式RT-PCR法是目前较常用的分子分析技术,能够在RNA水平上检测相关融合基因,较染色体分析敏感。儿童ALL中常见的融合基因有BCR/ABL、MLL/AF4、TEL/AML1、E2A/PBX1等。BCR/ABL和MLL/AF4属于临床危险度分级的高危因素,预后差。TEL/AML1多被认为是预后较好的融合基因。E2A/PBX1融合基因在ALL预后上尚存在争议。本研究利用巢式RT-PCR技术检测E2A/PBX1融合基因,通过比较该融合基因阳性与阴性中危组ALL患儿临床特征、治疗反应以及预后等方面,探讨该融合基因检测在儿童ALL中的临床意义。
1 对象与方法
1.1 研究对象 郑州儿童医院血液科2010年1月至2014年6月入院的初诊急性B淋巴细胞白血病患儿共523例,其中采用巢式RT-PCR方法检测出携带E2A/PBX1融合基因的患儿共26例。男15例,女11例,年龄1.6~14.1岁,中位年龄7.3岁。按危险度分组标准,高危1例,中危21例,标危3例,1例在确诊后放弃治疗。选取同期收治的急性B淋巴细胞白血病且不携带E2A/PBX1融合基因的中危组患儿共43例为对照组,男27例,女16例,年龄1.1~13.9岁,中位年龄5.5岁。本研究中所有患儿危险度分级均参照2006年《小儿急性白血病诊疗建议(修订草案)》[3],随访终点为2016年1月30日。
1.2 方法
1.2.1 微小残留监测 所有患儿微小残留病(MRD)均采用定量聚合酶链式反应方法。诱导化疗第33天取患儿肝素抗凝骨髓液2~3 ml,经Ficoll分离单个核细胞,进行四色荧光标记检测(CD34/CD19/CD10组合基础上再添加CD38、CD58、CD66c及TdT等),参考患儿初诊时的免疫分型的原始数据,在双参图上,若在原白血病细胞出现区域仍有细胞存在,即判断为白血病微小残留,这些残留细胞占骨髓单个核细胞总数的比例即为MRD监测结果。
1.2.2E2A/PBX1融合基因检测 取患儿肝素抗凝骨髓液2~3 ml,用淋巴细胞分析液提取单个核细胞,采用巢式RT-PCR方法检测E2A/PBX1融合基因。
1.3 统计学分析 应用SPSS 20.0软件包,E2A/PBX1阳性组与阴性组患儿的临床特点采用独立样本t检验,两组临床特征构成比之间的比较采用χ2检验。5年EFS率及总生存(OS)率采用Kaplan-Meier曲线生存分析法,不同生存情况采用双侧Log-Rank进行检验。EFS在以下几种情况终止:诱导不缓解、诱导时死亡、缓解时死亡、复发、第2肿瘤以及末次随访。总生存时间在以下情况终止:从诊断到各种原因的死亡时间。
2 结果
2.1 临床特征E2A/PBX1阳性与阴性中危组患儿在性别以及初诊时年龄、外周血白细胞、血红蛋白、血小板计数方面比较,差异均无统计学意义(P>0.05)。见表1。

表1 E2A/PBX1阳性与阴性中危组ALL患儿的临床特征比较
2.2 治疗特点E2A/PBX1阳性组中,标危患儿3例,其中2例分别在治疗第7个月(骨髓复发)和第14个月复发(中枢复发);中危组21例患儿VDLP诱导治疗第8天泼尼松反应均良好,除1例在诱导第21天因严重感染死亡,余20例患儿第33天骨髓均为完全缓解(原淋+幼淋<5%),缓解率为100%;高危组1例,在治疗第1个月后形态和分子生物学缓解,治疗第28个月骨髓复发。E2A/PBX1阴性组中43例中危患儿第8天泼尼松反应均良好,第33天骨髓均为完全缓解(原淋+幼淋<5%)。E2A/PBX1阳性和阴性中危组患儿CR率比较,差异无统计学意义(P>0.05)。
在E2A/PBX1阳性中危组中,除1例患儿在诱导治疗第21天死亡外,余20例中,7例第33天MRD为1%~0.01%,13例MRD<0.01%;E2A/PBX1阴性中危组中10例第33天MRD为1%~0.01%,33例MRD<0.01%;两组比较,差异无统计学意义(P>0.05)。
2.3 生存分析 截至随访日期结束,E2A/PBX1阳性中危组患儿中,3例复发(均为骨髓复发),2例放弃治疗后死亡,1例接受骨髓移植后仍生存。E2A/PBX1阴性中危组中,1例在诱导第34天因严重感染死亡,8例复发(1例睾丸复发,1例中枢加骨髓复发,6例骨髓复发),其中4例放弃治疗后死亡,1例具体死亡时间失访,1例接受化疗和2例接受骨髓移植后仍生存。E2A/PBX1阳性与阴性中危组患儿5年EFS率分别为81.0%和78.6%,差异无统计学意义(χ2=0.024,P=0.877)。两组OS率分别为85.7%和83.3%,差异无统计学意义(χ2=0.023,P=0.879)。见图1、2。
2.4 复发时间及复发率E2A/PBX1阳性中危组早期复发2例(第10、16个月),中期复发1例(第29个月);阴性组早期复发2例(第12、17个月),中期复发4例(第20、23、30、31个月),晚期复发2例(第40、 48个月)。两组复发时间比较,差异无统计学意义(P=0.269)。两组复发率分别为14.3%、18.6%,差异无统计学意义(χ2=0.220,P=0.639)。
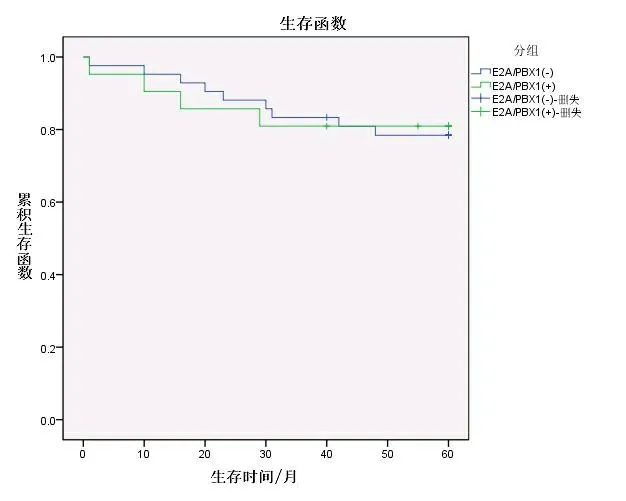
图1E2A/PBX1阳性与阴性中危组ALL患儿5年EFS率比较
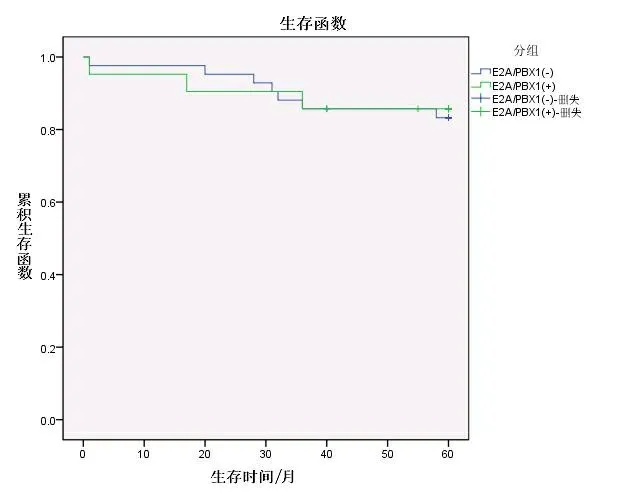
图2E2A/PBX1阳性与阴性中危组ALL患儿5年OS率比较
3 讨论
近30年来,ALL无事件生存率及治愈率有了很大提高,这与染色体/融合基因参与危险度分型并指导个体化治疗有着密切关系。E2A/PBX1融合基因是ALL患儿中较常见的分子遗传学改变,是由t(1;19)(q23;p13)染色体易位形成,在ALL中的发生率为3%~5%。本研究中E2A/PBX1融合基因在初诊ALL患儿中的发生率为4.97%,与Hu等[4]文献报道相近。
既往文献报道,携带E2A/PBX1融合基因的ALL患儿具有白细胞计数高、治疗反应差,是预后不良的重要因素,提高化疗强度可改善预后[5]。本研究中E2A/PBX1融合基因阳性标危患儿3例,采用标危治疗方案后2例复发,提示该融合基因阳性患儿需采用强烈化疗方案,以抵消其负面作用。本研究中,E2A/PBX1融合基因阳性中危组患儿21例,以同期危险度分型相同的阴性组做对照,发现两组患儿在性别、年龄、外周血白细胞数、血红蛋白以及血小板方面差异均无统计学意义,与庞丽等[6]文献报道一致。
过去认为,E2A/PBX1融合基因阳性ALL患儿易出现早期复发,且以中枢神经系统复发多见。本研究中E2A/PBX1阳性与阴性中危组患儿复发率分别是14.3%和18.6%,差异无统计学意义。虽然E2A/PBX1阳性中危组患儿早期复发更常见,占66.7%(2/3),但两组患儿的复发时间比较,差异无统计学意义,可能与本研究观察的例数少有关。Jeha等[7]报道E2A/PBX1阳性的初诊ALL患儿易出现中枢复发,本研究中E2A/PBX1阳性患儿复发3例,均为骨髓复发。Felice等[8-9]同样也未观察到该基因阳性易中枢复发。这可能与样本量小以及各研究组使用的化疗方案不同有关,仍需扩大样本量进一步研究。
E2A/PBX1阳性ALL患儿接受强烈化疗可改善预后,目前该亚型的EFS率已达80%~85%[10]。本研究中E2A/PBX1阳性中危组ALL患儿5年EFS率为81.0%,与阴性对照组78.6%比较,差异无统计学意义(P>0.05);5年OS率分别为85.7%和83.3%,差异无统计学意义(P>0.05)。由于本研究随访时间较短,故E2A/PBX1融合基因阳性ALL患儿的长期预后还待进一步观察。
综上所述,E2A/PBX1是儿童ALL中较常见的融合基因,阳性患儿接受强烈化疗方案可消除该融合基因的负面作用。在ALL中危组中,E2A/PBX1融合基因阳性与阴性患儿在初诊时的临床特征、早期治疗反应及预后未见明显差异,该融合基因是儿童ALL临床危险度分级的中危因素。
[1] 儿童急性淋巴细胞白血病诊疗研究协作组.上海儿童医学中心急性淋巴细胞白血病2005方案疗效多中心研究[J].中华儿科杂志,2013,51:1-7.
[2] Stary J,Zimmermann M,Campbell M,et al.Intensive chemotherapy for childhood acute lymphoblastic leukemia:results of the randomized intercontiental trial ALL IC-BFM 2002[J].J Chin Oncol,2014,32:174-184.
[3] 中华医学会儿科分会血液学组,中华儿科杂志编辑委员会.儿童急性淋巴细胞白血病诊疗建议(第三次修订)[J].中华儿科杂志,2006,44(5):392-393.
[4] Hu Y,He H,Lu J,et al.E2A-PBX1 exhibited a promising prognosis in pediatric acute lymphoblastic leukemia treated with the CCLG-ALL 2008 protocol[J].Onco Targets Ther,2016,22(9):7219-7225.
[5] Privitera E,Kamps M P,Hayashi Y,et al.Different molecular consequences of the 1;19 chromosomal translocation in childhood B-cell precursor acute lymphoblastic leukemia[J]. Blood,1992,79(7):1781-1888.
[6] 庞丽,赵文理,车琳,等.E2A/PBX1融合基因阳性儿童急性淋巴细胞白血病的临床特点及预后分析[J].中华实用儿科临床杂志,2014,29(3):199-202.
[7] Jeha S,Pei D,Raimondi S C,et al.Increased risk for CNS relapse in pre-B cell leukemia with the t(1;19)/TCF3-PBX1[J].Leukemia,2009,23(8):1406-1409.
[8] Felice M S,Gallego M S,Alonso C N,et al.Prognostic impact of t(1;19)/TCF3-PBX1 in childhood acute lymphoblastic leukemia in the context of Berlin-Frankfurt-Münster-based protocols[J].Leuk Lymphoma,2011,52(7):1215-1221.
[9] Pang L,Liang Y,Pan J,et al.Clinical features and prognostic significance of TCF3-PBX1 fusion gene in Chinese children with acute lymphoblastic leukemia by using a modified ALL-BFM-95 protocol[J].Pediatr Hematol Oncol,2015,32(3):173-181.[10]Pui C H,Carroll W L,Meshinchi S,et al.Biology,risk stratification,and therapy of pediatric acute leukemias:an update[J].J Chin Oncol,2011,29:551-565.
Clinical significance ofE2A/PBX1 fusion gene in childhood acute lymphoblastic leukemia
Zhu Yingying,Song Lili,Shi Lihuan,Li Yange,Liu Wei
(Children’HospitalofZhengzhou,Zhengzhou450000,China)
Objective To investigate the clinical significance ofE2A/PBX1 fusion gene measurement in childhood acute lymphoblastic leukemia (ALL).MethodsE2A/PBX1 fusion gene was evaluated by nested reverse transcription polymerase chain reaction (RT-PCR) in 523 newly B-ALL childhood patients from January 2010 to June 2014. 26 patients were identified asE2A/PBX1(4.97%, 26/523 cases), including 21 patients classfied to the intermediate-risk group, and at the same time 43 cases with negativeE2A/PBX1 fusion gene were regarded as control group. The clinical characteristics at diagnosis, 5-year event-free survival(EFS) rate and overall survival(OS) rate in the two groups were analyzed.Results There were no significant differences between the two group in gender, age, initial white blood cell count, hemoglobin level and platelet count. Statistic differences were not found in minimal residual disease(MRD) level at day 33 after induction treatment, 5-year EFS rates (81.0% vs 78.6%) and OS rates (85.7% vs 83.3%) between two groups(allP>0.05).Conclusion The prognosis can be improved through intense chemotherapy for ALL childhood patients withE2A/PBX1 fusion gene. At intermediate-risk group, statistic differences were not found in clinical characteristics, response to early treatment and prognosis between theE2A/PBX1 positive and negative patients.E2A/PBX1 fusion gene palys an intermediate-risk role in B-ALL childhood patients.
acute lymphoblastic leukemia;child;E2A/PBX1 fusion gene;prognosis
R 725.5
10.3969/j.issn.1004-437X.2017.10.002
2017-02-03)

