结直肠癌患者血浆游离DNA含量与临床特征的相关性
陈亚伟, 兰 玲, 张恒辉, 周炳喜, 韩明阳, 谢 毅, 李 剑, 李景南, 张 莉, 于 静
1.郑州大学人民医院消化内科,河南 郑州 450003;2.首都医科大学附属北京地坛医院传染病研究所;3.郑州大学人民医院胃肠外科;4.郑州大学附属肿瘤医院普外科;5.中国医学科学院 北京协和医院消化内科
结直肠癌患者血浆游离DNA含量与临床特征的相关性
陈亚伟1, 兰 玲1, 张恒辉2, 周炳喜1, 韩明阳3, 谢 毅3, 李 剑4, 李景南5, 张 莉1, 于 静1
1.郑州大学人民医院消化内科,河南 郑州 450003;2.首都医科大学附属北京地坛医院传染病研究所;3.郑州大学人民医院胃肠外科;4.郑州大学附属肿瘤医院普外科;5.中国医学科学院 北京协和医院消化内科
目的 探讨结肠癌及其早期病变不同分期之间血浆游离DNA水平的差异及结直肠癌病变特性与血浆游离DNA水平的关系。方法 收集2016年5月-2016年10月郑州大学人民医院收治的结肠息肉、结肠癌、直肠癌患者血浆样本共72例。采用磁珠法提取患者血浆游离DNA,采用Qubit 3.0荧光计定量血浆游离DNA的浓度,分析血浆游离DNA含量与患者临床特征的相关性。结果 结肠癌患者血浆游离DNA(439.4±218.8)ng/ml水平显著高于结肠息肉组(307.6±215.4)ng/ml(P<0.05),也显著高于直肠癌组(256.7±123.2)ng/ml(P<0.01),结肠息肉患者血浆游离DNA水平与患者年龄、性别、息肉病理类型、数量、大小无显著相关性,结直肠癌患者血浆游离DNA水平与患者年龄、性别、肿瘤分期、大体类型无显著相关性,与肿瘤体积的对数呈正相关(r=0.477,P<0.01)。结论 血浆游离DNA水平可有助于诊断结肠癌,并可间接反映结直肠癌患者体内的肿瘤负荷。
结肠息肉;结肠癌;直肠癌;游离DNA;肿瘤负荷
结直肠癌是发病率和病死率都极高的恶性肿瘤之一[1-3],早期无明显症状,多数患者诊断时已为中晚期,约20%的患者在初诊时就已发生了远处转移,5年生存率仅为11.7%[4]。内镜及内镜下活组织检查是诊断结直肠癌的金标准,然而,内镜及组织活检为有创侵入性检查,患者依从性较差,为早期诊断带来困难,因此,采用非侵入性诊断方法筛选出结直肠癌的高风险人群,继而进行有目的内镜精查是较为可行的诊断策略。游离DNA(cell free DNA,cfDNA)是一种无细胞状态的胞外DNA,在肿瘤患者中,主要来源于肿瘤细胞的坏死或凋亡、微转移灶或循环肿瘤细胞的裂解和增殖旺盛的肿瘤细胞所释放[5]。健康人外周血也存在cfDNA,肿瘤患者的外周血cfDNA含量较健康人显著性增高[6]。因其采集简便、快速、无创,可以对肿瘤患者进行实时、动态监测,在肿瘤的诊断、预后中显现出越来越重要的前景。本研究纳入结肠息肉、结肠癌、直肠癌患者,分析结肠癌及其早期病变不同分期之间血浆cfDNA水平的差异及结肠息肉、结直肠癌病变特性与血浆cfDNA水平的关系,以期为血浆cfDNA 在结直肠癌的早期筛查、伴随诊断中的应用提供依据。
1 资料与方法
1.1 一般资料 收集2016年5月-2016年10月郑州大学人民医院收治的结肠息肉、结肠癌、直肠癌患者肿瘤血浆样本共72例。本研究通过河南省人民医院医学伦理委员会的批准,所有样本均在患者签署了根据赫尔辛基宣言的拟定的书面知情同意书后收集。纳入标准:(1)经病理组织学/细胞学检查诊断为结肠息肉、结肠癌、直肠癌;(2)心、肝、肾等主要脏器功能正常;(3)近期无手术史;(4)自愿入组,签署知情同意书,依从性好,配合随访。排除标准:(1)患有肝炎、肺炎、结肠炎、直肠炎等慢性炎症;(2)患有系统性红斑狼疮等免疫性疾病;(3)目前存在未控制的严重感染;(4)依从性差,或患有精神疾病。
1.2 方法
1.2.1 材料:EDTA抗凝管购自臻和(北京)科技有限公司。MagMAX游离DNA抽提试剂盒购自赛默飞世尔科技有限公司。Qubit dsDNA HS Assay Kit核酸定量分析试剂盒购自赛默飞世尔科技有限公司。Qubit 3.0荧光计购自赛默飞世尔科技有限公司。
1.2.2 血浆的采集、处理与储存:采集患者术前乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝血5~8 ml。外周血6 h内离心,以3 000 r/min低速离心10 min,取上清于1.5 ml离心管中,以5 000 r/min高速离心2 min去除有形细胞的沾染,再取上清于一新的1.5 ml离心管中,-20 ℃保存待用。
1.2.3 游离DNA的提取:MagMAX游离DNA抽提试剂盒购自赛默飞世尔科技有限公司,具体操作步骤参照试剂盒说明书。在1 ml血浆中加入1 250 μl游离DNA结合液和15 μl Dynal磁珠,震荡10 min,使游离DNA与磁珠结合。磁力收集后分别用500 μl游离DNA洗涤液和500 μl 80%乙醇洗涤磁珠。待磁珠干燥后,加入50 μl游离DNA洗脱液,将磁珠上的游离DNA洗脱下来。待磁力收集,上清即为纯化的游离DNA,将游离DNA转入1.5 ml离心管中备用。
1.2.4 游离DNA的定量:游离DNA定量使用Qubit dsDNA HS Assay Kit核酸定量分析试剂盒,具体操作步骤参照试剂盒说明书。一个反应的Qubit工作液由199 μl缓冲液和1 μl染料组成。分别取190 μl Qubit工作液至2个Qubit分析管中,分别加入10 μl标准品1和标准品2,震荡混匀,室温孵育2 min用于校正Qubit 3.0荧光计。游离DNA定量时在199 μl Qubit工作液中加入1 μl游离DNA,室温孵育2 min,在Qubit 3.0荧光计上读取游离DNA的浓度。
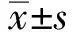
2 结果
2.1 一般资料 本研究纳入结肠息肉患者27例,结肠癌患者21例,直肠癌患者24例,共72例。男48例,年龄(56.0±12.8)岁;女24例,年龄(57.8±13.8)岁。结肠息肉按照病变性质分类[7],其中炎性/增生性息肉9例,非进展期腺瘤8例,进展期腺瘤10例,结直肠癌患者按UICC/AJCC第7版标准进行分期[8-9],其中Ⅰ期6例、Ⅱ期21例、Ⅲ期17例、Ⅳ期1例。
2.2 结肠息肉、结直肠癌患者血浆游离DNA水平与临床特征分析 结肠癌患者的血浆cfDNA浓度显著高于结肠息肉患者(P<0.05)。炎性/增生性息肉、非进展期腺瘤、进展期腺瘤患者血浆cfDNA浓度组间比较,差异无统计学意义(P>0.05)。结肠癌Ⅰ~Ⅱ期、Ⅲ期患者血浆cfDNA浓度组间比较,差异无统计学意义(P>0.05,见表1)。结肠息肉患者年龄、性别、病理类型、数量、大小与血浆cfDNA水平组间比较,差异无统计学意义(P>0.05,见表2)。
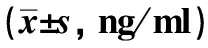
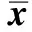

病变性质例数cfDNA浓度P值结肠息肉27307.6±215.40.042△ 炎性/增生性息肉9263.1±177.00.57 非进展期腺瘤8285.2±208.0 进展期腺瘤10365.4±257.6结肠癌21439.4±218.8 Ⅰ~Ⅱ期12417.3±230.80.606 Ⅲ期9468.9±211.5
注:△:与结肠癌比较的P值。
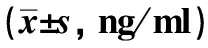
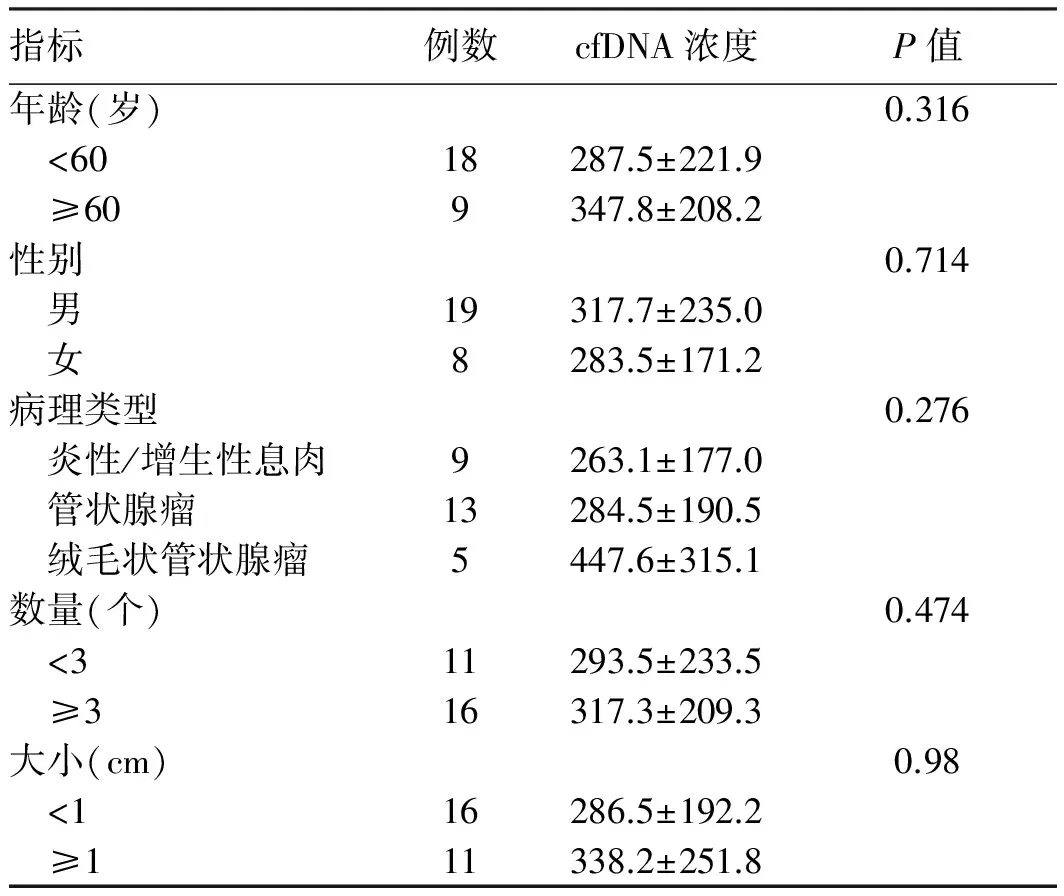
指标例数cfDNA浓度P值年龄(岁)0.316 <6018287.5±221.9 ≥609347.8±208.2性别0.714 男19317.7±235.0 女8283.5±171.2病理类型0.276 炎性/增生性息肉9263.1±177.0 管状腺瘤13284.5±190.5 绒毛状管状腺瘤5447.6±315.1数量(个)0.474 <311293.5±233.5 ≥316317.3±209.3大小(cm)0.98 <116286.5±192.2 ≥111338.2±251.8
结肠癌患者血浆cfDNA浓度显著高于直肠癌组患者(P<0.05),右半结肠癌患者cfDNA浓度与左半结肠癌组患者比较,差异无统计学意义(P>0.05)。结直肠癌患者年龄、性别、肿瘤分期、大体类型与血浆cfDNA水平组间比较,差异无统计学意义(P>0.05,见表3)。血浆cfDNA水平与肿瘤TNM综合分期无相关性,与肿瘤体积大小的对数呈正相关(r=0.474,P<0.01)(见图1~2)。
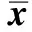

指标例数cfDNA浓度P值年龄(岁) <6023363.6±245.10.449 ≥6022319.4±126.7性别 男29350.4±222.40.702 女16326.8±139.0TNM分期 Ⅰ6336.0±47.70.878 Ⅱ21319.9±224.1 Ⅲ17366.7±199.6 Ⅳ1422部位 结肠21439.4±218.80.001△ 右半结肠11434.4±255.90.526∗ 左半结肠10445.0±183.3 直肠24256.7±123.2大体类型 溃疡型37337.7±203.20.603 隆起型8362.0±165.1
注:△:与直肠比较的P值;*:与左半结肠比较的P值。
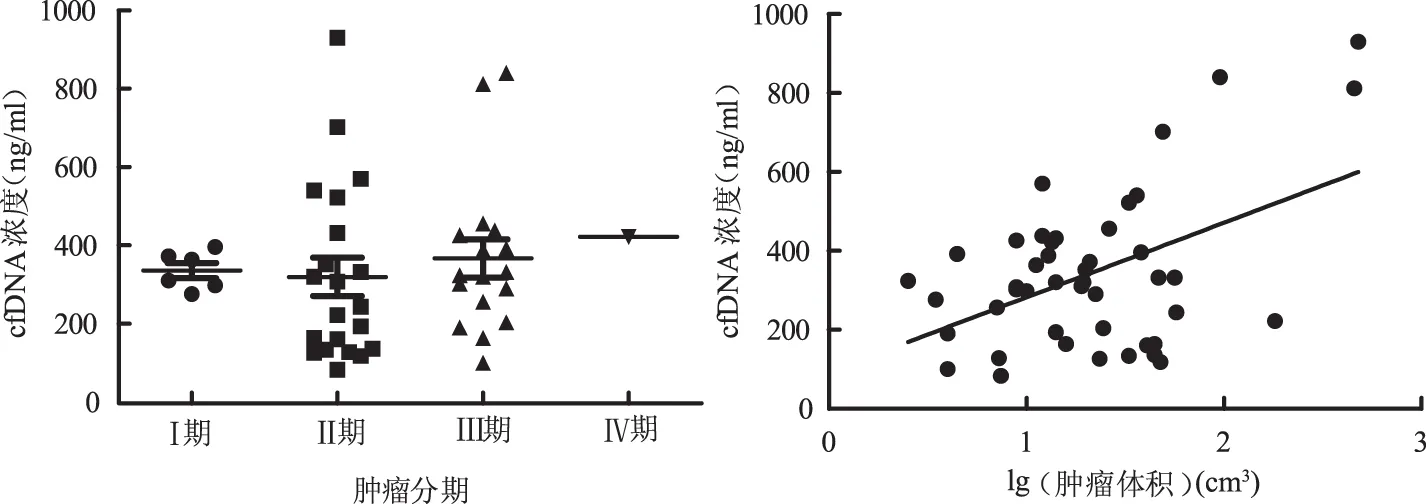
图1 结直肠癌不同分期游离DNA浓度;图2 结直肠癌游离DNA浓度与肿瘤体积相关性
Fig 1 The level of cfDNA in different stages of colorectal cancer; Fig 2 The correlation analysis between cfDNA and tumor volume in colorectal cancer
3 讨论
随着近年研究的深入,cfDNA因其具有无创方便、可反复取材等优点,在肿瘤早期筛查与诊断中的地位越来越得到重视[10-11],然而通过cfDNA水平的定量分析来评价罹患肿瘤的风险仍存在争议,许多研究认为cfDNA水平具有肿瘤早期诊断价值[12],也有研究提出cfDNA水平与患者年龄、性别、发生部位、肿瘤分化程度、TNM分期等均无相关性[13]。目前国内外有关cfDNA水平对结直肠癌的诊断价值研究并不多,且大部分研究都是对结直肠癌患者与健康对照组进行比较研究,缺乏结直肠癌及其早期良性病变各分期亚组的对照研究,而对结直肠癌及其早期良性病变相关临床病理特征进行系统性分析及亚组分析,对于确定cfDNA是否可以作为肿瘤的早期诊断指标具有重要意义。
本研究致力于探讨结肠癌及其早期病变不同分期之间血浆cfDNA水平的差异及结肠息肉、结直肠癌病变特性与血浆cfDNA水平的关系,结果发现,从结肠早期病变到结肠癌中晚期,随着病变的进展,血浆cfDNA水平逐渐增高,且结肠癌cfDNA水平显著高于结肠息肉患者,差异有统计学意义(P<0.05)。可能的原因是,随着肿瘤的进展,肿瘤组织局部血供不足,缺氧坏死、坏死或凋亡的肿瘤细胞被巨噬细胞吞噬,释放出大量的DNA片段,从而显著增加了cfDNA的浓度,提示cfDNA水平可有助于诊断结肠癌,有望作为无创的分子诊断方法用于结肠癌高危人群的筛查。
在对结肠息肉病变特性与临床病理特征系统分析中发现,血浆cfDNA水平与患者年龄,性别,息肉病理类型、数量、大小均无相关性。对结直肠癌病变特性与临床病理特征系统分析中发现,血浆cfDNA水平与患者年龄、性别、肿瘤分期、大体类型均无相关性,与肿瘤部位、体积相关。血浆cfDNA水平与肿瘤体积呈正相关,这与现有的一些研究结果一致[14]。我们推测这可能是体积大的肿瘤,其癌细胞坏死或凋亡释放更多的DNA到外周血,从而使血浆cfDNA水平升高,提示血浆cfDNA的水平可间接反映患者体内的肿瘤负荷。结肠癌患者血浆cfDNA水平显著高于直肠癌患者,分析发现,本研究入组结肠癌患者肿瘤体积显著大于直肠癌,也进一步说明cfDNA水平可反映患者体内的肿瘤负荷。同时结肠癌与直肠癌在生化学、基因学等方面存在明显差异。
总之,血浆游离DNA水平在早期结肠良性病变到晚期结肠癌的不同时期中呈上升趋势,可有助于诊断结肠癌,并可间接反映结直肠癌患者体内的肿瘤负荷。同时cfDNA样本采集无创,临床依从性较好,可以对肿瘤患者进行实时、动态监测,我们拟下一步对结直肠病变cfDNA基因突变进行分析,了解结直肠癌及其早期良性病变各分期亚组在基因水平的差异,以期进一步为结直肠癌伴随诊断的平台搭建提供基础。
[1]Zheng R, Zeng H, Zhang S, et al. National estimates of cancer prevalence in China, 2011 [J]. Cancer Lett, 2016, 370(1): 33-38.
[2]Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016 [J]. CA Cancer J Clin, 2016, 66(1): 7-30.
[3]姜艳芳, 魏志, 孙自勤. 中国青年大肠癌发病趋势分析[J]. 胃肠病学和肝病学杂志, 2016, 25(9): 982-987. Jiang YF, Wei Z, Sun ZQ. Analysis of the incidence trend of young-onset colorectal cancer in China [J]. Chin J Gastroenterol Hepatol, 2016, 25(9): 982-987.
[4]Brenner H, Kloor M, Pox CP. Colorectal cancer [J]. Lancet, 2014, 383(9927): 1490-1502.
[5]van der Vaart M, Pretorius PJ. The origin of circulating free DNA [J]. Clin Chem, 2007, 53(12): 2215.
[6]Anker P, Mulcahy H, Chen XQ, et al. Detection of circulating tumour DNA in the blood (plasma/serum) of cancer patients [J]. Cancer Metastasis Rev, 1999, 18(1): 65-73.
[7]Strum WB. Colorectal adenomas [J]. N Engl J Med, 2016, 374(11): 1065-1075.
[8]Benson AB, Venook AP, Bekaii-Saab T, et al. Colon cancer, version 3.2014 [J]. J Natl Compr Canc Netw, 2014, 12(7): 1028-1059.
[9]Benson AB 3rd, Venook AP, Bekaii-Saab T, et al. Rectal cancer, version 2.2015 [J]. J Natl Compr Canc Netw, 2015, 13(6): 719-728; quiz 728.
[10]Schwarzenbach H, Hoon DS, Pantel K. Cell-free nucleic acids as biomarkers in cancer patients [J]. Nat Rev Cancer, 2011, 11(6): 426-437.
[11]Crowley E, Di Nicolantonio F, Loupakis F, et al. Liquid biopsy: monitoring cancer-genetics in the blood [J]. Nat Rev Clin Oncol, 2013, 10(8): 472-484.
[12]Chen K, Zhang H, Zhang LN, et al. Value of circulating cell-free DNA in diagnosis of hepatocellular carcinoma [J]. World J Gastroenterol, 2013, 19(20): 3143-3149.
[13]Frattini M, Gallino G, Signoroni S, et al. Quantitative analysis of plasma DNA in colorectal cancer patients: a novel prognostic tool [J]. Ann N Y Acad Sci, 2006, 1075: 185-190.
[14]Diehl F, Li M, Dressman D, et al. Detection and quantification of mutations in the plasma of patients with colorectal tumors [J]. Proc Natl Acad Sci U S A, 2005, 102(45): 16368-16373.
(责任编辑:陈香宇)
The correlation analysis between the concentration of plasma cell free DNA and clinical features in colorectal cancer
CHEN Yawei1, LAN Ling1, ZHANG Henghui2, ZHOU Bingxi1, HAN Mingyang3, XIE Yi3, LI Jian4, LI Jingnan5, ZHANG Li1, YU Jing1
1.Department of Gastroenterology, Zhengzhou University People’s Hospital, Zhengzhou 450003; 2.Institute of Infectious Diseases, Beijing Ditan Hospital, Capital Medical University; 3.Department of Gastrointestinal Surgery, Zhengzhou University People’s Hospital; 4.Department of General Surgery, the Affiliated Cancer Hospital of Zhengzhou University (Henan Cancer Hospital); 5.Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, China
Objective To compare the difference of the concentration of plasma cell free DNA (cfDNA) of patients with different stages of colon cancer and early benign lesions, and to analyze the correlation between the concentration of cfDNA and clinical features in colorectal cancer. Methods A total of 72 cases of colonic polyps, colonic cancer and rectal cancer were enrolled in this study. The plasma samples of patients were collected and extracted. The concentration of cfDNA was detected by Qubit 3.0 fluorimeter. Results The concentration of cfDNA of patients with colon cancer (439.4±218.8) ng/ml was significant higher than the colonic polyps group (307.6±215.4) ng/ml (P<0.05), and also significant higher than the rectal cancer group (256.7±123.2) ng/ml (P<0.01). The concentration of cfDNA was positively correlated with the logarithm of tumor size in colorectal cancer (r=0.477,P<0.01). The concentration of cfDNA was not related with TNM stage, gross type of tumor, gender, and age in colorectal cancer patients. The concentration of cfDNA was not related with pathological pattern, size and quantity of the polyps, gender, and age in colon polyps patients. Conclusion The concentration of cfDNA can help in the diagnosis of colonic cancer, and is positively correlated with tumor burden in colorectal cancer.
Colonic polyps; Colonic cancer; Rectal cancer; Cell free DNA; Tumor burden
10.3969/j.issn.1006-5709.2017.06.021
陈亚伟,硕士研究生,研究方向:消化道肿瘤发病机制。E-mail:cchenyawei@163.com
于静,主任医师,教授,硕士生导师,研究方向:消化系统疾病诊治。E-mail:yuj123@126.com;兰玲,副主任医师,副教授,硕士生导师,研究方向:消化道肿瘤发病机制。E-mail:lanling95@163.com
R735.3+5
A
1006-5709(2017)06-0709-04
2017-03-26

