Nesfatin-1对内脏高敏感大鼠内脏敏感性影响机制的研究
古巧燕,史盛梅,张 军,年媛媛,冯义朝
1.延安大学附属医院消化科,陕西 延安 716000; 2.西安交通大学第二附属医院消化内科
Nesfatin-1对内脏高敏感大鼠内脏敏感性影响机制的研究
古巧燕1,史盛梅1,张 军2,年媛媛2,冯义朝1
1.延安大学附属医院消化科,陕西 延安 716000; 2.西安交通大学第二附属医院消化内科
目的 研究Nesfatin-1对内脏高敏感大鼠血液、脑肠轴组织5-HT表达的影响,探讨Nesfatin-1对内脏高敏感大鼠内脏敏感性影响的机制,为进一步明确内脏高敏感形成机制的研究提供思路。方法 将新生2 d龄雄性SD大鼠随机分为健康对照组和模型组,模型组大鼠通过母婴分离和醋酸灌肠相结合的方法制备内脏高敏感大鼠模型。模型验证成功后,模型组分为干预对照组、低浓度干预组、中浓度干预组和高浓度干预组,应用IHC、ELISA、Western blotting方法检测内脏高敏感模型大鼠血液、脑肠轴不同部位5-HT的表达,对实验结果进行统计学分析。结果 (1)不同分组大鼠血清5-HT水平的ELISA检测结果:健康对照组、干预对照组大鼠分别与低浓度组、中浓度组、高浓度组比较,大鼠血清5-HT水平差异有统计学意义(P<0.05)。(2)不同分组大鼠脑肠轴组织5-HT表达IHC检测结果:健康对照组、干预对照组分别与低浓度组、中浓度组、高浓度组比较,结肠组织、脊髓组织、脑组织中5-HT阳性表达差异有统计学意义(P<0.05),Nesfatin-1不同浓度组大鼠脑肠轴5-HT阳性表达明显高于健康对照组、干预对照组。(3)不同分组大鼠脑肠轴组织5-HT表达Western blotting检测结果:健康对照组、干预对照组分别与低浓度组、中浓度组、高浓度组比较,结肠组织、脊髓组织、脑组织中5-HT表达差异有统计学意义(P<0.05)。结论 Nesfatin-1通过中枢途径干预内脏高敏感大鼠,发现Nesfatin-1可以上调内脏高敏感大鼠血液、脑肠轴不同部位5-HT水平,推测Nesfatin-1可能通过上调5-HT的水平影响中枢和外周5-HT信号通路,最终参与内脏高敏感的形成及调控。
Nesfatin-1;内脏敏感性; 大鼠
肠易激综合征(irritable bowel syndrome,IBS)是一种最常见的功能性肠道疾病,临床表现为持续或间歇加重的腹痛、腹胀、腹泻、便秘等肠道功能紊乱的症状,同时又缺乏肠道生化学和形态学改变[1-2]。2006年首次发现Nesfatin-1[3],它是一种新型的脑肠肽,参与机体摄食活动、体温调控、意识活动、消化液分泌等多种复杂的生理病理活动[4-9],我们前期研究[10]显示,Nesfatin-1对内脏高敏感模型大鼠的内脏敏感性、结肠运动有影响,基于此,本研究通过建立内脏高敏感性大鼠模型,给予中枢途径Nesfatin-1对内脏高敏感性大鼠进行干预,观察干预后内脏高敏感性大鼠血液、脑肠轴组织5-HT水平的变化,探讨Nesfatin-1影响内脏高敏感大鼠内脏敏感性的可能机制。
1 材料与方法
1.1 主要试剂 Nesfatin-1(上海吉尔生化有限公司,批号:P140508-SL262333);大鼠5-HT ELISA检测试剂盒(武汉优尔生科技股份有限公司,货号:CEA808Ge;批号:L140908201);羊抗兔二抗(英国Abcam公司,批号:GR101082-1),工作浓度为1∶500。
1.2 实验动物分组及药物干预 选取实验大鼠40只,其中内脏高敏感模型大鼠32只,健康大鼠8只,模型组大鼠通过母婴分离醋酸灌肠相结合的方法制备内脏高敏感大鼠模型。模型大鼠随机分为4组:干预对照组、低浓度组、中浓度组、高浓度组,每组8只大鼠;各组大鼠具体处理措施如下:健康对照组:大鼠不给予任何处理;干预对照组:大鼠给予侧脑室注射生理盐水0.5 μl 0.9%氯化钠;低浓度组:大鼠给予侧脑室注射0.5 μl 0.5 μmol/L的Nesfatin-1;中浓度组:大鼠给予侧脑室注射0.5 μl 5 μmol/L的Nesfatin-1;高浓度组:大鼠给予侧脑室注射0.5 μl 50 μmol/L的Nesfatin-1。
1.3 ELISA检测 取实验大鼠静脉血2 ml,分离血浆,进行5-HT检测。
1.4 Western blotting检测 不同分组大鼠脑肠轴不同组织进行处理后,进行5-HT检测。
1.5 制作切片及免疫组化检测 实验结束后处死大
鼠,结肠组织取材部位为降结肠,脊髓组织取材部位为腰骶段、脊髓背角、胸腰段,脑组织取材部位为大脑皮质、海马、中缝核,组织制片后应用免疫组化方法检测5-HT表达。采用半定量法分析染色结果:按照染色强度和阳性细胞百分比乘积进行评价。

2 结果
2.1 实验大鼠血清5-HT水平的ELISA检测结果 健康对照组、干预对照组大鼠分别与低浓度组、中浓度组、高浓度组比较,大鼠血清5-HT水平差异均有统计学意义(P<0.05,见表1)。
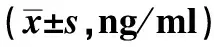
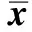

组别只数5⁃HT健康对照组871.12±3.73干预对照组893.11±21.63#低浓度组8118.25±19.93##∗中浓度组8146.14±22.64##∗∗高浓度组8163.34±14.08##∗∗
注:与健康对照组比较,#P<0.05,##P<0.01;与干预对照组比较,*P<0.05,**P<0.01。
2.2 实验大鼠脑肠轴组织5-HT表达的IHC检测结果 健康对照组、干预对照组分别与低浓度组、中浓度组、高浓度组比较,结肠组织、脊髓组织、脑组织中5-HT阳性表达差异有统计学意义(P<0.05);Nesfatin-1不同浓度组大鼠脑肠轴5-HT阳性表达明显高于健康对照组和干预对照组,且脑组织中5-HT阳性表达最显著(见表2、图1~3)。
2.3 实验大鼠脑肠轴组织5-HT表达的Western blotting检测结果 健康对照组、干预对照组分别与低浓度组、中浓度组、高浓度组比较,结肠组织、脊髓组织、脑组织中5-HT表达差异有统计学意义(P<0.05,见表3、图4~6)。
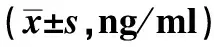
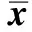

组别只数结肠脊髓脑健康对照组82.96±0.912.50±0.783.88±1.39干预对照组83.58±1.21#2.96±0.75#4.92±1.25##低浓度组85.92±1.47##∗∗3.63±1.09##∗6.33±1.37##∗中浓度组86.33±1.37##∗∗4.29±1.19##∗∗8.08±1.18##∗∗高浓度组88.08±1.18##∗∗5.96±1.19##∗∗9.42±1.95##∗∗
注:与健康对照组比较,#P<0.05,##P<0.01;与干预对照组比较,*P<0.05,**P<0.01。
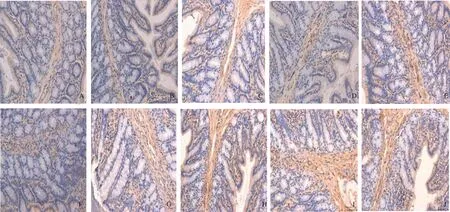
图1 不同分组大鼠结肠组织5-HT阳性表达(200×) A~B: 健康对照组; C~D: 干预对照组; E~F: 低浓度组; G~H: 中浓度组; I~J: 高浓度组
Fig 1 Expressions of 5-HT in colon in different groups (200×) A-B: healthy control group; C-D: intervention control group; E-F: low concentration intervention group; G-H: medium concentration intervention group; I-J: high concentration intervention group
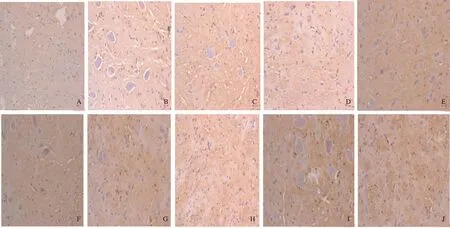
图2 不同分组大鼠脊髓组织5-HT阳性表达(200×) A~B: 健康对照组; C~D: 干预对照组; E~F: 低浓度组; G~H: 中浓度组; I~J: 高浓度组
Fig 2 Expressions of 5-HT in spinal cord in different groups (200×) A-B: healthy control group; C-D: intervention control group; E-F: low concentration intervention group; G-H: medium concentration intervention group; I-J: high concentration intervention group
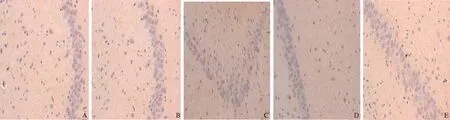
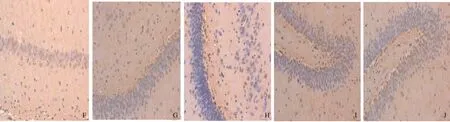
图3 不同分组大鼠脑组织5-HT阳性表达(200×) A~B: 健康对照组; C~D: 干预对照组; E~F: 低浓度组; G~H: 中浓度组; I~J: 高浓度组
Fig 3 Expressions of 5-HT in brain in different groups (200×) A-B: healthy control group; C-D: intervention control group; E-F: low concentration intervention group; G-H: medium concentration intervention group; I-J: high concentration intervention group
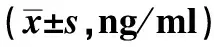
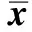

组别只数结肠脊髓脑健康对照组80.31±0.000.52±0.030.59±0.08干预对照组80.36±0.02#0.60±0.09#0.71±0.12#低浓度组80.45±0.12##∗0.69±0.01##∗0.81±0.08##∗中浓度组80.52±0.00##∗∗0.72±0.01##∗0.93±0.04##∗∗高浓度组60.64±0.06##∗∗0.97±0.09##∗∗1.17±0.04##∗∗
注:与健康对照组比较,#P<0.05,##P<0.01;与干预对照组比较,*P<0.05,**P<0.01。

图4 不同分组大鼠结肠组织5-HT表达情况;图5 不同分组大鼠脊髓组织5-HT表达情况;图6 不同分组大鼠脑组织5-HT表达情况
Fig 4 Expressions of 5-HT in colon in different groups; Fig 5 Expressions of 5-HT in spinal cord in different groups; Fig 6 Expressions of 5-HT in brain in different groups
3 讨论
内脏高敏感是IBS的重要机制,但是其具体的形成机制仍不明确,本研究前期发现Nesfatin-1可以增加内脏高敏感模型大鼠的内脏敏感性和影响模型大鼠结肠快波、慢波、收缩波,提示Nesfatin-1与内脏敏感性有关[10],可能参与IBS内脏高敏感的形成,我们仍需要进一步思考研究,Nesfatin-1对IBS内脏高敏感形成中的具体作用机制如何,怎样通过干预Nesfatin-1可以有效调控内脏敏感性,进而控制IBS呢?
5-HT是一种重要的脑肠肽物质,参与机体复杂的神经内分泌免疫网络系统的调控,通过激活相应的受体来调节肠道动力和肠道敏感性,同时在内脏敏感性疼痛产生、调控、传递、情绪调控及睡眠等生理病理活动中起着正反调控的重要作用;IBS患者体内血清、肠黏膜组织中5-HT水平有不同程度升高,众多研究从不同角度证实了5-HT信号通路与IBS的发生、发展有密切关系[11-14],5-HT曾被认为是内脏高敏感形成的启动因子,5-HT合成、释放、与相应受体结合及重摄取等信号转导系统中任何环节的异常都可能导致胃肠道动力、分泌功能异常和内脏敏感性的变化,目前,许多5-HT受体及相关制剂已经很广泛地应用到IBS的临床治疗和基础研究。
一方面,我们基于前期研究结果即Nesfatin-1与内脏高敏感模型大鼠内脏敏感性及结肠动力有关;另一方面,基于许多研究结果显示的Nesfatin-1、5-HT与内脏高敏感的相关性及三者之间各种复杂关系,我们这部分研究通过Nesfatin-1中枢途径干预模型大鼠后,应用ELISA、IHC、Western blotting检测方法,检测内脏高敏感模型大鼠脑肠轴不同部位5-HT阳性表达情况,进一步探讨Nesfatin-1参与内脏高敏感形成的可能机制。本实验研究首先应用ELISA方法检测各组大鼠血清中5-HT水平,健康对照组和干预对照组分别与不同浓度组大鼠进行比较,差异均有统计学意义。其次应用IHC方法检测不同实验分组大鼠脑肠轴不同部位组织5-HT阳性的表达情况,健康对照组、干预对照组分别与不同浓度组比较,结肠组织、脊髓组织、脑组织中5-HT阳性表达差异均有统计学意义,Nesfatin-1不同浓度组大鼠在结肠组织、脊髓组织、脑组织三个部位的表达均高于健康对照组、干预对照组。最后,应用Western blotting方法检测实验大鼠脑肠轴不同部位组织5-HT表达情况,健康对照组和干预对照组分别与不同浓度组比较,结肠组织、脊髓组织、脑组织中5-HT阳性表达差异也有统计学意义。由上可见,三种不同的检测方法从不同的角度对比健康对照组、干预对照组与不同浓度组大鼠脑肠轴不同部位的5-HT表达的差异,结果均提示Nesfatin-1可以上调模型大鼠外周及中枢5-HT水平,不同方法的差异性不完全一致,有必要调整实验条件进一步深入研究。
总之,Nesfatin-1能够通过中枢途径增加内脏高敏感模型大鼠的内脏敏感性,改变内脏高敏感大鼠结肠电生理指标,上调模型大鼠外周及中枢不同部位5-HT表达,高表达的5-HT可以作用于胃肠道5-HT受体,激活多种活性生物物质释放,调控胃肠道运动和分泌功能,并将这种影响传至中枢,同时高表达的5-HT还参与中枢对下行神经系统的调控;由此推测在内脏高敏感大鼠模型中Nesfatin-1可能通过上调5-HT的表达水平,进而影响中枢和外周5-HT信号通路,导致内脏高敏感模型大鼠的内脏敏感性增加,从而参与IBS内脏高敏感的形成及调控,可见Nesfatin-1的参与有可能是形成内脏高敏感的一个重要机制,而且Nesfatin-1参与内脏高敏感形成的机制是多靶点、多通路的,但是关于Nesfatin-1与IBS之间的研究刚刚开始,尤其是其与内脏高敏感的关系,故还需要进一步深入探讨Nesfatin-1在内脏高敏感形成中的具体作用及影响5-HT信号通路的具体机制。深入研究这些可以为未来明确IBS发病机制,进一步阐明内脏高敏感机制及有效控制内脏高敏感,提高IBS的治疗效果和预后提供新思路。
[1]Camilleri M, Lasch K, Zhou W. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. The confluence of increased permeability, inflammation, and pain in irritable bowel syndrome [J]. Am J Physiol Gastrointest Liver Physiol, 2012, 303(7): G775-G785.
[2]Drossman DA. The functional gastrointestinal disorders and the Rome Ⅲ process [J]. Gastroenterology, 2006, 130(5): 1377-1390.
[3]Oh-I S, Shimizu H, Satoh T, et al. Identification of nesfatin-1 as a satiety molecule in the hypothalamus [J]. Nature, 2006, 443(7112): 709-712.
[4]Shimizu H, Osaki A. Nesfatin/Nucleobindin-2 (NUCB2) and glucose homeostasis [J]. Curr Hypertens Rev, 2014, [Epub ahead of print].
[5]Hatef A, Shajan S, Unniappan S. Nutrient status modulates the expression of nesfatin-1 encoding nucleobindin 2A and 2B mRNAs in zebrafish gut, liver and brain [J]. Gen Comp Endocrinol, 2015, 215: 51-60.
[6]Xu L, Wang Q, Guo F, et al. Nesfatin-1 signaling in the basom edial amygdala modulates the gastric distension-sensitive neurons discharge and decreases gastric motility via melanocortin 3/4 receptors and modified by the arcuate nucleus [J]. Eur J Pharmacol, 2015, 764: 164-172.
[7]Masuo K. Nesfatin-1 could be a strong candidate obesity or diabetes medication, if blood pressure elevation can be controlled [J]. Hypertens Res, 2014, 37(2): 98-99.
[8]Watanabe A, Mochiki E, Kimura A, et al. Nesfatin-1 suppresses gastric contractions and inhibits interdigestive migrating contractions in conscious dogs [J]. Dig Dis Sci, 2015, 60(6): 1595-1602.
[9]Kim J, Chung Y, Kim H, et al. The tissue distribution of nesfatin-1/nucb2 in mouse [J]. Dev Reprod, 2014, 18(4): 301-309.
[10]古巧燕, 张军, 年媛媛, 等. Nesfatin-1对内脏高敏感性大鼠内脏敏感性和结肠动力的影响[J]. 热带医学杂志, 2015, 15(4): 458-462. GU QY, Zhang J, Nian YY, et al. The effect of Nesfatin-1 on visceral sensitivity and colonic motility of visceral sensitivity rats [J]. Journal of Tropical Medicine, 2015, 15(4): 458-462.
[11]D’Amato M. Genes and functional GI disorders: from casual to causal relationship [J]. Neurogastroenterol Motil, 2013, 25(8): 638-649.
[12]Mayer EA, Gupta A, Kilpatrick LA, et al. Imaging brain mechanisms in chronic visceral pain [J]. Pain, 2015, 156 Suppl 1: S50-S63.
[13]Elsenbruch S. Abdominal pain in irritable bowel syndrome: a review of putative psychological, neural and neuro-immune mechanisms [J]. Brain Behav Immun, 2011, 25(3): 386-394.
[14]Al Omran Y, Aziz Q. Functional brain imaging in gastroenterology: to new beginnings [J]. Nat Rev Gastroenterol Hepatol, 2014, 11(9): 565-576.
(责任编辑:王全楚)
The effect of Nesfatin-1 on visceral sensitivity in visceral hypersensitivity rats
GU Qiaoyan1, SHI Shengmei1, ZHANG Jun2, NIAN Yuanyuan2, FENG Yichao1
1.Department of Gastroenterology, the Affiliated Hospital of Yan’an University, Yan’an 716000; 2.Department of Gastroenterology, the Second Affiliated Hospital of Xi’an Jiaotong University, China
Objective To study the effect of Nesfatin-1 on 5-HT expression and the mechanism of Nesfatin-1 on visceral sensitivity in visceral hypersensitivity rats, in order to provide the new ideas for clarifying the mechanism visceral hypersensitivity.Methods Two days male Spragne-Dawley rats were divided randomly into healthy control group and model group. The model group was induced to visceral hypersensitivity by maternal separation and acetic acid enema methods. After the model validation succeeded, the rats in model group were divided randomly into intervention control group, low concentration intervention group, medium concentration intervention group and high concentration intervention group. The expressions of 5-HT in blood and the brain gut axis were tested by immunohistochemistry (IHC), enzyme-linked immunosorbent assay (ELISA) and Western blotting methods, then the results were analyzed by statistical method.Results (1) The ELISA blood test results of 5-HT in different groups: compered with the healthy control group and the intervention control group respectively, the expression of serum 5-HT in the different concentration groups had statistical difference (P<0.05). (2) The IHC test results of 5-HT expression in different groups: the positive expression of 5-HT in the healthy control group and the intervention control group had statistical difference compared with the different concentration groups (P<0.05), the positive expression of 5-HT was significantly higher in different concentration groups than that in the healthy control group and the intervention control group. (3) The Western blotting test results of 5-HT expression in different groups: compared with the healthy control group and the intervention control group respectively, the expression of 5-HT in the different parts of the brain gut axis in different concentration groups had statistical difference (P<0.05).Conclusion The different concentrations of Nesfatin-1 interven the visceral hypersensitivity rats by the central route, Nesfatin-1 can up-regulate the level of 5-HT in the blood and the brain gut axis of model rats; Nesfatin-1 may affect 5-HT signaling pathways in the central and peripheral parts by increasing the level of 5-HT,finally involves in the formation and the regulation of visceral hypersensitivity.
Nesfatin-1; Visceral sensitivity; Rat
古巧燕,博士研究生,副主任医师,研究方向:各种肝病、胃肠动力疾病的诊断与治疗。E-mail:guyewuyue@163.com
张军,博士,主任医师,教授,研究方向:胃肠动力及食管疾病的诊治。E-mail:jun3z@163.com
10.3969/j.issn.1006-5709.2017.06.020
R574.4
A
1006-5709(2017)06-0704-05
2016-12-27

