TGF-β1/Smad3在博来霉素肺纤维化大鼠中的作用
邱 静,李万成
1.成都医学院 基础医学院 (成都 610500);2.成都医学院第一附属医院 呼吸内科 (成都610500)
·论著·
TGF-β1/Smad3在博来霉素肺纤维化大鼠中的作用
邱 静1,李万成2△
1.成都医学院 基础医学院 (成都 610500);2.成都医学院第一附属医院 呼吸内科 (成都610500)
目的 通过Smad3特异性抑制剂(specific inhibitor of Smad3,SIS3)干预博来霉素肺纤维化大鼠,观察转化生长因子β1(TGF-β1)、Smad3蛋白表达情况,探讨TGF-β1/Smad3信号通路在肺纤维化中的作用。方法 选取健康成年雄性SD大鼠60只,随机分为4组:生理盐水对照组(NS组),博来霉素组(BLM组),SIS3干预组(SIS3组),二甲基亚砜溶媒组(DMSO组),每组15只。BLM组、SIS3组和DMSO组气管内注射博来霉素溶液(5 mg/kg)建立大鼠肺纤维化模型;NS组以同样方法注入等量生理盐水;SIS3组大鼠腹腔内注射SIS3(2.5 μg/g)干预处理,BLM组注射等量生理盐水,DMSO组注射等量DMSO。各组于造模后第7、14、28天分别处死5只大鼠,行Masson染色观察各组肺组织胶原纤维差异。免疫组化检测各组TGF-β1、Smad3表达情况。结果 与NS组比较,BLM组、DMSO组大鼠肺组织出现明显纤维化,TGF-β1、Smad3表达明显增高;与BLM组、DMSO组相比,SIS3组大鼠肺纤维化程度减轻,TGF-β1、Smad3表达减少。结论 SIS3干预肺纤维化大鼠,能够减轻大鼠肺泡炎,降低肺纤维化程度;TGF-β1/Smad3信号通路在肺纤维化中可能起到重要作用。
肺纤维化;Smad3特异性抑制剂;转化生长因子β1;Smad3蛋白
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性间质性肺病,早期病理改变为肺泡炎,此后纤维化逐渐加重,肺功能呈进行性减退,病因不明[1]。IPF属慢性进行性发展的致死性疾病,预后差,中位生存时间为2~2.8年。糖皮质激素和/或免疫抑制剂等常规治疗措施有效率不足30%,因此,寻找新治疗药物意义重大[2]。本研究通过Smad3特异性抑制剂(specific inhibitor of Smad3,SIS3)对博来霉素诱导肺纤维化大鼠进行干预,以探讨TGF-β1/Smad3在肺纤维化中的作用。
1 材料与方法
1.1 实验材料与仪器
1.1.1 实验动物 健康SD大鼠,共60只,雄性,8~10周龄,体质量(250±50)g,SPF级,由成都达硕实验动物有限公司提供,分笼饲养,自由饮水与摄食。
1.1.2 药物与试剂 注射用盐酸博来霉素(海正辉瑞制药有限公司),SIS3(美国Sigma公司),DMSO(武汉博士德生物公司),Masson染色试剂盒(福建迈新生物技术开发有限公司),兔抗大鼠TGF-β1单抗、DAB显色试剂盒和HRP免疫组化试剂盒(武汉博士德生物公司),兔抗大鼠Smad3单抗(北京博奥森生物技术公司)。
1.1.3 主要仪器 石蜡包埋机、(半自动石蜡切片机德国SLEE公司),CUT 5062,ZT-12K生物组织自动脱水机(湖北孝感亚光医用电子技术研究所),高压锅(上海实验仪器总厂),离心机(美国赛默飞Thermo),MCS7200显微图像采集系统(德国Leica),双目数字显微镜(德国Leica DMS300),去离子水制备机(德国ELGA公司),移液器(德国普兰德Brand),冰箱(青岛海尔集团有限公司)。
1.2 实验方法
1.2.1 动物分组 取体质量(250±50)g,健康雄性SD大鼠,周龄8~10周,SPF级,实验条件下饲养1周,随机分为生理盐水对照组(NS组),博来霉素组(BLM组),SIS3干预组(SIS3组)和二甲基亚砜溶媒组(DMSO组),每组15只。
1.2.2 动物模型建立 4组大鼠给予10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,固定于操作台,无菌操作下颈正中切开,暴露气管。BLM组、SIS3组、DMSO组在环状软骨下端经气管间隙缓慢注入博来霉素溶液(5 mg/kg),注射剂量0.3 mL,注射后将动物直立旋转,使药液在肺内分布均匀,建立大鼠肺纤维化模型;NS组以同样方法气管内注射无菌生理盐水0.3 mL;SIS3组腹腔内注射SIS3(2.5 μg/g)进行干预处理,剂量为0.5 mL,2次/周;DMSO组腹腔内注射等量DMSO作为对照,NS组、BLM组腹腔内注射等量生理盐水作为对照。
1.2.3 标本采集 4组大鼠分别于第7、14、28天3个时间点处死,每个时间点处死5只。10%水合氯醛麻醉后固定于操作台,开胸取肺,右肺于4%中性甲醛溶液中固定24 h后石蜡包埋、切片,分别行Masson染色及免疫组化检测。
1.3 肺纤维化指标检测
1.3.1 Masson染色图像分析 使用全自动计算机图像分析系统Image Pro-Plus6.0对Masson染色切片进行胶原纤维染色面积测定。通过irregular工具选中的预检测区域(area of interest,AOI),计算胶原着色的面积及AOI面积,分析胶原着色面积与AOI面积之比,得出胶原所占比例。
1.3.2 免疫组化染色图像分析 使用全自动计算机图像分析系统Image Pro-Plus6.0对免疫组化染色结果进行半定量分析,计算积分光密度值(IOD)。每张免疫组化切片均采取200倍视野下观察并采集图像,随机选择5个视野进行采图,测定其阳性染色的IOD值,以其均值反映表达量。
1.4 统计学方法

2 结果
2.1 肺组织病理学改变
显微镜下观察NS组大鼠第7、14、28天Masson染色,肺泡结构正常,肺泡间隔无增厚,未见充血、水肿病灶,未见明显蓝色胶原沉积。BLM组大鼠第7天Masson染色肺泡结构大体正常,开始出现大量中性粒细胞等炎性细胞渗出,肺泡壁稍增厚,少量蓝色胶原纤维渗出;第14、28天大鼠肺泡结构破坏严重,肺泡间隔明显增厚,肺泡腔融合、陷闭,肺泡形态基本消失,大量蓝色胶原纤维填充;与NS组大鼠相比,BLM组纤维化程度加重,蓝染胶原面积明显增加,差异有统计学意义(P<0.05)。SIS3组大鼠第7天肺泡结构出现破坏,炎性细胞渗出较多,少量蓝染胶原纤维渗出,第14、28天肺泡结构被大量破坏,大量炎细胞及蓝色胶原纤维沉积,肺泡结构尚存;较BLM 组明显减少,差异有统计学意义(P<0.05)。DMSO组第7、14、28天肺组织Masson染色与BLM组相似,差异无统计学意义(P>0.05)(图1,表1)。
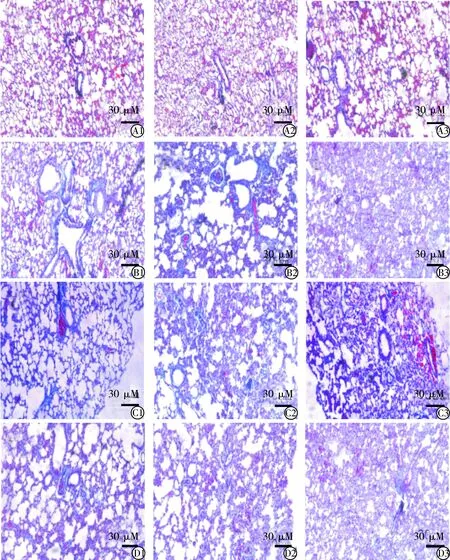
图1 大鼠肺组织Masson染色(100×)
注:A1、A2、A3为NS组第7、14、28天Masson染色; B1、B2、B3为BLM组第7、14、28天Masson染色; C1、C2、C3为SIS3组第7、14、28天Masson染色; D1、D2、D3为DMSO组第7、14、28天Masson染色
2.2 免疫组化结果
2.2.1 TGF-β1免疫组化结果 NS组大鼠第7、14、28天TGF-β1在肺泡巨噬细胞中呈弱阳性。BLM组第7、14、28天肺组织巨噬细胞及血管内皮细胞TGF-β1明显表达,阳性表达区域逐渐增大,与NS组相比,差异有统计学意义(P<0.05)。SIS3组大鼠表达趋势与BLM组相似,但低于BLM组,差异具有统计学意义(P<0.05)。DMSO组大鼠表达与BLM组相似,差异无统计学意义(P>0.05)(图2,表2)。
表1 4组肺组织Masson染色面积比
注:与NS组相比,aP<0.05;与BLM组相比,bP<0.05
表2 4组大鼠肺组织免疫组化TGF-β1表达结果±s,平均积分光密度)
注:与NS组相比,aP<0.05;与BLM组相比,bP<0.05
2.2.2 Smad3免疫组化结果 NS组大鼠第7、14、28天Smad3在肺泡巨噬细胞呈弱阳性表达。BLM组第7、14、28天肺组织巨噬细胞及血管内皮细胞Smad3明显表达,阳性表达区域逐渐增大,与NS组相比,差异具有统计学意义(P<0.05)。SIS3组Smad3的表达趋势与BLM组相似,但低于BLM组,差异具有统计学意义(P<0.05)。DMSO组与BLM组表达相似,差异无统计学意义(P>0.05)(图3,表3)。

图2 大鼠肺组织TGF-β1免疫组化(200×)
注:图A1、A2、A3为NS组第7、14、28天免疫组化;图B1、B2、B3为BLM组第7、14、28天免疫组化;图C1、C2、C3为SIS3组第7、14、28天免疫组化;图D1、D2、D3为DMSO组第7、14、28天免疫组化

表3 4组大鼠肺组织免疫组化Smad3表达结果(平均积分光密度,±s)
注:与NS组相比,aP<0.05;与BLM组相比,bP<0.05

图3 大鼠肺组织Smad3免疫组化(200×)
注:A1、A2、A3为NS组第7、14、28天免疫组化;B1、B2、B3为BLM组第7、14、28天免疫组化;C1、C2、C3为SIS3组第7、14、28天免疫组化;D1、D2、D3为DMSO组第7、14、28天免疫组化
3 讨论
IPF是一种慢性进行性、纤维化性间质性肺炎,为临床最常见的一种特发性间质性肺炎,组织学和/或胸部HRCT特征性表现为UIP,主要病理特征为肺间质及肺泡腔内纤维增生和炎细胞浸润合并存在。本研究通过大鼠气管内注射博来霉素模拟出IPF病理组织特点的肺纤维化动物模型,为目前公认的经典的研究肺纤维化方法之一[3]。Masson染色结果提示BLM组肺纤维化程度较NS组明显加重,说明BLM诱导大鼠肺纤维模型成功。同时,SIS3组大鼠肺纤维化程度较BLM组明显减轻,表明SIS3干预措施可成功减轻大鼠肺纤维化。DMSO组与BLM组肺纤维化程度相似,表明DMSO溶媒对肺纤维化无干预作用。目前IPF的治疗缺乏直接对预后因素或治疗反应起到决定性作用的药物,糖皮质激素或免疫抑制剂、细胞毒药物仍是其主要的治疗药物,其疗效均欠佳,临床不足30%的病人对治疗有反应,且可出现毒副反应[2-3],因此寻找新药及新的分子治疗靶点意义重大。
TGF-β1被证实是肺纤维化形成与发展的关键因子,能促进成纤维细胞趋化,促使胶原合成及改变细胞外基质成分。Smad蛋白是TGF-β下游信号转导和调节分子,参与TGF-β信号细胞内传导[4]。磷酸化的Smad2、3与Smad4形成Co-Smads进入细胞核调控靶基因转录,诱导肺组织纤维化改变[5]。本研究中博来霉素诱导大鼠肺纤维化的形成,TGF-β1、Smad3的表达明显增加,证实TGF-β1/Smad3为肺纤维化发病机制之一。因此,调控TGF-β1/Smad3可能成为肺纤维化治疗的新切入点。
SIS3具有强效、高选择性抑制Smad3的功能。Jinnin等[6]研究证明,SIS3可抑制TGF-β1诱导的磷酸化Smad3,Smad3与Smad4相互作用以及Smad3与细胞核DNA结合,同时不影响Smad2磷酸化。SIS3可减弱TGF-β1转录活性,抑制TGF-β1诱导成肌纤维细胞转化为成纤维细胞。SIS3通过选择性抑制Smad3,成为评价TGF-β1调节细胞机制的有用工具。Li等[7]研究表明,SIS3在早期糖尿病肾病中可抑制内皮间质转化发生,从而延缓糖尿病肾脏纤维化的发展。本研究通过SIS3干预博来霉素诱导的肺纤维化大鼠,结果表明SIS3干预组大鼠,肺纤维化程度较BLM组减轻,表明SIS3可减轻肺纤维化程度。
综上所述,TGF-β1/Smad3是肺纤维化形成的重要机制之一,实验结果表明,SIS3可特异性抑制Smad3蛋白表达,阻断TGF-β1细胞内信号传导,抑制肺纤维化的形成,为肺纤维化新药的开发及临床应用提供新的方向。
[1]李万成. SU5416在博来霉素肺纤维化小鼠中的抗纤维化机制研究[D]. 成都:四川大学, 2007:11.
[2]King T E Jr, Pardo A, Selman M. Idiopathic pulmonary fibrosis[J]. Lancet, 2011, 378(9807): 1949-1961.
[3]Kim K K, Wei Y, Szekeres C,etal. Epithelial cell alpha3beta1 integrin links beta-catenin and Smad signaling to promote myofibroblast formation and pulmonary fibrosis[J]. J Clin Invest, 2009, 119(1): 213-224.
[4] Attisano L, Wrana J L. Signal transduction by the TGF-beta superfamily[J]. Science, 2002, 296(5573): 1646-1647.
[5] Zaringhalam J, Akhtari Z, Eidi A,etal. Relationship between serum IL10 level and p38MAPK enzyme activity on behavioral and cellular aspects of variation of hyperalgesia during different stages of arthritis in rats[J]. Inflammopharmacology, 2014, 22(1): 37-44.
[6]Jinnin M, Ihn H, Tamaki K. Characterization of SIS3, a novel specific inhibitor of Smad3, and its effect on transforming growth factor-beta1-induced extracellular matrix expression[J]. Mol Pharmacol, 2006, 69(2): 597-607.
[7]Li J, Qu X, Yao J,etal. Blockade of endothelial-mesenchymal transition by a Smad3 inhibitor delays the early development of streptozotocin-induced diabetic nephropathy[J]. Diabetes, 2010, 59(10): 2612-2624.
A Study on the Role of TGF-β1/Smad3 in Rats with Bleomycin-induced Pulmonary Fibrosis
Qiu Jing1, Li Wancheng2△.
1. School of Basic Medical Sciences, Chengdu Medical College, Chengdu 610500,China; 2. Department of Respiratory Medicine, The First Affiliated Hospital of Chengdu Medical College, Chengdu 610500, China
Objective To observe the expressions of transforming growth factor-β1 (TGF-β1) and Smad3 protein in rats with bleomycin-induced pulmonary fibrosis via the intervention of specific inhibitor of Smad3 (SIS3) and explore the role of TGF-β1/Smad3 signaling pathway in pulmonary fibrosis. Methods Sixty male SD rats were randomly divided into four groups including the normal saline control group (NS group), bleomycin group (BLM group), SIS3 intervention group (SIS3 group), and dimethyl sulfoxide (DMSO group), and each group consisted of 15 rats. The rats in the BLM, SIS3 and DMSO groups were given intratracheal injection with bleomycin solution (5 mg/kg) to establish the rat models with pulmonary fibrosis, while the rats in the NS group was injected with the same amount of normal saline. The rats in the SIS3 group were injected intraperitoneally with SIS3 (2.5 μg/g), those in the BLM group were injected with the same amount of normal saline, and those in the DMSO group were injected with the same amount of dimethyl sulfoxide. Five rats of each group were sacrificed on the 7th, 14th and 28th day after the modeling. The Masson staining was applied to observe the differences of collagen fibers in lung tissues, and the immunohistochemical staining was adopted to detect the expressions of TGF-β1, Smad3 in each group. Results Compared with the NS group, the lung tissues of the BLM and DMSO groups showed significant fibrosis and the expressions of TGF-β1 and Smad3 were significantly increased. Compared with the BLM and DMSO groups, the degree of pulmonary fibrosis were decreased in the SIS3 group and the expressions of TGF-β1 and Smad3 were decreased. Conclusion Firstly, SIS3 can alleviate alveolitis and reduce the pulmonary fibrosis in rats with pulmonary fibrosis. Secondly, the TGF-β1/Smad3 signaling pathway may play an important role in pulmonary fibrosis.
Pulmonary fibrosis; Specific inhibitor of Smad3; Transforming growth factor-β1; Smad3 protein
http://www.cnki.net/kcms/detail/51.1705.R.20170222.1401.002.html
10.3969/j.issn.1674-2257.2017.03.007
R563
A
△通信作者:李万成, E-mail:316608439@qq.com

