银杏叶提取物对小鼠心肌细胞氧化应激损伤的影响*
宋 军,朱燕梅,王秋林
成都医学院第一附属医院 心血管内科(成都 610500)
·论著·
银杏叶提取物对小鼠心肌细胞氧化应激损伤的影响*
宋 军,朱燕梅,王秋林△
成都医学院第一附属医院 心血管内科(成都 610500)
目的 探讨银杏叶提取物(ginkgo biloba extract, EGb)对缺氧/复氧所致心肌细胞氧化应激损伤的保护作用。方法 将原代大鼠心肌细胞分为空白对照组(Con组)、高剂量EGb对照组(C160组)、缺氧/复氧组(H/R组)、低剂量EGb组(EGb40组)、中剂量EGb组(EGb80组)、高剂量EGb组(EGb160组)。采用四唑盐(MTT)法检测各组细胞活力,采用酶联免疫吸附法检测各组细胞的MDA含量、SOD活力、GSH与GSSG含量,并计算GSH/GSSG比值以及GSH/GSSG氧化还原电势(Eh(GSH/GSSG))。结果 与Con组相比,H/R组的MDA含量、Eh(GSH/GSSG)升高(P<0.01),细胞活力、GSH/GSSG值及SOD活力降低(P<0.01)。EGb40、EGb80和EGb160组的MDA含量、Eh(GSH/GSSG)较H/R组降低(P<0.01),细胞活力、GSH/GSSG值及SOD活力升高(P<0.01),且呈浓度依赖性(P<0.01)。结论 EGb具有明显的抗氧化应激能力,EGb预处理可明显衰减H/R心肌细胞所受的氧化损伤。
银杏叶提取物;心肌细胞;氧化应激
扩张冠脉、溶栓、冠脉搭桥以及介入等再灌注疗法是治疗缺血性心脏病最主要的治疗手段,但在这些治疗措施产生疗效的同时,也会引起潜在的缺血-再灌注(ischemia-reperfusion,I/R)损伤,直接影响患者预后[1]。大量证据表明,引起心肌细胞氧化应激损伤的重要病理机制是心肌缺血再灌注期间细胞内产生的大量活性氧(reactive oxygen species,ROS)[2-3],进而使机体的氧化和抗氧化平衡系统向氧化系统倾斜,表现为大量脂质过氧化产物如丙二醛(malondialdehyde,MDA)产生、超氧化物歧化酶(superoxide dismutase,SOD)活力下降,还原型谷胱甘肽(glutathione,GSH)转变为氧化型谷胱甘肽(glutathione disulfide,GSSG)增多,导致GSH/GSSG比值降低,GSH/GSSG氧化还原电势Eh(GSH/GSSG)升高。如何保护缺血性心肌,减轻心肌I/R损伤是目前治疗缺血性心脏疾病的重要难题之一。银杏叶提取物(ginkgo biloba extract, EGb)是一种天然的自由基清除剂。近年来临床研究发现其对于预防心肌缺血再灌注损伤具有较显著的作用[4],可明显提高SOD的活性并发挥其独特的抗自由基作用[5]。本研究旨在观察EGb对缺氧/复氧所致心肌细胞氧化应激损伤的保护作用。
1 材料与方法
1.1 主要试剂与仪器
舒血宁注射液(EGb,国药准字Z13020795,神威药业,中国);四唑盐(MTT)购自美国Amresco公司;MDA检测试剂盒、SOD检测试剂盒、GSSG检测试剂盒均购自南京建成生物技术工程研究所。酶标仪购自美国Bio-rad公司;紫外分光光度仪购自德国Agilent Technologies公司。
1.2 实验分组与模型制备
取生长达到70%~80%融合的心肌细胞(取自1~3 d龄SD大鼠乳鼠),随机分为空白对照组(Con组,持续CO2培养箱培养,无处理)、高剂量EGb对照组(C160组,持续CO2培养箱培养+160 mg/L EGb)、缺氧/复氧组(H/R组,仅作缺氧/复氧处理,不加药)、低/中/高剂量EGb组(EGb40组/EGb80组/Egb160组,缺氧/复氧处理+40/80/160 mg/L EGb)。药物预处理2 h后,参照文献[6]的方法在厌氧培养箱中缺氧培养(5% CO2;5% H2;90% N2;37 ℃)24 h,缺氧处理完毕后再进行复氧培养(5% CO2;95% 空气;37 ℃)4 h,完成缺氧/复氧模型的建立。
1.3 检测指标与方法
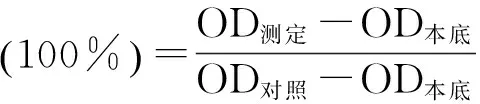

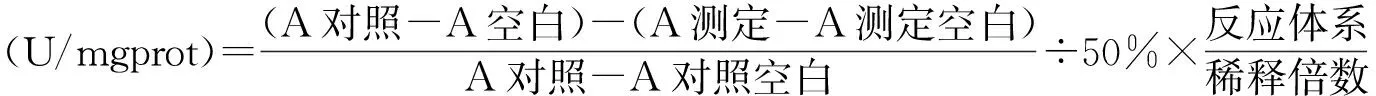

1.4 统计学方法

2 结果
2.1 心肌细胞形态学观察结果
倒置显微镜下观察心肌细胞,刚分离的乳鼠心肌细胞呈圆形,大小均一;培养72 h后可见细胞呈簇生长且搏动明显,折光性强,有伪足伸出,细胞形态多样化,如圆形、梭形,菱形等(图1A)。H/R组心肌细胞搏动幅度减弱或消失、节律不齐且部分停搏,折光性下降,伪足缩短或消失(图1B)。EGb160组心肌细胞形态得到明显改善,逆转了H/R损伤造成的搏动频率和节律的异常(图1C)。
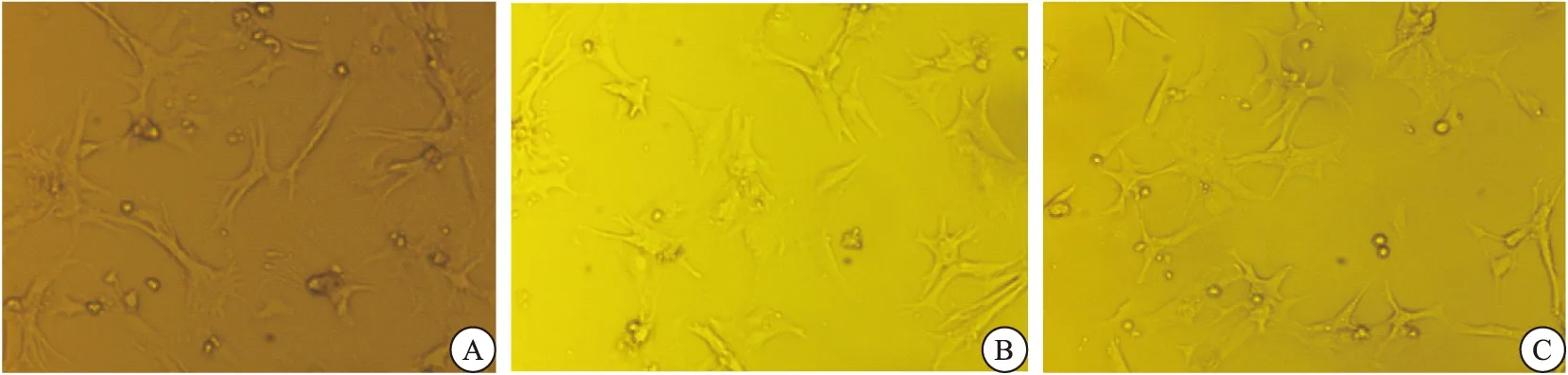
图1 心肌细胞形态图
注:A为正常心肌细胞(Con)10×;B为缺氧复氧心肌细胞(H/R)10×;C为EGb 160 mg/L(EGb160)10×
2.2 EGb对心肌细胞H/R损伤诱发的氧化应激的影响
H/R组MDA含量较其他组高(P<0.001),3组递增剂量EGb预处理组的MDA含量较H/R组低(P值均<0.001),呈浓度依赖性,且EGb40、EGb80与EGb160组间差异有统计学意义(P<0.001)(图2)。

图2 银杏叶对心肌细胞H/R损伤后MDA的影响±s)
注:##代表与Con组比较P< 0.001,**代表与H/R组比较P< 0.001
2.3 EGb对心肌细胞H/R损伤后抗氧化酶活力的影响
与Con组比较,H/R组SOD活力降低(P<0.001),3组递增剂量EGb预处理组的SOD活力较H/R组上升(P=0.002,P<0.001,P<0.001),呈浓度依赖性,且EGb40、EGb80与EGb160组间差异明显(P<0.001)(图3)。


注:##代表与Con组比较P< 0.001,**代表与H/R组比较P<0.001
2.4 EGb对心肌细胞H/R损伤后氧化还原状态改变的影响
与Con组比较,H/R组GSH/GSSG值下降(P<0.001),而Eh(GSH/GSSG)上升(P=0.001)。3组递增浓度EGb预处理组的GSH/GSSG值较H/R组高(P<0.001,P<0.001,P<0.001),而Eh(GSH/GSSG)低(P=0.029,P=0.001,P<0.001),均呈浓度依赖性。GSH/GSSG值和Eh(GSH/GSSG)在EGb40、EGb80与EGb1603组间差异无统计学意义(P<0.001,P=0.004)(图4)。

图4 银杏叶对心肌细胞H/R损伤后氧化还原状态的影响
注:#和##分别代表与Con组比较P< 0.05和P< 0.001,*和**分别代表与H/R组比较P< 0.05和P< 0.001
3 讨论
EGb是从银杏叶中提取的有效药用成分,主要成分为黄酮及萜内酯,具有清除氧自由基,提高抗氧化酶的活性;降低Ca2+内流,减少细胞内钙超载;舒张血管,改善微循环;调节血脂;减少血小板聚集,抗血栓形成等作用。EGb的还原性羟基功能团可直接发挥抗氧化作用,清除超氧阴离子,增加SOD[7]和过氧化氢酶的活性及含量,增加谷胱甘肽水平,降低MDA,抑制髓过氧化物酶(MPO)活性[8-9],有效清除超氧阴离子[7],对抗二苯三硝基苯肼自由基的损伤[10]、抑制脂质过氧化反应[11],下调环氧化酶-2基因表达[12]、增加诱导型一氧化氮合酶的表达[13]。本研究利用EGb预处理H/R损伤心肌细胞,观察EGb对心肌细胞H/R损伤的影响。结果发现,H/R处理后,细胞活力下降,MDA含量增加、抗氧化酶SOD活性降低。经EGb预处理H/R损伤心肌细胞后,细胞存活率明显上升、MDA含量明显降低、SOD活力明显增强。提示EGb能对抗H/R损伤。这些结果与之前的研究结果[14-15]类似,再次证明EGb具有抗氧化应激作用。
氧化应激是心肌缺血再灌注损伤过程中关键的一个环节[16],它的诱发主要起源于再灌注期间ROS的爆发性产生[17]。生理状态下由于细胞内存在完善的抗氧化防御系统,使体内产生的ROS不断被清除,仅有1%~2%的氧生成ROS;但在I/R损伤等病理状态下,ROS爆发性产生使保护酶活性受抑制,破坏了机体氧化-抗氧化平衡,使细胞处于氧化状态,造成ROS生成与清除这一动态平衡被打破,机体累计过多的ROS而引起的一系列损伤。随着机体生理、疾病过程的变化,体内的氧化还原状态也随之发生改变。文献[18]报道,在与氧化应激相关的疾病如不同类型的肿瘤、急性胰腺炎和慢性阻塞性肺病过程中,机体的氧化还原状态明显向氧化方向偏移。氧化应激可引起GSSG浓度升高、GSH浓度降低而导致GSH/GSSG值下降,因此可以利用GSH/GSSG值评价机体氧化还原状态。由于考虑到Eh值可定量地表示GSH/GSSG获得或失去电子的趋势,再加上2GSH← →GSSG这一化学计量关系,可认为Eh(GSH/GSSG)比GSH/GSSG值更重要。而Eh(GSH/GSSG)易受GSH浓度及GSH/GSSG值的影响,因此Eh(GSH/GSSG)也不能完整阐明机体的氧化还原状态;本研究重点结合GSH/GSSG值与Eh(GSH/GSSG)共同反映机体的氧化还原状态的改变,检测了EGb对H/R心肌细胞GSH/GSSG值、Eh(GSH/GSSG)的影响。结果显示,经H/R处理后,细胞GSH/GSSG值下降、Eh(GSH/GSSG)上升,说明受H/R损伤后细胞的氧化还原状态向氧化方向偏移。而EGb预处理后GSH/GSSG值上升而Eh(GSH/GSSG)下降,表明EGb预处理可抵抗H/R损伤导致的氧化还原状态向氧化偏移,提高细胞的抗氧化能力。
综上所述,本研究成功建立了缺氧/复氧模型,证实了EGb具有明显的抗氧化应激能力,EGb预处理可明显衰减H/R心肌细胞所受的氧化损伤,其相关分子机制研究正在进行中。
[1]McMahon M, Thomas N, Itoh K,etal. Redox-regulated turnover of Nrf2 is determined by at least two separate protein domains, the redox-sensitive Neh2 degron and the redox-insensitive Neh6 degron[J]. J Biol Chem, 2004, 279(30): 31556-31567.
[2]Wang H, Liu K, Geng M,etal. RXRα inhibits the NRF2-ARE signaling pathway through a direct interaction with the Neh7 domain of NRF2[J]. Cancer Res, 2013, 73(10): 3097-3108.
[3]Wang W, Jaiswal A K. Nuclear factor Nrf2 and antioxidant response element regulate NRH:quinone oxidoreductase 2 (NQO2) gene expression and antioxidant induction[J]. Free Radic Biol Med, 2006, 40(7): 1119-1130.
[4]Wang X J, Li X, Tang X,etal. The Role of Nrf2 in Carcinogenesis[J]. Progress in Chemistry, 2013, 25(9):1544-1552.
[5]Cullinan S B, Gordan J D, Jin J,etal. The Keap1-BTB protein is an adaptor that bridges Nrf2 to a Cul3-based E3 ligase: oxidative stress sensing by a Cul3-Keap1 ligase[J]. Mol Cell Biol, 2004, 24(19): 8477-8486.
[6]Pullikotil P, Chen H, Muniyappa R,etal. Epigallocatechin gallate induces expression of heme oxygenase-1 in endothelial cells via p38 MAPK and Nrf-2 that suppresses proinflammatory actions of TNF-α[J]. J Nutr Biochem, 2012, 23(9): 1134-1145.
[7]Stella C, Burgos I, Chapela S,etal. Ischemia-reperfusion: a look from yeast mitochondria[J]. Curr Med Chem, 2011, 18(23): 3476-3484.
[8]Nioi P, Hayes J D. Contribution of NAD(P)H:quinone oxidoreductase 1 to protection against carcinogenesis, and regulation of its gene by the Nrf2 basic-region leucine zipper and the arylhydrocarbon receptor basic helix-loop-helix transcription factors[J]. Mutat Res, 2004, 555(1/2): 149-171.
[9]Sugano M, Hata T, Tsuchida K,etal. Local delivery of soluble TNF-alpha receptor 1 gene reduces infarct size following ischemia/reperfusion injury in rats[J]. Mol Cell Biochem, 2004, 266(1/2): 127-132.
[10] 谢咪雪, 蒋琦, 陈冬儿,等. 银杏叶提取物对心肌缺血再灌注损伤保护作用的研究进展[J]. 浙江中医药大学学报, 2012, 36(2):230-232.
[11] 朱晓洁, 梁飞, 王秀宏,等. 钴原卟啉对H9c2心肌细胞缺氧/复氧损伤的保护作用[J]. 中国药理学通报, 2009, 25(3):352-356.
[12] 于佳佳, 孙丽丽, 霍洪亮. 雌激素对心肌Nrf2及GST和GCL的影响[J]. 东北师大学报(自然科学), 2012, 44(2):91-94.
[13] Shih P H, Yen G C. Differential expressions of antioxidant status in aging rats: the role of transcriptional factor Nrf2 and MAPK signaling pathway[J]. Biogerontology, 2007, 8(2): 71-80.
[14] 高朝霞, 张国欣, 史志勇,等. 银杏叶提取物对缺氧复氧诱导心肌细胞损伤的影响[J]. 河北中医药学报, 2012, 27(2):38-39.
[15] 程阳, 唐桥斐, 赵丽妮. 银杏叶提取物预防心肌缺血再灌注损伤的研究[J].中国卫生产业, 2014(18):169-170.
[16] Sykiotis G P, Bohmann D. Stress-activated cap′n′collar transcription factors in aging and human disease[J]. Sci Signal, 2010, 3(112): re3.
[17] Hulsmans M, Holvoet P. The vicious circle between oxidative stress and inflammation in atherosclerosis[J]. J Cell Mol Med, 2010, 14(1/2): 70-78.
[18] Zakkar M, Van der Heiden K, Luong le A,etal. Activation of Nrf2 in endothelial cells protects arteries from exhibiting a proinflammatory state[J]. Arterioscler Thromb Vasc Biol, 2009, 29(11): 1851-1857.
A Study on the Effect of Ginkgo Biloba Extract on the Oxidative Stress Injury of Mouse Cardiomyocytes
Song Jun, Zhu Yanmei, Wang Qiulin△.
Department of Cardiology, The First Affiliated Hospital of Chengdu Medical College, Chengdu 610500, China
Objective To investigate the protective effect of Ginkgo Biloba Extract (EGb) on the oxidative stress injury induced by hypoxia/reoxygenation in cardiomyocytes. Methods The cardiomyocytes of primary rats were divided into the blank control group (Con group), and high-dose EGb control group (C160 group), hypoxia/reoxygenation group (H/R group), low-dose EGb group (EGb40 group), medium-dose EGb group (EGb80 group), and high-dose EGb group (EGb160 group). The methyl thiazolyl tetrazolium (MTT) method was used to detect the viability of cardiomyocytes in each group, and the enzyme-linked immunosorbent assay (ELISA) was adopted to measure the SOD activity and the content of MDA, GSH and GSSG. Then the ratios of GSH/GSSG and GSH/GSSG redox potential (Eh(GSH/GSSG)) were calculated. Results Compared with the Con group, MDA content and Eh(GSH/GSSG)in the H/R group were significantly increased (P<0.01), while the cell viability, GSH/GSSG ratio and SOD activity were significantly decreased (P<0.01). Compared with the H/R group, the MDA content and Eh(GSH/GSSG)in the EGb40, EGb80 and EGb160 groups were significantly lower (P<0.01), while the cell viability, GSH/GSSG ratio and SOD activity were significantly increased (P<0.01) in a concentration-dependent manner (P<0.01). Conclusion EGb has obvious capacity of antioxidant stress, and the EGb pretreatment can attenuate the oxidative damage of H/R cardiomyocytes.
Ginkgo biloba extract; Cardiomyocytes; Oxidative stress
http://kns.cnki.net/kcms/detail/51.1705.R.20170321.0922.016.html
10.3969/j.issn.1674-2257.2017.03.005
四川省教育厅自然科学科研项目(No:2006B109)
R285.5
A
△通信作者:王秋林,E-mail:wangredox@163.com

