光合细菌协同产气肠杆菌联合发酵制氢试验
张全国,张 甜,张志萍,周雪花,王 毅,贺 超
光合细菌协同产气肠杆菌联合发酵制氢试验
张全国1,2,张 甜1,张志萍1,2,周雪花1,2,王 毅1,贺 超1,2
(1. 河南农业大学农业部农村可再生能源新材料与装备重点实验室,郑州450002; 2. 生物质能源河南省协同创新中心,郑州450002)
暗-光联合生物制氢是提高底物利用率和产氢潜力的有益探索。该文以玉米秸秆酶解液为产氢底物,采用光合细菌()与产气肠杆菌()混合培养工艺,进行了同步糖化暗-光联合生物制氢试验研究。以累积产氢量为主要指标,利用单因素试验考察了底物质量浓度、初始pH值、光照强度、发酵温度对与产气肠杆菌混合培养条件下联合产氢的影响,并在单因素试验的基础上通过正交试验对产氢工艺参数进行了优化。结果表明:各工艺参数对与产气肠杆菌联合产氢影响的主次顺序为:发酵温度>初始pH值>底物质量浓度>光照强度。发酵温度和初始pH值是影响与产气肠杆菌联合产氢的显著因素。与产气肠杆菌混合培养联合产氢的较佳工艺条件为:底物质量浓度35 g/L、初始pH值6.5、光照强度3 500 lx、发酵温度30 ℃,在此条件下,72 h的累积产氢量达到332.6 mL,单位产氢量为47.5 mL/g。该试验研究可为基于秸秆类生物质的暗-光细菌混合培养联合产氢的进一步研究提供参考。
发酵;微生物;氢气;光合细菌;产气肠杆菌;混合培养;联合生物制氢
0 引 言
能源短缺,环境污染以及由此引起的人类健康等问题是当今社会面临的主要难题,因此,研究和开发可再生的洁净能源已变得迫在眉睫[1]。在众多的可再生清洁能源中,氢能因其能量密度高(122 kJ/g)[2-3],清洁可再生等特点而被认为是最理想的化石燃料的替代能源。
在众多的制氢方法中,生物制氢因其高效、绿色、低成本受到了越来越多的关注和重视。国内外对生物制氢的研究主要集中在厌氧暗发酵制氢和光发酵制氢[4-7],李建政等分别对暗发酵和光发酵生物制氢工艺进行了研究,得出其可以有效的处理污水和实现农业废弃物等生物质原料的能源转化[8-12]。而与单独的暗发酵或光发酵制氢相比,暗-光细菌混合培养共发酵联合制氢能够结合各种微生物的特性发挥其优势,从而实现生物产氢的最大潜能[13-14],因此,成为生物制氢领域新的探索方向[15]。郑耀通等[16]最早提出了将光发酵细菌和发酵产氢细菌混合培养且进行共固定来处理有机废水的生物制氢工艺技术。Yokoi等[17-18]以甘薯淀粉残渣和淀粉生产废物为底物,利用暗发酵细菌和联合光合细菌进行生物制氢,产氢能力分别为7.0和7.2 mol/mol葡萄糖。Kawaguchi等[19]采取乳酸菌和光合细菌进行共培养,共培养产氢体系的pH值基本维持在7.0左右,产氢速率达到(1.55±0.28) mmol/(h·L)。
暗-光联合生物制氢能够实现底物的有效利用,但先前研究对底物的处理大多采用的是先水解后产氢的两步发酵法[20-21],以生物质为底物进行同步糖化生物制氢的报道不多。和两步发酵法相比,同步糖化法用于秸秆类生物质制氢可以有效的解除反应料液过度酸化对细菌发酵产氢的抑制,且同步糖化发酵还可节约时间,降低成本,降低葡萄糖和纤维二糖对纤维素酶的反馈抑制。本课题组先前的对比试验结果显示:在相同的产氢条件下,同步糖化法的产氢量较两步发酵法的产氢量最低可提高40%,最高可提高1.4倍。因此,该研究还将同步糖化发酵法用于联合生物制氢过程中。中国具有丰富的秸秆类生物质资源,若能将其充分利用,将是一条增加能源产出和减少环境污染的有效途径。
因此,为了最大限度地提高产氢量和底物转化率以及更好地发挥菌种间的协同作用,本研究采用同步糖化发酵方式,以纤维素含量较高的玉米秸秆[22]为发酵底物,利用课题组富集培养的光合细菌()与暗发酵产氢菌产气肠杆菌()进行混合培养共发酵联合产氢试验研究。以累积产氢量为主要指标,利用单因素试验和正交试验对与产气肠杆菌混合培养联合产氢的工艺参数进行优化和分析,旨在最大化的实现玉米秸秆的产氢潜能,为秸秆类生物质暗-光发酵联合制氢研究提供参考。
1 材料与方法
1.1 原料
试验用玉米秸秆产自河南农业大学科教园区试验田,自然风干后粉碎,经60目(0.3 mm)分样筛过筛后密封储存备用。用改良的王玉万法[23]和EDS能谱[24]对其组分及主要元素进行测定和分析,测得其主要成分和主要元素的含量如表1所示。

表1 玉米秸秆各组分及主要元素含量
1.2 产氢细菌
暗发酵细菌:产气肠杆菌()。兼性厌氧,革兰阴性杆菌,无芽孢。产气肠杆菌生长培养基/产氢培养基:蒸馏水1 000 mL;胰蛋白酶消化物15 g;大豆蛋白酶消化物5 g;NaCl 5 g。
光发酵细菌:试验中用到的光发酵细菌由河南农业大学农业部可再生能源新材料与装备重点实验室提供,由深红红螺菌()27%、荚膜红假单胞菌()25%、沼泽红假单胞菌()28%、类球红细菌()9%、荚膜红细菌()11%组成[25]。光合细菌生长培养基:蒸馏水1 000 mL;NH4Cl0.5 g;NaHCO31 g;酵母膏0.5 g;K2HPO40.1 g;CH3COONa 2 g;MgSO40.1 g;NaCl 1 g。光合细菌产氢培养基:蒸馏水1 000 mL;NH4Cl 0.4 g;MgCl20.2 g;酵母膏0.1 g;K2HPO40.5 g;NaCl 2 g;谷氨酸钠3.56 g。
利用Logistic模型对细菌生长情况进行回归模拟,得到由细胞干质量表示的细菌生长曲线如图1所示。回归模拟得到其决定系数2分别为0.999 0和0.990 6,说明拟合效果很好。故分别选择培养48 h处于对数生长期细菌活性和浓度都较大的产气肠杆菌和光合细菌进行产氢试验。其中,对环境变化较敏感的光合细菌用海藻酸钠溶液进行包埋固定,使得光合细菌处于一个相对平衡稳定的环境中,在使得培养基中小分子碳源和营养物质进入其内为细菌提供生长及产氢所需基质的同时,还可以阻碍外界不利因素对细菌的影响,从而提高细菌对环境的耐受性以及产氢料液中的菌体浓度,进而提高细菌的产氢量和产氢速率。具体固定方法如下:取已培养好处于对数生长期的光合细菌,5 000 r/min转速下离心5 min得到湿菌体,用无菌水将湿菌体悬浮制备成菌悬液,然后按照海藻酸钠与湿菌体质量比为10:3,将菌悬液加入到质量分数为5%的海藻酸钠水溶液中,混合均匀后将其迅速吸入无菌注射器中,待凝固后将包埋好的细菌以球状颗粒注入反应瓶中。
a. 产气肠杆菌生长曲线图
a. Growth chart of Enterobacter aerogenes
1.3 产氢试验装置
混合培养联合产氢试验装置如图2所示。用电子天平准确称取试验所需质量的玉米秸秆,置于洗净烘干备用的150 mL锥形瓶中,向锥形瓶中加入100 mL pH=4.8的柠檬酸-柠檬酸钠缓冲液[26],按酶负荷150 mg/g秸秆加入纤维素酶,按比例加入产氢培养基(见本文1.2),按体积分数30%(暗/光=1:1)接入处于对数生长期的菌种(光合细菌用质量分数为5%的海藻酸钠溶液包埋固定),然后调节反应液的初始pH值至试验所需,最后迅速向锥形瓶中通入氩气10 min,使反应瓶内保持厌氧状态,振荡均匀后用橡胶塞密封瓶口,放入恒温培养箱,进行生物制氢试验。试验所需光照由对称布置的60 W白炽灯提供,生成的气体用排水法收集。每个试验梯度均设置3组平行重复试验,并将3组平行重复试验的结果经过平均值计算和误差分析后作为最终的试验结果。
1.4 试验方法
1.4.1 气体成分及含量的分析
所产气体用安捷伦公司生产的6820GC-14B型气相色谱仪进行氢气含量的测定。色谱条件:进样口温度100 ℃,柱温80 ℃,TCD检测器150 ℃,氩气作载气,进样量500L,保留时间2 min。
1.4.2 pH值的测定
采用上海世诺物理光学仪器有限公司生产的PHB—1笔型酸度计对生物制氢过程中的pH值进行动态测定,测量范围0~14,精度0.1。
1.4.3 光照强度的测定
采用泰仕电子工业股份有限公司生产的TES-1332数位式照度计对生物制氢过程中的光照强度进行测定和设定,测量范围:0.1~200 000 lx。
1.4.4 单因素试验设计
利用图2所示的生物制氢试验装置,进行光合细菌()与暗发酵产氢菌产气肠杆菌()混合培养共发酵联合产氢试验。在课题组前期研究的基础上,选定单因素试验的起始条件为[27]:发酵温度30 ℃,初始pH值7.0,光照强度3 500 lx,接种量30%,酶负荷150 mg/g,分别考察底物质量浓度(5、15、25、35、45 g/L)、初始pH值(5.0、6.0、6.5、7.0、8.0和9.0)、光照强度(2 500、3 000、3 500、4 000、4 500 lx)和发酵温度(25、30、35、40、45 ℃)对暗-光细菌混合培养联合生物制氢过程的影响。
1.4.5 正交试验设计
正交试验是进行多因素试验,寻求最优水平组合的一种高效试验设计方法。本研究在单因素试验的基础上,运用正交试验设计软件选择L9(34)型正交表进行正交试验并对各因素进行极差和方差分析,旨在对和产气肠杆菌联合产氢过程的工艺条件进行优化并得到其显著影响因素。正交试验的因素水平如表2所示。
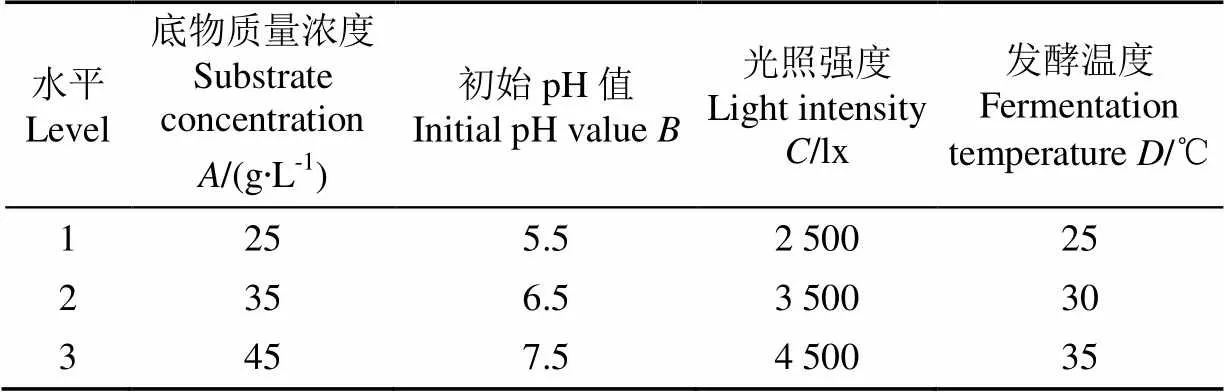
表2 正交试验因素水平表
2 结果与讨论
2.1 底物质量浓度对联合生物制氢过程的影响
在发酵温度为30 ℃、初始pH值为7.0、光照强度为3 500 lx、接种量为30%、酶负荷为150 mg/g的条件下,设定底物质量浓度分别为5、15、25、35、45 g/L进行发酵产氢试验,结果如图3所示。
由图3可以看出,不同底物质量浓度条件下的累积产氢量相差较大。底物质量浓度为35 g/L时,发酵72 h 的累积产氢量最大为283.04 mL,当底物质量浓度增大到45 g/L时,累积产氢量反而有所下降,此条件下的累积产氢量为271.40 mL,当底物质量浓度过低为5和15 g/L时,发酵36 h后产氢几乎停止,累积产氢量很低。结果表明:底物质量浓度对产氢过程影响较大,在合适的范围内,底物质量浓度增大可以提高发酵过程中的产氢量[28],但底物质量浓度过高或过低都不利于产氢[29]。分析其原因如下:底物质量浓度过低,产氢微生物得不到充足的营养物质而导致生长和代谢受限,从而影响其产氢效率。而底物质量浓度过高,底物水解副产物VFAs的大量积累会造成发酵料液过度酸化,影响产氢微生物的酶促反应,降低酶活性和细菌活性,抑制产氢反应向产氢、产酸方向进行;发酵料液中大量的固体物质会阻挡光的传输和增加光的反射所带走的能量,使得产氢细菌得不到充足的光能,从而降低其产氢效率;微生物对底物的转化不完全[30],会造成底物资源的浪费。该试验条件下得到的较佳发酵底物质量浓度为35 g/L。
2.2 初始pH值对联合生物制氢过程的影响
选定优化后的底物质量浓度35 g/L,其他条件仍设定为发酵温度30℃、光照强度3 500 lx、接种量30%、酶负荷150 mg/g。设定初始pH值分别为5.0、6.0、6.5、7.0、8.0和9.0 6个梯度进行发酵产氢试验,结果如图4所示。
由图4可以看出,不同初始pH值条件下的累积产氢量相差较大。初始 pH 值为6.5时,发酵72 h 的累积产氢量最大为327.39 mL,其次是偏酸性或中性pH值6.0和pH值7.0条件下,产氢量分别为309.66和264.57 mL,偏碱性pH值8.0和pH值9.0条件下产氢量较低,分别为175.74和146.26 mL,过度酸性条件pH值5.0时,基本上没有氢气的产生。结果表明:产气肠杆菌与混合培养联合产氢适宜在偏酸性或中性条件下进行,pH值过高或过低都会影响其产氢效率。分析其原因如下:产氢细菌的生长和繁殖是其机体内一系列酶促反应的结果,而酶促反应需要在合适的pH值范围内进行,过高或过低的pH值均会对酶的活性产生抑制,从而影响其产氢效率,而且pH值过高或过低还会影响底物(秸秆)糖化过程中纤维素酶的活性,进而影响底物的转化率和利用率。该试验条件下得到的产气肠杆菌与混合培养联合产氢的较佳发酵初始pH值为6.5。
2.3 光照强度对联合生物制氢过程的影响
选定优化后的底物质量浓度35 g/L、初始pH值6.5,其他条件仍设定为接种量30%、酶负荷150 mg/g、发酵温度30 ℃。设定光照强度分别为2 500、3 000、3 500、4 000、4 500 lx 5个梯度进行发酵产氢试验,结果如图5所示。
由图5可以看出,光照强度从2 500 lx增大到3 500 lx时,累积产氢量随着光照强度的增大而增大,光照强度为3 500 lx时,发酵72 h的累积产氢量最大为327.39 mL,当光照强度增大到4 000 lx时,累积产氢量有所下降,但下降幅度较小,但当光照强度继续增大达到4 500 lx时,累积产氢量明显下降,此条件下的累积产氢量仅为242.35 mL。结果表明:在合适的范围内,光照强度增大可以提高发酵过程中的产氢量,但光照强度过高或过低都不利于产氢。分析其原因如下:光照强度过低,固氮酶活性和ATP能量水平受到限制,产氢微生物因接收不到充足的光照其生长代谢也受到限制,因而产氢效率降低。而光照强度过高,光合器官吸收超过光合作用所需的光能,会引起光合系统的过量激发,产生光抑制和光饱和效应,导致细菌衰亡,从而影响代谢产氢效率。该试验条件下得到的较佳光照强度为3 500 lx。
2.4 发酵温度对联合生物制氢过程的影响
选定优化后的底物质量浓度35 g/L、初始pH值6.5、光照强度3 500 lx,其他条件仍设定为接种量30%,酶负荷150 mg/g。设定发酵温度分别为25、30、35、40、45 ℃ 5个梯度进行发酵产氢试验,结果如图6所示。
由图6可以看出,发酵温度为30 ℃时,发酵72 h的累积产氢量最大为327.39 mL,当发酵温度高于30 ℃时,产氢量开始急剧下降,发酵温度高达45 ℃时,基本没有氢气产生,累积产氢量仅为4.08 mL,发酵温度为40 ℃时,累积产氢量较低为67.08 mL。结果表明:在一定范围内,发酵温度升高可以提高发酵过程中的产氢量,但发酵温度过高或过低都不利于产氢。发酵温度过低,产氢微生物的细胞活性降低,生长代谢活动不旺盛,会降低其代谢产氢效率。发酵温度过高,产氢细菌代谢的酶促反应不能正常进行,细菌会加速衰亡,同样会影响其代谢产氢效率。温度过高或过低,会导致发酵产氢的延迟期变长,降低底物水解过程中纤维素酶的活性,导致底物的转化率和利用率降低,进而影响产氢效率。温度是影响产氢细菌生长和代谢的重要因素,不同微生物其最适生长和代谢的温度范围不同。在该试验条件下得到的较佳发酵温度为30 ℃。
2.5 正交试验结果与分析
在单因素试验的基础上,基于正交试验设计软件选择L9(34)型正交表进行正交试验,并对底物质量浓度,初始pH值,光照强度和发酵温度4个因素进行极差和方差分析,旨在对与产气肠杆菌联合产氢过程的工艺参数进行进一步优化并得到其显著影响因素。正交试验设计及试验结果如表3所示。
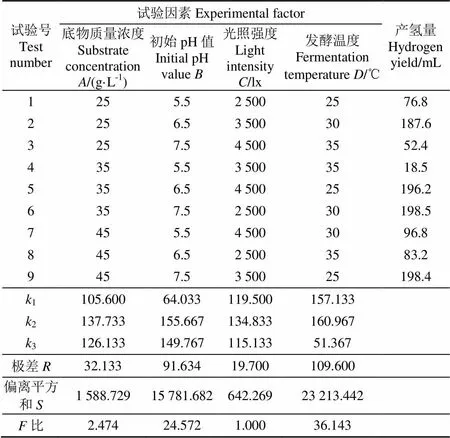
表3 正交试验设计与结果
正交试验的结果采用极差值和参数值进行分析。极差值越大,表明其对应因素对产氢过程影响越显著。值越大,表明产氢量越高,即值所对应的因素水平越有利于产氢。由试验结果中的极差值可以得出:4个因素对与产气肠杆菌联合产氢过程影响的主次顺序为>>>,即发酵温度>初始pH值>底物质量浓度>光照强度。由试验结果中的值可以得出2222为联合产氢的最优组合,即底物质量浓度35g/L,初始pH值6.5,光照强度3 500 lx和发酵温度30℃。在正交试验设计中没有该试验组合,因此在该组合条件下进行验证试验,得到此条件下72 h的累积产氢量达到332.6 mL,高于其他组合条件下的产氢量。由方差分析结果中的偏离平方和值和比值可以得出:发酵温度和初始pH值是影响与产气肠杆菌联合产氢的显著因素。发酵温度和初始pH值不仅影响底物水解过程中酶的活性,而且还影响产氢过程中产氢菌的生长代谢,进而影响整个系统的产氢效率,这从另一方面也验证了试验结果的可靠性。
3 结 论
暗-光联合生物制氢能够充分发挥暗发酵产氢菌与光发酵产氢菌之间的协同产氢能力,能够有效地提高底物利用率和产氢效率。通过单因素试验和正交试验,得出光合细菌与产气肠杆菌混合培养联合产氢的最佳工艺条件为:底物质量浓度35 g/L、初始pH值6.5、光照强度3 500 lx和发酵温度30 ℃,在此条件下,72 h的最大累积产氢量为332.6 mL,单位产氢量为47.5 mL/g。通过对各因素进行极差和方差分析,得出4个因素对与产气肠杆菌联合产氢过程影响的主次顺序为:发酵温度>初始pH值>底物质量浓度>光照强度,发酵温度和初始pH值是影响与产气肠杆菌联合产氢的显著因素。
[1] 张全国,尤希凤,张军合.生物制氢技术研究现状及其进展[J]. 生物质化学工程,2006,40(1):27-31.
Zhang Quanguo, You Xifeng, Zhang Junhe. The present situation and research progress in bio-hydrogen production technology[J]. Biomass Chemical Engineering, 2006, 40(1): 27-31.(in Chinese with English abstract)
[2] Chen L X.On scale production of hydrogen[C]//Proceedings of the Third National Hydrogen Academic Conference, 2001, 4: 4-33.
[3] Nandi R, Sengupta S. Microbial production of hydrogen: an overview [J]. Critical Reviews in Microbiology, 1998, 24(1): 61-84.
[4] Pallavi S, Anjana P. An evaluative report and challenges for fermentative biohydrogen production[J]. Hydrogen Energy, 2011, 36: 7460-7478.
[5] 尤希凤,郭新勇.生物制氢技术的研究现状及发展趋势[J].河南化工,2003(10):4-6.
[6] 路朝阳. 瓜果类生物质光合细菌产氢试验研究[D]. 郑州:河南农业大学,2015.
Lu Chaoyang. Study on Hydrogen Production from Fruit Biomass by Photosynthectic Bacteria [D]. Zhengzhou: Henan Agricultural University, 2015. (in Chinese with English abstract)
[7] 路朝阳,王毅,荆艳艳,等. 基于BBD模型的玉米秸秆光合生物制氢优化实验研究[J]. 太阳能学报,2014(8):1511-1516. Lu Chaoyang, Wang Yi, Jing Yanyan, et al. Experiment optimization of biohydrogen production from corn stalks based on BBD model[J]. ACTA Energiae Solaris Sinica, 2014(8): 1511-1516. (in Chinese with English abstract)
[8] 李建政,任南琪,林明,等. 有机废水发酵法生物制氢中试研究[J]. 太阳能学报,2002,23(2):252-256.
Li Jianzheng, Ren Nanqi, Lin Ming, et al. Hydrogen bio-production by anaerobic fermentation of organic wastewater in pilot-scale[J]. Acta Energiae Solaris Sinica, 2002, 23(2): 252-256. (in Chinese with English abstract)
[9] 包红旭,任南琪,王爱杰. 新菌X9协同B49同步发酵纤维素产氢能力分析[J]. 沈阳建筑大学学报:自然科学版,2008,24(3):465-467.
Bao Hongxu, Ren Nanqi, Wang Aijie. Analysis of biohydrogen production capacity of the cellulose degradation by cellulolyticum sp. X9and ethanoigens harbinense B49[J]. Journal of Shenyang Jianzhu University: Natural Science, 2008,24(3):465-467.
[10] 张全国,张相锋,王毅,等.光合产氢混合菌群的碳源代谢实验研究[J]. 太阳能学报,2012,33(2):253-257.
Zhang Quanguo, Zhang Xiangfeng, Wang Yi, et al. Hydrogen yield of photosynthetic bacteria flora under different carbon sources[J]. Acta Energiae Solaris Sinica, 2012, 33(2): 253-257. (in Chinese with English abstract)
[11] 张全国,雷廷宙,尤希凤,等. 影响天然混合红螺菌产氢因素的实验研究[J]. 太阳能学报,2005,26(2):248-252.
Zhang Quanguo, Lei Tingzhou, You Xifeng, et al. Study on hydrogen production influence factor[J]. Acta Energiae Solaris Sinica, 2005, 26(2): 248-252. (in Chinese with English abstract)
[12] 张全国,王素兰,尤希凤.光合菌群产氢量影响因素的研究[J]. 农业工程学报,2006,22(10):182-185.
Zhang Quanguo, Wang Sulan, You Xifeng. Effects of the influencing factors of photosynthetic bacteria group on hydrogen production[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE), 2006, 22(10): 182-185. (in Chinese with English abstract)
[13] Edwood M D, Paterson-Beedle M, Macaskie L E. Integrating dark and light bio-hydrogen production strategies: towards the hydrogen economy[J]. Reviews in Environmental Science and Biotechnology, 2009, 8(2): 149-185.
[14] Das D, Veziroglu T N. Advances in biological hydrogen production processes[J]. Hydrogen Energy, 2008, 33(21): 6046-6057.
[15] Kapdan I K, Kargi F. Bio-hydrogen production from waste materials[J]. Enzyme and Microbial Technology, 2006, 38(5): 569-582.
[16] 郑耀通,闵航. 共固定光合和发酵性细菌处理有机废水生物制氢技术[J]. 污染防治技术,1998,11(3):187-189.
[17] Yokoi H, Maki R, Hirose J, et al. Microbial production of Hydrogen from starch-manufacturing wastes[J]. Biomass & Bioenergy, 2002, 22(5): 389-395.
[18] Yokoi H, Saitsu A, Uchida H, et al. Microbial hydrogen production from sweet potato starch residue[J]. Biosci Bioeng, 2001, 91(1): 58-63.
[19] Kawaguchi H, Hashimoto K, Hirata K, et al. H2production from algal biomass by a mixed culture ofA-501 and[J]. Bioscience and Bioengineering, 2001, 91(3):277-282.
[20] 岳建芝. 超微化秸秆粉体物性微观结构及光合生物产氢实验研究[D]. 郑州:河南农业大学,2011.
Yue Jianzhi. Properties, Microstructures of Ultrafine Straw Powder and Hydrogen Production from it by Photosynthetic Bacteria[D]. Zhenzhou: Henan Agricultural University, 2011. (in Chinese with English abstract)
[21] 张志萍. 秸秆类生物质超微预处理技术及其产氢可行性研究[D]. 郑州:河南农业大学,2012.
Zhang Zhiping. Study on the Technology of Ultramicro Pretreatment by Straw Biomass and Feasibility Study of Hydrogen Production[D]. Zhenzhou: Henan Agricultural University, 2012. (in Chinese with English abstract)
[22] Sun Ye, Cheng Jiayang. Hydrolysis of lignocellulosic materials for ethanol production: A review[J]. Bioresource Technology, 2002, 3(6): 22-23.
[23] 申翔伟. 农作物秸秆光合细菌产氢原料的乙酸预处理技术实验研究[D]. 郑州:河南农业大学,2010.
Shen Xiangwei. Acetic Acid Pretreatment the Crop Straw of Hydrogen Production by Photosynthetic Bacteria Cells[D]. Zhengzhou: Henan Agricultural University, 2010. (in Chinese with English abstract)
[24] 王英姿,侯宪钦. 带能谱分析的扫描电子显微镜在材料分析中的应用[J]. 工艺与检测,2007(9):80-83.
[25] 蒋丹萍,韩滨旭,王毅,等.光合产氢细菌的生理特征和产氢特性分析[J]. 太阳能学报,2015,36(2):289-294.
Jiang Danping, Han Binxu, Wang Yi, et al. Characteristic analysis of physiological feature and hydrogen production byphotosynthetic bacteria[J]. Acta Energiae Solaris Sinica, 2015, 36(2): 289-294. (in Chinese with English abstract)
[26]阚国仕. 纤维素酶活力的测定[EB/OL]. (2010-09-15) http://www.bbi- oo.com/bio101/2006/7491.htm.
[27] Lu Chaoyang, Zhang Zhiping, Ge Xumeng, et al. Bio-hydrogen production from apple waste by photosynthetic bacteria HAU-M1[J]. International Journal of Hydrogen Energy, 2016, 41: 13399-13407.
[28] Wang J, Wan W. Factors influencing fermentative hydrogen production: A review[J]. International Journal of Hydrogen Energy, 2009, 34(2): 799-811.
[29] Lo Y, Chen W, Hung C, et al. Dark H2fermentation from sucrose and xylose using H2–producing indigenous bacteria: Feasibility and kinetic studies[J]. Water Reserch, 2008, 42(4/5): 827-842.
[30] 汤桂兰,孙振钧.厌氧污泥发酵制氢工艺试验研究[J]. 农业工程学报,2007,23(9):201-204.
Tang Guilan, Sun Zhenjun. Technology for biohydrogen production through anaerobic sewage sludge fermentation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2007, 23(9): 201-204. (in Chinese with English abstract)
Experiment of integrated fermentation hydrogen production by photosynthetic bacteria cooperating with
Zhang Quanguo1,2, Zhang Tian1, Zhang Zhiping1,2, Zhou Xuehua1,2, Wang Yi1, He Chao1,2
(1.(),450002,; 2.450002)
Along with the rapid development of society and unceasing improvement of human living standard, the consumption of fossil fuels is rising continuously, which has resulted in several problems such as energy shortage and environmental pollution. Therefore, the research and exploitation of renewable energy become extremely urgent. Hydrogen is a promising alternative energy, and can be produced through different methods. Considering the complementarity between different hydrogen-production microorganisms, dark-photo integrated bio-hydrogen production was regarded as a beneficial way to improve the utilization rate of substrate and the potential of hydrogen production. Dark-photo integrated bio-hydrogen production could combine the characteristics of various microbes, and exert their advantages. Moreover, enzymatic hydrolysis of complex substrate, VFAs production, VFAsconsumption, and hydrogen production could synchronously take place, so it could realize the reuse of byproducts (VFAs) and avoid the accumulation of liquid byproducts. In this study, enzymatic hydrolyzate of corn stover was taken as substrate,() and photosynthetic bacteria () were selected as hydrogen-production microorganisms, and simultaneous saccharification fermentative method was adopted to study the process of dark-photo integrated bio-hydrogen production by mixed cultivation ofand. Cumulative hydrogen yield was taken as key reference to optimize the process parameters of bio-hydrogen production. The single factor experiments were adopted to select the optimal lever and analyze the effects of substrate concentration, initial pH value, light intensity and fermentation temperature on the integrated bio-hydrogen production. On the basis of single factor experiments, orthogonal experimental design was also adopted to further optimize the bio-hydrogen production process parameters and evaluate the significance of influencing factors. The results of orthogonal range analysis showed that primary and secondary order of the influence of various process parameters on integrated bio-hydrogen production was: fermentation temperature>initial pH value>substrate concentration>light intensity. The analysis of variance showed that fermentation temperature and initial pH value were the most significant factors affecting integrated bio-hydrogen production and produced the most significant influence on the process of integrated bio-hydrogen production by mixed cultivation of photosynthetic bacteria and. The optimum process parameters were: substrate concentration of 35 g/L, initial pH value of 6.5, light intensity of 3 500 lx, and fermentation temperature of 30 ℃. The validation experiments under these conditions were performed, and the cumulative hydrogen yield of 332.6 mL for 72 h and the capacity of unit hydrogen production of 47.5 mL/g corn stover were obtained. The optimal process parameters for bio-hydrogen production provide a scientific reference for the further research on integrated bio-hydrogen production by mixed cultivation of dark-fermentative and photo-fermentative bacteria from straw biomass.
fermentation; mircroorganism; hydrogen; photosynthetic bacteria;; mixed cultivation; integrated bio-hydrogen production
10.11975/j.issn.1002-6819.2017.09.032
TK6
A
1002-6819(2017)-09-0243-07
2016-10-24
2017-04-08
国家自然科学基金项目(51676065);教育部博士点基金新能源优先领域项目(20134105130001)
张全国,男,河南郑州人,博士,教授、博士生导师,主要从事可再生能源工程方面的研究。郑州 河南农业大学450002。 Email:zquanguo@163.com
张全国,张 甜,张志萍,周雪花,王 毅,贺 超. 光合细菌协同产气肠杆菌联合发酵制氢试验[J]. 农业工程学报,2017,33(9):243-249. doi:10.11975/j.issn.1002-6819.2017.09.032 http://www.tcsae.org
Zhang Quanguo, Zhang Tian, Zhang Zhiping, Zhou Xuehua, Wang Yi, He Chao. Experiment of integrated fermentation hydrogen production by photosynthetic bacteria cooperating with[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(9): 243-249. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.09.032 http://www.tcsae.org

