循环miR-19a/b作为心肌缺血再灌注损伤标志物的研究
高莉,龚小芳,余修龙,帅希元
循环miR-19a/b作为心肌缺血再灌注损伤标志物的研究
高莉,龚小芳,余修龙,帅希元
目的:探讨miR-19a/b在调节心肌缺血再灌注损伤中的作用及临床意义。
方法:实时荧光定量聚合酶链式反应(PCR)检测miR-19a/b在经过10 h缺氧、2 h复氧后的H9c2心肌细胞中的表达,通过荧光素酶实验分析miR-19a/b的潜在靶基因。同时,以40例健康者的血清作为对照,采集40例急性心肌梗死(AMI)患者发病24 h内的外周血标本,分离血清后采用实时荧光定量PCR法检测血清中miR-19a/b表达水平,并采用化学发光免疫分析法检测血心肌肌钙蛋白I(cTnI)含量;免疫抑制法测定肌酸激酶同工酶(CK-MB)的酶活力。
结果:miR-19a和miR-19b在经过10 h缺氧、2 h复氧的H9c2心肌细胞中的表达比在正常H9c2细胞中分别增加了5.876倍和2.761倍(P均<0.01)。转染miR-19a/b类似物和miR-19a/b抑制剂分别上调和下调细胞中miR-19a/b的表达。荧光素酶报告基因实验发现,miR-19a/b与第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)蛋白3'UTR区有靶向作用关系。转染miR-19a/b类似物上调miR-19a/b的表达后,PTEN的表达降低;转染miR-19a/b抑制剂下调miR-19a/b的表达后,PTEN的表达增加。与健康受试者比较,miR-19a/b在AMI患者血清中的表达增加(P均<0.01);AMI患者胸痛发作后0~3 h开始升高,6~12 h达高峰;血清CK-MB酶活力和cTnI水平在AMI发作后2~6 h开始升高,24 h左右达高峰。
结论:miR-19a/b在心肌缺血再灌注过程中高表达,PTEN是miR-19a/b的潜在靶基因;循环miR-19a/b可作为心肌缺血再灌注损伤新的无创性诊断标志物。
微RNAs;再灌注损伤;生物学标记
(Chinese Circulation Journal, 2017,32:617.)
心血管疾病是影响人类最严重的疾病之一,其中以心肌梗死的死亡率最高。目前心肌梗死是人类第五位死因,据世界心脏联盟预计,到2020年,心肌梗死将成为人类第一位死因[1]。心肌缺血再灌注损伤是心肌组织在较长时间缺血后恢复血液灌流,反而出现比再灌注前更明显、更严重的损伤和功能障碍,包括收缩功能降低、冠状动脉血流量下降及血管反应性改变[2,3]。动物模型研究提示,致死性心肌缺血再灌注损伤体积占心肌梗死最终体积的比例可高达50%。因此,防治心肌缺血再灌注损伤可以提高急性心肌梗死(AMI)再灌注治疗的临床疗效[4,5],相关研究已成为热点,但迄今还没有可用于临床的相应药物。近年来的研究发现,心肌缺血再灌注损伤伴有多种微小核糖核酸(miRNA)的表达变化[6]。既往研究表明,不同疾病人群血清或血浆中miRNA的表达不同;miRNA分子与脱氧核糖核酸(DNA)和RNA一样,广泛存在于血清和血浆中,并且随着生理状况和疾病状况的不同,miRNA在血清和血浆中的种类和数量也会发生变化。既往已经发现,在心血管疾病的循环核酸中存在源自心血管系统的miRNA,这一现象提示,循环 miRNA可能成为心血管疾病的无创诊断标志物[7,8]。本研究通过检测循环中miR-19a/b的表达水平,评价其作为心肌缺血再灌注损伤无创诊断标志物的价值。
1 材料和方法
1.1 材料和试剂
材料:经新津县人民医院伦理委员会批准,患者签署知情同意书,收集40例AMI患者(平均年龄55岁)胸痛发作时24 h内不同时间点深静脉血液标本;另收集40例健康受试者的血液标本作为对照。所有血液标本在室温下静置1 h,4℃下1000 g离心20 min,移取血清置于无RNA酶的EP管中,冻存于-80℃冰箱中备用。心肌损伤生化标志物[首选心肌肌钙蛋白I(cTnI)]升高和(或)降低,至少有一次数值超过99%正常参考值上限,并有以下至少一项心肌缺血的证据可诊断为AMI[9]:(1)心肌缺血的症状;(2)新出现的ST-T改变或新出现的左束支传导阻滞;(3)新出现的病理性Q波;(4)影像学有新出现的心肌活力丧失或区域性室壁运动异常;(5)冠状动脉造影或尸检证实冠状动脉内有血栓。H9c2心肌细胞购自美国模式培养物集存库(美国,ATCC)。
主要试剂:改良杜氏伊格尔培养基(DMEM)培养基(Gibco,美国,加利福尼亚);胎牛血清(Gibco);选择性基本 (opti-MEM)培养基(Gibco);脂质体2000(Lipofectamine2000);胰酶(0.02%乙二胺四乙酸);TRIZOL RNA试剂盒、RT试剂盒、Taq酶、酶联免疫反应(PCR)试剂盒、miR-19a/b类似物和抑制剂,野生型和突变型磷酸酶及张力蛋白同源基因(PTEN)、荧光素酶报告基因均购自Invitrogen公司(美国,加利福尼亚)。
1.2 试验方法
细胞培养:H9c2心肌细胞于37℃、 5%二氧化碳细胞培养箱中培养,细胞扩增培养基为含10%胎牛血清的DMEM培养基。
缺血再灌注损伤细胞模型建立:分别将H9c2细胞、转染miR-19a类似物或抑制剂48 h后的细胞培养于不含血清及葡萄糖的DMEM培养基中,置于37℃缺氧箱中培养10 h,然后将其重新培养于含10%胎牛血清的DMEM培养基复氧2 h。
总RNA的提取及质量检测:收集到的细胞及每份样本取血清500 μl,参照TRIZOL试剂说明书的步骤,逐步提取两组血清标本中的总RNA。应用紫外分光光度计测定总RNA的吸光度A260值和A280值,用A260值计算其浓度,并计算A260/A280值检测其纯度,A260/A280值范围在1.8~2.1认为合格。
实时荧光定量 PCR测目的miRNA表达量:应用U6 snRNA、miR-19a、miR-19b特异性茎环引物和miRNA逆转录试剂盒(ABI,美国,加利福尼亚)对血清中提取获得的总RNA进行逆转录反应,获得相应miRNA的互补DNA(cDNA)。实时荧光定量PCR采用2xSYBR Green PCR Master Mix,取适量cDNA作为摸板,引物浓度0.4 μmol/L,15 μl体系进行扩增,每个待测样本设置3个平行样。用于特异扩增miR-19a/b的引物和试剂盒购自ABI公司。以U6 snRNA作为内参。PCR反应在实时定量PCR反应仪上进行。三次独立实验后得到的数据运用公式RQ=2-ΔΔCt的方法进行分析。
蛋白质印迹法分析PTEN蛋白表达:提取细胞总蛋白,BCA法蛋白定量[9],每孔中加样50 μg蛋白,经10%聚丙烯酰胺凝胶电泳后,电转移至聚偏二氟乙烯膜膜。5%小牛血清(BSA)/TBST[800 ml蒸馏水溶解8 g氯化钠、0.2 g氯化钾和3 g三羟甲基氨基甲烷(Tris-base),加入0.015 g酚红,用盐酸调至PH 7.4,用蒸馏水定容到1 L,分装后再高压蒸汽灭菌20 min,室温保持]室温封闭1 h,加入鼠抗人第10号染色体缺失的PTEN单克隆(1:200)孵育,4℃过夜。TBST漂洗三次,用辣根过氧化物酶标记的羊抗鼠免疫球蛋白G(1:5000)孵育,室温2 h,TBST漂洗三次,底物化学发光检测,暗室曝光10 s至10 min,显影。
双荧光素酶活性检测:将荧光素酶报告基因载体瞬时转染24 h后,将细胞裂解,然后利用G1oMaxTM 96 Microplate Luminometer发光检测仪分别测定萤火虫荧光素酶(firefly luciferase)和海肾荧光素酶(renilla luciferase)活性。共转pRL-SV40质粒作为内对照用来校正转染效率以Firefly luciferase与Renilla luciferase活性的比值作为荧光素酶的相对活性,进行不同样品间的比较。
肌酸激酶同工酶(CK-MB)活性和cTnI水平检测:采用Olympus,AU2700全自动生化分析仪及Olympus原装试剂分析CK-MB活性。根据cTnI、肌红蛋白、CK-MB三合一检测试剂[胶体金法,购自艾博生物医药(杭州)有限公司]说明书检测cTnI水平。
1.3 统计学方法
采用 SPSS 13. 0软件进行统计分析。cTnI水平和CK-MB酶活力的分析采用均数±标准差进行分析,计量资料的比较采用t检验或方差分析,计数资料的比较采用χ2检验,检验水准α=0.05。 P<0.05认为差异有统计学意义。
2 结果
健康受试者和AMI患者血清cTnI水平和CK-MB酶活力检测结果:健康受试者血清cTnI水平和CK-MB酶活力分别为(0.21±0.06)μg/ml和(11.2±2.8)U/L,与AMI患者胸痛发作后不同时间点的上述指标相比,差异均有统计学意义(P均<0.01)。AMI患者的血清cTnI水平和CK-MB酶活力动态监测结果显示(表1),cTnI在AMI发作后2~6 h开始升高,24 h左右达高峰,升高幅度达正常数十倍以上,且在血中半衰期长,约7~10 d恢复至近正常水平;CK-MB也在AMI发作后2~6 h开始升高,24 h左右达高峰,为正常数倍至近十倍,但升高持续时间短,治疗后2~3 d内多可恢复接近正常水平。

表1 急性心肌梗死患者胸痛发作后不同时间点血清cTnI水平和CK-MB酶活力检测结果(n=40,±s)
miR-19a/b在缺血再灌注损伤的H9c2心肌细胞模型中的表达(图1):与正常H9c2心肌细胞比较,miR-19a和miR-19b在经过10 h缺氧、2 h复氧的H9c2心肌细胞中的表达分别增加了5.876倍和2.761倍,差异具有统计学意义(P均<0.01)。

图1 实时荧光定量PCR检测miR-19a(1A)和miR-19b(1B) 在正常H9c2心肌细胞及缺血再灌注损伤H9c2心肌细胞中的表达比较(n=3)
转染miR-19a/b类似物或抑制剂对缺血再灌注损伤H9c2心肌细胞中miR-19a/b表达的影响(图2):与在正常H9c2心肌细胞中的表达比较,miR-19a/b在转染miR-19a/b类似物48 h的缺血再灌注H9c2心肌细胞中的表达明显增加(miR-19a:0.998±0.005 vs 8.780±0.55;miR-19b:0.976±0.007 vs 7.530±0.95),差异均具有统计学意义(P均<0.05,图2A和图2B);与在正常H9c2心肌细胞中的表达比较,miR-19a/b在转染miR-19a/b抑制剂48 h的缺血再灌注H9c2心肌细胞中的表达下降(miR-19a:0.992±0.019 vs 0.250±0.007;miR-19b:0.987±0.009 vs 0.370±0.05),差异均具有统计学意义(P均<0.05,图2C和图2D)。
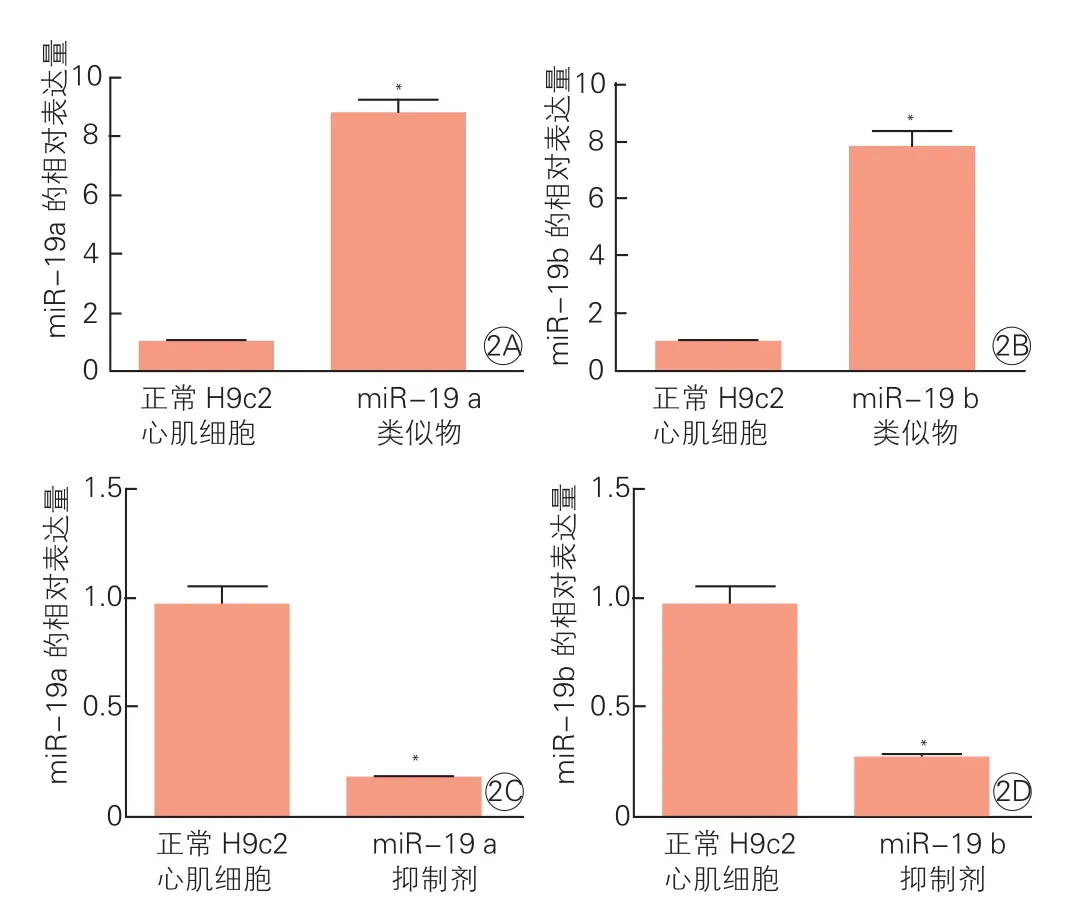
图2 实时荧光定量PCR检测转染miR-19a/b类似物(2A/2B)或抑制剂(2C/2D)对缺血再灌注损伤H9c2心肌细胞中miR-19a/b表达的影响(n=3)
转染miR-19a/b类似物或抑制剂对缺血再灌注损伤H9c2心肌细胞中PTEN表达的影响:通过基因信息学分析发现,miR-19a/b与PTEN之间有靶向作用关系。荧光素酶实验进一步确定,miR-19a/b与PTEN蛋白3' UTR区有靶向作用关系。转染miR-19a/b类似物上调缺血再灌注损伤的H9c2心肌细胞中miR-19a/b的表达后,与在正常H9c2心肌细胞中的表达比较,PTEN在信使RNA(mRNA)水平和蛋白水平上的表达均明显降低,差异具有统计学意义(P均<0.05);转染miR-19a/b 抑制剂下调缺血再灌注损伤的H9c2心肌细胞中miR-19a/b的表达后,与在正常H9c2心肌细胞中的表达比较,PTEN在mRNA水平和蛋白水平上的表达均明显增加(P均<0.05)。
miR-19a/b在AMI患者和健康受试者血清中的表达(图3):与健康受试者相比,AMI患者胸痛发作后24 h内血清中miR-19a/b的表达均明显增高,差异均具有统计学意义(P均<0.001)。
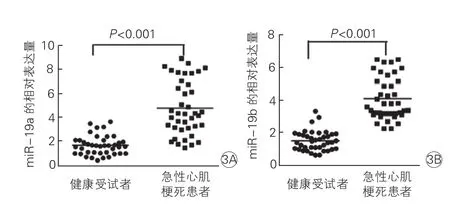
图3 实时荧光定量PCR检测急性心肌梗死患者胸痛发作24 h内和健康受试者血清中miR-19a(3A)和miR-19b(3B)的表达(n=40)
miR-19a/b在AMI患者胸痛发作后不同时间点血清中的表达(图4):实时荧光定量PCR检测结果显示,miR-19a/b在AMI患者胸痛发作后0~3 h开始升高,在6~12 h达高峰,12 h后开始降低,72 h后基本降至正常。

图4 实时荧光定量PCR急性心肌梗死患者胸痛发作后不同时间点血清中miR-19a(4A)和miR-19b(4B)的表达(n=40)
3 讨论
世界卫生组织制定的心肌梗死诊断依据要求有下列三项条件中至少两项:缺血性胸部不适病史、心电图的动态演变和血清标志物水平升降[10]。因此,心肌梗死患者血清标志物的检测对于明确诊断和指导治疗具有十分重要的意义[11]。众所周知,心肌梗死不仅导致心肌细胞坏死、凋亡,还累及血管床和心肌外胶原组织,复杂的病理生理、病理解剖导致心室重构,引起心功能不全。PTEN是新发现的一种人类抑癌基因,与细胞的生长、分化、凋亡、信号传递等密切相关。既往对PTEN的研究大多侧重于肿瘤方面,近些年来有研究发现,PTEN/丝氨酸-苏氨酸激酶(Akt)信号通路在心肌重构、心肌肥厚、心肌缺血再灌注损伤等方面亦发挥着重要的作用,但其机制尚未完全阐明。
miRNA是近年来发现的小分子调节RNA,由约22个内源性非编码的核苷酸组成,可以和与之互补的mRNA结合,抑制其翻译或促进其降解,对mRNA的稳定及翻译效率起到重要的调控作用,从而实现对基因表达的负性调节效果。miRNA不仅参与调控机体的多种生理过程,如细胞的新陈代谢、增殖分化、生长凋亡等,而且在众多疾病的发生、发展中起重要的调控作用[12]。2008年Mitchell等[13]发表的一项关于癌症标志物的研究提示,血浆中miRNA能以稳定的形式存在,避免内源性RNA酶的降解。正是由于这些非细胞性miRNA在循环中的稳定性,我们可以十分简便地获得外周静脉血并提取血清或血浆来代替心肌组织,从而研究心肌缺血再灌注损伤时特异性表达的miRNA。
近年来的研究发现,miR-7a/b能够靶向作用于二磷酸腺苷-核糖聚合酶防止缺血/再灌注心肌细胞损伤[14];三碘甲腺原氨酸通过调节p53 miR-30a/轴可以防止心脏缺血/再灌注细胞线粒体的损伤[15];miR-50通过下调c-myb基因的表达,增加过氧化氢诱导的心肌细胞损伤[16];miR-1加速小鼠心肌缺血再灌注损伤[17];miR-145通过靶向作用于线粒体凋亡通路,减少过氧化氢诱导的心肌细胞凋亡[18];miR-214通过控制钙离子超载和细胞死亡保护小鼠心脏缺血再灌注损伤[19];miR-494通过靶向促凋亡和抗凋亡蛋白减少缺血/再灌注诱导的心肌损伤[20];miR-19a/b通过靶向作用于肌萎缩素-1和肌环指蛋白-1调节心肌细胞肥大[21]。然而,国内外尚未见miR-19a/b对心肌缺血再灌注损伤的相关研究报道。
本研究发现,miR-19a/b在经10 h缺氧、2 h复氧的H9c2心肌细胞中高表达,PTEN是miR-19a/b的潜在靶基因;与健康受试者比较,miR-19a/b在AMI患者血清中的表达增加;AMI患者血清CK-MB活性和cTnI水平在胸痛发作后2~6 h开始升高,24 h左右达高峰,而miR-19a/b表达在胸痛发作后0~3 h开始升高,6~12 h达高峰。以上研究结果提示,miR-19a/b在心肌缺血再灌注过程中的升高早于目前常用的心肌损伤标志物CK-MB和cTnI,循环miR-19a/b可能作为心肌缺血再灌注损伤新的无创性早期诊断标志物。
[1] Drory Y, Kravetz S, Hirschberger G. Sexual activity of women and men one year before a first acute myocardial infarction. Cardiology, 2002, 97: 127-132.
[2] Dianat M, Sadeghi N, Badavi M, et al. Protective effects of coadministration of gallic Acid and cyclosporine on rat myocardial morphology against ischemia/reperfusion. Jundishapur J Nat Pharm Prod, 2014, 9: e17186.
[3] Hu F, Wang Y, Gong K, et al. Protective effects of drag-reducing polymers on ischemic reperfusion injury of isolated rat heart. Clin Hemorheol Microcirc, 2015, 10: 105-108.
[4] Thind GS, Agrawal PR, Hirsh B, et al. Mechanisms of myocardial ischemia-reperfusion injury and the cytoprotective role of minocycline: scope and limitations. Future Cardiol, 2015, 11: 61-76.
[5] 李萌玫, 邵一兵. 冠心病患者测定微循环阻力指数的临床意义. 中国循环杂志, 2016, 10: 1022-1024.
[6] Lorenzen JM, Batkai S, Thum T. Regulation of cardiac and renal ischemia-reperfusion injury by microRNAs. Free Radic Biol Med, 2013, 64: 78-84.
[7] D'Alessandra Y, Pompilio G, Capogrossi MC. MicroRNAs and myocardial infarction. Curr Opin Cardiol, 2012, 27: 228-235.
[8] Hulsmans M, Holvoet P. MicroRNAs as early biomarkers in obesity and related metabolic and cardiovascular diseases. Curr Pharm Des, 2013, 19: 5704-5717.
[9] Chapman AR, Adamson PD, Mills NL. Assessment and classification of patients with myocardial injury and infarction in clinical practice. BMJ, 2017, 103: 10-18.
[10] Myftiu S, Bara P, Sharka I ,et al. Heart failure predictors in a group of patients with myocardial infarction. Open Access Mace J Med Sci, 2016, 4: 435-438.
[11] 李静, 李希, 余苑, 等. 2001年~2011年中国东部农村ST段抬高型心肌梗死 诊疗变化趋势——ChinaPEACE回顾性急性心肌梗死研究.中国循环杂志, 2016, 31: 4-9.
[12] Geaghan M, Cairns MJ. MicroRNA and posttranscriptional dysregulation in psychiatry. Biol Psychiatry, 2014, 5: 13-18.
[13] Mitchell PS, Parkin RK, Kroh EM, et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci USA, 2008, 105: 10513-10518.
[14] Bai Y, Sun Y, Peng J, et al. Overexpression of secretagogin inhibits cell apoptosis and induces chemoresistance in small cell lung cancer under the regulation of miR-494. Oncotarget, 2014, 5: 7760-7775.
[15] Forini F, Kusmic C, Nicolini G, et al. Triiodothyronine prevents cardiac ischemia/reperfusion mitochondrial impairment and cell loss by regulating miR30a/p53 axis. Endocrinology, 2014, 155: 4581-4590. [16] 肖法嫚, 陈珍珠, 曾香萍, 等. 同源异型盒基因HOXA5对小细胞肺癌细胞多药耐药性的影响. 南方医科大学学报, 2013, 33: 1665-1668.
[17] Pan Z, Sun X, Ren J, et al. miR-1 exacerbates cardiac ischemiareperfusion injury in mouse models. PLoS One, 2012, 7: e50515.
[18] Li R, Yan G, Li Q, et al. MicroRNA-145 protects cardiomyocytes against hydrogen peroxide H2O2-induced apoptosis through targeting the mitochondria apoptotic pathway. PLoS One, 2012, 7: e44907.
[19] Aurora AB, Mahmoud AI, Luo X, et al. MicroRNA-214 protects the mouse heart from ischemic injury by controlling Ca2+overload and cell death. J Clin Invest, 2012, 122: 1222-1232.
[20] Wang X, Zhang X, Ren XP, et al. MicroRNA-494 targeting both proapoptotic and antiapoptotic proteins protects against ischemia/ reperfusion-induced cardiac injury. Circulation, 2010, 122: 1308-1318.
[21] Song DW, Ryu JY, Kim JO, et al. The miR-19a/b family positively regulates cardiomyocyte hypertrophy by targeting atrogin-1 and MuRF-1. Biochem J, 2014, 457: 151-162.
Investigation of Circulating miR-19a/b as the Biological Marker for Myocardial Ischemia Reperfusion Injury
GAO Li, GONG Xiao-fang, YU Xiu-long, SHUAI Xi-yuan.
Department of Cardiology, Xinjin County Hospital, Chengdu (611430), Sichuan, China
SHUAI Xi-yuan, Email: xiyuansh@163.com
Objective: To investigate the role of miR-19a/b in myocardial ischemia reperfusion injury (R/I) with its clinical significance.
Methods: Our research included in 2 parts. Part 1: in H9c2 cells. miR-19a/b expression in H9c2 cells with 10 h hypoxia and 2 h re-oxygenation was detected by real-time PCR, miR-19a/b potential target gene was assessed by luciferase reporter activity assay. Part 2: in natural person. Control group, n=40 healthy subjects and AMI (acute myocardial infarction) group, n=40 relevant patients. Peripheral blood levels of miR-19a/b were detected as Part 1, cTnI were measured by chemiluminescence immune analysis and CK-MB were assessed by immune inhibition method.
Results: Part 1: Compared with normal H9c2 cells, miR-19a/b expressions were increased 5.876 times and 2.761 times in H9c2 cells with 10 h hypoxia and 2 h re-oxygenation, both P<0.01. With respectively transfected miR-19a/b mimic and inhibitor, miR-19a/b expression was up-regulated and down-regulated respectively. miR-19a/b and chromosome-10 deleted phosphatase, tensing homolog gene (PTEN) had the targeting effect. With up-regulated miR-19a/b expression, PTEN level was decreased and with down-regulated miR-19a/b expression, PTEN level was increased. Part 2: Compared with Control group, AMI group had elevated blood level of miR-19a/b, P<0.01. In AMI patients, miR-19a/b was increasing at 0-3 h ofchest pain and reaching the peak at 6-12 h; CK-MB enzyme activity and cTnI content were elevating at 2-6 h of onset and reaching the peak at 24 h.
Conclusion: miR-19a/b expression was up-regulated by myocardial ischemia reperfusion in H9c2 cells, PTEN was the potential target gene of miR-19a/b. Circulating miR-19a/b might be used as a new non-invasive biological marker for myocardial ischemia R/I diagnosis.
MicroRNAs; Reperfusion injury; Biological markers
2016-07-08)
(编辑:朱柳媛)
611430 四川省成都市,新津县人民医院 心内科(高莉、龚小芳、余修龙);武警综合保障基地成都仓库卫生所(帅希元)
高莉 主治医师 学士 研究方向:心血管疾病 Email:Gaolimed@163.com 通讯作者:帅希元 Email:xiyuansh@163.com
R54
A
1000-3614(2017)06-0617-05
10.3969/j.issn.1000-3614.2017.06.020

