LncRNA-MIAT在肿瘤坏死因子α介导的血管内皮细胞炎症中的表达及作用
任成龙,张璐,宁险峰,赵青,蔡尚郎,张文忠
基础与实验研究
LncRNA-MIAT在肿瘤坏死因子α介导的血管内皮细胞炎症中的表达及作用
任成龙,张璐*,宁险峰,赵青,蔡尚郎,张文忠
目的:体外观察血管内皮细胞(ECs)在肿瘤坏死因子α(TNF-α)刺激下,细胞内长链非编码核糖核酸(LncRNA)心肌梗死相关转录本(LncRNA-MIAT)的表达变化,并探讨LncRNA-MIAT对ECs炎症的调控作用。
方法:以TNF-α诱导ECs表达LncRNA-MIAT,采用蛋白质免疫印迹法(Western Blot)、聚合酶链反应(PCR)及实时荧光定量PCR(qRT-PCR)方法分别检测ECs炎症状态下细胞间黏附分子-1(ICAM-1)和LncRNA-MIAT的表达情况。应用MIAT小干扰核糖核酸(siRNAMIAT)转染ECs细胞,观察LncRNA-MIAT敲低对ICAM-1表达的影响。
结果:LncRNA-MIAT随着TNF-α刺激时间的延长与浓度的增高呈上升趋势,刺激24 h、48 h分别与刺激0 h、6 h、12 h比较,LncRNA-MIAT表达量均增多,差异均具有统计学意义(P<0.05); TNF-α刺激浓度为1.000 ng/ml、10.000 ng/ml分别与刺激浓度为0.000 ng/ml、0.125 ng/ml比较,LncRNA-MIAT表达量增多,差异均具有统计学意义(P均<0.05)。 ECs经siRNAMIAT转染后,TNF-α诱导的ICAM-1蛋白表达被显著抑制(P<0.05)。
结论:LncRNA-MIAT可能参与血管ECs的炎症反应,并可能起到促炎作用。
核糖核酸酶类;肿瘤坏死因子α;细胞间黏附分子-1
冠心病的发生率和致死率呈逐渐上升趋势,成为威胁人们健康与生命的重要慢性疾病和耗费国家巨额财政的主要病种之一。动脉粥样硬化是冠心病的主要病理基础,其起始于血管内皮细胞(ECs)的损伤,损伤后的ECs会分泌细胞因子诱导单核细胞迁入内膜,吞噬脂质形成泡沫细胞,即在粥样硬化斑块内出现的特征性细胞,因此ECs在动脉粥样硬化过程中起到了关键作用[1]。全基因关联性研究(GWAS)发现,哺乳动物基因中超过98%转录为非编码核糖核酸(ncRNA),只有不到2%的基因转录蛋白质[2]。而随后的研究发现,长链非编码核糖核酸(LncRNA) 属于ncRNA的重要组成部分,其是指长度 > 200 nt、无蛋白编码功能的RNA,可从表观遗传学、转录调控及转录后调控等多个层面实现对基因表达的调控[3],其表达水平的变化与多种疾病密切相关,亦影响到心血管疾病[4,5]。研究发现,LncRNA-心肌梗死相关转录本(MIAT)在血管动脉粥样硬化进程中起调控作用[6]。
肿瘤坏死因子α(TNF-α)是目前公认在血管粥样硬化中重要的致炎因子之一[7]。我们应用TNF-α诱导ECs炎症状态,观察ECs炎症状态下细胞间黏附分子-1(ICAM-1)和LncRNA-MIAT的表达情况,后采用siRNAMIAT敲低ECs细胞中LncRNA-MIAT,进一步观察TNF-α刺激下敲低LncRNA-MIAT后的ECs中ICAM-1的表达情况,旨在探讨LncRNA-MIAT在ECs炎症中的调控作用。
1 材料与方法
1.1 细胞来源
人血管ECs株购自中国科学院上海细胞库,用含体积分数10%新生胎牛血清的DMEM高糖培养基培养,以质量浓度为2.5 g/L的胰蛋白酶消化传代,取对数生长期细胞用于实验。
1.2 试剂
DMEM高糖培养基购于美国Solarbio公司,胎牛血清购自上海依科赛生物科技有限公司,TNF-α购自美国PeproTech公司,ICAM-1抗体购自英国Abcam公司,总RNA抽提试剂Trizol购自美国Invitrogen公司,荧光定量试剂Premix Taq、逆转录试剂盒SYBR Green II购自日本TAKARA公司,小干扰核糖核酸(siRNA)(siRNAScramble、siRNAMIAT)购自上海吉玛制药技术有限公司,转染试剂Hiperfect购自德国Qiagen公司,RIPA蛋白裂解液购自康为世纪生物科技有限公司。
1.3 研究方法
细胞培养方法:(1)常规培养: ECs采用含体积分数10%胎牛血清、1 %双抗(青霉素/链霉素)的DMEM 高糖培养基,在37℃、常氧CO2培养箱中培养。(2) TNF-α刺激ECs培养: ①时间刺激:按照六孔细胞培养板中细胞密度于加药日达到50 %~60 %密度铺板,以TNF-α浓度为1.000 ng/ml的细胞培养液培养细胞,分别刺激0 h、6 h、12 h、24 h和48 h后收集细胞。 ②计量刺激:按照六孔细胞培养板中细胞密度于加药日达50 %~60 %密度铺板,分别以TNF-α浓度为0.000 ng/ml、0.125 ng/ml、0.250 ng/ ml、0.500 ng/ml、1.000 ng/m和l0.000 ng/ml的细胞培养液培养细胞24 h,于24 h后收集细胞。 ③常规TNF-α刺激:以TNF-α浓度为1.000 ng/ml的细胞培养液设定时间培养细胞。
聚合酶链反应(PCR):检测常规培养下ECs中LncRNA-MIAT表达,从NCBI数据库 (http:// www.ncbi.nlm.nih.gov/)网站获得LncRNA-MIAT序列,以Primier 5.0软件设计引物,由北京三博远志生物技术有限责任公司合成LncRNA-MIAT正义链:5'-GAGATTGGCGATGGTTGTGA-3',反义链: 5'-CAGTGACGCTCCTTTGTTGAA-3',以Trizol提取细胞总RNA,合成互补脱氧核糖核酸(cDNA)。PCR扩增LncRNA-MIAT,以空白组作为内部参照。配制20 μl反应体系。PCR反应条件: 95 ℃变性5 s,60 ℃退火30 s,共35个循环,最后72 ℃延伸10 min。PCR扩增产物经1 %的琼脂糖凝胶电泳后在紫外线下显影拍照,根据条带位置确定是否表达。
实时荧光定量PCR(qRT-PCR):按Trizol试剂盒说明书提取ECs总RNA,测得RNA浓度,质量定为500 ng,求得逆转录体积后,根据逆转录试剂盒说明书将已经提取的RNA逆转录成cDNA,按照SYBR Premix Ex Taq试剂盒配置20 μl反应体系(SYBRII 10 μl、cDNA 2 μl、上游引物 0.4 μl、下游引物 0.4μl、超纯水 8.0 μl)。以β肌动蛋白(β-actin)作为内部参照,反应条件如下:95℃预变性30 s:之后95℃ 5 s,60℃ 30 s,进行40个循环复性;最后94℃90 s,60℃ 180 s延伸,绘制扩增曲线。引物序列:正义链:5'-GAGATTGGCGATGGTTGTGA-3',反义链:5'-CAGTGACGCTCCTTTGTTGAA-3'。
siRNA干扰:按照12孔细胞培养板中细胞密度于转染日达30%~40%密度铺板,根据转染试剂Hiperfect说明书,转染前将孔板内细胞换液,每孔加入900 μl正常培养液。100 μl转染体系: 6 μl Hiperfect、2 μl siRNA,DMEM补齐至100 μl,常温孵育10 min后,加入12孔板,即每孔1 000μl(6孔板转染时siRNA、Hiperfect加倍)。应用siRNAScramble作为siRNAMIAT的阴性对照,分别于转染后培养24 h、48 h,收细胞进行qRT-PCR,检测转染效果。
蛋白质免疫印迹法(Western Blot)检测ICAM-1的表达:收集细胞,RIPA蛋白裂解液提取各组细胞中的总蛋白,BCA法定量蛋白,于10 %的聚丙烯酰胺凝胶中电泳,湿法转移至聚偏氟乙烯(PVDF)膜上.以体积分数5%的脱脂奶粉封闭后,加入ICAM-1抗体,4 ℃孵育过夜,缓冲溶液(TBST)漂洗后加入二抗,化学发光法显色,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,用目的蛋白ICAM-1的灰度值/内参照灰度值的比值,作为ICAM-1的相对表达量。
统计学处理:采用Image J、Prism5.0软件进行统计分析,统计结果以均数±标准误(±s)表示,组间比较采用单因素方差分析和t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PCR结果
PCR扩增产物见图1,与空白对照a相比,加入MIAT引物的b、c条带明显,提示ECs中表达LncRNA-MIAT,b与c条带亮度的比较差异不明显,说明当引物浓度增加时,LncRNA-MIAT表达量增加不明显。

图1 聚合酶链反应电泳结果
2.2 TNF-α不同时间与不同浓度刺激ECs后LncRNA-MIAT表达结果(图2)
随着TNF-α刺激时间延长,LncRNA-MIAT表达呈逐渐上升趋势。刺激24 h与0 h、6 h、12 h比较,LncRNA-MIAT表达量增多,差异均具有统计学意义(P均<0.05);刺激48 h与0 h、6 h、12 h比较,LncRNA-MIAT表达量增多,差异均具有统计学意义(P均<0.05)。图2A
随着TNF-α刺激浓度增高,LncRNA-MIAT表达呈逐渐上升趋势。TNF-α刺激浓度1.000 ng/ml与刺激浓度0.000 ng/ml、0.125 ng/ml比较,LncRNA-MIAT表达量均增多,差异具有统计学意义(P均<0.05); TNF-α刺激浓度10.000 ng/ml与刺激浓度0.000 ng/ml、0.125 ng/ml比较,LncRNAMIAT表达量均增多,差异具有统计学意义(P均<0.05)。图2B
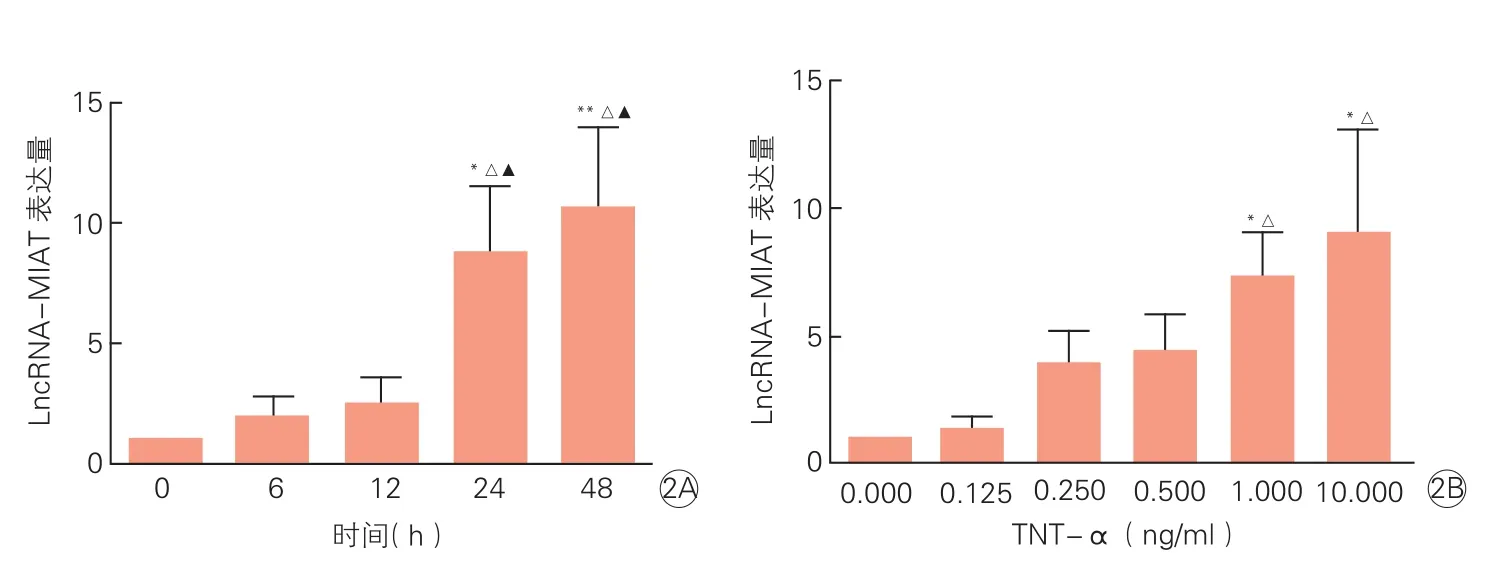
图2 TNF-α不同时间不同浓度刺激后LncRNA-MIAT的表达结果
2.3 qRT-PCR检测siRNAMIAT转染ECs后LncRNA-MIAT表达结果 (图3)
siRNAMIAT转染后培养 48 h与siRNAScramble比较,LncRNA-MIAT表达量显著下降,差异具有统计学意义(P<0.01);siRNAMIAT 转染后培养48 h与siRNAMIAT 24 h相比,LncRNA-MIAT表达量下降,差异具有统计学意义(P<0.05)。
2.4 Western Blot检测ICAM-1结果(图4)
应用浓度为1.000 ng/ml 的TNF-α刺激ECs后,ICAM-1的表达与空白对照(不加TNF-α)相比显著增高,差异有统计学意义(P<0.05)(图4A)。应用siRNAMIAT转染ECs培养48 h后,应用浓度为1.000 ng/ml TNF-α刺激ECs后,与阳性对照(加1.000 ng/ml TNF-α刺激而未经siRNAMIAT转染)相比,ICAM-1表达量被明显抑制,差异有统计学意义(P<0.01);与空白对照相比,差异无统计学意义(P> 0.05)。图4B
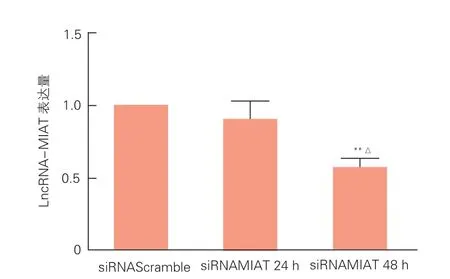
图3 siRNAMIAT转染ECs后LncRNA-MIAT的表达结果

图4 蛋白质免疫印迹法检测ICAM-1的表达结果
3 讨论
近年来,由于LncRNA在人类疾病的多种作用而获得广泛关注[8]。相对于编码蛋白质的基因,LncRNA的表达量不高,但是由于它们在生物过程和人类疾病中所起的重要作用而受到生物学家和临床医生的关注[4]。LncRNA的保守性相较于编码蛋白质的RNA较差,但在其分子内部,却含有较为保守的序列或二级结构,且其表达具有时空特异性,这些现象都提示LncRNA具有重要的生理生化功能。有些LncRNA和信使RNA(mRNA)一样具有5'帽子结构和 PolyA尾结构,通过剪切加工而成熟。在大多数情况下,LncRNA通过不同的作用机制参与表遗传学的调控、转录和转录后调控。同时,LncRNA还可作为小RNA的前体和亚细胞结构的组织框架。特定的LncRNA发生结构突变,引起表达水平及定位的改变,已被证明参与许多疾病的发生发展。本研究中,我们提供了直接证据,LncRNAMIAT参与调节ECs功能和病理变化。
目前,已经发现多种LncRNA参与心血管疾病的发生发展。LncRNA-Bvht可以通过作为心血管调节基因网络中的核心基因调节心血管病的进程[9]。LncRNA-Fendrr通过调节染色质修饰,从而影响心血管系统的发育[10]。血管ECs存在大量LncRNAMalat1,其参与调节一些血管内皮功能,例如细胞迁移和血管侧枝形成[11]。此外一些LncRNA已被证明与血管紧张素II相关性疾病有相关性,这些疾病其中包括冠脉粥样硬化[12]。
血管粥样硬化是心血管疾病的主要病理基础,其起始于ECs的损伤[13],而TNF-α是目前公认的致炎因子之一[14],同样,蛋白ICAM-1也被认为是提示炎症的主要目的蛋白之一[15]。自LncRNAMIAT被发现后,随后的一系列研究发现MIAT通过某些机制参与微血管功能失调的过程[16],而微血管功能失调恰恰是动脉粥样硬化过程中至关重要的因素。此外有研究发现,在神经系统中,LncRNA-神经生长(LncRNA-ND)促进神经祖细胞的分化,并在神经细胞分化过程中起到调节作用[17],而当LncRNA-ND功能失调时可以导致神经细胞功能障碍,甚至影响细胞正常生存[16]。在内分泌系统中,LncRNA-MIAT也参与糖尿病性视网膜病变的病理进程[6,18]。应用siRNA敲低LncRNA-MIAT后,可降低大鼠ECs凋亡、血管通透性增加和减少糖尿病诱导产生的促炎蛋白,从而减轻视网膜血管损伤[6]。
因此本研究首先通过TNF-α对ECs的刺激模拟动脉粥样硬化ECs的炎症损伤,通过Wstern Blot检测确定ICAM-1的表达增加。通过qRTPCR检测ECs中LncRNA-MIAT的表达,结果证实ECs中能够表达LncRNA-MIAT。之后,我们研究了LncRNA-MIAT在TNF-α诱导的血管ECs炎症中的表达及调控作用。结果显示,对于致炎因子TNF-α的刺激,ECs中LncRNA-MIAT的表达是增加的,随着TNF-α的刺激时间延长,LncRNAMIAT的表达趋势是逐渐上升的,而随TNF-α的刺激浓度的升高,LncRNA-MIAT的表达趋势也是逐渐上升的。我们又通过siRNA MIAT敲低LncRNAMIAT来检测ECs中ICAM-1的表达量的变化,发现LncRNA-MIAT敲低后,ICAM-1的表达量较对照明显减少。实验结果提示,LncRNA-MIAT可能参与ECs的炎症进程,并对ECs有促炎作用。
目前,对于LncRNA-MIAT的研究主要集中在神经系统、内分泌系统和心血管系统[4],但研究尚不透彻。而对于LncRNA-MIAT在其他系统中的作用以及其在神经系统、内分泌系统和心血管系统中的研究成果与其它系统相关性尚不明确,因此,尚需要深入细致的研究。本研究结果表明LncRNAMIAT可能参与ECs的炎症反应,丰富了关于LncRNA的研究,并提示LncRNA-MIAT在动脉粥样硬化相关疾病的治疗方面具有潜在的应用价值。
[1] Maier JA. Endothelial cells and magnesium: Implications in atherosclerosis. Clin Sci (Lond), 2012, 122: 397-407.
[2] Birney E, Stamatoyannopoulos JA, Dutta A, et al. Identification and analysis of functional elements in 1% of the human genome by the encode pilot project. Nature, 2007, 447: 799-816.
[3] Kapranov P, Cheng J, Dike S, et al. Rna maps reveal new rna classes and a possible function for pervasive transcription. Science, 2007, 316: 1484-1488.
[4] Boon RA, Jae N, Holdt L, et al. Long noncoding rnas: From clinical genetics to therapeutic targets? J Am Coll Cardiol, 2016, 67: 1214-1226.
[5] 马骏, 黄岚. 长链非编码RNA在心血管系统中的研究进展. 中国循环杂志, 2016, 31: 1248-1250.
[6] Yan B, Yao J, Liu JY, et al. Lncrna-miat regulates microvascular dysfunction by functioning as a competing endogenous rna. Circ Res, 2015, 116: 1143-1156.
[7] Zhang Y, Yang X, Bian F, et al. Tnf-alpha promotes early atherosclerosis by increasing transcytosis of ldl across endothelial cells: Crosstalk between nf-kappab and ppar-gamma. J Mol Cell Cardiol, 2014, 72: 85-94.
[8] Moran VA, Perera RJ, Khalil AM. Emerging functional and mechanistic paradigms of mammalian long non-coding rnas. Nucleic Acids Res, 2012, 40: 6391-6400.
[9] Klattenhoff CA, Scheuermann JC, Surface LE, et al. Braveheart, a long noncoding rna required for cardiovascular lineage commitment. Cell, 2013, 152: 570-583.
[10] Grote P, Wittler L, Hendrix D, et al. The tissue-specific lncrna fendrr is an essential regulator of heart and body wall development in the mouse. Dev Cell, 2013, 24: 206-214.
[11] Michalik KM, You X, Manavski Y, et al. Long noncoding rna malat1 regulates endothelial cell function and vessel growth. Circ Res, 2014, 114: 1389-1397.
[12] Khorkova O, Hsiao J, Wahlestedt C. Basic biology and therapeutic implications of lncrna. Adv Drug Deliv Rev, 2015, 87: 15-24.
[13] Magnani JW, Norby FL, Agarwal SK, et al. Racial differences in atrial fibrillation-related cardiovascular disease and mortality: The atherosclerosis risk in communities (aric) study. JAMA Cardiol, 2016, 61: 433-441.
[14] Gunther C, Martini E, Wittkopf N, et al. Caspase-8 regulates tnfalpha-induced epithelial necroptosis and terminal ileitis. Nature, 2011, 477: 335-339.
[15] Luo Y, Feng J, Xu Q, et al. Nsun2 deficiency protects endothelium from inflammation via mrna methylation of icam-1. Circ Res, 2016, 118: 944-956.
[16] Liao J, He Q, Li M, et al. Lncrna miat: Myocardial infarction associated and more. Gene, 2016, 578: 158-161.
[17] Rani N, Nowakowski TJ, Zhou H, et al. A primate lncrna mediates notch signaling during neuronal development by sequestering mirna. Neuron, 2016, 90: 1174-1188.
[18] Jae N, Dimmeler S. Long noncoding rnas in diabetic retinopathy. Circ Res, 2015, 116: 1104-1106.
Expression and Effect of LncRNA-MIAT in Tumor Necrosis Factor-α Induced Endothelial Cell Inflammation
REN Cheng-long, ZHANG Lu, NING Xian-feng, ZHAO Qing, CAI Shang-lang, ZHANG Wen-zhong.
Department of Cardiology, Qingdao University Affiliated Hospital, Qingdao (266003), Shandong, China
NING Xian-feng, Email: nxf66@163.com
Objective: To observe the expression of long non-coding RNA myocardial infarction associated transcript (LncRNAMIAT) in tumor necrosis factor-α (TNF-α) induced endothelial cells (ECs) inflammation in vitro and to study the impact of LncRNA-MIAT on inflammatory regulation.
Methods: LncRNA-MIAT expression in ECs was induced by TNF-α at different time and concentration. Expressions of intercellular adhesion molecule-1 (ICAM-1) and LncRNA-MIAT in inflammatory ECs were examined by quantitative real time polymerase chain reaction (qRT-PCR) and Western blot analysis. Moreover, ECs was transfected by siRNAMIAT to observe the effect of LncRNA-MIAT knock-down on ICAM-1 expression.
Results: LncRNA-MIAT expression showed the increasing trend by elevated time and concentration of TNF-stimulation. Compared with TNF-α stimulation at 0h, 6h and 12h, LncRNA-MIAT expressions were increased at 24h and 48h of TNF-α stimulation respectively, all P<0.05; compared with TNF-α concentration at 0ng/ml and 0.125ng/ml, LncRNA-MIAT expressions were elevated by TNF-α stimulation at 1.000ng/ml and 10.000ng/ml respectively, all P<0.05. With siRNAMIAT knock-down, TNF-α induced ICAM-1 protein expression was significantly reduced in ECs, P<0.05.
Conclusion: LncRNA-MIAT might be involved in ECs inflammatory response and it may play a role to promote inflammation.
Ribonucleases; Tumor necrosis factor alpha; Cell adhesion molecule-1 (Chinese Circulation Journal, 2017,32:607.)
2016-09-26)
(编辑:常文静)
山东省自然科学基金培养基金项目(ZR2014HP017)
266003 山东省青岛市,青岛大学附属医院 心内科(任成龙、宁险峰、赵青、蔡尚郎、张文忠),中心实验室(张璐)
任成龙 硕士研究生 主要研究方向:冠心病的诊断与治疗 Email:17614494@qq.com 通讯作者:宁险峰 Email:nxf66@163.com*为共同第一作者
R54
A
1000-3614(2017)06-0607-05
10.3969/j.issn.1000-3614.2017.06.018

