羟喜树碱通过诱导自噬抗宫颈癌的机制研究
陈干涛 董卫国
·基础研究·
羟喜树碱通过诱导自噬抗宫颈癌的机制研究
陈干涛 董卫国
目的 探讨抗肿瘤药物羟喜树碱(HCPT)对宫颈癌HeLa 细胞作用的机制。方法 CCK8检测Hela细胞增殖,Western blot检测自噬和凋亡相关蛋白的表达,GFP-LC3 shRNA转染和Hoechst染色后,荧光显微镜下观察细胞自噬特异小体量的改变以及凋亡形态学的变化。结果 HCPT抑制Hela细胞生长呈浓度依赖性(P<0.05),IC503 μmol/L HCPT作用Hela细胞后,自噬相关蛋白Beclin1、p62的表达以及LC3-Ⅱ/LC3-Ⅰ比值发生改变,差异有显著性意义(P均<0.05); 凋亡相关蛋白Bax 、cleaved caspase-3、Bcl-2表达也发生明显改变(P均<0.05);荧光显微镜下观察Hela细胞带有GFP-LC3的自噬体增加,凋亡细胞也增多(P均<0.05)。结论 HCPT能够诱导HeLa 细胞中自噬相关基因Beclin1、p62以及LC3 的表达增强,从而激活细胞自噬发生; 且HCPT能够激活宫颈癌HeLa细胞发生自噬,进而诱导细胞凋亡来达到抗肿瘤目的。
羟喜树碱;宫颈癌;自噬;凋亡
(ThePracticalJournalofCancer,2017,32:349~353)
宫颈癌(cervical cancer)是影响女性健康最常见的恶性肿瘤之一。是女性生殖道最常见的恶性肿瘤,发病率和病死率一直居高不下[1],因此,寻求相应药物进一步提高宫颈癌的治疗效果具有重要的临床意义,深入研究相关药物治疗宫颈癌及其细胞分子机制成为妇科肿瘤领域的研究重点。
自噬是真核细胞的1种非细胞凋亡性程序性死亡,又被称为Ⅱ型程序性细胞死亡。在生物的生长、发育、疾病发生过程中均有重要作用。营养缺乏、内质网应激、氧化应激、细胞器损伤以及细胞死亡都可以激活自噬信号通路[2-3]。近年来研究发现,自噬在神经退行性疾病、感染性疾病及肿瘤发生中扮演着重要作用。因此自噬现象可能成为包括宫颈癌在内的肿瘤药物治疗的新靶点[4]。
羟喜树碱(hydroxycamptothecin,HCPT)是唯一有选择性抑制DNA Topo I作用的植物类特异性肿瘤化学治疗药物,能够阻滞细胞于S期,目前在临床上已广泛应用,不良反应较小,在胃癌、肝癌、头颈癌及白血病等恶性肿瘤的治疗上已取得令人瞩目的成就[5],因此有望成为治疗宫颈癌的又一“锐利武器”;但有关其在治疗宫颈癌中的作用机制鲜有报道,本实验旨在研究HCPT对宫颈癌代表细胞株-HeLa细胞在自噬方面的影响,从细胞信号传导通路的角度探讨其作用机制。
1 材料与方法
1.1 材料
人宫颈癌细胞系HeLa细胞购自中国科学院上海细胞库;羟基喜树碱(HCPT)购自美国Santa Cruz公司;RPMI 1640细胞培养液及胎牛血清购自美国Life Technologies公司;GFP-LC3质粒由南京医科大学基础医学院惠赠。Beclin-1,p62,LC-3B,GAPDH等抗体购自美国Santa Cruz公司;Bax,Bcl-2,cleaved caspase3抗体购自英国Abcam公司。
1.2 方法
1.2.1 细胞计数法检测细胞活力 采用细胞活力检测试剂盒(cell counting kit-8,CCK8)法检测细胞活力。以5 000个/孔的密度将HeLa接种于96孔培养板中,12 h后,分别加入1、2、4、6、8、10 μmol/L羟喜树碱(用0.9%氯化钠溶液溶解),每浓度组设6个复孔,同时设立0.9%氯化钠溶液作为阴性对照;置于37 ℃培养箱中继续培养24 h。24 h后每孔加入10 μl的CCK-8溶液,放置37 ℃培养箱继续培养2 h,应用ELX-800型酶标仪(美国Bio-Tek公司)测定各孔450 nm处的吸光度(a)值。细胞抑制率(%)=1-(用药组a值/对照组a值)×100%。通过拟合函数曲线计算药物处理的半数抑制浓度即IC50。
1.2.2 Western blot法检测自噬与凋亡相关蛋白表达 将HeLa细胞均匀接种于60 mm培养皿中,药物处理后用预冷的PBS洗3遍,加入含有100 mmol/L PMSF的裂解液(RIPA)裂解细胞,冰上放置30 min充分裂解,4 ℃条件下12 000 r/min离心15 min,取上清液后经BCA法测定蛋白浓度。依次进行质量分数10%SDS-PAGE凝胶电泳,使用PVDF转膜,5%脱脂奶粉封闭2 h后,4 ℃封闭一抗过夜,TBST清洗3次(每次5 min)后加入相应二抗,室温下孵育60 min,TBST洗3次后进行显影,实验重复3次,采用计算机软件ImageJ分析灰度值并记录。
1.2.3 细胞凋亡形态学变化的观察 将HeLa细胞接种于六孔板中,每孔1×106,培养过夜,加入相应的药物分别处理12和24 h,同时设立对照组;细胞经PBS清洗3遍,4%多聚甲醛固定15 min,加入Hoechst33342(杭州碧云天生物科技有限公司)避光孵育10 min,PBS清洗3遍后,在荧光显微镜(日本Olympus公司)下观察细胞核形态并统计记录。
1.2.4 细胞自噬率检测 将HeLa细胞接种到6孔板内,培养过夜,使细胞密度达到60%~70%。通过Lipofectamine 2000(美国Life Technologies)转染GFP-LC3质粒体,6 h后换完全培养基继续培养24 h。之后加入羟基喜树碱分别作用12 h和24 h,PBS清洗3次,用4%多聚甲醛室温固定15 min,PBS清洗3次,荧光显微镜下观察对GFP-LC3的阳性自噬点数进行统计,统计对照组和处理组中单个细胞中GFP-LC3点荧光数,每组至少统计25个细胞。
1.3 统计学方法
2 结果
2.1 HCPT对HeLa细胞具有毒性作用
不同浓度的HCPT作用于HeLa细胞,结果表明,HCPT对细胞具有明显的生长抑制作用(P=0.034),见图1。其IC50约为3 μmol/L。本实验选取IC50即3 μmol/L浓度的HCPT探究其作用机制。

图1 不同浓度HCPT对HeLa细胞的生长抑制作用
2.2 HCPT能够诱导HeLa细胞自噬蛋白表达变化
给予HeLa细胞以3 μmol/L浓度的HCPT分别处理12 h和24 h,通过western blot检测显示,随着HCPT作用后,自噬标记蛋白Beclin1表达量增加,而自噬底物标记蛋白p62出现降解,作为自噬发生指标的LC3-Ⅱ/LC3-Ⅰ比值也同样表现出上升,差异有统计学意义(P值分别为0.0087和0.009),见图2。Western blot结果表明,HCPT能够引起HeLa细胞自噬,并随药物作用时间的延长自噬水平也出现升高。

注:A为Western blot检测结果;B为Hela细胞中自噬蛋白的表达情况。
2.3 HCPT引起HeLa细胞中GFP-LC3点状分布增加
GFP-LC3目前被认为是自噬体特异性标签。是1种检测自噬发生常用的实验技术手段,将HeLa细胞转染GFP-LC3后,用HCPT分别处理12 h和24 h,在荧光显微镜下观察并对带有GFP-LC3的自噬点阳性细胞数和总细胞数进行统计,见图3A。相对于对照组的细胞,HCPT能够明显增加细胞自噬体的数量(P值分别为0.018和0.008),见图3B。进一步证明了HCPT可以诱发HeLa细胞自噬发生。
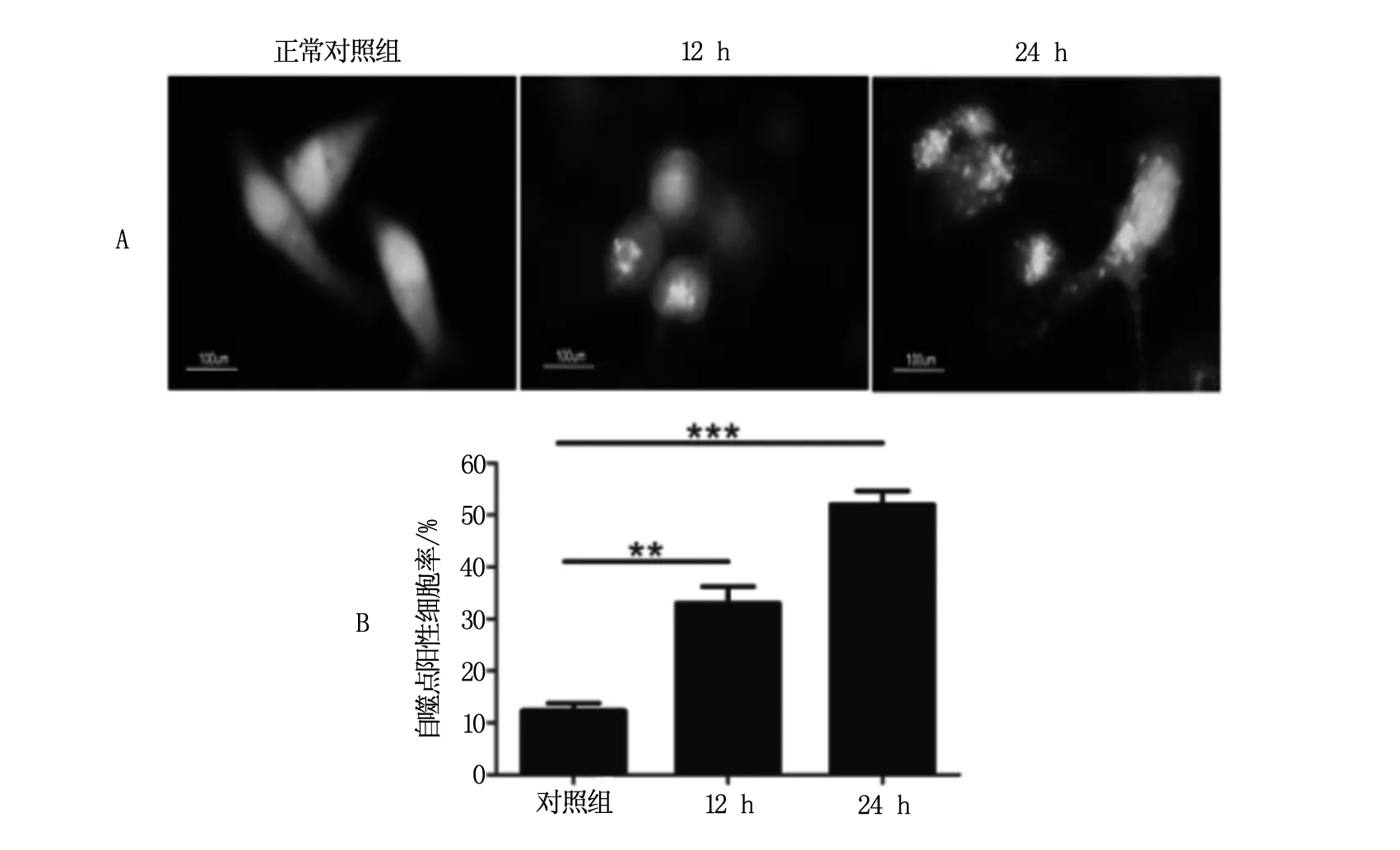
注:A为荧光显微镜观察HeLa细胞中GFP-LC3标记的自噬点;B为GFP-LC3标记的自噬点Hela细胞的阳性率。
2.4 HCPT诱导HeLa细胞凋亡的形态变化
给予HeLa细胞以3 μmol/L浓度的HCPT分别处理12 h和24 h,经过固定,Hoechst33342染色,在荧光显微镜下观察发现,相对于对照组,24 h处理组细胞出现细胞核皱缩,染色加深等凋亡形态,而12 h小时组并未出现明显细胞核变化,见图4A。3 μmol/L 的HCPT在处理24 h细胞后可引发细胞凋亡(P=0.006),而12小时作用并不明显(P=0.079),见图4B。提示HCPT引发的细胞凋亡是在细胞出现自噬后所引起的。
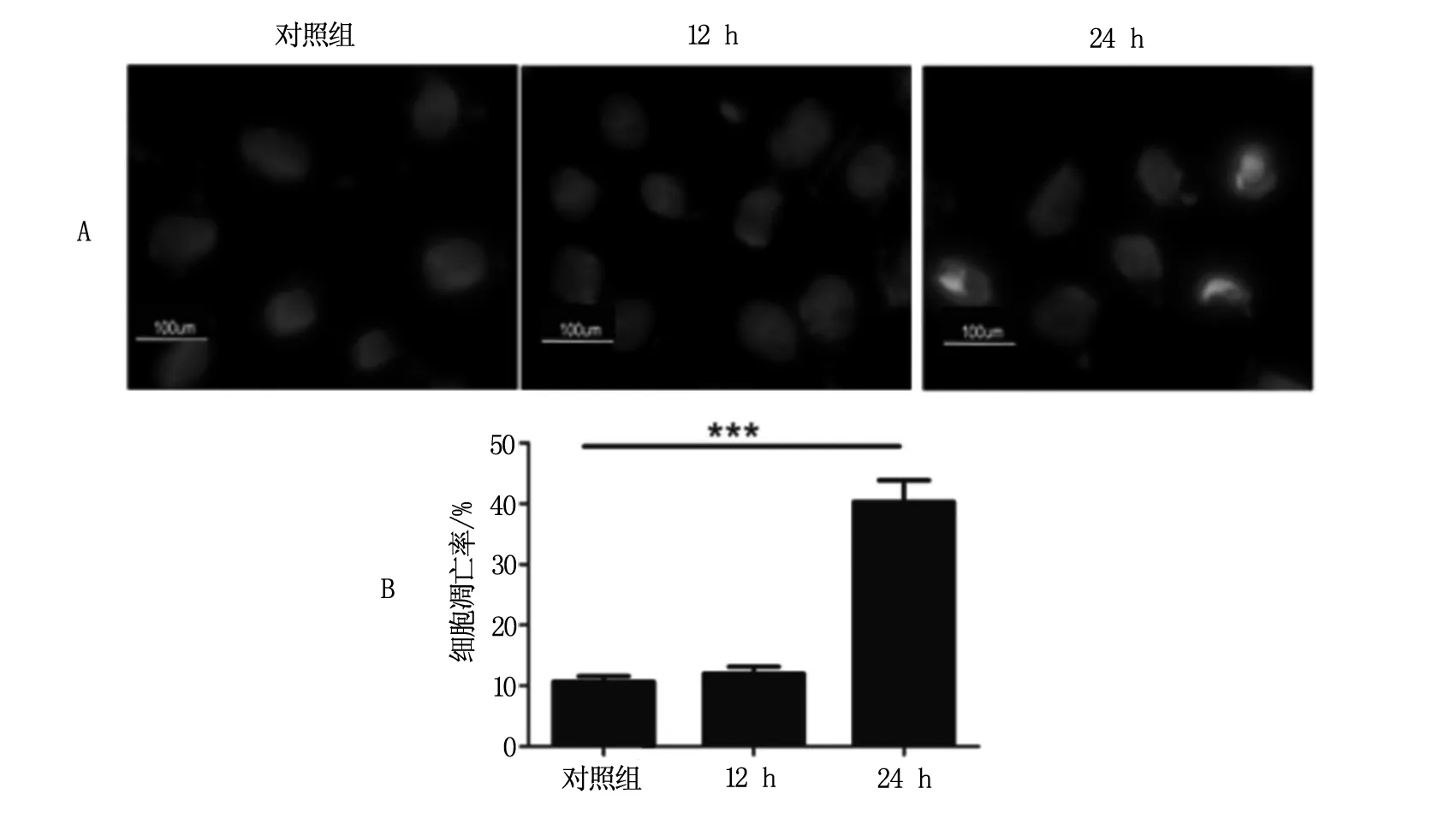
注:A为荧光显微镜观察Hela细胞凋亡情况;B为不同组Hela细胞凋亡率。
2.5 HCPT诱导HeLa细胞凋亡相关蛋白变化
为进一步证实HCPT所引发的细胞凋亡现象,通过Western blot方法检测了细胞凋亡相关蛋白的变化。在细胞处理24 h组中,细胞凋亡相关蛋白Bax的表达量上升(P=0.025),cleaved Caspase-3的表达量也增加,抗凋亡蛋白Bcl-2表达出现下降(P=0.018 )。而在12 h处理组中,上述蛋白并未出现明显变化,见图5A~5B。Western blot结果进一步证实了HCPT引发的细胞凋亡是跟随细胞自噬发生后出现的。

注:A为Western blot 检测结果;B为抗凋亡蛋白Bcl-2的表达情况;C为凋亡相关蛋白Bax的表达情况。
3 讨论
羟喜树碱是从我国特有的珙垌科植物喜树中分离提取出的五环生物碱,是唯一具有选择性抑制DNA Topo I作用的植物类抗肿瘤药,目前已广泛应用于临床。近来国内外已进行大量的研究发现羟喜树碱作用稳定且不良反应小,可有效诱导多种肿瘤细胞和部分非肿瘤细胞的凋亡[6]。宫颈癌发病率高,目前临床治疗效果较好,但最近几年治疗方法上没有突破,处于瓶颈期。因此,追寻新的方法来提高宫颈癌的治疗效果迫在眉睫[7]。
在本实验研究中,通过Western blot和GFP-LC3 shRNA转染细胞等检测方法,首次发现HCPT作用于HeLa细胞后能够引发自噬,并且随着作用时间的延长,其自噬水平成增强趋势。本实验所选取的自噬指标蛋白中,微管相关蛋白1轻链3(microtubule-associated protein 1light chain 3,LC 3)是目前研究较多的自噬标志性物质,其定位于前自噬泡和自噬泡膜表面,参与自噬体的形成,被认为是自噬特异性形成指标[8];而另一种蛋白-Beclin1是哺乳动物的自噬调控基因,是自噬发生的触发器,其表达的上调可诱导自噬的形成,两种自噬指示蛋白在HCPT的作用下,均出现表达量增加[3]。一些研究发现,在宫颈癌的发生发展中,自噬相关蛋白的表达被抑制,从而下调了自噬的形成,造成肿瘤的不断生长,另外,也有研究发现,当自噬相关蛋白过表达后,宫颈癌细胞的生长会受到明显抑制[9-10],因此,通过诱导自噬形成有可能成为未来宫颈癌治疗的策略之一。
同时,除了能够增加细胞的自噬外,我们通过Western blot以及Hoechst染色也证实了HCPT还可以引起细胞凋亡,并且凋亡现象出现在自噬发生之后,说明HCPT作用于细胞后,首先引起细胞自噬水平的升高,进而触发细胞凋亡信号的启动,最终导致肿瘤细胞死亡,达到抗肿瘤的目的。
很多研究发现,自噬与凋亡的机制之间关系复杂,存在着许多重叠的部分。一些观点则认为自噬是凋亡必需的,当自噬受到抑制时会延缓凋亡的发生,而自噬水平的升高往往会导致细胞凋亡通路的激活。本实验的研究证实,在宫颈癌细胞中,HCPT的抗肿瘤的机制是首先通过激活细胞自噬,进而触发细胞凋亡,从而达到其抗肿瘤的目的,这提示自噬和凋亡程序密不可分。同样,其他类似的研究也发现,顺铂作用HeLa细胞后,自噬小体形成数增加,自噬蛋白Beclin1和LC3表达量也增加,同时激活了内质网应激通路,表明内质网应激—自噬反应参与了顺铂对宫颈癌细胞的细胞毒性作用[11-12]。由于自噬与凋亡之间仍然存在着很多不明之处,因此,仍需要今后进行大量、细致的研究来探讨。
而自噬是维持细胞稳态的重要通路,在疾病中的作用逐步得到认同。我们的研究首次表明了HCPT在抗宫颈癌发生过程中的机制问题,是通过激活细胞自噬(还有可能是通过激活自噬诱导宫颈癌细胞凋亡)从而抑制宫颈癌细胞的生长,最终导致细胞死亡,为HCPT在治疗宫颈癌方面提供了理论基础,也为开发类似药物提供了新的思路。
[1] Alberts DS,Blessing JA,Landrum LM,et al.Phase II trial of nab-paclitaxel in the treatment of recurrent or persistent advanced cervix cancer:A gynecologic oncology group study〔J〕.Gynecol Oncol,2012,127(3):451-455.
[2] 赵 坤,叶小鸣.自噬在肝细胞癌中的研究进展〔J〕.中华肝脏外科手术学电子杂志,2015,4(1):57-59.
[3] 梁建锋,王 成,翁军权,等.微小RNA-30a靶向Beclin1抑制舌鳞状细胞癌细胞自噬活性的研究〔J〕.中华口腔医学研究杂志(电子版),2015,9(2):95-99.
[4] Chaurasia M,Bhatt AN,Das A,et al.Radiation-induced autophagy:mechanisms and consequences 〔J〕.Free Radic Res,2016,50(3):273-290.
[5] Bian Z,Yu Y,Quan C.RPL13A as a reference gene for normalizing mRNA transcription of ovariancancer cells with paclitaxel and 10-hydroxycamptothecin treatments〔J〕.Mol Med Rep,2015,11(4):3188-3194.
[6] Kai GY,Wu C,Gen LY,et al.Biosynthesis and biotechnological production of anti-cancer drug Camptothecin〔J〕.Phytochem Rev,2015,14(3):525-539.
[7] 闫 蓓,杨黎明,杨 琛,等.上海市浦东新区2002-2010年宫颈癌流行状况及生存分析〔J〕.中国慢性病预防与控制,2014,22(4):506-508.
[8] Ramachandran G,Gade P,Tsai P,et al.Potential role of autophagy in the bactericidal activity of human PMNs for Bacillus anthracis〔J〕.Pathog Dis,2015,73(9):ftv080.
[9] Sánchez-Sánchez L,Escobar ML,Sandoval Ramírez J,et al.Apoptotic and autophagic cell death induced by glucolaxogenin in cervical cancer cells〔J〕.Apoptosis,2015,20(12):1623-1635.
[10] Zhu WP,Pan XH,Li F,et al.Expression of Beclin 1 and LC3 in FIGO stage Ⅰ-Ⅱ cervical squamous cell carcinoma and relationship to survival 〔J〕.Tumour Biol,2012,33,(5):1653-1659.
[11] Xu L,Liu JH,Zhang J,et al.Blockade of Autophagy Aggravates Endoplasmic Reticulum Stress and Improves Paclitaxel Cytotoxicity in Human Cervical Cancer Cells〔J〕.Cancer Res Treat,2015,47(2):313-321.
[12] 李 欢,管福琴,陈 雨,等.积雪草酸通过改变自噬作用促进胶质瘤细胞T98G凋亡的实验研究〔J〕.中国药理学通报,2015,31(10):1363-1368.
(编辑:吴小红)
Antitumor Mechanism of Hydroxycamptothecin on Cervical Cancer byInducing Cell Autophagy
CHEN Gantao,DONG Weiguo.
Renmin Hospital of Wuhan University,Wuhan 430062
Objective To investigate the antineoplastic mechanism of hydroxycamptothecin (HCPT) on cervical cancer HeLa cell line.Methods CCK8,western blot and fluorescence microscopy were used to detect cellular morphology,autophagy-related proteins and apoptosis-related proteins and the volume and shape of autophagosome after the Hela cell was treated with HCPT,and being transfected with GFP-LC3 shRNA and stained by Hoechst.Results HCPT inhibited the growth of Hela cells in a concentration-dependent manner (P<0.05) with IC503μmol/L.After 3μmol/L HCPT being used on Hela cells,the expression of autophagy-related proteins Beclin1 and p62 were heighten obviously and LC3-Ⅱ/LC3-Ⅰ ratio was changed apparently(P<0.05).The expression of apoptosis-related proteins Bax,cleaved caspase-3 and Bcl-2 were also varied significantly (P<0.05).HeLa cells with GFP-LC3 showed an increase of autophagy and apoptotic cells observed by fluorescence microscopy(P<0.05).Conclusion HCPT could induce the expression of autophagy-related genes Beclin1,p62 and LC3,thereby to activate cellular autophagy and apoptosis.Besides,HCPT could activate the autophagy in cervical cancer HeLa cells,thereby inducing the apoptosis to achieve the purpose of anti-tumor.
Hydroxycamptothecin(HCPT);Cervical cancer;Autophagy;Apoptosis
湖北省卫生厅项目(编号:2012Z-Y02);湖北省卫计委一般面上项目(编号:WJ2015MB084)
430060 武汉大学人民医院(陈干涛,董卫国);433000 湖北省仙桃市第三人民医院(陈干涛)
董卫国
10.3969/j.issn.1001-5930.2017.03.001
R737.33
A
1001-5930(2017)03-0349-05
2016-05-04
2016-11-15)

