CD4+CD25+调节性T 细胞对晚期肺癌患者免疫抑制作用的研究
程小珍 谢宗宙 崔荣花 张曙波 毛山山 王美清
CD4+CD25+调节性T 细胞对晚期肺癌患者免疫抑制作用的研究
程小珍 谢宗宙 崔荣花 张曙波 毛山山 王美清
目的 探讨Treg及Th1/Th2类细胞因子在晚期肺癌肿瘤免疫抑制中的作用。方法 选取100例初治晚期肺癌患者及50例健康自愿者。采用流式细胞术检测其外周血中Treg、Th1类细胞因子(IFN-γ、IL-2、TNF-a)、Th2类细胞因子(IL-4、IL-6、IL-10)水平,同时分析CD4+CD25+Treg与Th1/Th2类细胞因子之间的相关性。结果 ①晚期肺癌患者外周血中Treg为(11.12±5.83)%,高于健康对照组(7.46±3.07)%,差异有统计学意义(P=0.003);②化疗前肺癌患者外周血中Treg为(11.12±5.83)%,明显高于化疗后(6.45±3.74)%,差异有统计学意义(P<0.001);③晚期肺癌患者与正常对照组Th1/Th2类细胞因子水平分别为:IFN-γ(8.56±3.62 vs 10.79±3.27,P=0.049)、IL-2(8.48±2.87 vs 10.22±4.03,P=0.03)、TNF-a(6.18±2.67vs8.14±2.87,P=0.007)、IFN-γ/IL-4(3.33±1.44 vs 4.09±1.00,P=0.028)、IL-4(3.17±1.19 vs 2.45±0.43,P<0.001)、IL-6(3.88±2.08 vs 2.33±0.88,P<0.001)、IL-10(3.64±1.73 vs 2.54±1.08,P=0.008),其中Th2类因子水平明显升高,差异有统计学意义(P均<0.05);④CD4+CD25+Treg与Th1类细胞因子IFN-γ、TNF-a、IL-2及IL-6无相关性(P均>0.05);与Th1/Th2(γ=-0.273,P=0.003)呈负相关;与Th2类细胞因子IL-4(γ=0.237,P=0.009)、IL-10(0.626,P<0.001)呈正相关(P均<0.05)。结论 晚期肺癌患者CD4+CD25+Treg、Th2类细胞因子水平显著升高,Th1类细胞因子水平下降,它们共同导致肿瘤患者免疫抑制及肿瘤进展,监测其水平变化有助于判断肺癌患者疗效、预后,有效调控CD4+CD25+Treg及负性细胞因子水平可能是治疗肺癌的一个新策略。
肺癌;CD4+CD25+调节性T细胞;Th1/Th2类细胞因子;免疫抑制
(ThePracticalJournalofCancer,2017,32:378~381)
体内外研究表明,随着肿瘤的发生、发展,大多数恶性肿瘤患者都伴随着机体免疫功能失调。肿瘤细胞逃避机体免疫监视与肿瘤细胞本身及宿主免疫系统两方面有关,如肿瘤细胞缺乏共刺激分子诱导T细胞耐受、肿瘤细胞表达共抑制分子PD-L1[1-2]、肿瘤细胞释放免疫抑制因子TGF-β及IL-10增加等[3]、肿瘤细胞抗原性差、主要组织相容性复合物表达下调、宿主体内免疫抑制细胞数量及功能增强等。
近年来,越来越多的研究发现免疫抑制细胞及免疫抑制因子,如CD4+CD25+调节性T细胞、Th1/Th2类细胞因子在肿瘤免疫抑制中的重要作用。多种恶性肿瘤,如肝癌[4]、急性淋巴细胞白血病[5]、胃癌[6]、肾癌[7]等患者外周血中可检测到CD4+CD25+调节性T细胞升高,且CD4+CD25+调节性T细胞水平与肿瘤患者不良预后[8-10]有关。但CD4+CD25+调节性T细胞作用机制尚不明确,目前研究表明其与细胞因子关系密切,动物实验[11]发现去除Treg后,IL-10、TGF-β水平下降;通过联合吉西他滨化疗及CIK免疫治疗后,荷瘤裸鼠体内细胞因子IL-10、TGF-β、及IFN-γ水平下降明显。
本研究采用流式细胞仪来检测肺癌及健康对照组外周血CD4+CD25+调节性T细胞以及细胞内细胞因子IFN-γ、IL-2、TNF-a、IL-4、IL-6、IL-10水平变化,并分析CD4+CD25+调节性T细胞与细胞因子的相关性,探讨Treg及细胞因子与晚期肺癌患者免疫抑制的关系。
1 材料与方法
1.1 实验对象
选取Ⅲ~Ⅳ期的初治肺癌患者100例,所有患者均经细胞学或病理组织学证实为肺癌,既往均无免疫性疾病及使用免疫抑制剂病史。肺癌患者中男性82例,女性18 例,年龄为35~70岁,中位年龄58岁;TNM分期为Ⅲ期47例,Ⅳ期53例,其中鳞癌34例,腺癌36例,小细胞癌25例,其他5例;高分化31例,中分化33例,低分化36例。选取同期的健康体检者50例为正常对照组,其中男性39例,女性11例,年龄为34~69岁,中位年龄59岁。所有肺癌患者均采用含顺铂两药联合方案化疗,化疗前及化疗结束后1周采集外周静脉血。
1.2 主要实验试剂及仪器
单克隆抗体使用美国BD公司生产的FITC标记的鼠抗人CD4、IFN-γ、IL-2抗体,PE标记的鼠抗人抗CD25、IL-4、IL-6、IL-10、TNF-a抗体,及同型对照抗体。采用美国BD公司的FACSCanto流式细胞仪进行细胞检测。
1.3 实验方法
1.3.1 CD4+CD25+Treg检测 于清晨空腹抽取EDTA抗凝外周血5 ml。吸取100 μl EDTA抗凝的外周血至样品测定管中,加入10 μl FITC标记的鼠抗人CD4及PE标记的鼠抗人抗CD25单克隆抗体,震荡混匀后在室温下孵育20 min,然后加入1 ml红细胞裂解液,离心、弃上清,PBS洗2次,2 h内用FACS Canto流式细胞仪(美国BD公司)检测。
1.3.2 细胞内细胞因子的流式细胞仪检测 采用密度梯度离心法分离外周血淋巴细胞,用RPMI 1640培养液稀释为1×106细胞/ml备用。取1 ml淋巴细胞悬液置于24孔培养板,各加入10 μl佛波酯、离子霉素、莫能霉素刺激细胞,用500 μl冻固定液(4 ℃)固定细胞(4 ℃冰箱过夜)。取100 μl细胞悬液,加20 μl抗CD4-FITC进行细胞表面抗原染色。然后以1.5 ml打孔液进行细胞打孔,最后各加入10 μl抗IFN-γ-FITC、抗IL-2-FITC、抗TNF-a-PE、抗IL-4-PE、抗IL-6-PE、抗IL-10-PE,并设一管阴性对照,2 h内上流式细胞仪分析。
1.4 统计学分析
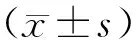
2 结果
2.1 实验组和对照组外周血CD4+CD25+Treg比例
100例晚期肺癌患者外周血中CD4+CD25+Treg水平为(11.12±5.83)%,明显高于50例健康对照组的CD4+CD25+Treg水平[(7.46±3.07)%],差异有统计学意义(P=0.003)。
2.2 晚期肺癌患者化疗前后外周血CD4+CD25+Treg比例
晚期肺癌患者化疗前外周血CD4+CD25+Treg水平为(11.12±5.83)%,明显高于化疗后1周CD4+CD25+Treg水平[(6.45±3.74)%],差异有统计学意义(P<0.001)。
2.3 晚期肺癌患者与健康对照组Th1/Th2类细胞因子水平比较
晚期肺癌患者Th1类细胞因子IFN-γ、IL-2、TNF-a水平下降,差异有统计学意义(P<0.05);Th2类细胞因子IL-4、IL-6、IL-10水平明显升高,差异有统计学意义(P<0.05),见表1。
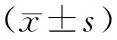
表1 晚期肺癌患者与健康对照组Th1/Th2类细胞因子水平比较
2.4 CD4+CD25+Treg水平与外周血Th1/Th2类细胞因子的关系
CD4+CD25+Treg与Th1类细胞因子IFN-γ、TNF-a、IL-2及IL-6无相关性(P均>0.05);与Th1/Th2(γ=-0.273,P=0.003)呈负相关;与Th2类细胞因子IL-4(γ=0.237,P=0.009)、IL-10(γ=0.626,P<0.001)呈正相关(P均<0.05)。
3 讨论
以往基础及临床研究发现,肿瘤的发生、发展与免疫抑制性细胞CD4+CD25+Treg关系密切,在多种恶性肿瘤患者的组织标本和外周血中均可检测到其水平升高。Yamamoto等[12]报道在胰腺癌患者外周血中Treg比例低于正常对照组,手术可切除的患者Treg水平低于未能手术切除的患者。在非小细胞肺癌[3]、肝癌[4]患者研究中也发现Treg数量和比例的升高,提示肿瘤细胞可能通过分泌趋化因子促进Treg细胞的增殖与分化,但目前尚未见相关研究报导。本研究同样发现晚期肺癌患者CD4+CD25+Treg的比例显著高于健康体检者,表明肿瘤患者CD4+CD25+调节性T细胞是晚期肺癌患者免疫抑制及肿瘤进展的原因之一。本研究还发现化疗后Treg水平下降,提示可能化疗后患者体内肿瘤负荷减少,肿瘤细胞分泌的对Treg趋化作用的因子减少,导致Treg水平下降。以上实验结果表明CD4+CD25+调节性T细胞比例可能是一个较好的反映细胞免疫功能状态的指标,在肺癌治疗的不同阶段,监测其水平变化有助于判断肺癌患者的疗效和预后。
体外细胞及动物实验研究发现,Treg可以抑制CD8+T细胞的增殖和活性,抑制CD4+T细胞的辅助性作用,抑制细胞因子IL-2、IFN-γ的产生,降低免疫细胞对肿瘤细胞的免疫应答。Zhou等[13]在小鼠肝癌模型中发现,用CCL21联合抗CD25单抗处理小鼠后,可增强抗肿瘤免疫及延长生存期,不仅能抑制肿瘤血管和细胞增殖,而且可导致肿瘤内CD4+T、CD8+T和CD11c+DC数量增加,同时显著诱导局部肿瘤位点处的肿瘤特异性CD8+细胞毒性T细胞;肿瘤内免疫应答伴有IL-12和IFN-γ的增加,但免疫抑制介质IL-10和TGF-β1的释放减少。本研究还发现,晚期肺癌患者外周血中Th1类细胞因子IFN-γ、IL-2、TNF-a水平下降,差异有统计学意义(P<0.05);Th2类因子IL-4、IL-6、IL-10水平明显升高,差异有统计学意义(P<0.05),且CD4+CD25+调节性T细胞与IL-4、IL-10呈正相关;与Th1/Th2负相关;与IL-2、IL-6、IFN-γ、TNF-y均无明显相关性。以上实验结果表明,CD4+CD25+Treg在体内微环境中的抑制作用与IL-4、IL-10、Th1/Th2比例有关,而非与某一独立的因素直线相关,IL-4、IL-10水平越高,Th1/Th2比值越低,其作用越强,免疫抑制细胞及免疫抑制因子相互作用,共同促进肿瘤进展。
总之,通过研究我们发现晚期肺癌患者外周血CD4+CD25+调节性T细胞水平升高,随着肿瘤负荷的减少其水平有下降的趋势;并且肿瘤患者免疫抑制作用与肿瘤微环境中的Th1/Th2比例及负性细胞因子IL-4、IL-10有关,它们可能可以协同促进肿瘤进展,但仍需更多的实验研究来证实其具体作用的分子机制。在肺癌患者治疗的不同阶段,定期的监测其外周血中Treg及细胞因子水平有助于判断肺癌患者荷瘤状态及疗效评估。采用有效措施来调节肿瘤微环境中Treg细胞数量及功能以及联合使用抗体调节Th1/Th2类细胞因子的水平,可能可以增强肺癌患者的疗效,这也是未来肿瘤免疫治疗的一个方向。
[1] Pan ZK,Ye F,Wu X,et al.Clinicopathological and prognostic significance of programmed cell death ligand1 (PD-L1) expression in patients with non-small cell lung cancer:a meta-analysis〔J〕.J Thorac Dis,2015,7(3):462-470.
[2] Gu X,Gao XS,Xiong W,et al.Increased programmed death ligand-1 expression predicts poor prognosis in hepatocellular carcinoma patients〔J〕.Onco Targets Ther,2016,9:4805-4813.
[3] Wei T,Zhang J,Qin Y,et al.Increased expression of immunosuppressive molecules on intratumoral and circulating regulatory T cells in non-small-cell lung cancer patients〔J〕.Am J Cancer Res,2015,5(7):2190-2201.
[4] Liao J,Xiao J,Zhou Y,et al.Effect of transcatheter arterial chemoembolization on cellular immune function and regulatory T cells in patients with hepatocellular carcinoma〔J〕.Mol Med Rep,2015,12(4):6065-6071.
[5] Idris SZ,Hassan N,Lee LJ,et al.Increased regulatory T cells in acute lymphoblastic leukaemia patients〔J〕.Hematology,2016,21(4):206-212.
[6] Chen SL,Cai SR,Zhang XH,et al.Expression of CD4+CD25+regulatory T cells and Foxp3 in peripheral blood of patients with gastric carcinoma〔J〕.J Biol Regul Homeost Agents,2016,30(1):197-204.
[7] Zhang CH,Huang Y.Effect of Peripheral Blood CD4+CD2 5+Regulatory T Cell on Postoperative Immunotherapy for Patients with Renal Carcinoma〔J〕.Asian Pac J Cancer Prev,2016,17(4):2027-2030.
[8] Shao B,Li HP,DI LJ,et al.Predictive and prognostic value of monitoring lymphocyte subsets in peripheral blood before and after chemotherapy in patients with metastatic breast cancer〔J〕.Beijing Da Xue Xue Bao,2016,48(2):304-309.
[9] Chang C,Wu SY,Kang YW,et al.High levels of regulatory T cells in blood are a poor prognostic factor in patients with diffuse large B-cell lymphoma〔J〕.Am J Clin Pathol,2015,144(6):935-944.
[10] Chen X,Du Y,Lin X,et al.CD4+CD25+regulatory T cells in tumor immunity〔J〕.Int Immunopharmacol,2016,34:244-249.
[11] Zhao P,Zhu D,Zhang Z,et al.Gemcitabine treatment enhanced the anti-tumor effect of cytokine induced killer cells by depletion of CD4+CD25bri regulatory T cells〔J〕.Immunol Lett,2017,181:36-44.
[12] Yamamoto T,Yanagimoto H,Satoi S,et al.Circulating CD- 4+CD25+regulatory T cells in patients with pancreatic cancer〔J〕.Pancreas,2012,41(3):409-415.
[13] Zhou S,Chen L,Qin J,et al.Depletion of CD4+CD25+regulatory T cells promotes CCL21-mediated antitumor immunity〔J〕.PLoS One,2013,8(9):e73952.
(编辑:吴小红)
Study of the Immunosuppressive Effect of CD4+CD25+Regulatory T Cells on Patients with Advanced Lung Cancer
CHENG Xiaozhen,XIE Zongzhou,CUI Ronghua,et al.
Central South University Xiangya School of Medicine Affiliated Haikou Hospital/Haikou People’s Hospital,Haikou,570208
Objective To explore the role of CD4+CD25+regulatory T cells and Th1 and Th2 cytokines in tumor immunosuppression of advanced lung cancer patients.Methods The blood samples of 100 patients with lung cancer and 50 healthy volunteers were collected,and the levels of CD4+CD25+regulatory T cells and Th1and Th2 cytokines in peripheral blood were determined by flow cytometry.The correlation of CD4+CD25+regulatory T cells and Th1 and Th2 cytokines was analyzed.Results
①The proportion of Treg was significantly higher in advanced lung cancer patients(11.12±5.83)% than in healthy donors (7.46±3.07)% (P=0.003);②The proportion of Treg was lower in advanced lung cancer patients treated with chemotherapy(6.45±3.74)% compared to those patients without chemotherapy(11.12±5.83)% (P<0.001);③ The level of Th1 and Th2 cytokines in advanced lung cancer patients and normal controls were:IFN-γ(8.56±3.62 vs 10.79±3.27,P=0.049)、IL-2(8.48±2.87vs10.22±4.03,P=0.03)、TNF-a(6.18±2.67vs8.14±2.87,P=0.007)、IFN-γ/ IL-4(3.33±1.44vs4.09±1.00,P=0.028)、IL-4(3.17±1.19vs2.45±0.43,P<0.001)、IL-6(3.88±2.08vs2.33±0.88,P<0.001)、IL-10(3.64±1.73vs2.54±1.08,P=0.008).Th2 cytokines levels were significantly higher,the difference was statistically significant(P<0.05).④No statistically significant relationships was found between Treg and IFN-γ,TNF-a,IL-2,IL-6(P>0.05).Treg levels were negatively correlated with Th1/Th2(P=0.003),but were positively correlated with IL-4 and IL-10(P<0.05).Conclusion The levels of CD4+CD25+regulatory T cells and Th2 cytokines were increased and Th1 cytokines levels were decreased in peripheral blood of advanced lung cancer patients.They may be together led to immune suppression and tumor progression in lung cancer patients.Monitoring the change of these indicators was very helpful for judging the curative effect and prognosis.It may be a new strategy to lung cancer to adjust the level of CD4+CD25+regulatory T cells and Th1/Th2 cytokines.
Lung neoplasms;CD4+CD25+regulatory T cells;Th1 and Th2 cytokines;Immunesuppression
海口市重点科技计划项目(编号:2014-084)
570208 中南大学湘雅医学院附属海口医院,海口市人民医院
程小珍
10.3969/j.issn.1001-5930.2017.03.009
R734.2
A
1001-5930(2017)03-0378-04
2016-12-28
2017-02-14)

