巴戟天水提液有效萃取成分促进微波致雄性大鼠生殖损伤的修复
宋斌1,2,3,王玮1,2,3 *
(1福建医科大学基础医学院人体解剖学与组织胚胎学系;2福建省高校脑老化与神经变性疾病重点实验室;3福建医科大学神经生物学研究中心,福州 350122)
巴戟天水提液有效萃取成分促进微波致雄性大鼠生殖损伤的修复
宋斌1,2,3,王玮1,2,3 *
(1福建医科大学基础医学院人体解剖学与组织胚胎学系;2福建省高校脑老化与神经变性疾病重点实验室;3福建医科大学神经生物学研究中心,福州 350122)
目的探讨巴戟天(Morinda officinalis F. C. How)水提液对微波辐射致生殖系统损伤的修复作用。方法以900MHz频率、218μm/cm2辐射密度的低功率微波持续辐射10天,建立雄性SD大鼠生殖损伤模型。66只健康成年雄性SD大鼠随机分为11组。A 组为空白对照组,B组为辐射未给药组,C组为辐射+生理盐水组,D组为巴戟天水提液乙酸乙酯萃取水层治疗组,E组为巴戟天水提液乙酸乙酯萃取酯层治疗组(其中D、E组各有10g、20g、30g、40g生药量/kg浓度梯度组)。每天灌胃1.5ml,持续14d。观察大鼠性行为学指标差异,同时检测血清睾酮变化;比较睾丸、附睾指数以及睾丸组织形态学的改变。结果巴戟天水提液乙酸乙酯萃取各层浓度梯度组分别给药后,D3、D4组扑捉潜伏期与B、C组相比缩短,D4组扑捉次数较之B、C组增加,余治疗组性行为学指标与B、C组无明显差别。D3、D4组睾酮水平较之B、C组均显著升高。HE染色和PCNA/SCP3双重免疫荧光染色显示,随着给药剂量增大,D组大鼠生精细胞数量逐渐增多,以A型精原细胞和粗线期初级精母细胞修复最为明显。结论巴戟天水提液乙酸乙酯萃取水层可改善大鼠性欲、修复生精上皮生精细胞和精子生成,最佳治疗剂量为40g/kg,其机制可能与促进睾酮分泌增加有关。
巴戟天;微波辐射;精子生成;男性不育
在不育症中,男性不育或生育能力低下占近50%的比例[1]。近年来,国内外研究表明环境因素对男性生殖功能造成的损伤超过以往的预期[2]。暴露在微波辐射如移动电话、笔记本电脑和无线路由器等环境中可导致人类精子质量的降低[3]。微波是指频率为300MHz~300GHz的电磁波。微波辐射对全身各个系统均可造成损伤,尤其以生殖系统和神经系统损害为重。微波辐射对生殖系统的影响主要表现为性欲下降、睾丸病理性损伤、精子参数和相关激素的水平偏离正常值范围等[4]。临床上常用西药如克罗米酚等治疗各种少精、弱精子症不育患者,具有一定的效果,但是存在引起体重和性欲改变、轻度抑郁、恶心晕眩、视觉障碍、胃肠道反应和皮疹等副作用。因此,寻找生精效果好和毒副作用小的新型生精药物是当前新药研发热点之一。
现代药理学研究认为中草药巴戟天(Morinda officinalis How)能提高人体免疫力、增强性欲,消除性功能障碍等。巴戟天水提物已被证实可改善雄性大鼠微波辐射所致的生殖功能损伤[5]。但巴戟天对雄性生精障碍及性欲方面的修复机制尚不清楚,关于巴戟天中起修复作用的有效成分单体尚无定论,而巴戟天水提液给药浓度与修复雄性生精障碍之间的量效关系研究较少。本实验拟在前期实验基础上,以巴戟天水提物的乙酸乙酯萃取层(酯层)和水层分别对微波辐射诱导生精障碍模型大鼠进行干预,比较各组大鼠性行为学、血清睾酮水平、睾丸指数以及睾丸组织形态学差异,并研究不同给药浓度和上述指标间的量效关系,以探讨巴戟天水提液中有效成分在乙酸乙酯萃取各层的分布情况及对生精功能修复的最佳浓度、具体修复生精细胞类型,从而为巴戟天有效成分单体提取的后续研究提供基础,并为不育症患者的中药治疗提供实验依据和参考。
材料与方法
1 实验对象
66只健康成年雄性SD大鼠,4月龄,体重(247.73±13.61)g,由福建医科大学实验动物中心提供【动物许可证号:SYXK(闽2012-0001)】;以福建医科大学实验动物中心生产的普通颗粒饲料,新鲜自来水进行喂养;室温控制在18~24℃,湿度控制在45%~65%。
2 主要试剂及仪器
巴戟天干燥根(福建南靖);ELISA-T 试剂盒(美国R&D公司);增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)鼠单克隆抗体(丹麦DAKO);联会复合体蛋白3(synaptonemal complex protein 3,SCP3)兔多克隆抗体(美国Novus Biologicals);Alexa 546羊抗兔荧光二抗 (1∶500) (美国Invitrogen);Alexa 488羊抗鼠荧光二抗 (1∶500) (美国Invitrogen);DAPI(碧云天生物技术研究所);非离子型去污剂Brij® L23(C12E23聚氧乙烯月桂醚) (美国Sigma公司);伊红染色液(碧云天生物技术研究所);苏木素染色液(碧云天生物技术研究所);实验用其他试剂均为国产分析纯。微波信号发生器(泉州荣盛达电讯公司); ML-91型微波漏能测试仪(宿迁市精诚无线电仪器有限公司);R-200旋转蒸发仪(瑞士BUCHI公司);酶标仪ELx 800(美国Bio-Tek);HM-525冰冻旋转切片机(德国Microm International GmbH);TCS SP5激光共聚焦显微镜(德国Leica);ECLIPSETS-100 型倒置显微镜(日本Nikon)。
3 动物分组及造模
66只健康成年雄性SD大鼠随机分为11组,每组6只。A 组为空白对照组,B组为辐射组,C组为辐射+生理盐水组,D组为巴戟天水提液乙酸乙酯萃取水层治疗组,E组为巴戟天水提液乙酸乙酯萃取酯层治疗组(其中D、E组各有10g 、20g、30g和40g生药量/kg浓度梯度组,分别表示为D1、D2、D3、D4和E1、E2、E3、E4)。
大鼠于大号鼠笼中取自由体位,同鼠笼一并置于前方开口的白色铁皮箱中。微波辐射发生装置发射天线位于白色铁皮箱前方5cm,辐射密度为218um/cm2,辐射时间为24h/d、连续辐射10d。C组辐射指标同辐射组,辐射10d后给予1.25ml生理盐水灌胃。D1-D4组及E1-E4组辐射10d后,分别给予巴戟天水提物萃取水层及萃取酯层10g、20g、30g和40g生药量/kg灌胃,给药时间为每日晨8∶00,每天一次,每次1.25ml,持续14d。
4 巴戟天提取方法
巴戟天干燥根经250g手提式高速中药粉碎机粉碎,以蒸馏水浸泡、煎煮2次,药汁过滤,药渣丢弃,旋转蒸发装置减压回收蒸馏水,浓缩后40C保存,备用。浓缩液取500ml置入1L分液漏斗中,加入500ml乙酸乙酯混匀。静置30min后可见混合液分层,上层为浅黄色的乙酸乙酯萃取酯层,包含了可溶于乙酸乙酯的巴戟天水提液成份及乙酸乙酯;下层为深棕色的萃取水层,包含了巴戟天水提液中可溶于水的成份、蒸馏水及残留的乙酸乙酯。经再次旋转蒸发去除残留的乙酸乙酯,并将萃取各层溶液调整成所需浓度。
5 大鼠性行为学实验
大鼠性行为学实验在隔音、恒温的动物行为学实验室内进行。将各组中的每只大鼠依次放入45cm×25cm×20cm的鼠笼中适应5min,随后以1∶1的雌雄比投入同批饲养的健康雌性大鼠,观察30min内以下指标变化:①扑捉潜伏期(Capture incubation period, CIP):自雌鼠投入开始计时,至雄鼠第一次扑捉雌鼠的时间。②扑捉次数(Capture times, CT):自雌鼠投入30min内,雄鼠扑捉雌鼠或爬背或舔阴动作次数。
6 血清睾酮测定
大鼠辐射10d后,禁食24h,以10%水合氯醛(3~6ml/kg)腹腔注射麻醉后,将大鼠仰卧位固定于手术台上。打开胸腔,暴露心脏,取5ml一次性注射器,自右心房进针取血3~5ml,置于预冷的EP管中,冰上静置30min。血样分层后置4℃离心机中,经2500r/min离心15min,小心吸取上层血清,置于另一EP管中,-20℃保存备用。ELISA法测定血清睾酮浓度。
7 组织学标本制备
自大鼠左心室留取血样后进行灌注固定。自左心室向升主动脉插入灌注针头,剪开右心耳,快速灌注0.9%生理盐水150ml进行冲洗后,灌注预先配好的4%多聚甲醛苦味酸固定液固定,持续约2h。在阴囊内寻找并仔细分离两侧睾丸和附睾,去除多余的脂肪和结缔组织,分别测量并记录睾丸和附睾重量。睾丸置于30%蔗糖溶液中脱水沉底后,行20μm冰冻切片,分别进行常规HE染色及免疫荧光染色。
8 免疫荧光染色
切片以0.01mol/L 磷酸盐缓冲液(PBS,pH7.4)漂洗5min×3次;滴加含1% 牛血清白蛋白(BSA)的封闭液(PBS配制)室温放置30min;分别加浓度为1:100的SCP3一抗和1:200的PCNA一抗20μl,4 ℃ 过夜 ;0.075% Brij/PBS(pH7.4)漂洗10 min×3次、PBS漂洗5 min×3次;加入浓度为1:500的Alexa 546驴抗兔荧光二抗和Alexa 488驴抗鼠荧光二抗各20μl,37℃ 避光孵育60min;0.075% Brij/PBS漂洗10 min×3次、PBS漂洗5 min×3次,避光;滴加DAPI(5μg/ml)20μl,避光反应5min;PBS漂洗5 min×3次,避光。防荧光淬灭封片液封片,激光共聚焦显微镜下观察、拍照。省略一抗做对照实验,结果为阴性。
9 睾丸和附睾指数
睾丸指数:双侧睾丸重量和(g)/体重(g);附睾指数:双侧附睾重量和(g)/体重(g)。
10 统计学处理
数据用SPSS 20.0 for Windows分析软件分析。用均数±标准差表示,以方差齐性及t检验、单因素ANOVA统计方法分析,P<0.05表示差别有统计学意义。
结 果
1 乙酸乙酯萃取水层高剂量组给药改善大鼠性欲
对大鼠性行为分析显示:与A组相比,B组大鼠CIP延长约50%;巴戟天水提液乙酸乙酯萃取各层浓度梯度液治疗后,D3、D4组CIP B、C组均缩短约16%;B组大鼠CT较A组减少约35%,D4组CT较B、C组增加约17%;余治疗组性行为指标与B、C组差别均无统计学意义(图1)。
2 乙酸乙酯萃取水层高剂量组干预促进血清睾酮升高
以ELISA法测定并比较各组大鼠给药或者生理盐水后血清睾酮水平,A组与B组睾酮水平差别无统计学意义;D3、D4组睾酮水平较B、C组分别升高约94%和208%;余治疗组睾酮水平与B、C组差别均无统计学意义(图2)。
3 乙酸乙酯萃取水层40g剂量组给药增加生殖腺重量
对睾丸指数和附睾指数测量显示:B组睾丸指数低于A组,D4组睾丸指数较B、C组上升约31%,余治疗组与B、C组差别均无统计学意义(图3a);B组附睾指数低于A组,降低约17%;D4组附睾指数较B、C组升高,余治疗组与B、C组差别均无统计学意义(图 3b)。

图1 各组大鼠给药后CIP和CT值分别比较。a,CIP;b,CT; *,与A组相比,0.01<P<0.05 ( n = 6);#,与B、C组相比,0.01<P<0.05( n = 6)Fig. 1 Comparison of CIP and CT among the groups after administration. a, CIP; b, CT; *, 0.01<P<0.05, compared with Group A (n=6); #, P<0.05, compared with Groups B and C (n=6)

图2 各组大鼠给药后血清睾酮水平比较。#,与B、C组相比,0.01<P<0.05 ( n = 6)Fig. 2 Comparison of serum testosterone level among the groups after administration. #, 0.01<P<0.05, compared with Groups B and C (n=6)
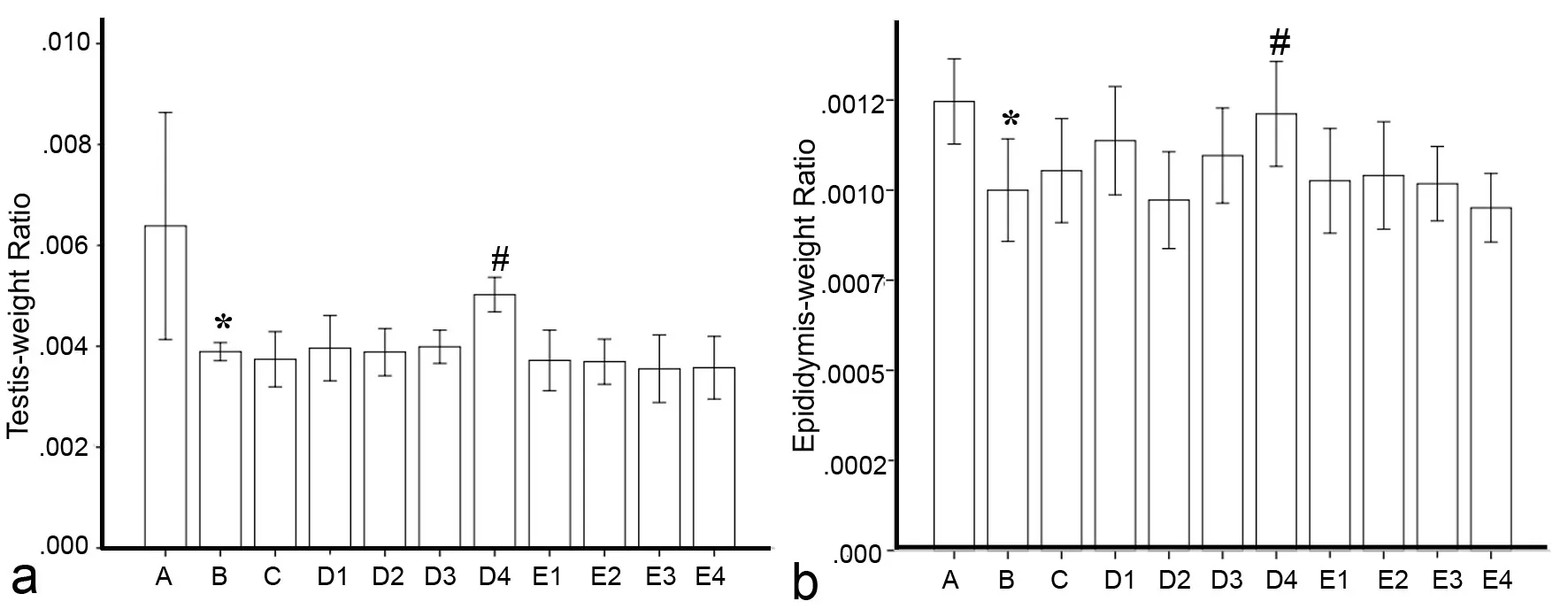
图3 各组大鼠给药后睾丸指数和附睾指数分别比较。a,睾丸指数,b,附睾指数;*,与A组相比,0.01<P<0.05 ( n = 6);#,与B、C组相比,0.01<P<0.05 ( n = 6)Fig. 3 Comparison of testis-weight ratio and epididymis-weight ratio among the groups after administration. a, testis-weight ratio; b, epididymis-weight ratio; *, 0.01<P<0.05, compared with Group A (n=6); #, 0.01<P<0.05, compared with Groups B and C (n=6)
4 乙酸乙酯萃取水层40g剂量组干预促进睾丸生精小管上皮修复
HE染色发现,A组睾丸生精上皮精原细胞、初级精母细胞、次级精母细胞、圆形精子细胞排列紧密、整齐有规律,生精小管基底膜完整,管内可见大量精子(图 4A)。B组及C组睾丸形态学发生病理改变,表现为各生精小管之间间隙增大,结构疏松,生精小管上皮生精细胞排列紊乱、脱落、坏死,管腔内充满脱落的生精细胞及坏死的细胞碎片,生精小管内精子数量显著减少或未见精子(图 4B、C);D组可见精原细胞较B组及C组数量增多,可见部分初级精母细胞,大鼠睾丸生精小管上皮恢复产生各级生精细胞,新生的生精细胞排列规则、紧密,同时观察到D1-D4管腔内精子数量随给药剂量增高而逐渐增多(图 4D-G);E1-E4组,睾丸生精小管上皮损伤严重,各层生精细胞均脱落、坏死,管腔内未见精子(图 4H);睾丸其余不同阶段生精上皮各组间比较也可见上述类似改变,其中以D4组大鼠睾丸生精小管上皮各级生精细胞及精子数量逐渐增多较为显著。
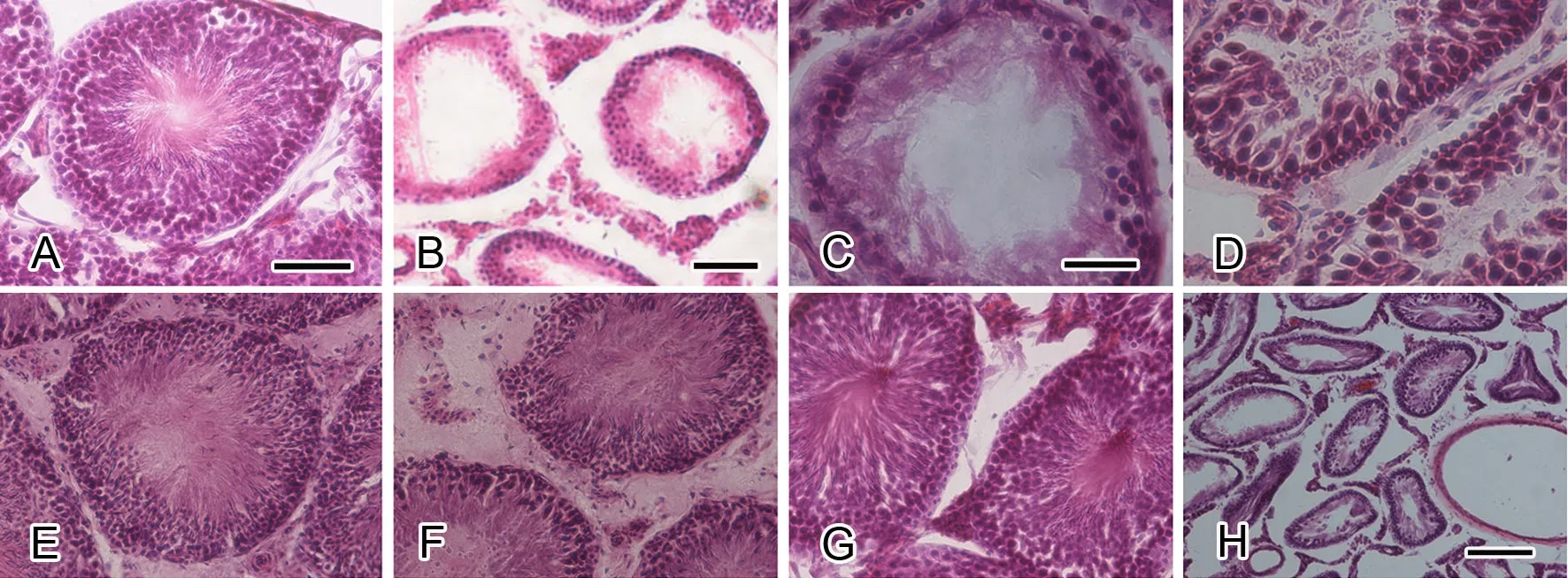
图4 巴戟天提取物对各组大鼠睾丸生精小管上皮组织形态学影响的HE染色观察。A,空白对照组;B,辐射组;C,辐射+生理盐水组;D- G,巴戟天水提液乙酸乙酯萃取水层10g 、20g、30g和40g生药量/kg浓度梯度组(D1、D2、D3、D4组);H,巴戟天水提液乙酸乙酯萃取酯层各浓度梯度组(E1、E2、E3、E4组)代表图片;比例尺:A,E,F和G,100µm;C和D,50µm;B,200µm;H,500µmFig.4 The efect of the aqueous extract of M. ofcinalis on the histomorphology of rat spermatogenic epithelium observed by HE staining. A, Group A; B, Group B; C, Group C; D-G, Groups D1, D2, D3 and D4; H, a representative picture of Group E; scale bar∶ 100µm in A, E, F, G; 50µm in C and D; 200µm in B; 500µm in H

图5 巴戟天提取物对各组大鼠睾丸生精细胞影响的PCNA/SCP3双重免疫荧光染色观察。A,空白对照组;B,辐射组+生理盐水组;C,巴戟天水提液乙酸乙酯萃取水层10g、20g和30g生药量/kg浓度梯度组(D1、D2、D3组)代表图片;D,巴戟天水提液乙酸乙酯萃取水层40g生药量/kg组(D4组)。红色箭头示粗线期初级精母细胞;白色箭头示A型精原细胞;比例尺,20μm。Fig. 5 The efect of the aqueous extract of M. ofcinalis on rat spermatogenic cells detected by PCNA/SCP3 double immunofuorescent staining. A, Group A; B, Group C; C, a representative picture of Groups D1, D2 and D3; D, Group D4; red arrows indicate pachytene primary spermatocytes; white arrows indicate type A spermatogonia; scale bar, 20μm
PCNA/SCP3双重免疫荧光染色进一步显示,微波辐射和含巴戟天有效成分萃取物给药后对生精细胞影响的具体类型及其所处时期:A组空白对照组睾丸染色呈PCNA+/SCP3-的为A型精原细胞,位于生精上皮的最外层、紧贴基底膜,形态呈扁椭圆形;呈PCNA+/SCP3+的为粗线期初级精母细胞,位于生精上皮中层,细胞体积较大,数量多;DAPI染色显示大量圆形精子细胞和位于管腔内的精子,精子细胞靠近管腔、呈球形、体积约为初级精母细胞的一半大小、核圆形并位于细胞中央(图 5A);C组辐射加生理盐水组大鼠A型精原细胞消失,粗线期初级精母细胞数量显著减少、体积变小并外移至生精上皮的最外层,圆形精子细胞排列紊乱、部分也由管腔处外移至靠近基底膜(图 5B);D1-D3组大鼠辐射并给药后上述生精细胞损伤未见明显改变(图 5C);D4组可见A型精原细胞重新出现在基底膜侧,体积较大的粗线期初级精母细胞明显增多并位于生精上皮中层精原细胞内侧(图 5D);E组染色结果同图5B。
讨 论
巴戟天是天然中草药,茜草科藤状灌木的根,为我国四大南药之一。主要生长在福建省闽南山区、广东和广西[6]。中医认为巴戟天具有壮阳补肾、固精安神功效。林芳花等[7]以巴戟甲素对正常大鼠灌胃处理,并对雄性大鼠性行为指标进行观察,结果显示巴戟甲素可显著提高大鼠扑捉次数及射精次数,而首次扑捉时间及首次射精时间均显著缩短。Wu等研究[8]显示巴戟甲素治疗可明显改善羟基脲诱发肾阳虚小鼠的性行为学指标,提高血清睾酮浓度,并改善精子质量。在我们的研究中,巴戟天提取物治疗前后,萃取水层30g/kg及40g/kg剂量组扑捉潜伏期较辐射组、生理盐水组明显缩短,萃取水层40g剂量组30分钟扑捉次数较辐射组、生理盐水组增多,均提示巴戟天可提高雄性大鼠性行为能力,但可能需达到适当的剂量才能达到较佳效果,结果与上述研究一致。
Chang等[9]以H2O2诱导小鼠睾丸间质细胞氧化应激损伤,并应用巴戟天进行干预后检测超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、脂质过氧化反应及睾酮水平,结果显示巴戟天可显著提高睾酮水平、降低脂质过氧化反应,并改善SOD及CAT水平,表明巴戟天可拮抗H2O2诱导氧化应激损伤,并达到保护生殖功能效果。Li等研究[10]提示手机辐射可致大鼠血清黄体生成素(luteotropic hormone,LH)升高,巴戟天治疗可降低LH水平。本课题组前期研究[11]显示巴戟天水提液及可改善微波辐射所致生殖损伤大鼠性行为学,其机制可能与调节HPTA下丘脑、垂体以及性腺各个水平上相关激素分泌有关。巴戟天多糖还可能通过下调细胞因子如TGF-β3和TNF-α水平来调节包括睾酮在内的各种激素水平表达,从而修复实验性精索静脉曲张大鼠的生精上皮及其中支持细胞紧密连接损伤[12]。本研究亦显示巴戟天水提液萃取水层可提高微波辐射后大鼠血清睾酮水平,且睾酮水平与给药量呈正相关。
Liu等[13]比较生晒巴戟天与盐制巴戟天对未成熟大鼠的生殖保护及抗缺氧能力的作用,结果发现,盐制巴戟天组睾丸重量明显增加,与对照组间差别有统计学意义。生晒巴戟天组睾丸重量亦有所增加,但差别无统计学意义;两种炮制方式巴戟天均可增加大鼠包皮腺、精囊腺重量。Chen等[14]应用激光共聚焦拉曼光谱对过氧化氢损伤的人类精子DNA进行变化分析,结果显示过氧化氢损伤后精子DNA光谱较对照组有显著差异,而巴戟天寡糖治疗后精子DNA光谱几乎恢复至正常。张巍等[15]采用微波辐射造成SD大鼠睾丸生精功能损伤模型,并以巴戟天水提液进行干预处理,结果显示给药组精子活性及精子密度均较对照组显著增高,提示巴戟天对微波损伤的雄鼠睾丸生精功能有修复作用。本课题组前期研究也证实巴戟天对睾丸体积及重量的修复作用[5,11,12]。本研究结果亦显示巴戟天水提液萃取水层可提高微波辐射后大鼠睾丸及附睾指数,并改善微波辐射后睾丸及附睾病理变化,但以上治疗效果仅当给药剂量达30~40g/kg方明显呈现。
本研究证实巴戟天水提液乙酸乙酯萃取水层可改善微波辐射所致生殖损伤的雄性大鼠性欲、修复生精上皮生精细胞和精子生成,最佳治疗剂量为40g/kg,其机制可能与促进睾酮分泌增加有关。本研究未能纳入更多的治疗剂量组,关于更高浓度的疗效尚有待进一步考证,同时药物对全身各系统的毒副作用影响也需考虑和开展实验,从而为不育症患者的中药治疗时的剂量选择提供实验依据和参考。
[1] Kumar N,Singh AK. Trends of male factor infertility, an important cause of infertility∶ A review of literature. J Hum Reprod Sci, 2015, 8(4)∶ 191-196.
[2] Skakkebaek NE, Rajpert-De Meyts E, Buck Louis GM, et al. Male Reproductive Disorders and Fertility Trends∶ Infuences of Environment and Genetic Susceptibility. Physiol Rev, 2016, 96(1)∶ 55-97.
[3] Mortazavi S, Parsanezhad M, Kazempour M, et al. Male reproductive health under threat∶ Short term exposure to radiofrequency radiations emitted by common mobile jammers. J Hum Reprod Sci, 2013, 6(2)∶ 124-128.
[4] La Vignera S, Condorelli RA, Vicari E, et al. Efects of the exposure to mobile phones on male reproduction∶ a review of the literature. J Androl, 2012, 33(3)∶ 350-356.
[5] Wang FJ, Wang W, Li R, et al. Morinda ofcialis how extract improves microwave-induced reproductive impairment in male rats. Zhonghua Nan Ke Xue, 2013, 19(4)∶ 340-345.
[6] 林美珍, 巫庆珍,郑松. 闽产巴戟天的本草考证及其鉴别.中国民族民间医药, 2010∶ 12-15.
[7] 林芳花, 林励,肖凤霞. 巴戟甲素对正常雄鼠交配能力和免疫器官系数的影响.中国新药杂志,2008, 17(22):1924-1926.
[8] Wu ZQ, Chen DL, Lin FH, et al. Efect of bajijiasu isolated from Morinda officinalis F. C. how on sexual function in male mice and its antioxidant protection of human sperm. J Ethnopharmacol, 2015, 164∶ 283-292.
[9] Chang MS, Kim WN, Yang WM, et al. Cytoprotective efects of Morinda officinalis against hydrogen peroxide-induced oxidative stress in Leydig TM3 cells. Asian J Androl, 2008, 10(4)∶ 667-674.
[10] Li R, Yang WQ, Chen HQ, et al. Morinda Ofcinalis How improves cellphone radiation-induced abnormality of LH and LHR in male rats. Zhonghua Nan Ke Xue, 2015, 21(9)∶824-827.
[11] Song B, Wang F,Wang W. Efect of Aqueous Extract from Morinda officinalis F. C. How on Microwave-Induced Hypothalamic-Pituitary-Testis Axis Impairment in Male Sprague-Dawley Rats. Evid Based Complement Alternat Med, 2015, 2015∶ 360730.
[12] Zhang L, Zhao X, Wang F, et al. Efects of Morinda ofcinalis Polysaccharide on Experimental Varicocele Rats. Evid Based Complement Alternat Med, 2016. 2016∶ 5365291.
[13] Liu S, Ou HY, Yang YT, et al. Efects of radix morindae from diferent processed products on anti-hypoxia and reproductive system of mice. Zhong Yao Cai, 2009, 32(11)∶ 1671-1673.
[14] Chen DL, Li N, Lin L, et al. Confocal mirco-Raman spectroscopic analysis of the antioxidant protection mechanism of the oligosaccharides extracted from Morinda ofcinalis on human sperm DNA. J Ethnopharmacol, 2014, 153(1)∶ 119-124.
[15] 张巍, 康思鹏, 陈清瑞,等. 巴戟天对微波损伤的雄鼠睾丸生精功能的影响. 解剖学研究,2010,32(5):338-340.
Effective extractive from the aqueous extract of Morinda officinalis F. C. How facilitates the repair of microwave-induced male reproductive impairment of rats
Song Bin1,2,3, Wang Wei1,2,3*
(1Department of Human Anatomy, Histology and Embryology, School of Basic Medical Sciences, Fujian Medical University, Fuzhou 350122, China;2Key Laboratory of Brain Aging and Neurodegenerative Diseases of Fujian Provincial Universities and Colleges, Fuzhou 350122, China;3Research Center of Neuroscience, Fujian Medical University, Fuzhou 350122, China)
ObjectiveTo study the repair of microwave-induced male reproductive impairment by the aqueous extract of Morinda officinalis F. C. How.MethodsThe reproductive impairment model was established by continuous 900MHz and 218μm/cm2microwave radiation for ten days. Sixty-six healthy male adult SD rats were randomly divided into 11 groups (including subgroups)∶Group A, Blank control; Group B, Radiation; Group C, Radiation + NS; Group D, Radiation + the aqueous layer in ethyl acetate extraction of the aqueous extract of M. ofcinalis; Group E, Radiation + the ethyl acetate layer in ethyl acetate extraction of the aqueous extract of M. ofcinalis; Groups D and E were further divided into four subgroups respectively according to the dose of M. ofcinalis treatment (10/20/30/40g crude drug/kg). 1.5ml M. ofcinalis extraction or NS were administered by oral gavage per day for 14 days. The sexual behavior, serum testosterone, testis-weight ratio, epididymis-weight ratio and histomorphological changes of the testis were compared among the groups.ResultsAfter treatment, compared with Groups B and C, the capture incubation period (CIP) decreased signifcantly in Groups D3 and D4, and the capture frequency (CF) increased signifcantly in Group D, while no obvious diference in sexual behavior was observed in the other treatment groups. The level of testosterone was signifcantly higher in Groups D3 and D4 than in Groups B and C. HE staining and PCNA/SCP3 double immunofurorescent staining results showed that in Group D, the num-ber of spermatogenic cells increased with the addition of administration dosage, among which the repair of type A spermatogonia and pachytene primary spermatocytes was the most remarkable. Conclusion The aqueous layer in ethyl acetate extraction of the aqueous extract of M. officinalis can improve the sexual desire of rats, repair spermatogenic cells and promote spermatogenesis, possibly by stimulating the secretion of testosterone. The optimal administration dosage was 40g/kg.
Morinda officinalis How; microwave radiation; spermatogenesis; male infertility
R339.2
A
10.16705/ j. cnki. 1004-1850.2017.02.004
2017-01-23
2017-03-30
福建省自然科学基金(2014J01330)
宋斌,女(1979年),汉族,讲师
*通讯作者(To whom correspondence should be addressed):wangwei@fjmu.edu.cn

